耐除草剂甜菜H7-1多重PCR检测方法的建立
2017-01-05李忆尹全
李忆,尹全
(1.四川民族学院环境与生命科学系,四川康定626001;2.四川省农业科学院分析测试中心,四川成都610066)
耐除草剂甜菜H7-1多重PCR检测方法的建立
李忆1,尹全2
(1.四川民族学院环境与生命科学系,四川康定626001;2.四川省农业科学院分析测试中心,四川成都610066)
依据耐除草剂甜菜H7-1分子特征,同时选择甜菜内源参照基因(GluA)、外源基因P-FMV 35S,CP4-EPSPS和T-E9 3'等4个基因作为多重PCR检测参数,基因特异性引物序列参照相关国家标准,通过对反应条件的优化以及方法特异性和灵敏度测试,建立了多重PCR检测体系。利用已知样品对该体系验证,耐除草剂甜菜H7-1能被同时检出GluA,P-FMV 35S,CP4-EPSPS和T-E9 3'等4个基因,而其他样品均不能被同时检出这4个基因,结果表明,此体系可运用于耐除草剂甜菜H7-1检测。
甜菜;H7-1;多重PCR;检测
甜菜(Beta vulgaris L.)为藜科甜菜属2年生异花授粉作物,是我国主要的糖料、能源和优良的饲料作物[1]。甜菜是加工白糖的主要原料,占白糖加工原料的1/3;其副产品有糖蜜和甜菜粕,均可用于食品和饲料。甜菜粕是食用纤维的主要原料之一,被广泛应用于食品加工行业。甜菜粕也被广泛用作猪、牛饲料,尤其是奶牛的首选优质饲料[2]。
目前,商业化转基因甜菜已有3个品系,分别为抗草甘膦甜菜H7-1、抗草胺膦甜菜T120-7、抗草甘膦甜菜GTS B 77,被大面积种植的是抗草甘膦甜菜H7-1。1998年,转基因甜菜首次被批准商业化种植。至今,转基因甜菜已经在美国、加拿大等国被批准种植,在美国、澳大利亚、日本、墨西哥等国被批准食用[3],我国也在2009年批准耐除草剂甜菜H7-1进口,用作加工原料[4]。
随着农业生物技术的不断发展,转基因生物的安全性问题争议也越来较大,许多国家出台了转基因产品标签制度及相关法规,要求对转基因产品进行标识[5]。2006年,日本发布《关于转基因食品质量标签标准的修正草案》,要求对糖用甜菜及以糖用甜菜作为主要配料的加工食品强制性标识转基因成分。现在出口到欧盟、日本等国的白糖、甜菜粕等甜菜加工产品,要求出口商出具非转基因检测证书。然而,要科学地执行转基因标识制度,就必须依托方便快速、可靠的转基因产品检测技术。
灵敏、快速、简便是PCR技术应用于转基因作物和产品检测的主要优势,可以用于检测转基因作物及产品中的标记基因和目的基因[6-7]。但对产品的检测经常需对多个转基因成分进行检测来确认其是否为转基因产品及含哪些转基因成分,然而用普通PCR分别检测各成分存在操作繁琐、时间和试剂耗费大等缺点。因此,多重PCR(Multiplex polymerase chain reaction,MPCR)技术在转基因产品检测中得到了应用。MPCR是指在常规PCR的基础上,向1个反应体系中加入多对特异性引物,针对1个或多个DNA模板的不同区域扩增多个目的片段的PCR技术[8]。近年来,MPCR技术得到了较大的发展,陈贞等[9]用7重PCR对转基因菜籽粕中的转基因成分进行了检测;Germini等[10]建立了一个能同时区分4种转基因玉米和1种转基因大豆的MPCR体系。因此,MPCR在原材料及深加工产品检测中有重要的应用价值。
虽然国内外已有耐除草剂甜菜H7-1转化体特异检测方法,但并没有对甜菜H7-1转化体中多个基因进行多重PCR的检测方法。为了提高耐除草剂甜菜H7-1转化体特异检测效率,本研究根据耐除草剂甜菜H7-1插入的基因元件,预期建立一种包括甜菜内源参照基因(GluA)、玄参花叶病毒启动子(P-FMV 35S)、豌豆的核酮糖-1,5二磷酸羧化酶E9基因小亚基3′端序列终止子(T-E9 3′)、目的基因(CP4-EPSPS)的4重PCR,为耐除草剂甜菜H7-1的检测提供另外一种方法,在同一个反应体系内同时扩增出4条目的条带,根据目的条带可识别耐除草剂甜菜H7-1。
1 材料和方法
1.1 材料
1.1.1 试验材料转基因甜菜H7-1、转基因玉米MON810和NK603来源于IRRM(Institute for Reference Materials and Measurements,Joint Research Centre(JRC));转基因油菜GT73来源于FLUKA;转基因大豆GTS-40-3-2和转基因水稻TT51-1为四川省农业科学院分析测试中心实验室保存。
1.1.2 主要试剂植物基因组提取试剂盒、Master Mix、标准分子量(M)购于天根生化科技(北京)有限公司;引物由成都擎科梓熙生物技术有限公司合成。
1.2 引物序列
根据耐除草剂甜菜H7-1的分子特征选择甜菜内源基因(GluA),外源基因玄参花叶病毒启动子(P-FMV 35S)和豌豆的核酮糖-1,5二磷酸羧化酶E9基因小亚基3′端序列终止子(T-E9 3′)以及目的基因(CP4-EPSPS)等4个基因作为MPCR检测基因,特异性引物序列引用国家相关标准(表1)。将各检测基因上下游引物浓度稀释为10 μmol/L。

表1 引物序列、扩增片段长度及检测依据
1.3 样品DNA提取
样品DNA提取按照植物基因组DNA提取试剂盒方法进行,测定提取DNA浓度和判断质量。
1.4 多重PCR方法的建立
1.4.1 单基因特异性反应体系:东洋纺2×Master Mix12.5 μL,上下游引物F和R各1 μL,样品DNA模板2 μL,加ddH2O至25 μL。扩增程序:94℃预变性5 min;94℃30 s,58℃30 s,72℃30 s,35个循环;72℃3 min,4℃保存。PCR反应结束后,采用Qiagen毛细管电泳仪对反应产物进行结果分析。
1.4.2 多重PCR方法条件优化利用以下体系和程序对多重PCR退火温度进行优化。反应体系:东洋纺2×Master Mix 12.5 μL,4对引物中,上下游引物F和R各0.25μL,样品DNA模板2μL,加ddH2O至25 μL。扩增程序:94℃预变性5 min;94℃30 s,退火温度设置梯度50,54,56,58,60,64℃30 s,72℃30 s,35个循环;72℃延伸3 min。PCR反应结束后,采用Qiagen毛细管电泳仪对反应产物进行结果分析,选择最适合的退火温度。
利用以下体系和程序对多重PCR引物浓度进行优化。反应体系:东洋纺2×Master Mix 12.5 μL,4对引物终浓度按照表2设置引物浓度梯度,模板DNA 2 μL,加ddH2O至25 μL。扩增程序选择退火温度优化后确定的程序。PCR反应结束后,采用Qiagen毛细管电泳仪对反应产物进行结果分析,选择最适合的引物浓度配比。

表1 引物终浓度配比
1.5 多重PCR方法灵敏度
以去离子水对转基因甜菜H7-1基因组DNA进行梯度稀释,使得每个反应体系中基因组DNA分别为10,3,1,0.5,0.1 ng。
1.6 已知样品验证
利用本研究建立的多重PCR检测体系,对已知样品进行实例验证。
2 结果与分析
2.1 样品DNA提取
样品总DNA提取纯化采用植物基因组提取试剂盒,通过Nano Drop 1000(Thermo scientific)超微量分光光度计测定浓度和质量,经测定,所有样品浓度都大于25 ng/μL,且OD260/OD280范围在1.8~2.0,OD260/OD230大于2.0,说明提取的样品DNA可满足本研究MPCR的需要。将样品DNA浓度稀释至25 ng/μL待测。
2.2 多重PCR单基因特异性验证
本研究选择的单基因PCR检测方法都可以将目的基因片段成功扩增,而其他不含此基因的样品中没有相应扩增(图1),结果说明,4个基因目的条带都是特异的,没有非特异性条带出现。所以,本研究选择的4个基因可用于多重PCR检测体系。

2.3 多重PCR条件的优化
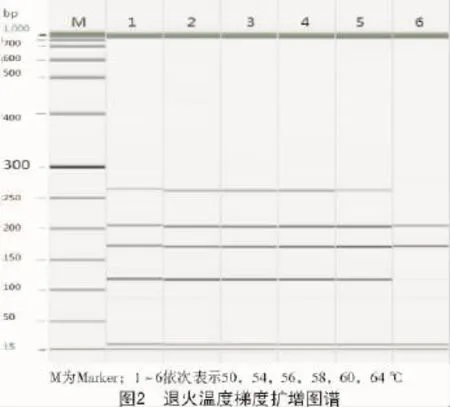
退火温度梯度试验结果表明,退火温度太低容易产生非特异性条带,而退火温度太高又不能将需要的目的条带理想扩增;如在64℃条件下,T-E9 3′基因的目的条带未得到有效扩增,内源基因(GluA)的扩增量也非常小,所以,退火温度64℃不适合(图2)。在其他温度条件下,虽然所有目的条带都得到扩增,但目的条带之间的扩增量有所不同,当退火温度为56℃时各目的条带的扩增量相对一致,因此,最终选择多重PCR反应的退火温度为56℃。
引物浓度梯度试验结果表明,各引物终浓度按照方案B配比时,各目的基因的扩增效率一致;而其他几种引物浓度方案结果均不理想,目的基因存在无扩增、扩增效率不一致等(图3)。所以,最终确定最优化的引物终浓度(μmol/L)配比为0.2∶0.2∶0.2∶0.2。

2.4 多重PCR灵敏度
多重PCR灵敏度试验结果显示,在模板浓度不低于0.5 ng时,4个目标片段均可得到有效扩增;当模板浓度低至0.5 ng时,除内源参照基因(GluA)得到扩增外,其他目的条带均未得到有效扩增;在模板浓度低于0.5 ng时,4个外源基因几乎没有扩增(图4)。说明本研究所建立的多重PCR检测体系灵敏度可达0.5 ng。

2.5 已知样品验证
采用已建立的多重PCR体系检测已知样品结果表明,所有样品扩增的目的条带与其分子特征显示的基因元件是一致的(图5)。此结果进一步验证了本研究建立的多重PCR检测方法的可靠性。

3 讨论
为了提高检测效率,本研究首次将分辨率更高、电泳条带更清晰的毛细管电泳引入到多重PCR检测体系中,也是本研究的最大特点。目前,毛细管电泳技术已被应用于无机及有机化合物、蛋白质、氨基酸、肽的分离分析,核酸的分离分析等方面[14-15]。虽然目的基因间碱基差异大,也可以采用普通琼脂糖凝胶电泳方法进行分析判断,但毛细管电泳能将扩增目的条带分离得更明显,结果更加清晰;如果需要检测的目的基因间的碱基差异大小不能采用普通琼脂糖凝胶电泳方式进行准确分析,特别是在只有几个碱基差异时,毛细管电泳的优势则更明显。本研究的多重PCR反应体系选择的基因扩增条带大小虽然差异较大,但采用毛细管电泳更能清晰地将二者区分开,并进行正确判断。
多重PCR最早由Chamberlain等[8]于1988年提出,目前已被广泛应用于医学及生物等领域,包括基因敲除分析、突变、多态性分析、定量分析、RNA检测及微生物耐药检测等[16-18]。在实际应用中,由于不同引物序列存在很多因素(如引物浓度、退火温度等)影响多重PCR结果,所以,在关键影响因素引物浓度选择过程中,本研究采用不同引物浓度梯度对多重PCR体系进行优化,在充分考虑PCR反应过程中易产生引物二聚体、非特异性条带等特殊情况,选择目的条带特异、引物二聚体少以及各基因引物扩增效率相对一致的引物浓度配比,最终建立了多重PCR检测体系。
退火温度是多重PCR反应中一个关键因素。通常情况下可以依据引物的解链温度直接选择退火温度,但有的时候其结果与预期并不一致。在多重PCR反应条件优化过程中,最简单的方法就是设置54℃为初始退火温度,如果多重PCR扩增产生非特异性条带,需适当提高引物退火温度,反之则降低引物退火温度[19]。本研究从6个退火温度中,根据5个目的基因的特异性条带扩增效率、非特异性条带以及引物二聚体的产生等因素确定了56℃作为耐除草剂甜菜H7-1转化体特异检测方法的多重PCR检测体系退火温度。以后根据实际检测需求,进一步对引物设计和多重PCR反应条件进行优化。
本研究建立的耐除草剂甜菜H7-1转化体特异检测方法多重PCR反应体系,可实现在1个反应体系中同时检测耐除草剂甜菜H7-1内源参照基因和多个外源基因成分,有效简化了操作程序、缩短了检测时间、提高了检测效率,有效降低了出现漏检现象的概率,为转基因甜菜H7-1提供另外一种有效的检测手段。
[1]路运才.转基因甜菜研究进展[J].中国糖料,2008(1):57-60,66.
[2]杨克科.甜菜抗除草剂转基因的研究[D].哈尔滨:黑龙江大学,2012.
[3]Center for Environment Risk Assessment.GM crop database(H7-1)[EB/OL].[2015-05-24].http://cera-gmc.org/GmCropDatabaseEvent/H7-1.
[4]农业部农业转基因生物安全管理办公室.2004—2011年进口用作加工原料的农业转基因生物审批情况[EB/OL]. [2015-05-27].http://www.moa.gov.cn/ztzl/zjyqwgz/spxx/201202/P0 20130618408715248212.pdf.
[5]金芜军,贾士荣,彭于发.不同国家和地区转基因产品标识管理政策的比较[J].农业生物技术学报,2004,12(1):1-7.
[6]尹全,宋君,刘勇.生物技术作物食品检测技术研究进展[J].江西农业学报,2010,22(5):135-137.
[7]张富丽,雷绍荣,刘勇.转基因作物及加工品检测技术概述[J].生物技术通讯,2009,20(5):733-737.
[8]Chamberlain J S,Gibbs R A,Ranier J L,et al.Detection screening of the duchenne muscular dystrophy locus via multiplex DNA implication[J].Nucl Acids Res,1988,16:1141-1156.
[9]陈贞,芦春斌,杨梦婕,等.多重PCR检测转基因菜籽粕中的转基因成分[J].植物检疫,2011,25(3):35-38.
[10]Germini A,Zanetti A,Salati C,et al.Development of a seven target multiplex PCR for the simultaneous detection of transgenic soybean and in feeds and foods[J].Journal of Agricultural and Food Chemistry,2004,52(11):3275-3280.
[11]中华人民共和国农业部.农业部1485号公告-3-2010转基因植物及其产品成分检测耐除草剂甜菜H7-1及其衍生品种定性PCR方法[S].北京:中国标准出版社,2010.
[12]中国国家标准化管理委员会.GB/T19495.6—2004转基因产品检测基因芯片检测方法[S].北京:中国标准出版社,2004.
[13]中华人民共和国国家质量监督检验检疫总局.SN/T 1197—2003油菜籽中转基因成分的定性PCR检测方法[S].北京:中国标准出版社,2003.
[14]陈义.毛细管电泳技术及应用[M].北京:化学工业出版社,2000.
[15]高乐怡,方禹之.21世纪毛细管电泳技术及应用发展趋势[J].理化检验:化学分册,2002,38(1):1-6.
[16]赵红庆,苑锡铜,黄留玉.多重PCR技术在病原检测中的应用[J].生物技术通讯,2007,8(5):863-866.
[17]邵碧英,陈文炳.玉米及其制品中转基因成分的单一PCR及多重PCR检测[J].食品科学,2005,26(9):380-385.
[18]何玮玲,张驰,杨静,等.食品中4种肉类成分多重PCR的快速鉴别方法[J].中国农业科学,2012,45(9):1873-1880.
[19]Henegariu O,Heerema N A,Dlouhy S R,et al.Multiplex PCR: critical parameters and step-by-step protocol[J].Biotechniques,1997,23(3):504-511.
Establishment of Multiplex PCR Detection Method for Herbicide-tolerant Sugar Beet H7-1
LI Yi1,YIN Quan2
(1.Department of Environment and Life Sciences,Sichuan University for Nationalities,Kangding626001,China;2.Center of Analysis and Testing,Sichuan Academy of Agricultural Sciences,Chengdu 610066,China)
To establish a kind of herbicide-tolerant sugar beet H7-1 multiplex PCR detection method,according to the molecular characteristics of herbicide-tolerant sugar beet H7-1,the sugar beet endogenous reference gene GluA,exogenous gene P-FMV 35S, CP4-EPSPS and T-E9 3'were selected as detection genes for multiplex PCR,which the sequences of specific primers referred to China national standards,and the reaction conditions were optimized and tested for its specificity and sensitivity.The multiplex PCR detection system was established including an endogenous gene and four exogenous genes.This system was validated by the known sample,and herbicide-tolerant sugar beet H7-1 could be checked out GluA,P-FMV 35S,CP4-EPSPS,T-E9 3',four genes at the same time,while other samples couldn't be checked out the four genes at the same time.The result indicates that this system can be applied to the detection of herbicide-tolerant sugar beet H7-1.
sugar beet;H7-1;multiplex PCR;detection
S566.3
A
1002-2481(2016)01-0014-05
10.3969/j.issn.1002-2481.2016.01.05
2015-09-14
四川省教育厅自然科学一般项目(15ZB0331);四川省财政现代农业技术创新与示范专项资金项目(2014CXSF-040)
李忆(1982-),女,四川泸定人,讲师,硕士,主要从事生物教学及研究工作。尹全为通信作者。
