超声波辅助响应面法提取藜麦多酚及抗氧化性研究
2017-01-05陈树俊胡洁王振文庞震鹏刘晓娟徐晓霞仪鑫石玥李乐
陈树俊,胡洁,王振文,庞震鹏,刘晓娟,徐晓霞,仪鑫,石玥,李乐
(山西大学生命科学学院,山西太原030006)
超声波辅助响应面法提取藜麦多酚及抗氧化性研究
陈树俊,胡洁,王振文,庞震鹏,刘晓娟,徐晓霞,仪鑫,石玥,李乐
(山西大学生命科学学院,山西太原030006)
以山西静乐藜麦为原料,采用超声波辅助响应曲面法对藜麦多酚提取工艺进行优化,并测定其体外抗氧化活性。结果表明,以多酚得率为指标,考虑提取时间、乙醇体积分数、料液比、提取温度4个单因素的影响,在单因素试验的基础上进行响应面实验优化。结果表明,超声波提取藜麦多酚的最佳条件为:提取时间23 min,乙醇体积分数71%,料液比1∶23(g/mL),提取温度52℃;在此条件下,多酚提取量为3.33 mg/g。采用超声波辅助提取藜麦多酚,方法简便,大大缩短了提取时间,增加了提取效率;同时,藜麦多酚提取液具有很强的1,1-二苯基-2-三硝基苯肼(DPPH·)、羟自由基(·OH)清除能力,其半抑制浓度(IC50)分别为1.62,21.27 μg/mL,均强于抗坏血酸;此外,藜麦多酚还具有很强的还原能力且其质量浓度与抗氧化活性具有良好的量效关系。说明藜麦富含多酚并且具有良好的抗氧化能力。
藜麦;多酚;响应面;提取;抗氧化性
藜麦(Chenopodium quinoa Willd.)原产于印第安地区,为双子叶植物,由于其丰富的营养价值和独特的功能特性,被印第安人称为“粮食之母”[1-2]。藜麦的营养价值在国际上也得到了认可,联合国粮农组织(FAO)认为,藜麦是唯一一种单体植物,是可满足人体基本营养需求的食物,正式推荐藜麦为最适宜人类的完美“全营养食品”[3]。藜麦中含有大量的多酚类物质,而多酚类物质是植物在生长发育中产生的次生代谢产物,广泛存在于植物的根、茎、皮、叶及果实内。多酚类物质具有清除自由基[4]和抗氧化[5-6]、抗肿瘤[7]以及预防心血管疾病[8]等生理功能。目前,国外对藜麦多酚的研究相对较多[9-11],着重于藜麦与其他“假谷物”含量及抗氧化性的对比分析,但国内对其研究相对较少。
超声波法经常被应用于对生物活性物质的提取,此方法相比一般提取方法,提取效率高,能大大缩短提取时间,在提取工艺研究中起到了至关重要的作用。多酚提取经常使用水浴提取法和超声波法,卢宇等[12]研究表明,水提法提取藜麦,多酚得率为(226.77±1.94)mg/100 g,阙淼琳等[13]通过提取藜麦种子多酚含量以及分析品种间差异得出,品种“PI596293”的多酚含量最高,达2.72mg/g。
本试验通过单因素试验和响应面实验探索一种提取藜麦多酚的最佳工艺条件,并对其抗氧化性进行分析,旨在为藜麦进一步加工利用及深入研究提供理论支持。
1 材料和方法
1.1 材料及试剂
供试材料藜麦(福林酚)购自山西稼祺农业科技有限公司。Folin-Ciocalteu、没食子酸、乙醇、硫酸亚铁、水杨酸、双氧水;铁氰化钾、三氯乙酸、三氯化铁、DPPH等试剂均为分析纯。
1.2 主要仪器及设备
磨粉机,永康市小宝电器有限公司;DHG-9240A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;JA1203N型精密电子天平,上海良平仪器仪表有限公司;UV-2800型紫外分光光度计,美国尤尼柯仪仪器有限公司;SB5200DTD超声波清洗机,宁波新芝生物科技有限公司;TDL-5型台式离心机,上海安亭科学仪器厂;HRHS24 Haier电热恒温水浴锅,青岛海尔医用低温科技有限公司。
1.3 方法
1.3.1 样品预处理将新鲜藜麦除杂后置于65℃烘箱内烘干至恒质量,用粉碎机打磨10 min,过0.230mm筛网,备用。
1.3.2 藜麦多酚的提取准确称取藜麦粉1.00 g,置于25 mL具塞试管中,按一定比例加入一定体积分数的乙醇溶液,在特定温度下超声波辅助提取一定时间,提取完毕后,于3 500 r/min下离心15 min,取上清液作为待测液。
1.3.3 多酚含量的测定根据Folin-Ciocalteu法[12]测定(稍作修改)。精确吸取1.00 mL的样品液于10 mL容量瓶中,加入0.5 mL Folin-Ciocalteu试剂,混匀,4~6 min内加入1 mL 7%的Na2CO3溶液,充分摇匀后用蒸馏水定容,避光放置1 h,在波长760 nm下测定其吸光度值。以没食子酸为标准样品制作标准曲线,得到线性回归方程为:y=0.0389x+0.020 9(R2=0.997 6)。根据标准曲线计算多酚得率。
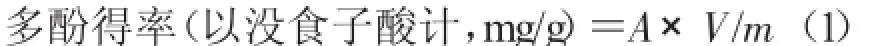
式中,A为样液多酚含量(μg/mL);V为样液体积(mL);m为样品质量(g)。
1.3.4 单因素试验
1.3.4.1 超声提取时间对多酚得率的影响在乙醇体积分数70%、料液比1∶15(g/mL)、提取温度60℃的条件下,设置不同提取时间为10,15,20,25,30 min,考察超声提取时间对多酚得率的影响,以选择最佳超声提取时间范围。
1.3.4.2 乙醇体积分数对多酚得率的影响在超声提取时间20 min、料液比1∶15(g/mL)、提取温度60℃的条件下,设置乙醇体积分数梯度为50%,60%,70%,80%,90%,考察乙醇体积分数对多酚得率的影响,以选择最佳乙醇体积分数范围。
1.3.4.3 料液比对多酚得率的影响在超声提取时间20 min、乙醇体积分数70%、提取温度60℃的条件下,设置不同料液比为1∶10,1∶15,1∶20,1∶25,1∶30(g/mL),考察料液比对多酚得率的影响,以选择最佳料液比范围。
1.3.4.4 超声提取温度对多酚得率的影响在超声提取时间20 min、乙醇体积分数70%、料液比1∶15(g/mL)的条件下,设置不同超声提取温度为30,40,50,60,70℃,考察超声提取温度对多酚得率的影响,以选择最佳超声提取温度范围。
1.3.5 响应面优化设计根据单因素试验结果,依照Box-Behnken中心组合实验设计原理,选取超声提取时间、乙醇体积分数、料液比、超声提取温度4个因素为试验因素,以多酚得率为响应值,设计4因素3水平共29个试验组的响应面实验,采用Design Expert 8.05软件进行分析,得到模型回归方程,以确定藜麦多酚含量的最佳提取工艺参数。响应面因素水平列于表1。

表1 响应面实验因素水平
1.3.6 藜麦多酚体外抗氧化活性分析
1.3.6.1 清除DPPH自由基能力测定其参照文献[15]的方法稍加改进。精确吸取2.00 mL不同浓度的样品液于10 mL试管中,加入2.00 mL DPPH溶液,摇匀,室温避光放置30 min后,于517 nm处测定吸光度值。空白组用蒸馏水替代样品,每个样品重复测定3次。


式中,Ai为2 mL DPPH溶液+2 mL样品液的吸光度值;Aj为2 mL样品液+2 mL无水乙醇的吸光度值;Ac=2 mLDPPH溶液+2 mL无水乙醇的吸光度值。
1.3.6.2 清除羟自由基能力测定其采用Fenton反应方法[16]进行。在试管中分别加入不同浓度样品液各2 mL,然后分别加入2 mL6 mmol/L硫酸亚铁溶液和2 mL6 mmol/L水杨酸-乙醇溶液,最后加入2 mL6 mmol/L双氧水进行反应,将反应液置于37℃下水浴30 min,以蒸馏水作参比,在510 nm下测定吸光度值,用抗坏血酸作对照。每个样品重复测定3次。
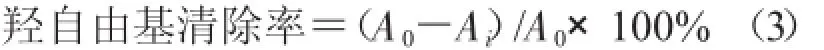
式中,A0为不加样液的吸光度值;Ai为加入不同浓度样品液的吸光度值。
1.3.6.3 还原能力测定其参考文献[17]进行。分别吸取不同浓度样品液2.5 mL,加入0.2 mol/L pH值为6.6的PBS溶液2.5 mL和1%的铁氰化钾溶液2.5 mL,混合均匀后于50℃条件下水浴20 min,迅速冷却,立即加入2.5 mL 10%三氯乙酸(TCA)溶液,将该混合物于3 000 r/min离心10 min。然后取上清液2.5 mL,加入2.5 mL去离子水和0.5 mL 0.1%氯化铁溶液混合均匀,反应10 min后,测定700 nm处吸光度值,每个样品重复测定3次。
1.4 数据分析
采用Origin 6.0,Excel软件分析数据、作图,数据用平均值±SD值表示。采用Design Expert 8.05分析处理响应曲面模型回归方程及方差分析。
2 结果与分析
2.1 单因素结果分析

由图1可知,在其他条件一定时,多酚得率随着超声提取时间的增加逐渐增加,当达到20 min时,多酚得率达到最大,表明在此条件下多酚得到了充分提取;之后,随着时间的增加多酚得率又呈现下降的趋势,可能是由于长时间超声波发出机械振动破坏了多酚结构[18]。所以,选择15~25 min作为超声提取时间考察范围。
由图2可知,在其他条件一定时,多酚得率随着乙醇体积分数的增加逐渐增加,当达到70%时,多酚得率达到最大;之后,当乙醇体积分数再增加时多酚得率反而减少,说明高浓度乙醇会影响多酚的溶出[19]。所以,选择60%~80%作为乙醇体积分数考察范围。

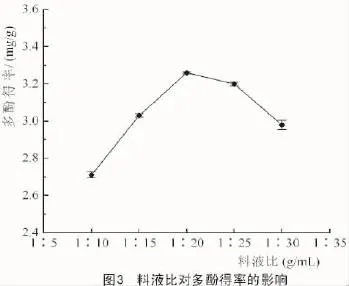
由图3可知,其他条件一定时,料液比在(1∶10)~(1∶20)范围内,多酚得率随着料液比增大而逐渐增大;之后,当继续增加料液比时,多酚得率呈现减少的趋势,说明溶解的多酚达到饱和状态,从节约资源的角度考虑,选择(1∶15)~(1∶25)为料液比考察范围。

从图4可以看出,在其他条件一定的情况下,多酚得率随着超声提取温度的增加逐渐增加,当达到50℃时,多酚得率达到最大;之后,随着温度的继续增加,多酚得率呈现减小的趋势,可能是由于高温破坏了多酚的化学结构,从而导致多酚含量的减小,而且高温使得溶剂蒸发,导致料液比发生变化[20]。所以,选择40~60℃作为超声提取温度考察范围。
2.2 响应面优化结果分析
根据表2的试验设计和结果,采用Design Expert 8.05对数据进行回归分析,得到响应面二次多项式模型方差分析表(表3)及交互作用响应曲面图(图5)。以藜麦多酚得率为响应值,得到拟合二次回归方程模型如下。


表2 响应面实验设计及结果
从表3可以看出,本试验模型达到极显著水平(P<0.0001),失拟项P=0.7839>0.05,不显著,R2=0.966 2,说明本试验回归模型与实际拟合较好,可以用于藜麦多酚提取工艺的预测,并可用回归方程对试验结果进行分析。

表3 响应面二次多项式模型方差分析

2.3藜麦多酚体外抗氧化活性分析
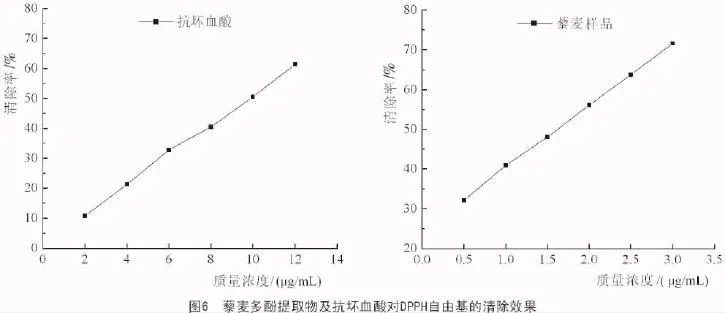
2.3.1 清除DPPH自由基能力测定DPPH自由基在517 nm波长附近有最大吸收峰,当DPPH自由基与自由基清除剂反应后,深紫色的DPPH自由基被还原成黄色,自由基清除能力越大,褪色程度越大[19-21]。从表4可以看出,藜麦多酚提取物对DPPH自由基清除效果非常明显,半抑制浓度(IC50)达到1.62 μg/mL,远远强于抗坏血酸(9.76 μg/mL),并且随着质量浓度的增加自由基清除率增加。

表4 清除DPPH自由基能力
从图6可以看出,藜麦多酚提取物质量浓度与对DPPH·自由基清除率呈现出良好的线性关系,由于清除DPPH·自由基能力是表征抗氧化性的一个重要指标,所以藜麦多酚具有良好的抗氧化活性。
2.3.2 清除羟自由基能力测定羟自由基(·OH)是生命活动氧化代谢过程中体内最为活泼的活性氧,它能杀死红细胞,可介导许多病理变化,如引起脂质过氧化、造成细胞结构和功能的破坏等。因此羟自由基的产生与衰老和许多疾病发生发展密切相关[22-23]。从表5、图7可以看出,藜麦多酚提取物和抗坏血酸清除羟自由基能力都随着浓度的增加逐渐增强,当清除率达到50%时藜麦样品浓度为21.27 μg/mL,而抗坏血酸为217.84 μg/mL,说明藜麦多酚对羟自由基的清除效果远优于抗坏血酸。

表5 清除羟自由基能力

2.3.3 还原能力测定还原能力是表征物质抗氧化的重要特征,也是用来评价物质抗氧化性能的常用方法。一般情况下,样品的还原力越强,说明其抗氧化能力越强[26-27]。从表6、图8可以看出,在一定浓度范围内,藜麦多酚提取物的还原能力随着样品浓度的增加而增大,并且呈现良好的线性关系;当吸光度达到0.5时,藜麦样品与抗坏血酸的浓度分别为7.58,34.50 μg/mL,说明与抗坏血酸相比,藜麦多酚具有良好的还原能力。

表6 清除羟自由基能力

3 结论
本研究通过单因素试验和响应面实验优化,采用超声波辅助法探索提取藜麦多酚类物质的最佳工艺条件,利用Design Expert 8.05软件中Box-Behnken中心组合实验对结果进行优化分析。结果表明,最佳提取条件为提取时间23 min,乙醇体积分数71%,料液比1∶23(g/mL),提取温度52℃;在此条件下,多酚提取量为3.33 mg/g,本试验的工艺条件适于藜麦多酚的提取。另外,通过清除DPPH·、羟自由基能力和还原能力的测定,分析结果得出,藜麦多酚与3项指标均呈现一定的量效关系,而且抗氧化活性均强于抗坏血酸,说明藜麦多酚具有良好的抗氧化活性。作为一种天然抗氧化植物,藜麦具有很好的发展前景与潜力。
[1]Bhargava A,Sydhir S,Ohri D.Chenopodium quinoa:an Indian perspective[J].Industrial Crops and Products,2006,23(1):73-87.
[2]朱剑宏.南美藜的化学组成和营养价值[J].成都大学学报:自然科学版,2002,21(2):24-28.
[3]肖正春,张广伦.藜麦及其资源开发利用[J].中国野生植物资源,2014,33(2):62-66.
[4]古绍彬,吴影,董红敏,等.苹果多酚抗氧化作用及其清除自由基能力的研究[J].中国粮油学报,2013,28(4):58-61.
[5]邵芳芳,尹卫平,梁菊.重要的植物多酚及其抗氧化性能的研究概况[J].西北药学杂志,2010,25(1):66-68.
[6]张红城,赵亮亮,胡浩,等.蜂胶中多酚类成分分析及其抗氧化活性[J].食品科学,2014,35(13):59-65.
[7]陆雪莹,肖向文,李晓波.新疆石榴皮总多酚有效部位抗氧化、抗菌及抗肿瘤活性[J].食品科学,2012,33(3):26-30.
[8]Lee J H,Park K H,Lee M H,et al.Identification,characterisation and quantification of phenolic compounds in the antioxidant activity-containing fraction from the seeds of Korean perilla(Perilla frutescens)cultivars[J].Food Chemistry,2013,136(2):843-852.
[10]Alvarez-Jubete J.Polyphenol composition and in vitro antioxidant activity of amaranth,quinoa buckwheat and wheat as affected by sproutingand baking[J].Food Chemistry,2010,119(2):770-778.
[11]Tang Y,Li X H,Zhang B.Characterisation of phenolics,betanins and antioxidant activities in seeds of three Chenopodium quinoa Willd.Genotypes[J].Food Chemistry,2015,166(1):380-388.
[12]卢宇,阿荣,张园园,等.响应面法优化藜麦多酚提取工艺的研究[J].食品工业科技,2016,37(12):311-315,344.
[13]阙淼琳,蒋玉蓉,曹美丽,等.响应面试验优化藜麦种子多酚提取工艺及其品种差异[J].食品科学,2016,37(4):7-12.
[14]Hirose Y,Fujita T,Ishii T,et al.Antioxidative properties and flavonoid composition of Chenopodium quinoa seeds cultivated in Japan[J].Food Chemistry,2010,119(4):1300-1306.
[15]Ting Sun,Chi-Tang Ho.Antioxidant activities of buckwheat extracts[J].Food Chemistry,2005,90(40):743-749.
[16]李秀丽,韩建春,郭荣佳,等.大麦麸皮发酵液的体外抗氧化活性研究[J].食品工业科技,2014,35(7):112-115.
[17]Babbar N,Oberoi H S,Uppal D S,et al.Total phenolic content and antioxidant capacity of extracts obtained from six important fruit residues[J].Food Research International,2011,44(11):391-396.
[18]Carrera C,Ruiz-rodr GUEZ A,Palma M.Ultrasound assisted extraction of phenolic compounds from grapes[J].Analytica Chimica Acta,2012,732(30):100-104.
[19]Yang L,Jiang J G,Li W F,et al.Optimum extraction process of polyphenols from the bark of Phyllanthus emblica L.based on the response surface methodology[J].Journal of Separation Science,2009,32(3):1437-1444.
[20]令博,王捷,吴洪斌.葡萄皮渣多酚超声波辅助提取工艺响应面法优化及抗氧化活性研究[J].食品科学,2011,32(18):24-29.
[21]韦献雅,殷丽琴,钟成,等.DPPH法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-322.
[22]Shimada K,Fujikawa K,Yahara K,et al.Antioxidative properties of xan than on the autioxidation of soybean oil in cyclodextrin emulsion [J].Journal of Agricultural and Food Chemistry,1992,40(6):945-948.
[23]Kumaran A,Karunakaran R J.Antioxidant and free radieal seavenging activity of anaqueous extract of Coleus aromaticus[J].Food Chemstry,2006,97(1):109-114.
[24]王旭苹,杨小兰.不同溶剂酒花多酚提取物清除羟自由基活性的研究[J].山东轻工业学院学报,2013,27(3):20-24.
[25]王虹玲,武婷茹,姜诗文,等.香蕉皮单宁的提取及其提取物的抑菌抗氧化活性[J].食品与发酵工业,2014,40(11):253-259.
[26]朱晓红,沈佳鑫,马瑞,等.蓝莓叶水提物的体外抗氧化活性[J].山西农业科学,2012,40(8):833-836.
[27]陈彩薇,吴晖,赖富饶,等.米糠中不同存在形态酚类物质的抗氧化活性研究[J].现代食品科技,2015,31(2):42-46.
Study on Extraction Process by Ultrasonic-assisted Response Surface Method and Antioxidant Activity of Quinoa Polyphenol
CHENShujun,HUJie,WANGZhenwen,PANGZhenpeng,LIUXiaojuan,XUXiaoxia,YI Xin,SHI Yue,LI Le
(College ofLife Sciences,Shanxi University,Taiyuan 030006,China)
Ultrasonic-assisted response surface method was adopted to explore the optimum extraction of polyphenols from Shanxi Jingle quinoa seed,and antioxidant activity in vitro was measured.The paper took polyphenols yield as index,considering the effect on extraction time,ethanol concentration,solid-liquid ratio,extraction temperature four factors.Response surface test was applied based on the single factor experiment.The results showed that the best conditions for ultrasonic extraction of quinoa polyphenols was as follows: extraction time 23 min,ethanol concentration 71%,solid-liquid ratio 1∶23(g/mL),extraction temperature 52℃,under these conditions,the yield of polyphenols was 3.33 mg/g.The ultrasonic assisted method was used to extract quinoa polyphenols which was simple,greatly shorten the extraction time and increased extraction efficiency.At the same time,the polyphenols extracted from quinoa showed strongradical scavenging activity against 1,1-diphenyl-2-picrylhydrazxyl(DPPH·)and hydroxyl(·OH)which were stronger than ascorbic acid,and half inhibitory concentration(IC5)0of them were 1.62,21.27 μg/mL,respectively.Besides,quinoa polyphenol also had strong reducing power and in a concentration-dependent manner with antioxidant activity.These results illustrated that quinoa was rich in polyphenols and had good antioxidant abilities.
quinoa;polyphenol;response surface;extraction;antioxidant activity
TQ914.1
A
1002-2481(2016)11-1708-08
10.3969/j.issn.1002-2481.2016.11.32
2016-05-16
陈树俊(1964-),男,山西定襄人,副教授,主要从事食品新工艺及功能食品研究工作。
