鸡源丁酸梭状芽孢杆菌的分离筛选与鉴定及益生性的研究
2017-01-05肖海蒂张莉力史东辉许云贺
肖海蒂,张莉力,史东辉,许云贺
(辽宁省锦州市锦州医科大学,辽宁 锦州 121001)
鸡源丁酸梭状芽孢杆菌的分离筛选与鉴定及益生性的研究
肖海蒂,张莉力,史东辉,许云贺*
(辽宁省锦州市锦州医科大学,辽宁 锦州 121001)
为了降低抗生素的使用频率,提高微生态制剂的利用率。本试验从健康散养大骨鸡的盲肠内容物中分离与纯化细菌,获得多株芽孢杆菌,经菌落观察、镜检、生化试验初步确定三株芽孢杆菌,并对其益生性进行研究发现D-19益生性能较好,进行16S rDNA序列分析,鉴定D-19株为丁酸梭状芽孢杆菌。研究结果为进一步研究动物肠道内微生物及应用该菌奠定了基础。
丁酸梭状芽孢杆菌;散养大骨鸡;肠道微生物;鉴定
丁酸梭状芽胞杆菌(Clostridium butyricum)又名酪酸梭菌、丁酸梭菌,属于芽孢杆菌科,梭菌属,革兰氏阳性,有芽孢,孢子卵圆,偏心或次端生,可抵抗不良环境。丁酸梭菌是普遍存在于人和动物肠盲肠和结肠内的一种益生菌,是肠黏膜细胞的主要能量来源,也是肠道健康水平的标志。通过改善胃肠道微生物区系,可稳定胃肠道环境与肠道pH,为厌氧有益菌群的生长提供有利环境,也能抑制肠道内葡萄球菌、大肠杆菌等有害菌的生长繁殖,从而调节菌群平衡,具有调节消化道菌群和促进畜禽生长的双重作用[1]。2000年陆俭等[2]发现了丁酸梭菌对霍乱弧菌具有拮抗作用。
1944年,日本将丁酸梭菌活菌制剂以整肠剂药品正式投入临床应用。目前,丁酸菌在畜牧业中一般作为微生态制剂添加到饲料中。2002年赵建新等[3]从健康人的粪便中分离了4株丁酸梭菌,对这4株菌进行安全性评价,其中丁酸梭状芽孢杆菌Z-10被证明可以安全的用于制造微生态制剂。2012年刘亭婷等[4]将丁酸梭菌添加到饲粮中对蛋用仔公鸡肠道菌群的影响进行研究分析,结果表明,丁酸梭菌能够增加乳杆菌和双歧杆菌的数量,降低大肠杆菌的数量,从而调节肠道菌群的平衡,改善肠道微环境。2013年梁明振等[1]研究表明,在饲粮中添加适量的丁酸梭状芽孢杆菌,不仅可以降低肠道pH和大肠杆菌的含量,还能提高肠道内丁酸梭状芽孢杆菌和乳酸杆菌的含量。
1 材料与方法
1.1试验材料
1.1.1 样品来源 在20只85日龄散养大骨鸡中挑选平均体重相近的6只进行解剖,解剖后取盲肠内容物装入EP管中液氮保存然后迅速转移至-80℃冰箱中。
1.1.2 试验用培养基 RCM梭菌增殖培养基和TSN梭菌选择性培养基参照杜云平等[5]试验用培养基。
1.1.3 试验仪器与设备 超净工作台、厌氧培养箱、高压灭菌锅、摇床、显微镜、PCR仪、凝胶成像仪等。
1.2试验方法
1.2.1 菌株的分离 菌株的富集培养:取-80℃保存的样品10 g加入90 mL无菌生理盐水中,摇床震荡20 min后80℃水浴10 min,杀死非芽孢菌,在超净工作台中吸取10 mL加入100 mL RCM液体培养基,37℃厌氧培养箱中培养48 h再取菌液10 mL加入RCM液体培养基,37℃厌氧培养箱中培养48 h后80℃水浴10 min,取富集后的菌液10 mL加入100 mL TSN选择性液体培养基,37℃厌氧培养24 h。
菌株的分离:取10 mL菌液加入90 mL无菌生理盐水中,进行梯度稀释至10-6,每个稀释度取100 μL涂布于TSN琼脂平板上,37℃厌氧培养48 h后观察菌落形态。
1.2.2 生理生化试验 由于丁酸梭菌隶属梭菌属,根据《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册第8版》中鉴定梭菌属的试验方法对菌株鉴定到属。
1.2.3 菌株益生性的研究
1.2.3.1 耐酸性 ①取斜面保藏的菌落活化24 h后按5%的接种量种于已经配制好的10 mL pH为2、3、4的人工胃液中。②刚接入后摇匀即取样,0 h计数作为对照组,然后在培养3 h后取样,做3个平行,用PBS缓冲液稀释平板计数,计算存活率(试验组菌落数/对照组菌落数×100%)。
1.2.3.2 耐胆盐性 ①取斜面保藏的菌落活化24 h后按5%的接种量种于已经配制好的浓度为0.1%、0.2%、0.3%的人工肠液中。②刚接入后摇匀即取样,0 h作为对照组,培养4 h后取样用生理盐水稀释涂平板计数,计算存活率(试验组菌落数/对照组菌落数×100%)。
1.2.3.3 细菌表面疏水性的测定(MATH法) 细菌培养物经12 000 r/min,5 min离心,然后用无菌的50 mmol/L的K2HPO4(pH 6.5)洗脱2次,每次10 mL。调整重悬液在A600处的吸光值接近0.6,此时从其中吸取3 mL与0.6 mL二甲苯混合30 s,停顿10 s后震荡30 s,室温下静置5~10 min分层,取下层水相,以缓冲液为空白对照,在波长600 nm处测量吸光值并记录。试验进行3次重复。
表面疏水率(H%)计算公式:H%=(A0-A)/A0式中A0和A分别是与二甲苯混匀前后菌液在600 nm处的吸光值。
1.2.3.4 抑菌性 丁酸梭菌的活化:取斜面保存的丁酸梭挑取一环放入RCM液体培养基,37℃培养24 h。
金黄色葡萄球菌的活化:实验室保藏菌种,挑取一环菌用牛肉膏蛋白胨培养基,37℃培养24 h。
大肠杆菌的活化:实验室保藏菌种,挑取一环菌用牛肉膏蛋白胨培养基,37℃培养24 h。
分别取100 μL大肠杆菌和金黄色葡萄球菌的菌液涂布于平板上,静置10 min,让菌液充分吸附在固体培养基上,然后在培养基上间隔均匀的放置3个牛津杯,里面注入丁酸梭菌菌液100 μL,盖上培养皿上盖,37℃培养24 h后观察结果。
1.2.4 16s rDNA的分子鉴定 变性:挑取菌体于50 μL TaKaRa Lysis Buffer for Microorganism to Direct PCR中变性后离心取上清液作为模板。
反应条件:80℃,15 min。
PCR扩增:使用TaKaRa 16s rDNA Bacterial identification PCR Kit,进行PCR扩增目的片段。
反应条件: 94℃,5 min,1个循环;94℃,1 min,55℃,1 min,30个循环;72℃,1.5 min,72℃,5 min,1个循环。
PCR产物的回收纯化并测序由宝生物工程(大连)有限公司完成。
1.2.5 菌落形态观察 将鉴定为丁酸梭装芽孢杆菌的菌株进行扩大培养,观察其在TSN琼脂平板上的菌落形态。
1.2.6 显微镜下形态观察 挑取TSN平板上的菌落涂到载玻片上,加适量蒸馏水混合,待晾干后进行革兰氏染色,观察显微镜下的菌落形态。
1.2.7 统计处理 应用SPSS 17.0软件单因素方差分析进行统计分析,结果均以均值±标准差形式表示。
2 结果与分析
2.1分离出的菌株的菌落形态结果见表1。

表1 分离菌株的菌落形态Table1 Strain morphology of isolated strains
2.2生理生化鉴定结果结果见表2。

表2 菌株的生理生化鉴定结果Table2 Physiological and biochemical identification results of strains
2.3菌株益生性研究试验结果
2.3.1 菌株在人工胃液中的存活率 结果见表3。

表3 耐酸性存活率Table3 Survival rate of acid resistant
由表3结果可以看出,D-19在pH为4培养3 h后存活率显著高于其他两株菌株(P<0.05);当pH为2和3时,D-2和D-19显著高于D-8(P<0.05)。
2.3.2 菌株在人工肠液中的存活率 结果见表4。
由表4结果可知,D-19在胆盐浓度为0.2%和0.3%时都显著高于其他两株(P<0.05),在浓度为0.1%时三组之间没有显著差异(P>0.05)。
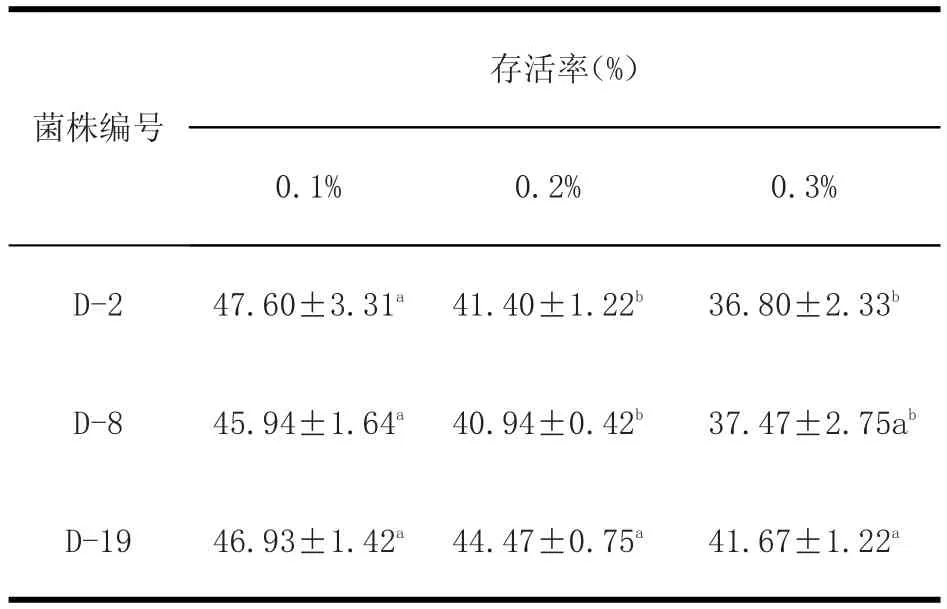
表4 耐胆盐存活率Table4 Survival rate of bile salt resistant
2.3.3 菌株的疏水率的测定 结果见表5。
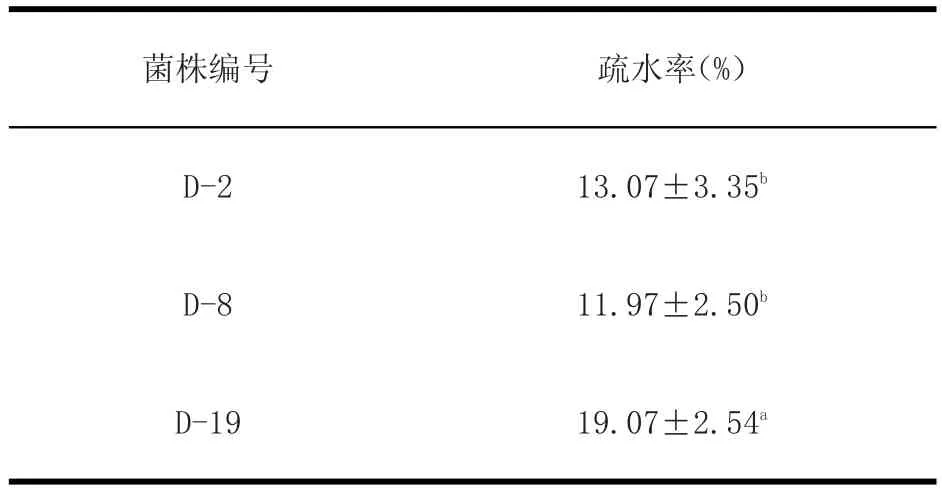
表5 疏水率Table5 Hydrophobic rate
由表5可知,菌株D-19的疏水率显著高于其他两株(P<0.05),而D-2和D-8之间没有显著差异(P>0.05)。
2.3.4 菌株对病原菌的抑菌性 结果见表6。
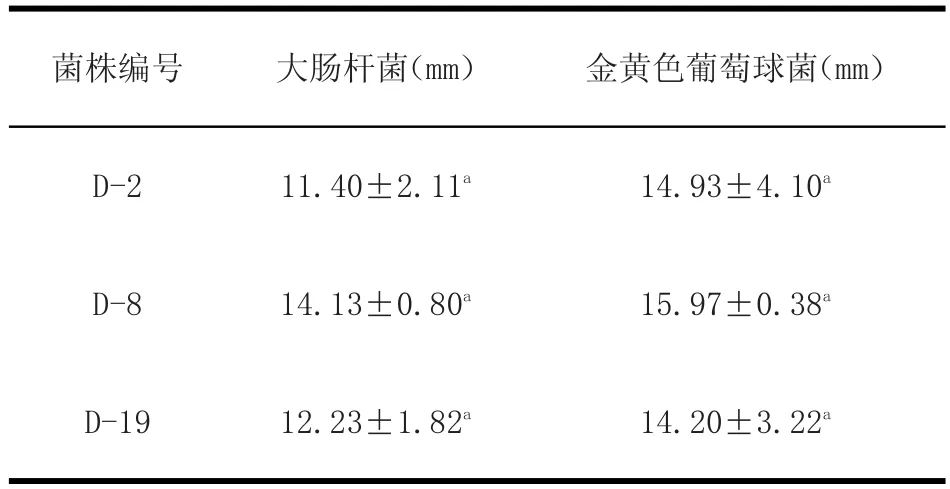
表6 抑菌圈直径Table6 Antibacterial property
由表6可知,三株菌对大肠杆菌和金黄色葡萄球菌的抑菌效果差异不显著(P>0.05)。
综合以上益生性相关试验结果来看,菌株D-19的试验结果在耐酸性方面显著高于其他两株菌,胆盐浓度为0.2%和0.3%时显著高于其他两株,疏水率也显著高于其他两株,所以选取D-19进行16s rDNA分子鉴定。
2.416 s rDNA分子鉴定结果1%琼脂糖凝胶电泳检测PCR结果,进行琼脂糖凝胶电泳,电泳结果见图1。

图1 琼脂糖凝胶电泳图Fig.1 The picture of agarose gel electrophoresis
2.5菌落形态经过16s rDNA分子测序后与NCBI数据库进行比对,筛选出的菌株与Clostridium butyricum同源性达到99%,确定其为丁酸梭状芽孢杆菌,将筛选出的丁酸梭状芽孢杆菌进行扩大培养,菌落形态:边缘不整齐,表面稍突,乳白色,菌落较大,直径5 mm左右。见图2。
2.6染色及镜检革兰氏染色呈蓝紫色,梭状,菌体中间膨大,孢子卵圆。见图3。
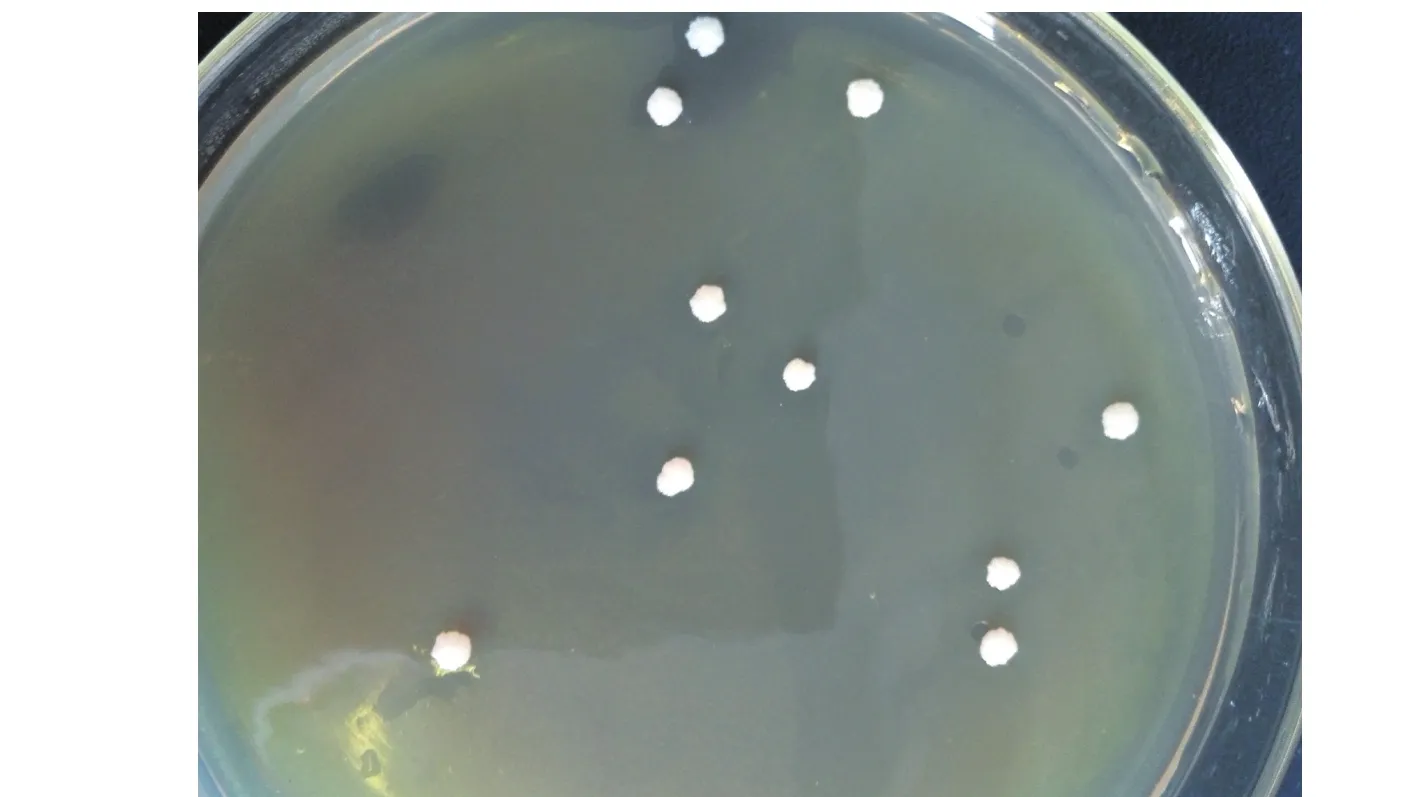
图2 丁酸梭菌在TSN平板上的菌落形态Fig.2 Colony morphology of Clostridium botulinum on TSN plate
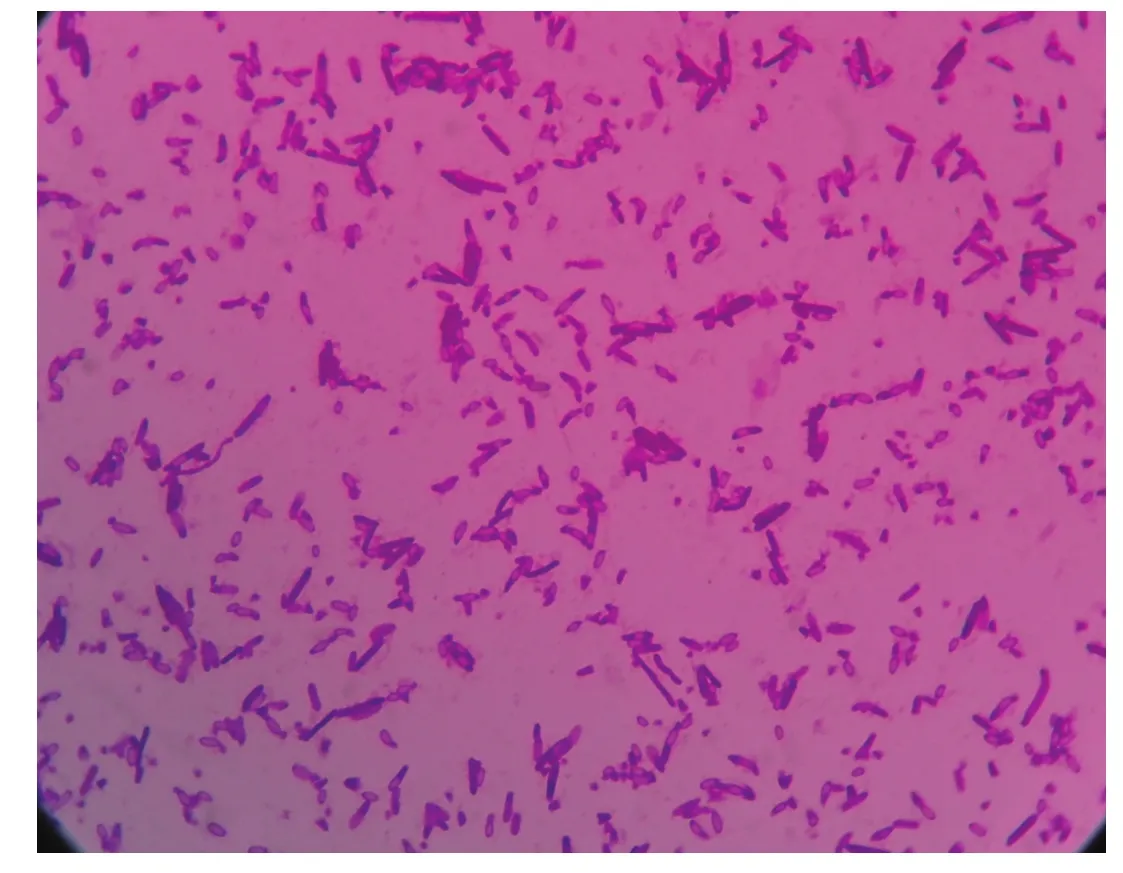
图3 丁酸梭状芽孢杆菌染色镜下图(×1000)Fig.3 Clostridium butyrate staining microscope(×1000)
3 讨论
自抗生素发现以来,给人类的生活、生产带来了巨大的改变,但随着抗生素作为饲料添加剂的广泛应用,人们也逐渐发现了它的弊端,如导致动物胃肠道正常菌群失调,产生耐药性和药物残留等副作用[6]。而动物微生态制剂具有维持动物肠道健康、改善畜舍环境、缓解不良应激、调节机体脂肪代谢和改善畜产品品质的功能,它能替代抗生素添加到饲料中从而很好地解决滥用抗生素而产生的问题[7]。
本研究分离出的菌株是从85日龄健康散养大骨鸡的盲肠内最终筛选出三株丁酸梭状芽孢杆菌,并对三株菌进行益生性能的研究,经过试验得出D-19株菌株的益生性能最好,其菌落形态为乳白色的表面光滑而边缘不规则的菌株。由于来源于健康鸡肠道所以能很好的定植于肠道内,抗逆性强,能耐酸碱和高温高压,在饲料加工和储存过程中不易失活[8],这是其能作为微生态制剂的一大优点。
下一步对其安全性等进行研究,使其能安全有效地代替抗生素作为微生态制剂添加到饲料中应用于生产,充分发挥其功能。
[1]梁明振,李莉,刘浩.丁酸梭状芽孢杆菌对断奶仔猪肠道微生物区系的影响[J].中国畜牧杂志,2013,49(23):64-67.
[2]陆俭,张雪平,孟筱琦.酪酸菌和婴儿型双歧杆菌对霍乱弧菌的拮抗试验[J].微生物学通报,2000,27(5):338-341.
[3]赵建新,张灏,田丰伟.丁酸菌的分离、鉴定及筛选[J].无锡轻工大学学报,2002,21(6):597-601.
[4]刘亭婷,滑静,王晓霞,等.丁酸梭菌对蛋用仔公鸡肠道菌群、形态结构及黏膜免疫相关细胞的影响[J].动物营养学报,2012,24(11):2210-2221.
[5]杜云平,周庆丰,余国莲,等.猪粪中丁酸梭菌的分离[J].现代农业科学,2009,16(3):21-23.
[6]石现瑞,高峰.抗生素添加剂的负面效应及其代替品的研究[J].饲料博览,2000,(3):24-26.
[7]徐鹏,董晓芳,佟建明.微生物饲料添加剂的主要功能及其研究进展[J].动物营养学报,2012,24(8):1397-1403.
[8]郝永任.新型动物微生态制剂一复合酪酸菌制剂的研制[D].济南:山东师范大学,2002.
The isolation,screening and identification of Clostridium butyricum from chicken and the research of probiotics
Xiao Haidi,Zhang Lili,Shi Donghui,Xu Yunhe*
(Jinzhou Medical University,Liaoning Jinzhou 121001)
In order to reduce the frequency of use of antibiotics,improve the utilization rate of micro ecological agents.From the bulk health raise big bone chicken cecal contents in separation and purification of bacterial and obtain many strains of Bacillus,the colonies were observed,microscopy,biochemical test initially identified three strains of Bacillus,the probiotic research found D-19 probiotic properties better,16S rDNA sequence analysis and identification of D-19 strains of Clostridium butyricum.In order to lay a foundation for further research on the intestinal microflora and the application of the bacteria.
Clostridium butyricum;Cage-free big bone chicken;Gut microbes;Identification
S831.5 < class="emphasis_bold"> 文献标识码:B
B
1672-9692(2016)06-0001-06
2016-04-12
肖海蒂(1990-),女,硕士研究生,主要研究方向为肠道微生物。
许云贺(1978-),男,博士,副教授,研究方向为动物营养与饲料研究。
辽宁省自然科学基金项目(2014022046)。
