高中化学“反应与能量变化”考点的归类
2017-01-04尹辉
尹 辉●
江苏省泗洪中学(214500)
高中化学“反应与能量变化”考点的归类
尹 辉●
江苏省泗洪中学(214500)
高中化学中“反应与能量变化”作为重要的考试内容,在进行课程总结的过程中,需要明白其能量变化的根本就在于化合价的变化导致的能量吸收与释放.在化学变化中,对其化学反应中能量的变化分析,主要在于对高能量向低能量上转变,而其反应也主要分为了四大类反应,氧化还原反应、置换反应、分解反应与离子反应.下面针对三反应进行简要归类论述.
一、氧化还原反应
氧化还原反应是通过对原子核外电子的转移实现的化合价变化,在化合价的升降变化中,实现了能量的变化.如燃烧反应等反应,都属于较为典型的氧化还原反应.氧化还原反应均有典型的化合价得失.根据反应的形式有分为吸热反应与放热反应两大类.
在反应中,各类物质又可分为氧化剂与还原剂,氧化产物和分解产物四类,汇总分析如下表1所示.

概念含义概念含义氧化剂在反应过程中承担化合价降低的反应物之一被还原在反应中氧化剂化合价升高的反应过程还原剂反应过程中承担化合价降低的反应物之一被氧化在反应中还原剂化合价升高的过程氧化产物反应后被氧化的产物还原产物反应后,被还原的产物氧化反应元素在反应过程中出现化合价升高的反应还原反应元素在化学反应过程中出现的化合价降低的反应
在对氧化还原反应的考点归类过程中,主要包括以下的基本资料.

表2 常用氧化剂与还原剂的总结
而对于氧化还原的放热反应,就在于原有物质的分子内能高于生成物的分子内能,从而完成了反应.
二、置换反应

置换反应中,常见的反应为离子置换反应,而其离子置换反应中则主要遵循金属离子的活性排布规律,其主要规律为“钾>钙>钠>镁>铝>锌>铁>锡>铅>(H)>铜>汞>银>铂>金”,在进行置换反应的过程中,就需要结合实际的反应情况选择合理的使用范围.对于这一规律的使用,通过离子化合键的变化,从而完成能量的增减变化.
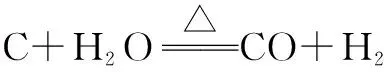
三、分解反应

对于放热反应则如KNO3的分解,自身会放出大量的热,甚至爆炸,这也是黑火药的主要组成成分之一,其反应有较强的代表性.
分解反应大多数为吸热反应,放热反应属于少数个体.
四、离子反应
离子反应又可成为中和反应,因其属于酸碱盐之间的相互反应,有固定的规律可循,牵扯到了电离强弱的效果,因此在应用中就需要格外注意酸碱盐的强弱程度.而对常用的离子结构中,主要的强弱酸碱盐归类,就分为如下表3中的几类.

表3 强弱酸碱离子总结
在进行离子反应的知识总结中,需要对酸碱的强弱进行总结分析.而对于碱性强弱的定性,则根据其金属离子的正价数来进行比对,同时根据其金属活性顺序相同.对于强弱酸的定义上,则需要结合实际的反应情况来确定酸碱的强度.强酸的酸性基本相同,与浓度有关,这与碱相同.而碱中只有氢氧化铝与氨水属于弱碱物质,因此可忽略不计.而氨基酸、醋酸等有机酸自身有一定的酸性,会产生水解从而导致溶液呈现弱酸性.因此在进行这一类知识点的排布中,就需要结合汇总信息来确定其最终的顺序.如同类二元酸强于一元酸,如草酸酸性强于醋酸.
而在反应过程中,就会因为反应自身的强弱酸碱性而导致整体反应的快慢,同时放出大量的热量.这也是离子键变化导致的能量释放.
G
B
