AP-1及其siRNA对心肌细胞中TGF-β1的影响
2017-01-04李斌,陈晶
李 斌,陈 晶
(包头医学院基础医学与法医学院,内蒙古包头 014040)
AP-1及其siRNA对心肌细胞中TGF-β1的影响
李 斌,陈 晶
(包头医学院基础医学与法医学院,内蒙古包头 014040)
采用RNA干扰方法研究转录因子AP-1对TGF-β1的转录调控影响及其对心肌细胞的影响。设计合成两对AP-1基因的siRNA-59和siRNA-60,同时合成与AP-1基因序列无关的siRNA-58,试验设置阴性对照、阳性对照组及干扰组(AP-1-58、AP-1-59和AP-1-60)共5组,使用LipofectantineTM2000转染AP-1 siRNA入培养的大鼠心肌细胞,倒置显微镜观察细胞形态;采用实时荧光定量PCR法检测AP-1和TGF-β1在心肌细胞中mRNA水平表达量的变化。结果显示,siRNA-58对AP-1的基因沉默(表达下调)无显著差异(P>0.05),siRNA-59和siRNA-60对AP-1的基因沉默(表达下调)有显著差异(P<0.05),同时对应siRNA-59和siRNA-60组的TGF-β1基因有显著性下调(P<0.05),说明AP-1和TGF-β1的基因表达存在正相关。
AP-1;TGF-β1;心肌细胞;RNA干扰;实时荧光定量PCR
心血管疾病尤其是心脏疾病发病率一直居高不下,且有逐年增加和年轻化的趋势。心肌肥厚是多种心脏疾病共同的病理过程,影响因素较多,包括心肌细胞肥大,具体表现为心肌细胞体积增大、心肌细胞表型胚胎基因再表达及与收缩功能有关的收缩蛋白的改变等[1-2]。心肌肥厚机制非常复杂,至今人们尚未研究清楚。
资料显示转化生长因子β1(transforming growth factor β1,TGF-β1)可以刺激心肌细胞合成收缩蛋白[3]。Li C[4]等在大量的动物模型和人手术后的病理标本检测结果显示,各种原因导致的心肌肥厚均同时伴随着TGF-β1表达的上调。在左心室肥厚的体外试验中,大量研究均表明TGF-β1与左心室肥厚关系密切,呈显著正相关[5-7]。
本研究采用RNA干扰技术[8],设计AP-1(c-jun)的siRNA,体外检测细胞中的AP-1和TGF-β1的表达情况。
1 材料与方法
1.1 材料
1.1.1 心肌细胞 大鼠心肌细胞H9C2购于北京协和细胞资源中心。
1.1.2 主要试剂 LipofectantineTM2 000试剂盒为Invitrogen公司产品;胎牛血清(FBS),胰酶为杭州四季青生物制品工程公司产品;培养基DMEM(高糖型)为Gibeo公司产品;反转录试剂盒PrimeScript®RT reagent kit perfect real-time、实时荧光定量试剂盒SYBR®premix ExTaqTM Ⅱ RT-PCR kit和Trizol RNA提取试剂盒为宝生物工程(大连)有限公司产品;SiRNA 为Invitrogen公司产品。
1.2 方法
1.2.1 细胞培养与传代 H9C2细胞在 DMEM、100 mL/L的小牛血清、100 U /mL青霉素及100 U/mL链霉素培养基中,于37℃、体积分数为5% CO2培养箱中培养,细胞传代用 2.5 g/L胰蛋白酶消化细胞。用相差显微镜常规观察细胞生长形态及生长规律。
1.2.2 siRNA的脂质体瞬时转染 采用 Invitrogen公司 Lipofectamine 2000并按说明书进行:将1 mL无抗培养基中接种0.5×105~2×105细胞于6孔板,经24 h培养待细胞生长融合度达40%~50%后进行瞬时转染[9]。用250 μL DMEM稀释5 μL LipofectantineTM2000,静置5 min;用250 μL DMEM稀释5 μL siRNA;混合转染试剂和SiRNA,静置20 min。转染4 h~6 h后换新培养基,再培养48 h。
试验分为3组,siRNA-AP-1组、control-RNAi-AP-1组和未进行细胞转染组。转染前1 d,胰酶消化细胞并计数,细胞铺板,使其在转染日密度为90%~95%,以LipofectamineTM 2000转染。将稀释的脂质体与合成的RNA寡聚物等体积混匀,滴加到细胞液中,让RNA寡聚物/脂质体复合物与细胞在37℃、体积分数为5%的CO2环境下接触6 h后,换成有血清和抗生素的培养液培养48 h~72 h,收集细胞,荧光相差显微镜检测转染率。
1.2.3 实时荧光定量PCR(real-time PCR)检测TGF-β1在mRNA水平的表达
1.2.3.1 总RNA提取及逆转录 用异硫氰酸胍法提取细胞总RNA(TaKaRa RNAiso plus),对RNA进行完整性和纯度检测,然后用反转录试剂盒(TaKaRa PrimeScript®RT reagent kit)反转录成cDNA,置-20℃保存。1.2.3.2 合成引物和内参 引物由上海生工生物工程技术服务有限合成,序列如下:GAPDH (129 bp) 5′-CCTGGAGAAACCTGCCAAGT-3′;5′-TGGGAGTTGCTGTTGAAGTC-3′;TGF-β1(149 bp) 5′-TGAGTGGCTGTCTTTTGACG-3′;5′-GTTTGGGACTGATCCCATTG-3′;AP-1(c-jun,125 bp) 5′-TGACTGCAAAGATGGAAACGA-3′;5′-CAGGTTCAAGGTCATGCTCTGT-3′。
2 结果
2.1 RNA干扰结果
使用6孔板分5组(阴性对照、阳性对照、 SiRNA-58、 SiRNA-59、 SiRNA-60),当细胞融合度达到40%左右时,进行转染干扰(图1A)。干扰后,阴性对照组细胞正常生长,细胞融合度由40%增长至70%(图1B);干扰后,阳性对照组细胞形态发生变化,有部分细胞死亡,细胞融合度由40%增长至60%左右,考虑可能是脂质体影响了细胞活性(图1C);干扰后,SiRNA-58组由于是与AP-1(c-jun)基因无关的SiRNA,现象比较接近阳性对照,细胞融合度50%至60%,考虑此SiRNA对细胞干扰不大,主要是脂质体影响了细胞活性(图1D);干扰后,SiRNA-59组细胞形态变化大,部分视野下细胞死亡,呈圆点或圆点状聚集,此SiRNA对细胞干扰明显(图1E),干扰后,SiRNA-60组细胞形态变化大,部分视野下细胞死亡,呈圆点或圆点状聚集,此SiRNA对细胞干扰最为明显(图1F)。
2.2 TGF-β1在mRNA水平的表达情况
经real-time PCR,各组中AP-1在mRNA水平
表达情况如图2所示,TGF-β1在mRNA水平表达情况如图3所示。在RNA干扰组中siRNA-58组为与AP-1基因无关的siRNA,假阳性组,与阴性对照和阳性对照相比,无显著性差异;siRNA-59组、siRNA-60组与阴性阳性对照相比,差异极显著;siRNA-60组干扰效果更为明显(图2)。TGF-β1在干扰组中呈显著性下调,与AP-1的表达量呈正相关(图3)。
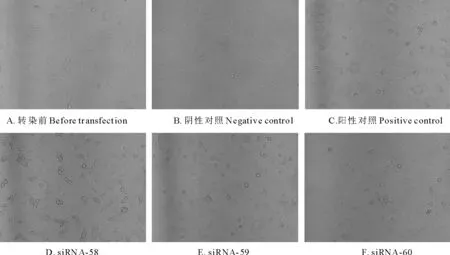
图1 转染前后细胞镜检结果
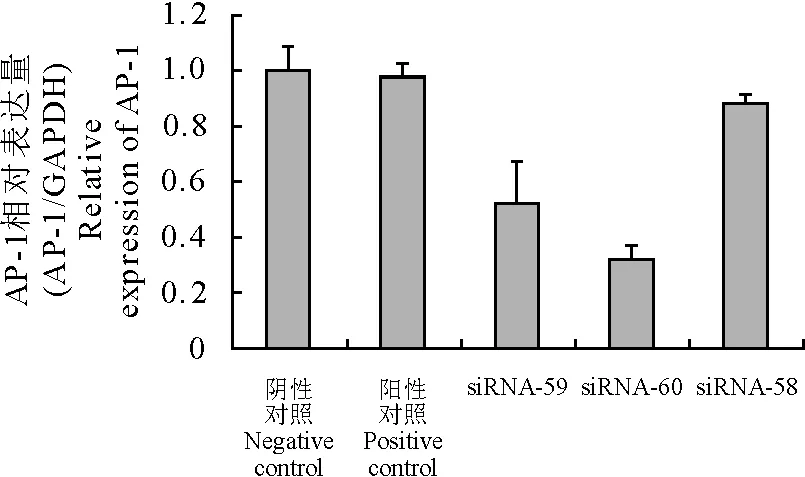
图2 各组细胞中AP-1在mRNA的表达情况

图3 各组细胞中TGF-β1在mRNA的表达情况
3 讨论
激动蛋白-1(activator protein-1,AP-1)属于碱性亮氨酸拉链转录因子,是由原癌基因c-jun和c-fos分别编码的c-Jun和c-Fos蛋白嵌合而成的二聚体复合物,且以c-Jun为主[11-12]。Weigert C等[13]发现TGF-β1的基因启动子中含有两个AP-1结合位点(位于-453至-323之间)。
我们通过RNA干扰技术,设计AP-1(c-jun)的siRNA,进行RNA干扰,体外检测细胞中的AP-1和TGF-β1的表达。研究显示,siRNA-59组、siRNA-60组干扰效果较为理想,TGF-β1在干扰组中呈显著性下调,与AP-1的表达量呈正相关。
TGF-β1在各种病因引起的心肌肥厚中均有上调趋势。Wang W S[14]将大鼠TGF-β1基因敲除后持续给AngⅡ并不发生心肌肥厚,提示TGF-β1可直接诱导心肌肥大。谢双伦等[15]以AP-1为靶点采用decoy ODNs技术对大鼠心肌成纤维细胞的影响进行研究,发现AP-1 decoy ODNs可以抑制成纤维细胞增殖和胶原的合成。TGF-β1在各种病因引起的心肌肥厚中均有上调趋势,是多种心脏疾病共同的病理过程,影响因素较多,包括心肌细胞肥大,具体表现为心肌细胞体积增大、心肌细胞表型胚胎基因再表达及与收缩功能有关的收缩蛋白的改变等。TGF-β1基因上游的启动子有AP-1结合位点,本研究证实了它们之间呈正相关。可以进一步检测心肌细胞表型胚胎基因再表达及与收缩功能有关的收缩蛋白的改变等,进而可能找到治疗心肌肥厚的新的靶点。
[1] Xing Y,Gao D,Liu Z,et al.MicroRNAs in heart failure[J].Chin Med J,2014,127(18):3328-3334.
[2] Johnson F L.Pathophysiology and etiology of heart failure[J].Cardiol Clin,2014,32(1):9-19.
[3] Zhan C Y,Tang J H,Zhou D X,et al.Effects of tanshinone ⅡA on the transforming growth β1/Smad signaling pathway in rat cardiac fibroblasts[J].Indian J Pharmacol,2014,6(6):633-638.
[4] Choy L,Derynck R.The type Ⅱ transforming growth factor(TGF)-beta receptor-interacting protein TRIP-1 acts as a modulator of the TGF-beta response [J].J Biol Chem,1998,273(47):31455-31462.
[5] Samarakoon R,Overstreet J M,Higgins S P,et al.TGF-β1SMAD/p53 /USF2 PAI-1 transcriptional axis in ureteral obstruction-induced renal fibrosis[J].Cell Tissue Res,2012,347( 1) :117-128.
[6] 石永英,卢俊江,陈广原,等.TGF-β1及AngⅡ对大鼠心肌细胞肥大的信号转导通路作用研究[J].心脏杂志,2014,26(5):514-519.
[7] 李 瑜,王凤龙,丁旭娜,等.TGF-β1对奶牛乳腺上皮细胞增殖与凋亡的影响[J].动物医学进展,2012,33(9):53-57.
[8] 刘 倩,史琳凯,李 磊,等.RNA干扰抑制大鼠肺泡巨噬细胞NR8383 TGR5受体表达的研究[J].动物医学进展,2014,35(6):6-10.
[9] 陈志胜,黄晓敏,廖敬森.慢病毒的包装及其对禽细胞的转基因效率研究[J].动物医学进展,2013,34(12):22-24.
[10] 刘笙腩,颜润川,李玲玲,等.miRN A-34c 实时荧光定量PCR检测方法的建立[J].动物医学进展,2013,34 (11):11-15.
[11] Jovicic M J,Lukic I,Radojcic M,et al.Modulation of c-Jun N-terminal kinase signaling and specific glucocorticoid receptor phosphorylation in the treatment of majordepression[J].Med Hypotheses,2015,85 (3):291-294.
[12] Hayden M S,Ghosh S.Regulation of NF-κB by TNF family cytokines[J].Semin Immunol,2014,26(3):253.
[13] Weigert C,Sauer U,Brodbeck K,et al.AP-1 proteins mediate hyperglycemia-induced activation of the human TGF-beta1 promoter in mesangial cells.[J].J Am Soc Nephrol,2000,11(11):2007-2016.
[14] Wang W S,Huang X R,Canlas E,et al.Essential role of smad3 in angiotensin Ⅱ-induced vascular fibrosis [J].Circulation Res,2006,98:1032-1039.
[15] 谢双伦,王景峰,聂如琼,等.以转录因子AP-1为靶点的decoy ODNs对大鼠心肌成纤维细胞增殖及胶原合成的抑制作用[J].南方医科大学学报,2008,28(5):811-814.
Effects of AP-1 and siRNA on TGF-β1in Myocardial Cells
LI Bin,CHEN Jing
(DepartmentofBasicMedicineandForensicMedicine,BaotouMedicalCollege,Baotou,InnerMongolia,014040,China)
To study the effect of transcription factor AP-1 on TGF-β1and cardiomyocytes by using RNA interference method,two pairs of siRNA of AP-1 genes were designed and synthesized,meanwhile unrelated siRNA of AP-1 genes was synthesized as control. The experiment was divided into five groups, including negative control group, positive control group and three interference groups(siRNA-58,siRNA-59,siRNA -60). The cultured rat cardiomyocytes were transfected with AP-1 siRNA using LipofectamineTM2000.Cell morphology was observed by inverted microscope.The changes of mRNA expressions of AP-1 and TGF-β1in cardiomyocytes were detected by real-time quantitative PCR.The results showed,there was no significant difference in the expression of AP-1 gene in siRNA-58 group.In the siRNA-59 group and siRNA-60 group, the expression of AP-1 gene decreased significantly,while the expression of TGF-β1gene was significantly reduced.The results indicated that the expression of AP-1 gene and TGF-β1gene were positively correlated.
activator protein-1; transforming growth factor β1; cardiomyocyte; RNA interference; real-time PCR
2016-05-19
内蒙古自治区高等学校科学技术研究项目(NJZY12215);内蒙古自然科学基金项目(2014MS0804,2016MS(LH)0826)
李 斌(1977-),男,内蒙古包头人,副教授,硕士,主要从事心血管疾病致病机制研究。
S856.2
A
1007-5038(2016)12-0046-04
