天蓝苜蓿黄酮组分的制备及清除DPPH自由基活性研究
2017-01-04李茂星段海婧王泾舟蔡香菊
马 兰 马 骏.2* 李茂星 段海婧,2 王泾舟 蔡香菊
1.甘肃中医药大学,甘肃 兰州 730000;
2.国家中医药管理局中医药科研三级实验室中药药理实验室,甘肃 兰州 730000;
3.兰州军区兰州总院药剂科、全军高原环境损伤与防治重点实验室,甘肃 兰州 730050
天蓝苜蓿黄酮组分的制备及清除DPPH自由基活性研究
马 兰1马 骏1.2*李茂星3段海婧1,2王泾舟1蔡香菊1
1.甘肃中医药大学,甘肃 兰州 730000;
2.国家中医药管理局中医药科研三级实验室中药药理实验室,甘肃 兰州 730000;
3.兰州军区兰州总院药剂科、全军高原环境损伤与防治重点实验室,甘肃 兰州 730050
目的:以聚酰胺色谱柱分离天蓝苜蓿中黄酮组分,研究其清除DPPH自由基的能力。方法:采用多功能动态热回流提取浓缩机组提取天蓝苜蓿乙醇提取物,通过聚酰胺色谱柱吸附黄酮成分,不同浓度乙醇洗脱后,干燥得不同浓度乙醇洗脱物;采用DPPH自由基清除法,比较天蓝苜蓿不同洗脱液中黄酮组分的抗氧化能力。结果:天蓝苜蓿黄酮以三氯化铝显色后于紫外423nm有最大吸收;聚酰胺色谱柱上样洗脱,上样速度:12mL/min,洗脱速度:18mL/min;不同溶剂洗脱物清除DPPH自由基能力为:30%乙醇洗脱物>60%乙醇洗脱物>90%乙醇洗脱物>水洗脱物。结论:聚酰胺色谱柱能够富集分离天蓝苜蓿黄酮组分,且30%乙醇洗脱物清除DPPH自由基能力最强。
天蓝苜蓿;聚酰胺色谱柱;黄酮;DPPH自由基
天蓝苜蓿(MedicagolupulinaL.)为豆科苜蓿属(Medicago)植物的茎叶或地上部分,广泛分布于东北、华北、西北、华中和西南各地;夏、秋采收,洗净晒干备用。其味甘、微涩、性平;具有清热利湿,凉血止血,舒经活络功效;主治黄疸型肝炎[1]。常见的苜蓿有紫花苜蓿、天蓝苜蓿、南方苜蓿。研究表明,紫花苜蓿主要含有黄酮类、多糖类、香豆素类等化合物;具有抗氧化、抗衰老、调节免疫、降血脂等作用[2-4],但对同科植物天蓝苜蓿的药理作用研究未见报道。实验以聚酰胺色谱柱分离天蓝苜蓿中黄酮组分,研究其清除DPPH自由基能力。
1 仪器与材料
1.1 仪器 6GU -50k多功能动态热回流提取浓缩机组(上海矩源机械设备有限公司);RE-52AA旋转蒸发器(上海亚荣生化仪器厂);HH-S26S恒温水浴锅(金坛大地自动仪器厂);HP-8453紫外分光光度计(美国惠普公司);LyoQuest-55plus冷冻干燥(西班牙Telster);BPZ6033LC真空干燥箱(上海-恒科技有限公司);YC1800喷雾干燥(上海雅程仪器设备有限公司);BP2010S电子天平(德国Sartorius公司);SpectraMax i3 全自动荧光酶标仪(美国Molecular公司)。
1.2 材料 天蓝苜蓿于2015年7月采自甘肃省平凉市崆峒区,由甘肃中医药大学药学院中药鉴定教研室杨扶德教授鉴定为豆科苜蓿属天蓝苜蓿(MedicagolupulinaL.)地上部分。聚酰胺(20~40目,批号:20111228,浙江省台州市路桥四甲生化塑料厂);95%乙醇(批号:20150424,甘肃润康药业有限公司制造);无水甲醇(批号:20141127,利安隆博华医药化学有限公司);三氯化铝(批号:HG3-927-76,天津市化学试剂厂);芦丁对照品(批号:100080-20070,中国药品生物制品检定所);DPPH试剂2,2-二苯基苦味酰基苯肼基自由基,(Sigma-Ald rich公司,批号:D9132-1G);维生素C(Sigma-Ald rich公司,批号:A92902-25G);二甲基亚砜(批号:100208,科昊生物工程有限责任公司)。
2 方法
2.1 天蓝苜蓿乙醇提取物的制备 称取1500 g天蓝苜蓿装入多功能动态热回流提取浓缩机组的提取罐中,加5倍70%乙醇浸泡0.5h,以10、10、8倍70%乙醇70℃回流提取三次,每次1h,合并三次回流提取液,减压回收乙醇得浓浸膏,60℃真空干燥得天蓝苜蓿乙醇提取物,得率为32.6%,即每克干浸膏相当于3.07g生药材。
2.2 聚酰胺色谱柱分离天蓝苜蓿黄酮组分
2.2.1 聚酰胺吸附剂的预处理 20~40目筛选聚酰胺吸附剂颗粒1000g,用95%乙醇浸润及浸泡过夜(≥12h),然后用大量蒸馏水洗去乙醇,装入玻璃层析柱,用蒸馏水冲洗密集后进行上样。
2.2.2 聚酰胺色谱柱的动态吸附及解吸 取适量天蓝苜蓿乙醇提取物,加蒸馏水溶解成0.1g/mL天蓝苜蓿提取物上样母液。上样速度:12mL/min,每收集200mL为1份,取流出液用紫外分光光度计进行扫描,测263nm波长处紫外吸光度值(A)。流出液与上样母液图谱相似时即为饱和,停止上样。相继用蒸馏水、30%、60%和90%乙醇进行洗脱(洗脱速度:18mL/min,同上,用紫外分光光度计进行扫描,在263、364nm波长处紫外吸光度值(A),洗脱曲线近似平直时为终点。以紫外吸光度值(A)和洗脱液体积,制作吸附曲线与洗脱曲线。
2.2.3 不同乙醇浓度天蓝苜蓿黄酮组分制备 将2.2.2所述方法得到的水洗脱液进行喷雾干燥(风速:25m/s,进样速度15mL/min),减压回收30%、60%、90%洗脱液,浓缩至一定体积,冷冻干燥。得水洗脱物、30%、60%、90%乙醇洗脱物,得率分别是55%、7.87%、7.62%、13.62%(55g、7.87g、7.62g、13.65g)。
2.3 天蓝苜蓿乙醇提取物黄酮组分含量测定
2.3.1 供试品溶液的制备 精密称取“2.2.3”方法中制备的洗脱物各0.1g,用70%乙醇配置为1mg/mL供试品溶液。
2.3.2 对照品溶液的制备 精密称取减压干燥至恒重的芦丁对照品0.1g置于100mL容量瓶中,加70%乙醇溶液至刻度,超声溶解,定容。即为1mg/mL芦丁对照品溶液。
2.3.3 标准曲线绘制 将1mg/mL芦丁标对照品溶液,准确吸取0.5、1.0、1.5、2.0、2.5mL分别置于10mL容量瓶中,分别加入2mL 0.1mol/L三氯化铝甲醇溶液,加蒸馏水摇匀,定容。以相应溶液为空白,于423nm波长处测定吸光度。以吸光度为纵坐标对芦丁浓度作图,绘制标准曲线,回归方程:Y=0.341X±0.0327(R2=0.9994)即在0.03707~0.16561mg范围内线性关系良好。
2.3.4 精密度实验 精密吸取芦丁对照品溶液1mL,置于10mL容量瓶中,按2.3.3中方法测定其吸光度,重复测6次,RSD=0.24%,表明此方法精密度良好。
2.3.5 稳定性实验 取供试品溶液(70%乙醇提取物溶液),按“2.3.3”中的方法,分别0、10、20、30、40、50、60min测定吸光度,RSD=0.43%,表明供试品溶液在60min内稳定性良好。
2.3.6 重复性实验 精密称取6份天蓝苜蓿70%乙醇提取物0.1g,按2.3.1项制备供试品溶液然后各精密吸取1mL,分别置于10mL容量瓶中,分别加入2mL 0.1mol/L三氯化铝甲醇溶液,加蒸馏水摇匀,定容。按“2.3.3”项下方法于423nm处测定其吸光度,计算得RSD=0.33%,表明此方法重复性良好。
2.3.7 加样回收率试验 精密称取已知含量的70%乙醇提取物0.05g共6份,置于10mL容量瓶中,加入一定量的芦丁对照品,加70%乙醇溶液至刻度,超声溶解,定容。按“2.3.3”项测定其吸光度,6次测定平均回收率为97.05%,RSD为1.12%。结果见表1。
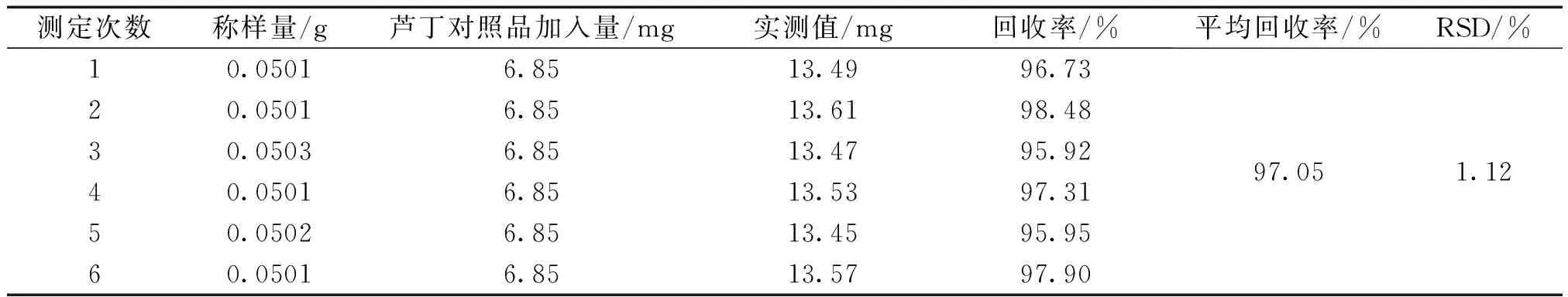
表1 天蓝苜蓿供试品溶液黄酮含量测定的回收率实验
2.3.8 测定 精密吸取天蓝苜蓿70%乙醇提取物、30%、60%、90%乙醇洗脱物,水洗脱物供试品溶液各2.5mL至10mL容量瓶中,分别加入2mL 0.1mol/L三氯化铝甲醇溶液,加蒸馏水定容。在423nm波长处测定吸光值。样品中的黄酮含量在标准曲线中查出相应值,天蓝苜蓿中的黄酮含量以芦丁对照品相对含量表示。
2.4 清除DPPH自由基自由基活性的测定方法
2.4.1 DPPH标准溶液制备 称取2mgDPPH自由基放置于50mL棕色容量瓶中,加无水乙醇溶解,定容。即0.04mg/mL DPPH自由基[5-6]。
2.4.2 DPPH自由基测定波长的选择 取2700μL 0.04mg/mL DPPH自由基与300μL的DMSO(二甲基亚砜)混合,在紫外分光光度计200~700nm范围扫描,最终DPPH自由基在520nm处有最大吸收。
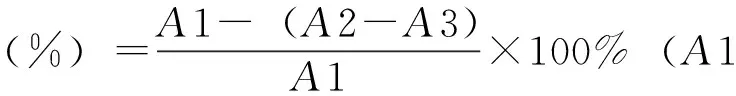
3 结果
3.1 聚酰胺色谱柱的动态吸附及解吸结果 天蓝苜蓿上样曲线,洗脱曲线如图1、2所示。由图1可知,从第3流份开始,流出液与母液峰形状相似,到第6流份流出液与母液图谱重合,此时母液上样体积约为1000mL,上样达到饱和。图2为蒸馏水洗脱完毕后,由30%、60%、90%依次进行洗脱时的曲线。30%洗脱后从第2份开始洗脱曲线在364nm有吸收,第15份吸收值最大,组分大部分被洗出,第25份时,吸收值与未洗脱前吸收值相似,即组分30%乙醇部位基本洗脱完全。继续用60%乙醇洗脱,第32、第45份时,吸收值最大及60%乙醇部位基本洗脱完全。继续用90%乙醇洗脱,第48、第65份时吸收值最大及90%乙醇部位基本洗脱完全。水洗脱液、30%、60%、90%乙醇洗脱液总量分别是5830mL、5000mL、3300mL、5000mL。
3.2 测定波长的选择 样品中黄酮含量的经典测定方法有亚硝酸钠-硝酸铝,酸水解后二氯氧锆,三氯化铝等显色法。在测定天蓝苜蓿中的黄酮组分时,最终以三氯化铝显色后进行紫外扫描,与标准品芦丁在400~430nm处波形相似。在423nm处有最大吸收,故选423nm为最大吸收测定波长。如图3所示,天蓝苜蓿不同浓度乙醇中黄酮组分紫外扫描图。

3.3 天蓝苜蓿不同浓度乙醇中黄酮含量的测定结果 由表2可知,100g天蓝苜蓿70%乙醇提取物经过聚酰胺色谱柱富集分离后,每克30%、60%、90%乙醇洗脱物是70%乙醇提取物中黄酮的3.14、1.54、3.91倍,回收总黄酮90.7%。
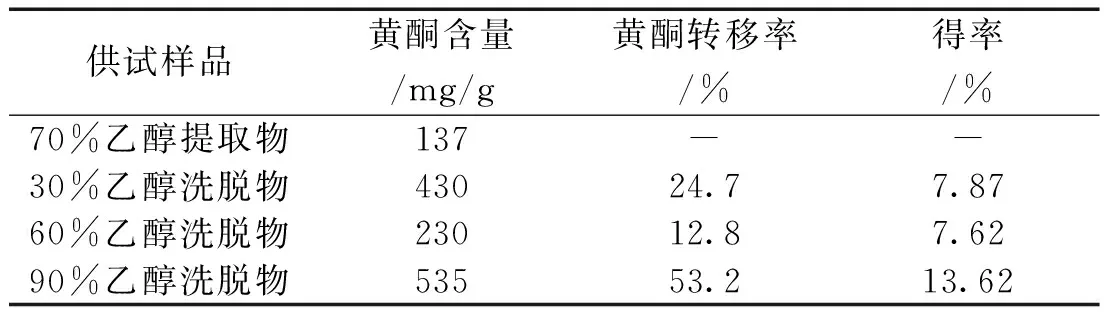
表2 不同浓度乙醇中天蓝苜蓿黄酮含量
3.4 供试样品清除自由基活性的测定结果 由图4、表3可知,几种供试样品对DPPH自由基的清除活性的IC50大到小的顺序为Vc<30%乙醇洗脱物<60%乙醇洗脱物<90%乙醇洗脱物<70%乙醇提取物<水洗脱物。即从聚酰胺色谱柱富集分离的不同天蓝苜蓿黄酮组分均具有清除DPPH自由基的能力且效果较好,也可以得出清除DPPH自由基能力为30%乙醇洗脱物>60%乙醇洗脱物>90%乙醇洗脱物>70%乙醇提取物>水洗脱物。
4 讨论
实验由于制备量较大,则应用多功能动态热回流提取浓缩机组提取设备,经过聚酰胺色谱柱富集分离后,根据洗脱量和减少有效成分的损失选用冷冻干燥机、真空干燥箱、干燥喷雾器等不同的干燥设备干燥。聚酰胺色谱柱分离天蓝苜蓿黄酮组分不仅方法简单,成本低,效率高,稳定性好且容易再生。聚酰胺色谱柱分离天蓝苜蓿黄酮组分时,上样,洗脱时全程有紫外-可见分光光度进行全程监测,保证了上样准确,洗脱完全。天蓝苜蓿经过聚酰胺分离后,每克30%、60%、90%乙醇洗脱物是70%乙醇提取物黄酮的3.14、1.54、3.19倍。
考察天蓝苜蓿黄酮组分显色检测方法时,用亚硝酸钠-硝酸铝,酸水解后二氯氧锆等显色后进行紫外-可见分光光度计于300~900nm处扫描都未能找到与标准品相似的的峰型。最终用三氯化铝显色后,样品与标准品在300~900nm扫描后有相似的峰,且在423nm处有最大吸收,即本实验选择三氯化铝比色法作为天蓝苜蓿中黄酮组分含量测定的方法。
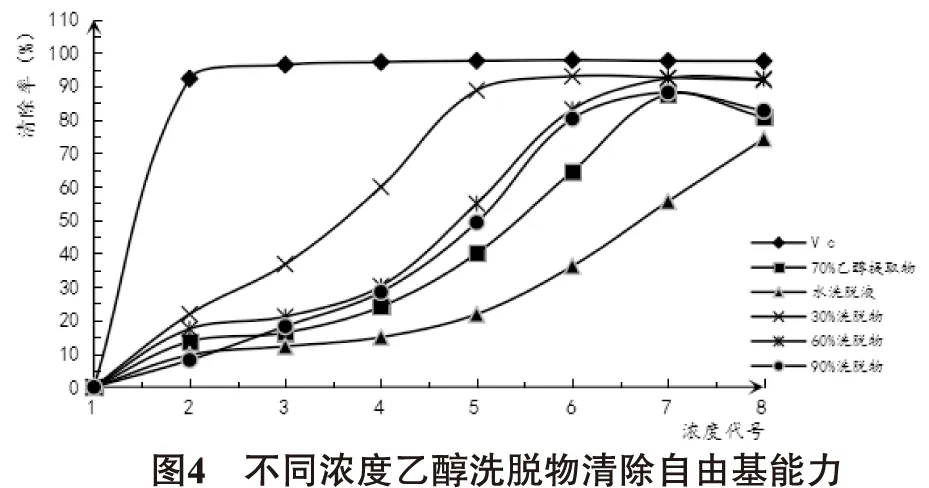
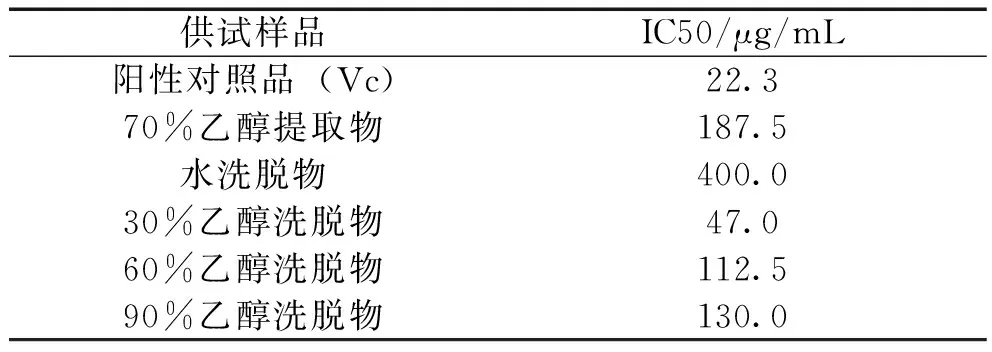
表3 供试样品对DPPH自由基的清除活性的IC50
清除DPPH自由基实验表明天蓝苜蓿黄酮组分具有一定抗氧化作用,且经过聚酰胺色谱柱分离后,清除DPPH自由基的能力增强,且清除能力为30%乙醇洗脱物>60%乙醇洗脱物>90%乙醇洗脱物>70%乙醇提取物>水洗脱物,但都小于阳性对照品Vc。从清除DPPH自由基的活性IC50可得出30%乙醇洗脱物是60%乙醇洗脱物的2.3倍,90%乙醇洗脱物的2.8倍,由此可得出天蓝苜蓿中的各黄酮组分都具有清除自由基的作用,清除能力与黄酮含量有一定关系但从实验数据得出与黄酮种类的关系更密切。由本实验得30%乙醇洗脱物清除DPPH自由基能力最强。
[1]《全国中草药汇编》编写组.全国中草药汇编(下册)[M].北京:人民卫生出版社,1978:103.
[2]刘让元.苜蓿的药用价值[J].中国食物与营养, 2010,7:76-78.
[3]王胜超,张国刚,米文珍.紫花苜蓿化学成分及药理活性的研究进展[J].沈阳药科大学学报,2009,26(3):243-248.
[4]何春年,高微微,徐文燕,等.紫花苜蓿黄酮类化学成分的研究[J].中草药,2008,39(12):1783-1785.
[5]赵丹,张秀玲.酸浆宿萼黄酮提取工艺优化与自由基清除活性研究[J].食品科技,2013,38(1):232-236.
[6]庄晶晶,陈卫,李亚,等.黑莓黄酮的自由基清除活性与防护肝细胞氧化损伤研究[J].中国食品学报,2015,15(7):46-53.
(编辑:梁志庆)
The Preparation of Flavonoid Components fromMedicagoLupulinaL. and the Free of DPPH Radical Scavenging Activities
MA Lan1MA Jun1,2*LI Maoxing3Duan Haijing1,2Wang Jingzhou1Cai Xiangju1
1.Gansu University of Traditional Medicine, Lanzhou 730000,China;2.3-Level Laboratory for Scientific Research Approved by SATCM Laboratory for Chinese Pharmacology, Lanzhou 730000,China;3.Department of Pharmacy, Lanzhou General Hospital of PLA, Key Larboratory of Prevetion and Cure for Plateau Enviornment Damage of PLA, Lanzhou 730050,China
Objective By polyamide chromatographic column separation of flavonoid components fromMedicagolupulinaL. and investigate the DPPH radical scavenging ability. Methods Multifunctional dynamic heat reflux extraction and concentration unit was used to extract the ethanol extract fromMedicagolupulinaL. and absorbed by polyamide chromatographic column, The column was eluted by ethanol with different concentration. The effluents were evaporated and dried in Vacuum, respectively. The antioxidant properties of different effluents were undertaken employing DPPH scavenging activity. Results Confirm that after chemical coloration of alchlor, by ultraviolet spectrophotometer at 423 nm measuredMedicagolupulinaL. Sample elution of polyamide chromatographic column, sample rate: 12mL/min, elution rate: 18mL/min. The ability of scavenging DPPH free radical with different solution was: 30% ethanol elution > 60% ethanol elution > 90% ethanol elution > queous elution. Conclusion Polyamide chromatographic column can be used to the enrichment and purification of flavonoids fromMedicagolupulinaL. 30% ethanol elution showed best DPPH radical scavenging ability than other parts.
MedicagolupulinaL.; Polyamide Chromatographic Column; Flavonoids; DPPH Free Radical;
2016-10-09
甘肃省自然科学研究基金计划项目(131ORJZA087)。
马兰(1991-),女,回族,在读硕士研究生,研究方向为中药药理与毒理。E-mail:1532058546@qq.com
马骏(1966-),男,回族,硕士,教授,硕士研究生导师,研究方向为中药药理与毒理。E-mial:zhongjm615@sina.com
R914
A
1007-8517(2016)23-0029-04
