氯吡脲在枇杷中的残留降解及其膳食风险评估
2017-01-04梁赤周陈小微
虞 淼,姚 芳,梁赤周,徐 永,陈小微
(浙江省农药检定管理所,浙江杭州 310020)
氯吡脲在枇杷中的残留降解及其膳食风险评估
虞 淼,姚 芳,梁赤周,徐 永,陈小微
(浙江省农药检定管理所,浙江杭州 310020)
采用简单快速的前处理方法结合液相色谱串联质谱准确测定氯吡脲在枇杷果实中的残留量,明确其消解规律,并进一步结合现有的风险评估模型,评价了杭州地区氯吡脲使用的环境和膳食风险。连续试验数据表明,氯吡脲在枇杷中的消解符合一级反应动力学方程,半衰期分别为2.89~4.08 d;在推荐剂量和2倍推荐剂量(100和50倍稀释倍数)下,在枇杷果径长至1 cm时浸泡施药1次,施药7 d后其残留量分别为0.039 8和0.052 8 mg·kg-1,施药21 d后均未检出,环境和膳食风险低。
氯吡脲;枇杷;残留;膳食风险评估
氯吡脲(forchlorfenuron)又称吡效隆、CPPU、KT-30等,其化学名称1-(2-氯-4-吡啶基)-3-苯基脲,CAS登记号68157-60-8,是一种新型的人工合成取代苯脲类植物生长调节剂。氯吡脲对提高坐果率、促进果实膨大及实现单性结实等方面具有显著效果,给使用者带来显著经济利益,也因此被广泛应用于各种果树和果菜类生产[1]。
自1987年四川大学在国内率先合成氯吡脲开始,我国对氯吡脲在农业生产中的应用开展了广泛的研究,基本涵盖了黄瓜、西瓜、草莓、苹果、梨、桃、猕猴桃、葡萄、柑橘、枇杷、菠萝等主要果树和果菜类。试验结果多令人满意,但因氯吡脲可能会对人体健康带来潜在危害[2],各国对其最高残留量做出了严格限定。GB 2763—2014规定,氯吡脲在猕猴桃、葡萄和枇杷上的限量值为0.05 mg·kg-1,在黄瓜和西瓜上为0.1 mg·kg-1。关于氯吡脲在果蔬中的残留[3-6]等安全性问题研究相对较少,范围也较为局限。柴振林等[4]研究了不同浓度氯吡脲在猕猴桃中的残留动态,掌握潜在风险,指导安全生产;侯玉茹等[5]采用固相萃取-高效液相色谱法对葡萄中的氯吡脲残留量进行测定;龚勇等[6]建立了氯吡脲在黄瓜、西瓜和土壤中的残留分析方法。近年来,随着越来越多的乒乓球葡萄、顶花带刺的黄瓜、体形硕大却淡而无味的猕猴桃等非常规果蔬产品的出现,使民众对氯吡脲等植物生长调节剂潜在的安全性问题表现出极大地疑虑,而2011年5月江苏的西瓜爆炸事件(缘于氯吡脲的使用不当)更是引发了消费者恐慌,虽经权威部门的及时辟谣而平静,但问题并未完全解决,亟须进一步研究。
张志恒等[7]的氯吡脲膳食风险评估报告,通过现有数据和模型及周密研算,明确指出我国各类人群氯吡脲残留的膳食摄入风险非常低,现有的氯吡脲MRL标准对消费者具有较高的保护水平。但该报告同时也指出,由于残留数据的缺乏,风险评估还存在一定的不确定性。有鉴于此,本文按照我国农药残留登记试验的要求进行了氯吡脲在杭州地区枇杷上的残留试验,以成熟的前处理方法和定性定量准确的液相色谱串联质谱仪共同提供严谨的残留数据,为科学评价氯吡脲的膳食风险提供坚实的数据基础。
1 材料与方法
1.1 供试材料
试验地点设在浙江省海宁市许村浙江省农业科学院杨渡科研基地。供试枇杷品种为未施用过氯吡脲的枇杷果园中树龄为5~7年且长势良好的白沙枇杷树。
仪器有液相色谱-串联质谱仪(Waters Xevo TQ MS),匀浆机(IKA®-WERKE,T25 basic),电热恒温水浴锅(上海浦东荣丰科技仪器有限公司,H. H.S-8),水浴氮吹仪(Organomation Associates Jnc,N-EVAP 112),旋涡混匀器(IKA MS3 basic),电子天平(BSA2202S,Sartoris公司)。
试剂有1 000 mg·L-1氯吡脲(forchlorfenuron)标准溶液(农业部环境保护科研监测所);0.1%氯吡脲水剂(成都施特优化工有限公司);乙腈为UV级(Honeywell Burdick&Jackson公司);乙二胺-N-丙基硅烷吸附剂(PSA)、无水硫酸镁、氯化钠等试剂均为市售分析纯;试验用水为去离子水;有机滤膜0.22μm。
1.2 消解动态处理设计
每小区2株,设3个重复及空白对照区,小区间设保护行。0.1%氯吡脲因易引起药害(枇杷裂果),因此按说明书推荐剂量施用,即稀释100和50倍,施药方式为浸渍1 cm左右果径的幼果(疏掉其余幼果及花蕾)30 s,并分别于施药后2 h(果实表面干爽)和2、5、7、14、21、28 d后采集枇杷样品。
1.3 分析方法
1.3.1 样品预处理
将采集的样品去核后高速捣碎,装瓶密封后在-20℃冰箱中保存待测。
1.3.2 样品提取与净化
称取枇杷样品30.00 g,置于250 m L的烧杯中,加入60 m L乙腈,高速匀浆2 m in后过滤到100 m L具塞量筒中,加入6 g氯化钠,振摇提取1 m in,静止15 m in分层后,分离有机相和水相,用吸量管量取10 m L有机相于50 m L小烧杯中,于80℃水浴氮吹至近干。用2 m L二氯甲烷+甲醇(9∶1,V/V)混合液溶解,待净化。
净化用氨基柱,先用4 m L二氯甲烷+甲醇(9∶1,V/V)的混合液预淋洗柱子,当溶液到达吸附层表面时,立即将上述浓缩液加至柱中,并用10 m L的刻度试管接洗脱液,以上述混合液4 mL洗涤3次,收集全部淋洗液。将收集的洗脱液在45℃水浴氮吹仪吹至近干,用2 m L的甲醇溶解,再加入2 m L超纯水混合摇匀。静止至室温后,用超纯水定容至5 m L,用0.22μm滤膜过滤,滤液加入进样瓶,待上机。
1.3.3 色质谱条件
色谱柱为C18柱(100 mm×2.1 mm×2.6μm);流动相为甲醇(A)与0.1%乙酸铵溶液(B);进样量5μL。洗脱条件及流速见表1。电离方式为ESI+;离子源温度150℃;毛细管电压为3.0 KV;脱溶剂气温度500℃;脱溶剂气流量800 L·h-1;锥孔反吹气流量40 L·h-1;碰撞气流速0.15 mL· min-1;锥孔电压30 V;检测方式为多反应监测MRM,m/z 247.9/129.0为定量离子对,m/z 247.9/93.1为定性离子对。
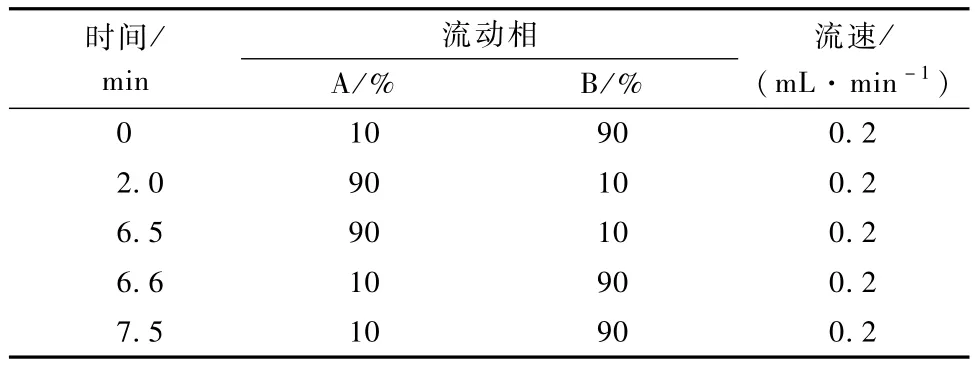
表1 流动相梯度及流速
1.3.4 标准工作曲线
准确移取浓度为1 000 mg·L-1氯吡脲标准溶液1.00 m L,用乙腈溶解并定容至10.0 m L,配制成浓度为100 mg·L-1的标准母液,再用空白样品提取溶液将标准母液稀释混匀,最终得到质量浓度分别为0.01、0.05、0.10、0.50、1.00、5.00 mg·L-1的标准工作液,过膜后检测。以进样质量浓度为x轴,峰面积为y轴,得到标准工作曲线。
1.3.5 数据统计
数据采用外标法定量,添加回收率采用单点法,样品消解动态采用标准曲线法定量计算。
2 结果与分析
2.1 方法的灵敏度与线性范围
通过基质加标的方式得到枇杷中的最低检测浓度为0.003 4 mg·kg-1(S/N=10),在0.01~5.00 mg·L-1质量浓度范围内的标准曲线方程为Y=476.4 X+164.9,R2=0.997,具有良好的灵敏度和线性范围。
2.2 添加回收率
在枇杷果实(去核)中添加氯吡脲标准溶液,使得枇杷果实中加标浓度分别为0.01,0.10和1.00 mg·kg-1,每浓度重复3次,测定方法的回收率。
表2显示,当添加水平为0.01~1.00 mg· kg-1时,回收率78.6%~127.1%,相对标准偏差(RSD)为1.4%~8.4%之间,符合农药残留分析要求。
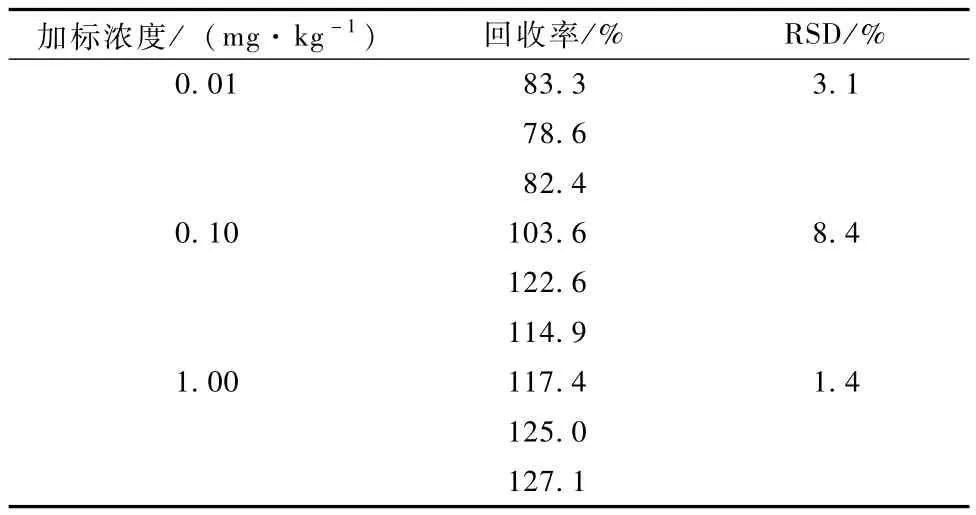
表2 氯吡脲在果实(去核)中的添加回收率
2.3 消解动态
2011年实行10和20 mg·L-1氯吡脲在枇杷上的消解动态试验(表3)。经回归分析,消解规律符合一级动力学反应模式,回归方程分别为ct= 0.188 e-0.24t(R2=0.930)和ct=0.310 e-0.17t(R2= 0.828),半衰期分别为2.89和4.08 d。
2.4 最终残留及膳食风险评估
不同施药剂量和不同采收间隔期的最终残留水平研究结果显示,距最后1次施药5 d采收的枇杷样品,氯吡脲的残留量均小于0.1 mg·kg-1,随着采收时间延长至7 d,残留量进一步降低,推荐剂量施药下的残留量为0.039 8 mg·kg-1,低于国标限量要求(0.05 mg·kg-1);2倍推荐剂量施药下的残留量为0.052 8 mg·kg-1,略高于国标的限量要求;当采收时间再延长时,残留量均低于国标要求甚至未检出。
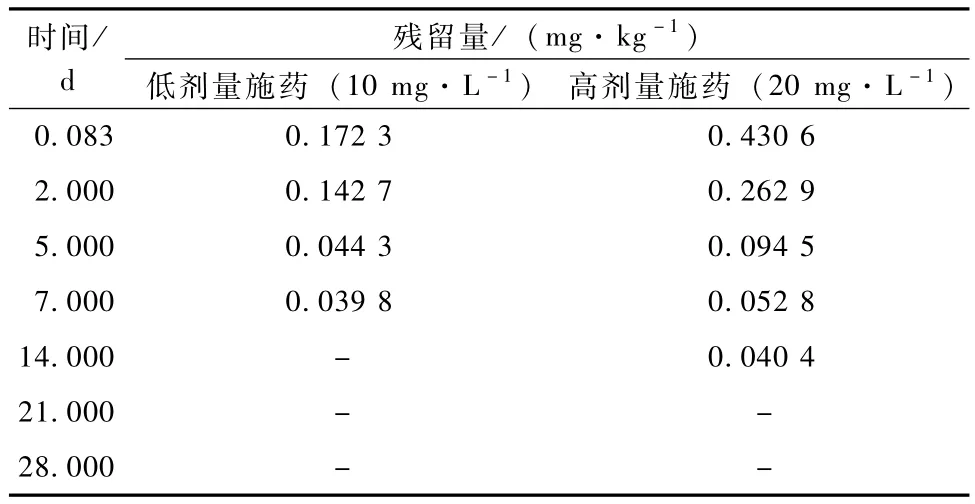
表3 氯吡脲在枇杷果实中的消解动态
3 小结
本试验采用高效液相色谱质谱法对枇杷中氯吡脲进行残留分析,前处理用液相萃取技术,C18色谱柱分离,简化了试验步骤,缩短了试验时间。以10倍信噪比计算出枇杷中氯吡脲的最低检出浓度为0.003 4 mg·kg-1,在0.01~1.0 mg·kg-1添加范围内,回收率在78.6%~127.1%,RSD为1.4%~8.4%,符合农药残留试验准则的要求。通过喷施2种不同剂量氯吡脲,检测发现,枇杷中常规剂量和加倍剂量下的消解半衰期分别为2.89和4.08 d,施药21 d后残留量未检出。这将为今后高效、安全、合理使用氯吡脲提供一定的参考价值。
[1] 张卫炜,杨永珍.氯吡脲的研究及应用进展[J].农药科学与管理,2006,27(5):36-40.
[2] 李瑞娟,于建垒,宋国春.氯吡脲的环境行为及其安全性的研究进展[J].农药,2008,47(4):240-243.
[3] 雷绍荣,郭灵安,毛建霏,等.氯吡脲残留检测技术进展及趋势[J].中国测试,2011,37(6):53-56.
[4] 柴振林,杨柳,朱杰丽,等.氯吡脲在猕猴桃中的残留动态研究[J].果树学报,2013,30(6):1011-1015.
[5] 侯玉茹,杨媛,石磊,等.固相萃取-高效液相色谱法检测葡萄中氯吡脲的研究[J].食品科技,2011,36(1):255-258.
[6] 龚勇,单炜力,简秋,等.黄瓜、西瓜和土壤中氯吡脲残留分析方法[J].农药科学与管理,2011,32(11):30-34.
[7] 张志恒,汤涛,徐浩,等.果蔬中氯吡脲残留的膳食摄入风险评估[J].中国农业科学,2012,45(10):1982-1991.
(责任编辑:张瑞麟)
S481
:A
:0528-9017(2016)12-2091-03
文献著录格式:虞淼,姚芳,梁赤周,等.氯吡脲在枇杷中的残留降解及其膳食风险评估[J].浙江农业科学,2016,57(12):2091-2093.
10.16178/j.issn.0528-9017.20161253
2016-08-15
虞 淼(1981—),男,浙江宁波人,农艺师,硕士,从事农产品中农药残留分析、农产品质量安全工作,E-mail:yumiao2020@sina.com。
