茶多酚对一次性力竭运动大鼠氧化应激和炎症反应的影响
2017-01-04吴秀琴尹玉娇何少栖刘丽霞
吴秀琴,杨 威,尹玉娇,何少栖,刘丽霞
茶多酚对一次性力竭运动大鼠氧化应激和炎症反应的影响
吴秀琴,杨 威,尹玉娇,何少栖,刘丽霞
目的:探讨茶多酚对力竭运动大鼠氧化应激和炎症因子的影响,为减少运动损伤寻找有效的干预手段。方法:24只雄性SD大鼠按体重随机分为对照组(C)、力竭组(E )和茶多酚力竭组(F,300 mg/kg/d茶多酚灌胃),4周后,进行一次力竭游泳运动,测定大鼠血清肌酸激酶(CK)、乳酸脱氢酶(LDH)、丙二醛(MDA)以及炎症细胞因子白细胞介素(IL-1β,IL-10)和肿瘤坏死因子-α(TNF-α)含量。结果:与C组相比,E组大鼠力竭运动后血清CK、LDH活性和MDA含量显著升高(P<0.05);促炎因子TNF-α和抗炎因子IL-10水平显著增加(P<0.01和P<0.05)。与E组相比,F组大鼠血清CK、LDH活性和MDA含量显著降低(P<0.05);促炎因子IL-1β和TNF-α水平显著下降(P<0.05),而IL-10/TNF-α比值显著升高(P<0.05)。相关性分析显示,MDA与CK和TNF-α之间存在显著正相关(P<0.05),与IL-10/TNF-α比值呈非常显著负相关(P<0.01)。结论:茶多酚补充能提高机体抗氧化状态,减轻炎症反应,对力竭运动的大鼠骨骼肌具有保护作用。
力竭运动;茶多酚;炎症因子;氧化应激;肌肉损伤
规律的运动有利于健康,可以降低心血管病、癌症和糖尿病的风险。然而,剧烈运动能引起摄氧量的显著增加,随着代谢活性的提高氧利用率的增加将引起活性氧(ROS)产生增多[24],当ROS产生的数量超过内源性抗氧化系统的防御能力时,会出现氧化应激。氧化应激会导致组织和细胞大分子如脂类、蛋白质和核酸的破坏[15]。有证据表明,运动引起的氧化应激可能与肌肉疲劳、肌肉损伤和运动能力下降有关[16,27,28]。运动后肌肉损伤或ROS增加促进急性期局部炎症反应,表现为炎症因子从各类型细胞中产生,刺激中性粒细胞和巨噬细胞向炎症部位聚集以修复受损组织[19,29]。而浸润的中性粒细胞和巨噬细胞会产生额外的超氧阴离子,可能加剧肌肉损伤[11,25]。因此,各种能减少剧烈运动自由基产生和抗炎症的补剂深受人们青睐。
茶多酚是茶叶中提取的多酚类物质,是茶叶的主要有效成分。大量的流行病学研究、体外实验及动物实验证实,茶多酚生物活性广泛,具有抗氧化,降血糖、抗炎、抗肿瘤和免疫调节作用[5]。以往的研究支持了茶多酚能减轻运动引起的氧化应激[2,4]。然而,茶多酚对运动引起的炎症的影响以及氧化应激与炎症之间的关系鲜有报道。本研究的目的是,探讨补充茶多酚对力竭运动大鼠血清炎症因子、氧化应激和肌肉损伤的影响。
1 实验材料与方法
1.1 实验材料
选取6周龄清洁级SD雄性大鼠24只,由福建医科大学实验动物中心提供,质量合格证号:NO.0000999(许可证编号:SCXK(闽)2012-001),体重157.47±7.65 g。采用国家级标准啮齿类动物饲料(由北京华阜康生物科技股份有限公司提供,产品许可证号:SCXK(京)2009-0008京饲审(2009)06170)分笼饲养,每笼4只,自由饮食饮水。动物房温度控制在22±2℃之间,相对湿度45%-55%,自然光照。隔天用消毒液对动物房进行消毒。
1.2 实验分组和喂养方案
所有大鼠在适应性喂养5天后,按体重随机分为3组:对照组(C组),力竭组(E组),茶多酚力竭组(F组),每组各8只。F组大鼠按每天300 mg/kg体重的剂量灌胃茶多酚(茶多酚用蒸馏水溶解,含量为92%,由福建省宁德市仙洋洋食品科技有限公司提供),灌胃给药体积为1 mL/100 g;C组和E组灌胃等剂量的蒸馏水;每周测量一次大鼠体重并调整给药体积,补剂干预时间为上午9:00—10:00,每日灌服1次,持续4周。
1.3 运动方案
C组大鼠不进行任何运动干预;E组和F组大鼠在灌胃结束前4天开始无负重适应性游泳训练3天,每天20 min。游泳池的规格为直径60 cm的塑料圆桶,水深60 cm,水温32℃±1℃。E组和F组大鼠于最后一次灌胃结束后,次日上午9:00尾部负自身体重3%进行一次性力竭游泳运动。判断力竭标准:大鼠连续在水面下运动,沉入水中10 s不能回到水面,捞出后不能完成翻正反射。
1.4 样本采集与保存
C组大鼠于灌胃结束后次日上午9:00,E组和F组于力竭运动结束后即刻,用20%的乌拉坦溶液麻醉,腹主动脉取全血3 mL置于普通采血管内,室温放置0.5 h待其自然凝固,4℃,3 000 rpm,离心10 min,留取上层血清,置于-80℃冰箱保存,用于测定CK、LDH、MDA以及炎症因子IL-1β、TNF-α和IL-10。
1.5 指标检测
测定MDA采用硫代巴比妥酸法(TBA)法;测定CK采用乙酰半胱氨酸法;测定LDH采用苯肼显色法;测定炎症因子采用ELISA方法,试剂盒由南京建成生物工程研究所提供。
1.6 统计学分析
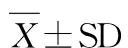
2 结果
2.1 各组大鼠血清CK和LDH的变化
如表1所示,与C组相比,E组大鼠力竭运动后CK、LDH水平显著升高(P<0.05);与E组相比,F组大鼠血清CK、LDH水平明显下降(P<0.05)。
表 1 各组大鼠血清CK 、LDH和MDA水平一览表
Table1 The Levels of Serum CK、LDH and MDA in Different Groups

CK(U/mL)LDH(U/L)MDA(nmol/mL)C组1.35±0.383377.89±1292.163.32±0.51E组1.86±0.35*5085.21±1340.39*4.01±0.34*F组1.41±0.47#3436.58±1299.85#3.53±0.46#
注:*P<0.05,代表与C组相比;#P<0.05,代表与E组相比,下同。
2.2 各组大鼠血清氧化应激水平的变化
如表1所示,与C组比较,E组大鼠血清MDA含量显著上升(P<0.05);与E组比较,F组大鼠血清MDA含量明显下降(P<0.05)。
2.3 各组大鼠血清促/抗炎细胞因子的变化
如表2显示,与C组相比,E组大鼠血清TNF-α和IL-10水平显著升高(P<0.01和P<0.05),IL-1β水平升高但没有显著差异(P>0.05);F组大鼠IL-10水平显著升高(P<0.05)。与E组相比,F组大鼠血清IL-1β、TNF-α水平显著下降(P<0.05),IL-10有升高的趋势(P>0.05),而IL-10/TNF-α比值显著上升(P<0.05)。
2.4 CK、MDA与炎症因子的相关性
如表3显示,CK与MDA显著正相关(P<0.05),CK、MDA与炎症因子TNF-α非常显著正相关(P<0.01),而MDA与IL-10/TNF-α比值呈非常显著负相关(P<0.01)。
表 2 各组大鼠血清IL-1β、TNF-α、IL-10和IL-10/TNF-α水平一览表
Table 2 The Levels of Serum IL-1β、TNF-α、IL-10 and L-10/TNF-α in Different Groups

IL-1β(ng/L)TNF-α(ng/L)IL-10(ng/L)IL-10/TNF-αC组36.11±1.46128.35±13.6073.32±3.890.57±0.03E组37.73±2.11160.37±7.03**83.57±12.19*0.52±0.07F组33.78±4.89#141.07±21.77#84.92±9.95*0.61±0.10#
注:**P<0.01,代表与C组相比。
表 3 CK、MDA和炎症因子之间的相关性一览表
Table 3 The Correlation between CK,MDA and Inflammation Cytokines

MDAIL-1βTNF-αIL-10IL-10/TNF-αCK0.59&0.380.65&&0.37-0.34MDA10.380.69&&0.12-0.59&&
注:&表示P<0.05,&&表示P<0.01。
3 讨论
许多文献已证实力竭运动能引起氧化应激、炎症反应和肌细胞结构损伤,发现血浆中胞质酶活性增加,即肌酸激酶(CK)和乳酸脱氢酶(LDH)活性增加[8,18,21]。血浆CK和LDH的活性是肌纤维损伤常见的标志物。本研究结果显示,力竭运动后血清CK、LDH水平显著升高,与前人的研究结果相一致。运动引起血清CK水平增加表明了肌细胞膜通透性的增加,而CK的增加与脂质过氧化产物丙二醛(MDA)的增加呈显著正相关(r=0.59,P<0.05),反映氧化应激参与了肌肉损伤过程。因此,可推测运动引起活性氧产生增加可能影响肌细胞膜的通透性,进而使肌细胞中的酶进入循环中[20]。与E组相比,F组运动后血清CK和LDH的水平显著降低,表明茶多酚对力竭运动的大鼠骨骼肌具有保护作用。
在正常生理条件下,氧自由基的产生和抗氧化防御机制处于平衡状态,但剧烈运动时,体内的氧化与抗氧化作用将失衡并导致细胞损伤。MDA是氧自由基反复攻击细胞膜的多不饱和脂肪酸而形成的脂质过氧化产物,被广泛地用做评价脂质氧化损伤的指标,因此,MDA可作为反映氧化应激的间接指标[15]。力竭运动后血清MDA含量增加已得到证实[6,17,22]。研究认为,力竭运动会使组织中抗氧化酶过度消耗,导致运动后即刻抗氧化酶活性下降,不足以平衡运动应激情况下产生的自由基,多余的自由基会引起不饱和脂肪酸形成脂质过氧化物,超过机体的保护机制,将导致氧化损伤[30]。本研究显示,力竭运动后大鼠血清MDA含量显著增加,表明急性力竭运动引起机体氧自由基脂质过氧化反应增强,机体表现为氧化应激状态。茶多酚组大鼠血清MDA水平显著下降,证实了茶多酚的抗氧化作用,与其他研究提出茶多酚能减轻氧化应激的结果相一致[2,4]。茶多酚可能通过激活细胞内抗氧化防御系统或者直接清除自由基[1],降低脂质过氧化反应产物来减轻急性力竭运动引起的氧化应激,从而有助于推迟肌肉损伤的发生和发展。
剧烈运动引起肌肉损伤,机体对运动后组织损伤的反应与感染引起的炎症免疫应答相似[26]。白细胞被动员和激活,诱导急性期反应,促炎细胞因子产生增加,细胞浸润和组织损伤[10]。事实上,肌肉损伤引起促炎细胞因子如白细胞介素IL-1β,IL-6和TNF-α的释放,紧接着激活抗炎细胞因子IL-10及IL-1受体拮抗剂(IL-1ra)的产生。抗炎细胞因子通过限制炎症细胞因子产生,上调其可溶性拮抗剂结合蛋白,抑制炎症细胞活动来减轻炎症[7]。近年来,IL-10/TNF-α比值被认为是衡量炎症反应程度的重要指标,高比值被称为抗炎比值,低比值则说明存在炎症反应[3]。本研究发现,力竭运动后大鼠血清TNF-α含量明显增加,IL-1β水平有上升的趋势(P>0.05),同时IL-10浓度也显著升高,与运动时促炎细胞因子和抗炎细胞因子之间的平衡假设一致[23,31]。炎症细胞因子有助于调节中性粒细胞的快速迁移,进而巨噬细胞进入损伤的肌细胞部位启动修复过程[9],通过促炎细胞因子如TNF-α的释放,有助于受损组织降解。促炎细胞因子如TNF-α和IL-1β的存在可以刺激IL-6和生长因子的产生,从而启动卫星细胞的增值和肌纤维的再生[12]。因此,剧烈运动后血浆TNF-α的升高可能是吞噬作用和肌肉重建的标志[32]。用茶多酚干预后,发现力竭组大鼠血清TNF-α、IL-1β水平显著下降,IL-10/TNF-α比值明显升高,表明茶多酚在力竭运动中可能通过降低促炎因子水平发挥抗炎作用。
细胞因子与氧化损伤标志物之间存在联系,通过相关性分析发现,MDA与TNF-α呈显著正相关、与IL-10/TNF-α比值呈显著负相关,证实了活性氧参与TNF-α从肌肉和免疫细胞的释放,并且,TNF-α也可能通过激活NADPH氧化酶引起活性氧的合成[13],使肌肉恢复过程中损伤进一步得到发展。此外,TNF-α也与CK呈显著正相关的关系,表明由于运动和ROS产生增加引起的肌细胞膜完整性的变化与促炎性免疫反应相一致。因此,茶多酚可以通过降低脂质过氧化反应产物和促炎细胞因子的水平,显著提高力竭运动大鼠的抗氧化状态并减轻炎症反应。
4 结论
4周茶多酚干预能提高机体抗氧化状态,减轻炎症反应,对力竭运动的大鼠骨骼肌具有保护作用。
[1]鲁春刚.一种新型的天然抗氧化添加剂——茶多酚[J].饲料广角,2010,(8):36-37.
[2]刘霞.茶多酚对力竭运动大鼠骨骼肌组织氧化损伤的保护作用[J].中国组织工程研究与临床康复,2010,14(37):6935-6937.
[3]练艺影.不同剂量健步走运动对绝经后女性低度慢性炎症因子的影响[D].北京:北京体育大学,2013.
[4]徐彤彤,吕祥威,姚艳敏.茶多酚对力竭运动小鼠心肌NADPH 氧化酶及活性氧代谢的影响[J].中国医院药学杂志,2011,31(3):211-213.
[5]杨贤强,王岳飞.茶多酚药理药效研究进展[J].茶叶,2005,31( 3) :139- 142.
[6]张钧,许豪文,郭勇力,等.芦丁和维生素C 对大鼠力竭运动后自由基代谢的影响[J].山东体育学院学报,1997,13(3):28-31.
[7]ANDERSSON H,RAASTAD T,NILSSON J,etal.Differences in the inflammatory plasma cytokine response following two elite female soccer games separated by a 72-h recovery[J].Scand J Med Sci Sports,2010,20(7):740-747.
[8]ARMSTRONG R B,OGILVIE R W,SCHWANE J A.Eccentric exercise-induced injury to rat skeletal muscle[J].J Appl Physiol Respirat Environ Exer Physiol,1983,54(1):80-93.
[9]BELCASTRO A N,ARTHURN G D,ALBISSER T A,etal.Heart,liver,and skeletal muscle myeloperoxidase activity during exercise[J].J Appl Physiol,1996,80(4):1331-1335.
[10]BRENNER I K,NATALE V M,VASILIOU P,etal.Impact of three different types of exercise on components of the inflammatory response[J].Eur J physiol,1999,80(5):452-460.
[11]CHILDS A,JACOBS C,KAMINSKI T,etal.Supplementation with vitamin C and N-acetyl-cysteine increases oxidative stress in humans after an acute muscle injury induced by eccentric exercise[J].Free Radic Biol Med,2001,31(6):745-753.
[12]COLLINS R A,GROUNDS M D.The role of tumour necrosis factor-alpha (TNF-alpha) in skeletal muscle regeneration:Studies in TNF-alpha(-/-) and TNF-alpha(-/-)/LT-alpha(-/-) mice[J].J Histochem Cytochem,2001,49(8):989-1001.
[13]DROGE W.Free radical in the physiological control of cell function[J].Physiol Rev,2002,82(1):47-95.
[14]FINAUD J,LAC G,FILAIRE E.Oxidative stress:Relationship with exercise and training[J].Sports Med,2006,36 (4):327-358.
[16]KIM S,PARK S H,LEE H N,etal.Prunus mume extract ameliorates exercise-induced fatigue in trained rats[J].J Med Food,2008,11 (3):460-468.
[17]LIU J,YEO H C,OVERVIK-DOUKI E,etal.Chronically and acutely exercised rats:Biomarkers of oxidative stress and endogenous antioxidants[J].J Appl Physiol,2000,89 (1):21-28.
[18]MALAGUTI M,ANGELONI C,GARATACHEA N,etal.Sulforaphane treatment protects skeletal muscle against damage induced by exhaustive exercise in rats[J].J Appl Physiol,2009,107( 4):1028-1036.
[19]MASTALOUDIS A,MORROW J D,HOPKINS D W,etal.Antioxidant supplementation prevents exercise-induced lipid peroxidation,but not inflammation,in ultramarathon runners[J].Free Radic Biol Med,2004,36(10):1329-1341.
[20]MCBRIDE J M,KRAEMER W J.Effect of vitamin E status on lipid peroxidation in exercised horses[J].J Strength Cond Res,1999,24(6):175-183.
[21]MCGINLEY C,SHAFAT A,DONNELLY A E.Does antioxidant vitamin supplementation protect against muscle damage?[J].Sports Med,2009,39(12):1011-1032.
[22]NIU A J,WU J M,YU D M,etal.Protective effect of Lycium barbarum polysaccharides on oxidative damage in skeletal muscle of exhaustive exercise rats[J].Int J Biol Macromol,2008,42 (5):447-449.
[23]OSTROWSKI K,ROHDE T,ASP S,etal.Pro and anti-inflammatory cytokine balansein strenuous exercise in humans[J].J Appl Physiol,1999,515(15):287-291.
[24]POWERS S K,JACKSON M J.Exercise-induced oxidative stress:Cellular mechanisms and impact on muscle force production[J].Physiol Rev,2008,88 (4):1243-1276.
[25]PYNE D.Regulation of neutrophil function during exercise[J].Sports Med,1994,17(4):245-258.
[26]SAID M,FEKI Y,HAMZA S,etal.Effects of two kinda of exhaustive maximal ecercise on pro-inflammatory cytokines concentrations in trained and untrained humans[J].Biol Sport,2005,22(4):329-339.
[27]SHAN X,ZHOU J,MA T,etal.Lycium barbarum polysaccharides reduce exercise-induced oxidative stress[J].Int J Mol Sci,2011,12 (2):1081-1088.
[28]WEI P,JIN H M.Blueberries extract supplementation improves physical performance and decreases oxidative stress in mice[J].Afr J Biotech,2011,10 (60):12999-13003.
[29]WILLOUGHBY D S,VANENK C,TAYLOR L.Effects of concentric and eccentric contractions on exercise-induced muscle injury,inflammation,and serum IL-6[J].J Exerc Physiol Online,2003,6(4):8-15.
[30]YU F,LU S,YU F,etal.Protective effects of polysaccharide from Euphorbia kansui (Euphorbiaceae) on the swimming exercise-induced oxidative stress in mice[J].Can J Physiol Pharmacol,2006,84(10):1071-1079.
[31]ZALDIVAR F,WANG-RODRIGUEZ J,NEMET D,etal.Constitutive pro- and anti-inflammatory cytokine and growth factor response to exercise in leukocytes[J].J Appl Physiol,2006,100(4):1124-1133.
[32]ZEMBRON-LACNY A,SLOWINSKA-LISOWSKA M,SUPERLAK E,Pro-Oxidative processes and cytokine response to training in professional basketball players[J].J Human Kinetics,2009,20(6):81-88.
The Effects of Tea Polyphenols Supplemneton Oxidative Stress and InflammatoryResponse in Rats after Exhaustive Exercise
WU Xiu-qin,YANG Wei,YIN Yu-jiao,HE Shao-xi,LIU Li-xia
Objectives:To study the effects of tea polyphenols supplemnet on oxidative stress and inflammatory response in rats after exhaustive exercise,find out effective interventions for reducing the sports injuries.Methods:Twenty-four male SD rats were randomly divided into three groups according to weight:control group(C),exhaustive exercise group (E),exhaustive exercise with Tea polyphenols (F,dose:300mg/kg/d).4 weeks later,the rats performed once exhaustive exercise,and the serum creatine kinase (CK),lactate dehydrogenase (LDH),malondialdehyde(MDA),the level of inflammatory cytokine:interleukin (IL-1β,IL-10) and the tumor necrosis factor alpha (TNF -a) were examined.Results:Compared with C group,the serum CK and LDH activity and MDA content of E group rats were significantly increased after exhaustive exercise (P<0.05);also,the levels of pro-inflammatory cytokine TNF-a and anti-inflammatory cytokine IL-10 were significantly increased (P<0.01 andP<0.01).Compared with E group,the serum CK and LDH activity and MDA content of F group rats significantly decreased (P<0.05); the levels of pro-inflammatory Cytokine TNF-a and IL-1β were all significantly decreased (P<0.05),whereas the ratio of IL-10/TNF-α was significantly improved(P<0.05).Correlation analysis showed that it appeared positive correlation MDA with CK and TNF-a (P<0.05),but with ratio of IL - 10 / TNF-a,they appeared very significantly negative correlation (P<0.01).Conclusion:The supplement of tea polyphenols can improve the body's antioxidant status,reduce inflammation response and play a protective role to skeletal muscle in rat performing exhaustive exercise.
exhaustiveexercise;teapolyphenols;inflammationcytokines;oxidativestress;skeletalmuscleinjury
1002-9826(2016)01-0092-04
10.16470/j.csst.201601013
2015-05-19;
2015-08-12
吴秀琴(1964-),女,福建霞浦人,副教授,硕士,硕士研究生导师,主要研究方向为运动人体科学,E-mail:xiuqin415@163.com。
福建师范大学 体育科学学院,福建 福州 350108 Fujian Normal University,Fuzhou 350108,China.
G804.23
A
