有氧运动对心肌细胞增殖的影响及CBP的调控作用
2017-01-04胡玉龙刘艳秋李宁川陈志军
胡玉龙,徐 慧,2,刘艳秋,李宁川,陈志军,昝 销
有氧运动对心肌细胞增殖的影响及CBP的调控作用
胡玉龙1,徐 慧1,2,刘艳秋3,李宁川1,陈志军1,昝 销1
目的:探讨有氧运动对心肌细胞增殖的激活和cAMP反应元件结合蛋白绑定蛋白(CBP)在其中的调控作用。方法:采用游泳训练(Swim)2周构建运动性心肌肥大模型,采用主动脉弓缩窄术(TAC)2周构建病理性心肌肥大模型。12周龄雄性C57Bl/6J小鼠随机分为4组:对照组(Control)、运动性心肌肥大组(Swim)、假手术组(Sham)、病理性心肌肥大组(TAC),每组10只。实验结束后,采用二维超声心动图检测室间隔厚度(IVS)、左室后壁厚度(LVPW)和心功能。对心肌组织蛋白采用Western Blot检测增殖细胞核抗原(PCNA)的表达水平,衡量心肌细胞增殖能力。采用RT-PCR、Western Blot和免疫组化的方法检测心肌细胞中CBP的表达水平。为验证CBP对心肌细胞增殖能力的激活作用,在离体实验中,以去氧肾上腺素(PE)诱导原代心肌细胞产生肥大,采用CBP抑制剂C646抑制CBP表达。离体实验分组情况:1)对照组(Control);2)PE组;3)C646组;4)PE+C646组。对心肌细胞爬片进行α-肌动蛋白(α-actin)的免疫荧光实验检测心肌细胞大小,免疫荧光检测增殖细胞核抗原Ki67的表达衡量心肌细胞增殖水平,RT-PCR检测CBP的mRNA水平。结果:1)游泳运动和TAC均能使小鼠产生明显的心肌肥大,与相应的对照组相比,两种心肌肥大模型的IVS、LVPW、左室容量(LV Vol)和射血分数(EF)都有明显升高(P<0.05)。2)Swim组小鼠心肌组织PCNA蛋白表达水平明显高于Control组(P<0.05)和TAC组(P<0.01)。3)Swim组心肌组织CBP的mRNA水平比Control组明显升高(P<0.01),且明显高于TAC组(P<0.05)。Swim组心肌组织CBP蛋白表达水平与Control组相比有明显升高(P<0.05),且显著高于TAC组(P<0.01),TAC组比Sham组明显降低(P<0.05)。心肌组织切片CBP的免疫组化结果显示,Swim组CBP阳性细胞显著多于Control组(P<0.01)与TAC组(P<0.01)。4)离体实验结果显示,PE组心肌细胞面积显著高于Control组(P<0.05)和PE+C646组(P<0.05)。PE能使CBP的mRNA表达水平比Control组明显升高(P<0.01),PE+C646组CBP的mRNA水平比PE组明显降低(P<0.01)。PE组Ki67阳性细胞与Control组相比明显增多(P<0.01),PE+C646组Ki67阳性细胞与PE组相比明显减少(P<0.05)。结论:有氧运动能明显激活心肌细胞的增殖能力,并伴随着CBP的mRNA和蛋白表达水平升高,抑制CBP的表达水平可以抑制心肌细胞的增殖能力,提示,CBP在有氧运动促进心肌细胞增殖的过程中发挥着重要的调控作用。
有氧运动;心肌肥大;心肌细胞增殖;CBP
心肌肥大是导致心血管疾病发生率和死亡率增高的独立危险因子,是心力衰竭的前驱病变。运动性心肌肥大是运动训练中的普遍生理现象,表现为心肌细胞、血管、间质成比例地增生,侧枝循环大量建立,有效地缓解了心肌肥大可能引发的相对缺血,维护了心脏的泵血功能[6,19]。因此,心肌细胞的增殖能力是决定心肌肥大发展转归和预后的重要因素,寻找心肌细胞增殖的调控因素,对于减少心力衰竭和心脏破裂猝死的风险,保障人们生命健康具有十分重要的意义。
运动对心肌细胞增殖的影响一直受到人们的关注。运动训练可以导致心肌肥大和心脏收缩能力加强,泵血功能增加。有研究发现[12],大鼠心梗手术后5周进行游泳或跑台运动,可减轻左心室扩张,非梗死区室壁发生适应性肥大,梗死面积缩小。运动还可诱导高血压大鼠心肌大量祖细胞趋向分化[13]。可见,运动对成体心肌细胞的再生、增殖具有促进作用,但其具体的机制和信号通路,目前还不是很清楚。因此,探讨运动对心肌细胞增殖的促进作用和关键调控分子,可为临床缺血性心肌疾病的治疗和康复运动提供理论依据和策略方法。
cAMP反应元件结合蛋白(cyclic-AMP-responsive element binding protein,CREB)是核内刺激基因转录的增强因子,CREB只有和CREB绑定蛋白(CREB-bingding protein,CBP)结合成复合物后,才能实现对转录的调节功能,因此CBP又被称为CREB的辅助激活因子[17]。目前发现,CBP能与多种核内转录因子结合,调控基因转录和蛋白表达,与胚胎发育、细胞生长和维持稳态等活动密切相关[14,15,20]。本研究主要观察运动性和病理性心肌肥大在心肌细胞增殖方面的表型差异,并探讨了CBP在心肌细胞增殖中的调控作用。
1 材料与方法
1.1 实验动物与分组
雄性C57Bl/6J小鼠,12周龄,购于扬州大学动物比较中心(动物许可证号:SYXK苏2012-0029)。实验小鼠随机分为4组:对照组(Control),运动性心肌肥大组(Swim),假手术组(Sham),病理性心肌肥大组(TAC),每组10只。饲养温度25℃±2℃,自然采光,分组分笼饲养,每笼3~5只。
1.2 运动方案
运动性心肌肥大组进行游泳耐力训练,游泳池体积为60 cm×40 cm×60 cm,水深为40 cm,水温为31℃~34℃。正式训练前9天为适应阶段,从第1天的10 min逐渐增加到第9天的90 min。正式训练时每天上、下午各1次,每次持续训练90 min,维持此强度训练2周。对照组正常饲养,不做任何处理。
1.3 病理性心肌肥大模型构建
病理性心肌肥大组小鼠进行主动脉弓缩窄手术(transverse aortic constriction,TAC)构建。TAC手术操作要点如下[2,11]:采用3.6%水合氯醛腹腔注射麻醉,经气管插管与啮齿动物呼吸机连接。经颈部正中切口向下暴露主动脉弓部,在左颈总动脉与头臂干之间血管下方穿一个7-0号丝线,并紧贴血管放置一个26号针头,用丝线将动脉与针头一起扎紧并迅速抽出针头,按照统一标准造成不完全缩窄,术后饲养2周。假手术组小鼠行开胸手术暴露主动脉弓但不进行动脉缩窄,进行缝合术后饲养2周。
1.4 实验仪器和试剂
主要仪器有小动物高频彩色超声系统(General Electric Co.,Fairfield,Conn),动物呼吸机(ALC-V8),冷冻切片机(LEICA),倒置荧光显微镜(OLYMPUS,IX51),低温高速离心机(Eppendrof),实时定量PCR仪(Applied Biosystems 7500),电泳仪和转移槽(BioRad),凝胶扫描成像系统(UVP,GDS-8000)等。主要试剂包括:抗CBP、PCNA、Lamin A、GAPDH一抗,购自Santa Cruz公司和康成生物;Trizol、逆转录试剂盒、SYBR Green Master (ROX)试剂盒,购自Invitrogen公司;PE、C646购自Sigma公司。
1.5 二维超声心动图检测
小鼠腹腔注射3.6%水合氯醛麻醉后,脱毛固定四肢于操作台上。取左室长轴切面二尖瓣水平,在第4肋间探及,探头频率为13 MHz,扫描速度100 mm/s,在二维超声引导下取M超声曲线。观测指标:心脏室间隔厚度(interventricular septum dimension,IVS)、左室后壁厚度(LV posterior wall dimension,LVPW)、左室射血分数(ejection fractional shortening,EF)和左室短轴缩短率(fractional shortening,FS)等心功能指标。
1.6 实时荧光定量PCR(real time PCR,RT-PCR)
充分研磨心肌组织,提取总RNA,逆转录和RT-PCR操作按试剂盒说明书进行,引物由Invitrogen公司合成,序列见表1。反应体系为SYBR Green (ROX) 10 μl,上、下游引物共0.6 μl,cDNA 100 ng,DEPC水加至总体积20 μl,充分混匀。PCR反应条件为:50℃预处理2 min,95℃预变性10 min,95℃变性15 s,60℃退火60 s共反应40个循环。ABI 7500软件记录数据并分析,将目的基因的Ct值与内参GAPDH的Ct值进行标准化,计算出目的基因的相对表达量。

表 1 本研究目的基因引物序列
1.7 Western Blot实验
采用蛋白提取液分别抽提胞浆蛋白和胞核蛋白,BCA法检测蛋白浓度。等量蛋白采用8% SDS聚丙烯酰胺凝胶垂直电泳,然后湿转至PVDF膜上,室温摇动封闭(5%脱脂牛奶)1 h。分别加入鼠抗CBP(1∶200),兔抗PCNA(1∶200),兔抗Lamin(1∶200),鼠抗GAPDH(1∶1 000)多克隆抗体。4 ℃孵育过夜,室温下洗膜后加入相应二抗孵育1 h,用化学发光底物ECL(Promega)进行发光显影。
1.8 乳鼠原代心肌细胞培养
取2~4天的SD乳鼠心脏,置于DMEM培养基中,充分剪碎,加入0.08% 胰酶2 ml,37℃水浴震荡,多次消化收集上清,至无明显颗粒。所有上清经1 000 rpm,离心10 min。弃上清,沉淀用300 μl DEME重悬,反复吹打,即为细胞悬液。经筛网过滤后,计数并分别接种于6孔板和24孔板,置于CO2培养箱中培养。待细胞贴壁生长后,分为4组:1)Control组,不做任何处理,细胞正常培养;2)PE组,给予去氧肾上腺素(Phenylephrine,PE)诱导心肌细胞肥大和增殖(10 μM),处理24 h;3)C646组,加入CBP抑制剂C646(30 μM)抑制CBP的表达,处理30 min后换正常培养基;4)PE+C646组,细胞贴壁生长后,加入C646处理30 min后,换正常培养液,加PE处理24 h。收取4组心肌细胞,进行心肌细胞免疫荧光及提取心肌细胞总RNA。
1.9 统计学分析
2 结果
2.1 在体实验结果
2.1.1 两种心肌肥大模型心室壁厚度和心功能结果比较
二维超声心动图详细数据见表2,心超结果提示,两种造模方法都能使小鼠心肌产生肥厚。Swim组和TAC组小鼠收缩期和舒张期IVS和LVPW与相应的对照组相比都有明显增加(P<0.05)。Swim组LVIDs,收缩期、舒张期LV Vol比Control组明显减小(P<0.05),TAC组收缩期、舒张期LVID、LV Vol与Sham组相比都有明显减小(P<0.05)。Swim组和TAC组EF和FS与相应的对照组相比,都有明显升高(P<0.05)。提示,两种心肌肥大模型尚处于向心性肥大阶段,因此心室内径减小,心功能尚处于代偿期,甚至有所升高。
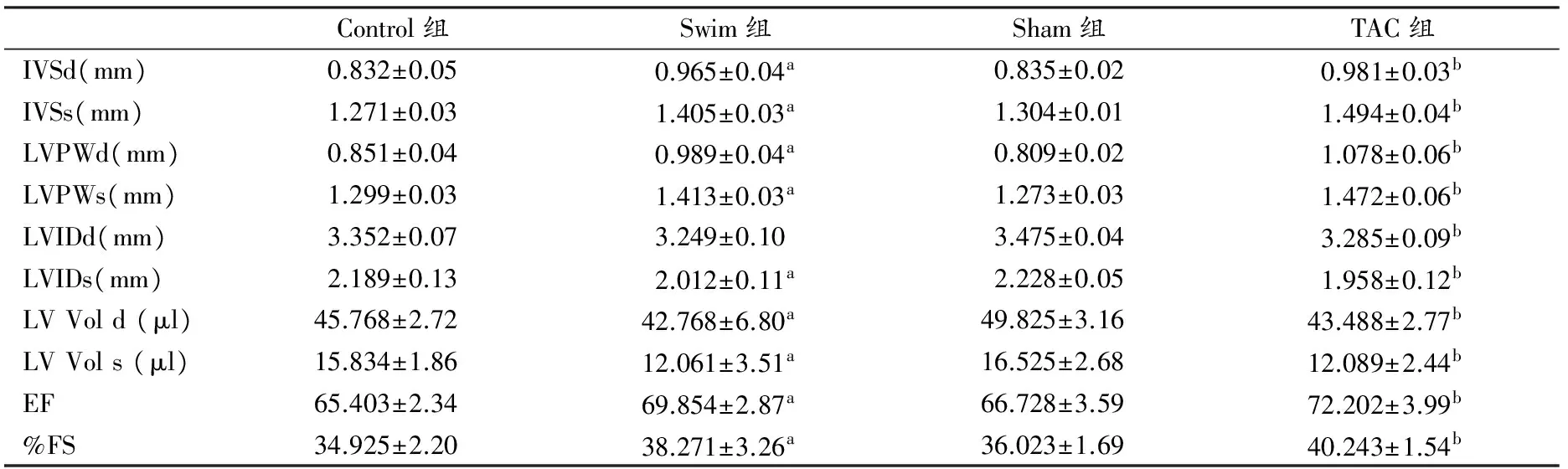
表 2 二维超声心动图检查的各项数据
注:a表示与Control组比较,P<0.05;b表示与Sham组比较,P<0.05,n=10。IVSd:舒张期室间隔厚度;IVSs:收缩期室间隔厚度;LVPWd:舒张期左室后壁厚度;LVPWs:收缩期左室后壁厚度;LVIDd:左室舒张末期内径;LVIDs:左室收缩末期内径; LV Vol d:左室舒张末期容积;LV Vol s:左室收缩末期容积;EF:射血分数;FS:缩短分数。
2.1.2 两种心肌肥大模型心肌细胞增殖程度比较
增殖细胞核抗原(proliferating cell nuclear autigen,PCNA)存在于细胞核内,是DNA合成和复制所必须的辅助因子,也是细胞增殖的分子标志。采用Western blot方法检测各组小鼠心肌组织PCNA的蛋白表达水平。如图1所示,Swim组和TAC组小鼠心肌组织PCNA表达水平分别较Control组(P<0.01)和Sham组(P<0.05)显著增高,其中Swim组升高更为明显,与TAC组比较也有显著性差异(P<0.05)。提示,Swim和TAC均可以使小鼠心肌细胞发生一定程度的增殖,但有氧运动对心肌细胞地增殖具有更为明显的激活作用。
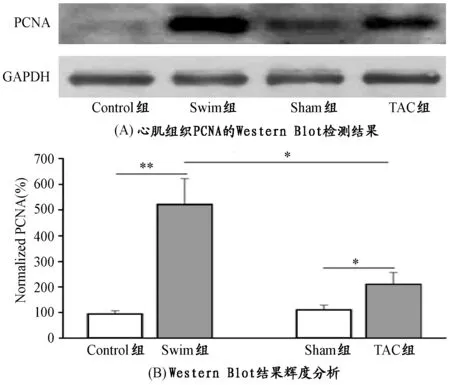
图 1 各组小鼠心肌组织PCNA表达水平示意图
2.1.3 两种心肌肥大模型心肌组织CBP的表达差异
对心肌组织冰冻切片进行CBP的免疫组化实验发现(图2A、2B),与Control组相比,Swim组小鼠心肌CBP阳性细胞显著增多(P<0.01),TAC组的CBP阳性细胞与相应对照组相比没有明显改变。Swim组心肌组织CBP阳性细胞比TAC组显著增多(P<0.01)。
对各组小鼠心肌组织总RNA进行RT-PCR检测CBP的表达水平(图2C),结果可见,与Control组相比,Swim组小鼠心肌组织CBP的mRNA水平显著升高(P<0.01);而TAC组与Sham组相比,CBP的mRNA水平有轻微增加,但无统计学差别。Swim组和TAC组相比,CBP的mRNA水平有显著性差异(P<0.05)。
采用Western blot检测各组小鼠心肌组织胞核的CBP蛋白表达水平。如图2D和2E所示,Swim组与Control组相比,小鼠心肌组织中CBP表达水平显著增高(P<0.05);TAC组较Sham组,CBP表达水平显著下降(P<0.05)。而Swim组与TAC组相比,CBP表达水平存在显著性差异(P<0.01)。
2.2 离体实验结果
2.2.1 各组心肌细胞肥大程度比较
离体实验采用给予PE诱导原代心肌细胞产生肥大,以CBP的抑制剂C646抑制CBP的表达。PE能在体外诱导心肌细胞产生肥大和增殖[10,16],C646是新发现的抑制CBP的小分子化学抑制剂,能减少CBP表达,抑制其乙酰化酶的活性[8]。对心肌细胞进行荧光抗体标记肌动蛋白(α-actin),检测心肌细胞面积,以此衡量心肌细胞肥大程度。如图3A、3B所示,PE能诱导心肌细胞肥大,PE处理组与Control组相比,心肌细胞面积增大明显(P<0.05)。而C646能明显抑制PE诱导的心肌细胞肥大,PE+C646组与PE组比较,心肌细胞面积明显减小(P<0.05);只使用C646的C646组小鼠,其心肌细胞面积与PE比较也有显著减小(P<0.01)。
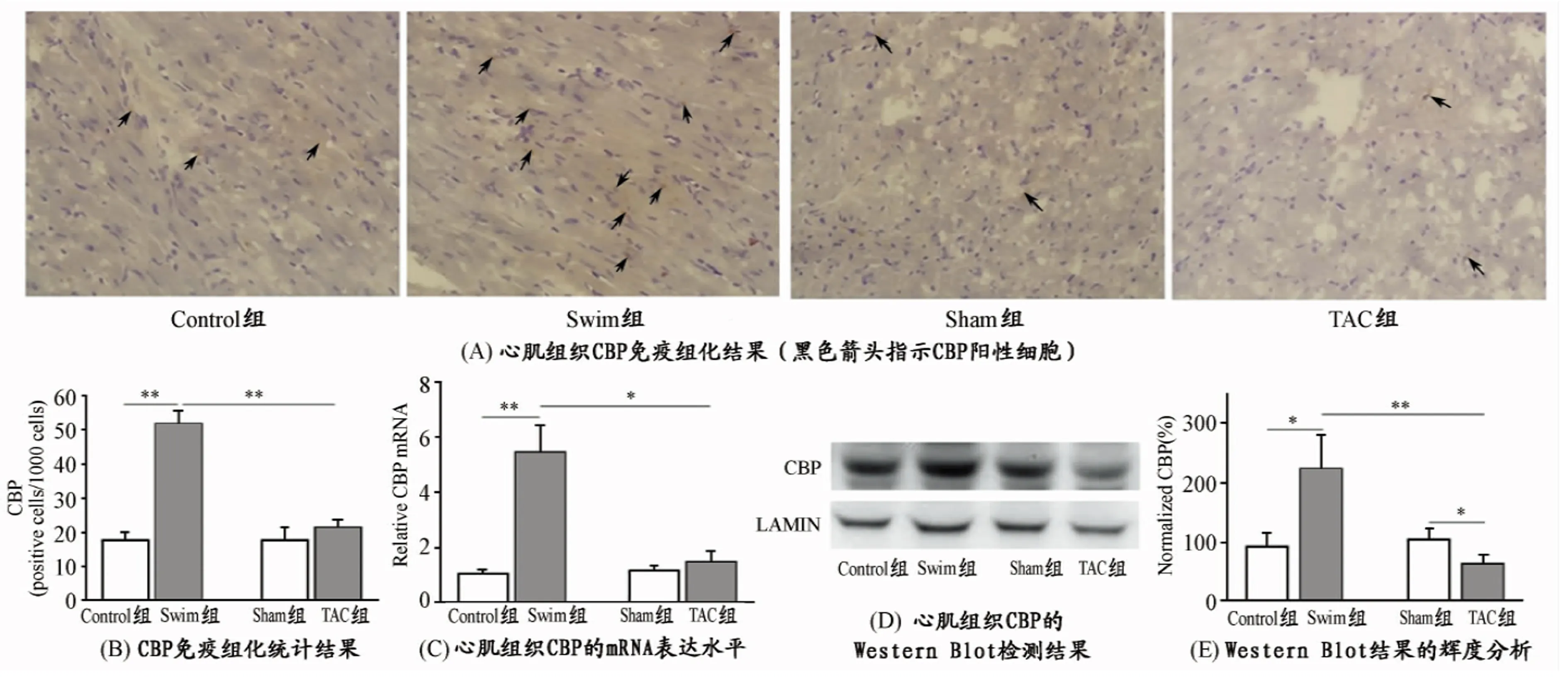
图 2 各组小鼠心肌组织CBP的表达水平示意图
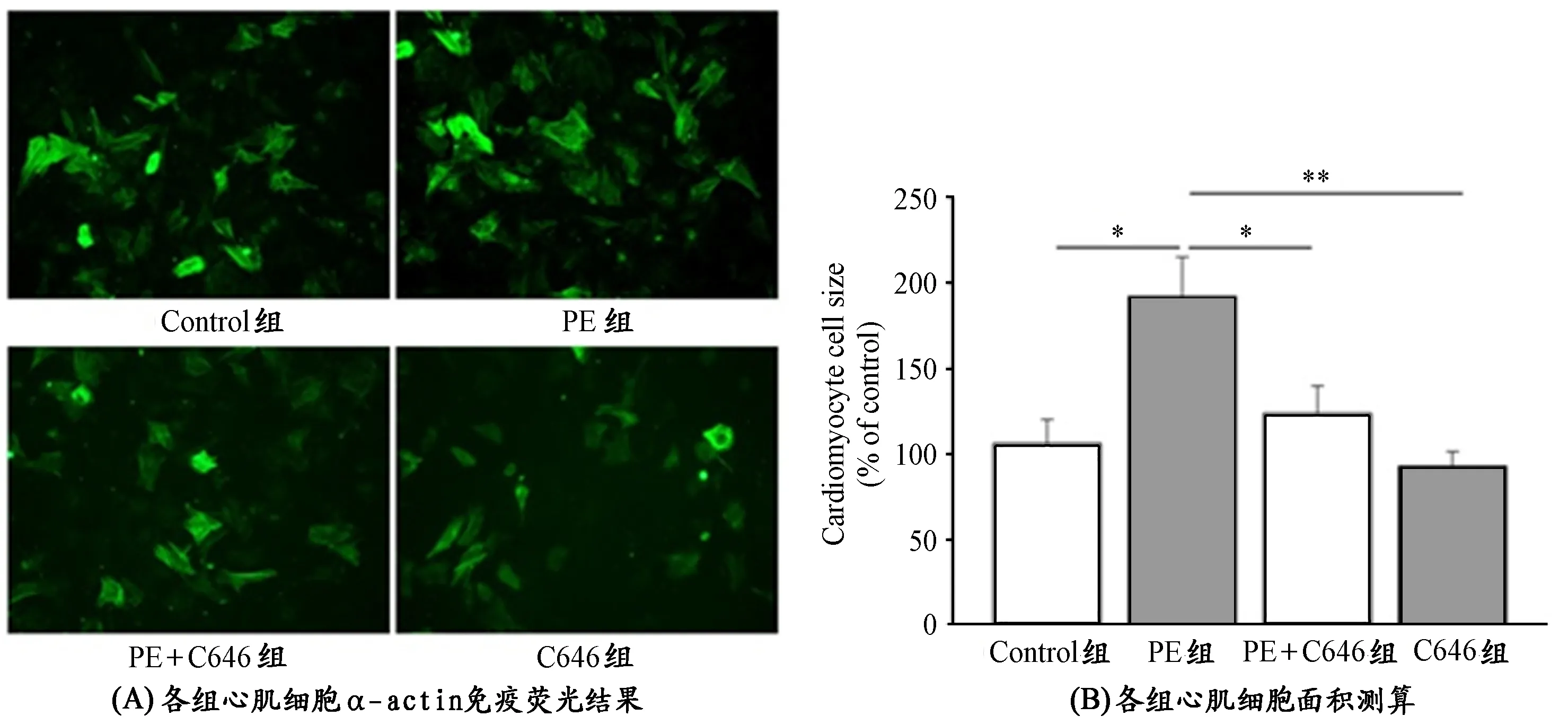
图 3 离体实验各组心肌细胞肥大程度示意图
2.2.2 各组心肌细胞CBP的mRNA表达水平比较
由图4可见,与Control组相比,PE组心肌细胞CBP的mRNA水平显著升高(P<0.01);C646组较Control组有轻微上调,但两组间无统计学差异。可见,C646处理能显著降低PE引起的CBP的mRNA水平上升(P<0.01),这与各组心肌细胞肥大的趋势相吻合。
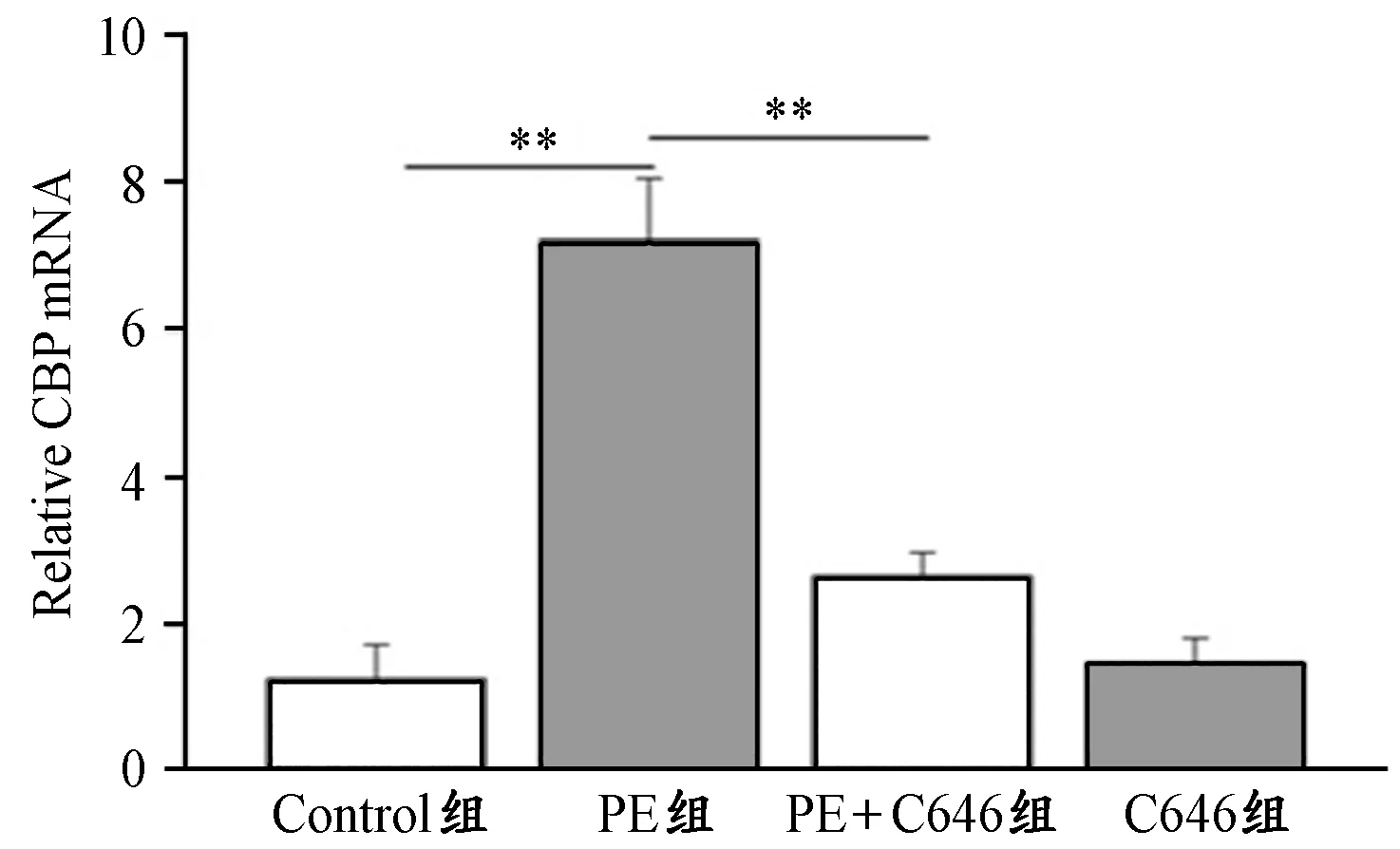
图 4 离体实验各组心肌细胞CBP的mRNA表达水平示意图
2.2.3 各组心肌细胞增殖程度比较
Ki67是一种与增殖细胞相关的核抗原,其功能与有丝分裂密切相关,Ki67的表达水平可作为衡量细胞增殖的标志性指标。如图5A、5B所示,PE组与Control组相比,Ki67表达阳性的心肌细胞显著增多(P<0.01);PE+C646组,Ki67阳性心肌细胞与PE组相比显著减少(P<0.05)。提示,CBP的表达水平受到抑制,能下调心肌细胞的肥大和增殖。
3 分析与讨论
3.1 运动性和病理性心肌肥大在表型方面的差异分析
心肌肥大是心脏对外界刺激的一种结构代偿性反应,分为运动性和病理性两种。二者在发病机制、疾病转归、预后等方面都存在诸多差异。在心肌肥大的发病机制中,心肌细胞的增殖尤为重要。心肌细胞增殖可以改善心肌的舒缩功能,有效防止心腔扩大和心力衰竭。本研究以游泳运动构建运动性心肌肥大模型,用TAC法构建病理性心肌肥大模型,探讨运动性和病理性心肌肥大在心肌细胞增殖上的差别及调控因子。
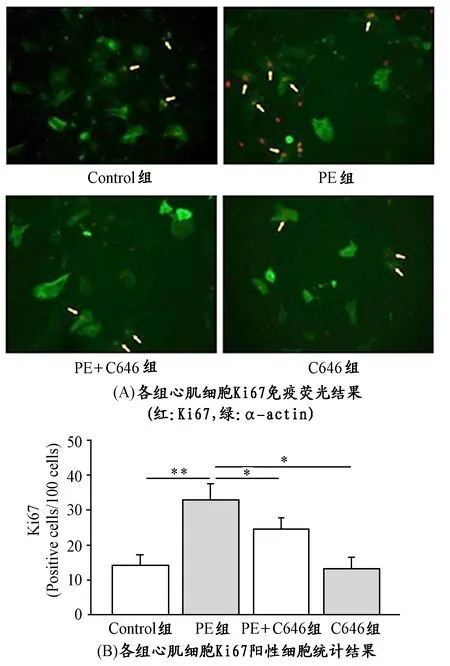
图 5 离体实验各组心肌细胞增殖程度示意图
研究表明,游泳运动和TAC法都能使小鼠左室室壁和室间隔增厚,提示,两种方法都能诱导小鼠心肌产生肥大,其中病理性心肌肥大模型更为明显,而LVIDd和LVIDs下降,提示,两种心肌肥大模型都处于早期,心室肌增厚明显,出现向心性肥大,心室内径略有下降,射血分数略有升高,心功能都处于代偿期。病理性心肌肥大早期,因为心室壁肥厚明显,心室内径减小,左心室舒张末期容积显著减少,每搏输出量减少,但EF值不降反升。而到了病理性心肌肥大后期,由于大量心肌细胞凋亡坏死,心室腔扩大,心肌舒缩乏力,EF值才会出现明显降低。所以,在评定心脏泵血功能时,不能单纯考虑每搏输出量和射血分数,心脏的舒张功能也很重要。有研究表明,病理性心肌肥大中心脏功能变化主要表现为舒张功能降低[4]。进而使心室充盈不足,从而严重影响心脏的泵血功能。
在研究中也发现[2],运动性心肌肥大模型心肌组织只有少量胶原纤维沉积,而病理性心肌肥大模型胶原纤维大量沉积,且大都堆积于血管周围。游泳运动使心肌中胚胎型基因心钠肽(attrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)的mRNA表达水平仅有轻微增加,而病理性心肌肥大小鼠心肌中ANP、BNP的mRNA表达水平显著增加。
综上,游泳运动训练和主动脉弓缩窄术都能诱导小鼠心脏出现明显的肥大,且二者的肥大程度没有明显差异。有氧训练诱导的心肌肥大没有明显的缺氧和损伤情况,但病理性心肌肥大具有较为严重的间质纤维化改变和心肌组织缺氧。
3.2 运动性和病理性心肌肥大在心肌细胞增殖方面的差异分析
一直以来,成体心肌细胞被认为是终末分化细胞,不再有增殖能力,细胞数目不会增加。但正常生理和运动状态下心肌细胞也有死亡和凋亡,心肌细胞数量却没有减少,提示,心肌细胞有一定的增殖能力,使心肌细胞数量处于动态平衡。随着研究技术的进步,科学家们逐渐发现,心肌组织中仍有部分心肌细胞处于有丝分裂期,缺血性心肌病患者处于有丝分裂期的细胞数量会大为增加[3,7]。Waring等[18]的研究结果表明,有氧运动组大鼠的肥大心肌细胞(体积>40 cm3)数量多于安静对照组,且运动组新生心肌细胞(体积<10 cm3)的细胞数量也多于安静对照组,说明,有氧运动不仅促进了大鼠心肌细胞肥大,且诱导了心肌细胞地增殖。本研究结果显示,游泳运动组小鼠心肌组织PCNA蛋白表达显著增高,说明有氧运动使心肌细胞的增殖明显激活。虽然运动性和病理性心肌肥大模型心肌PCNA的蛋白表达均有所升高,但上升幅度存在明显差异。其可能的原因是病理性心肌肥大模型的心肌细胞缺血、缺氧,能量代谢紊乱,心肌细胞增殖功能被部分激活,但不是很明显;而有氧运动对心肌细胞的增殖功能激活明显,抑制间质增生,减缓心室重构过程,使心脏舒缩功能增强,维持了心脏泵血功能。
3.3 CBP在有氧运动促进心肌细胞增殖能力中的作用
CREB是心肌细胞增殖通路IGF-1/Akt下游一个核内刺激基因转录的增强因子,其结合蛋白CBP最早作为一种与CREB结合的核蛋白被分离出来,CBP的KIX域与磷酸化的CREB的KID域相互作用形成复合物后,CREB才能实现对基因转录的调节功能[14]。目前研究发现,CBP能与多种核内转录因子结合,调控基因转录和蛋白表达,对骨骼、血细胞、肝细胞、骨骼肌等地增殖、再生过程发挥着重要的调控作用[9,14,17]。曾维政等[5]研究认为,CBP是将转化生长因子-β(transforming growth factor-β,TGF-β)信号转化为生物学效应的关键分子,TGF-β可以调节细胞生长和分化,促进胶原蛋白合成。肝组织中的CBP可以引起胶原蛋白合成、肝细胞增生、肝小叶重建。
CBP对心肌细胞的影响也有报道。Gusterson等[10]研究发现,PE诱导新生乳鼠心肌细胞产生肥大的过程中, CBP和p300这一对转录的共激活物被激活。构建反义引物或显性负性突变可以明显抑制PE诱导的心肌肥大。心肌细胞表现为蛋白合成减少,DNA率和细胞大小均减小。过表达CBP或p300时则可以导致心肌细胞肥大。因此,在PE诱导的心肌肥大中,CBP和p300承担着至关重要的作用,这种作用是通过组蛋白乙酰基转移酶(histone acetyltransferase,HAT)介导的。陈国珍等[1]研究表明,CBP在胚胎小鼠心脏发育阶段高表达,在心脏的发生发育中发挥重要作用。但CBP对心肌细胞增殖的影响,目前仍没有定论。
本研究结果提示,运动性心肌肥大小鼠心肌中CBP 的mRNA和蛋白表达均显著上调,且心肌细胞的增殖功能被明显激活。而在病理性心肌肥大中CBP的蛋白表达水平明显下调,心肌细胞增殖也不明显,提示,CBP的表达水平与心肌细胞细胞增殖之间存在某种关联。
为进一步探讨CBP的表达水平与心肌细胞增殖能力之间的关系,本研究利用体外实验进行了验证。对原代乳鼠心肌细胞采用PE诱导细胞肥大和增殖激活,发现其CBP的mRNA水平显著升高,细胞增殖功能也明显激活。而给予CBP的抑制剂C646处理后,心肌细胞CBP的mRNA水平明显受到抑制,心肌细胞面积减小,增殖能力也受到明显抑制,说明,CBP的表达水平对心肌肥大和心肌细胞增殖确实起到了关键性作用。
4 结论
运动性心肌肥大发生过程中,有氧运动能促使CBP表达水平升高,进而促进心肌细胞增殖、肥大,使心肌组织收缩能力加强,心功能明显改善。抑制CBP的表达水平后,可以抑制心肌细胞的增殖和肥大。对于缺血性心肌疾病的病人,建议适当的有氧运动或采用内源性激活CBP的方法,使心肌细胞的增殖功能激活,起到减缓心室重构,保护心功能的作用,这将成为新的治疗思路和靶点。
[1]陈国珍.组蛋白乙酰化酶亚型在小鼠心脏发育中的时空表达[D].重庆:重庆医科大学,2008:35-40.
[2]胡玉龙,徐慧,王永梅,等.AMPK在小鼠运动性和病理性心肌肥大能量代谢中的作用[J].体育科学,2014,34(9):39-43.
[3]田振军,蔡梦昕,邢维新.有氧运动对心肌细胞增殖/凋亡的影响及其机制探讨[J].体育科学,2012,32(3):60-66.
[4]郑德志.大鼠心肌缺血再灌注损伤心室重构及芒果苷对其作用和机制的研究[D].重庆:第三军医大学,2012:52.
[5]曾维政,吴晓玲,蒋明德,等.红景天甙对肝纤维化大鼠肝组织CBP、Smad基因表达的影响[J].世界华人消化杂志,2005,13(3):341-345.
[6]BERNARDO B C,WEEKS K L,PRETORIUS L,etal.Molecular distinction between physiological and pathological cardiac hypertrophy:Experimental findings and therapeutic strategies[J].Pharmacol Therapeut,2010,128 (1):191-227.
[7]CANTY JM JR,SUZUKI G.Myocardial perfusion and contraction in acute ischemia and chronic ischemic heart disease[J].J Mol Cell Cardiol,2012,52 (4):822-31.
[8]CRUMP N T,HAZZALIN C A,BOWERS E M,etal.Dynamic acetylation of all lysine-4 trimethylated histone H3 is evolutionarily conserved and mediated by p300/CBP[J].Proc Natl Acad Sci U S A,2011,108(19):7814-7819.
[9]EL JAMALI A,FREUND C,RECHNER C,etal.Reoxygenation after severe hypoxia induces cardiomyocyte hypertrophy in vitro:activation of CREB downstream of GSK3β[J].FASEB J,2004,18(10):1096-1098.
[10]GUSTERSON R J,JAZRAWI E,ADCOCK I M,etal.The transcriptional co-activators CREB- binding protein (CBP) and p300 play a critical role in cardiac hypertrophy that is dependent on their histone acetyltransferase activity[J].J Biol Chem,2003,278(9):6838-6847.
[11]HU Y,LI T,WANG Y,etal.Tollip attenuated the hypertrophic response of cardiomyocytes induced by IL-1 beta[J].Front Biosci,2009,14(1):2747-2756.
[12]KEMI O J,HOYDAL M A,MACQUAIDE N,etal.The effect of exercise training on transverse tubules in normal,remodeled,and reverse remodeled hearts[J].J Cell Physiol,2011,226(9):2235-2243.
[13]KOLWICZ S C,MACDONNELL S M,RENNA B F,etal.Left ventricular remodeling with exercise in hypertension[J].Am J Physiol Heart Circ Physiol,2009,297(4):H1361-H1368.
[14]LEMIEUX M E,CHENG Z,ZHOU Q,etal.Inactivation of a single copy of CBP selectively alters pre-mRNA processing in mouse hematopoietic stem cells[J].PloS One,2011,6(8):e24153.
[15]MULLIGHAN C,ZHANG J H,KASPER L H,etal.CREBBP mutations in relapsed acute lymphoblastic leukemia[J].Nature,2011,471(7337):235-239.
[16]SVENSSON HOLM A C,LINDGREN I,OSTERMAN H,etal.Thyroid hormone does not induce maturation of embryonic chicken cardiomyocytes in vitro[J].Physiol Rep,2014,2(12):e12182.
[17]TEO J L,KAHN M.The wnt signaling pathway in cellular proliferation and differentiation:A tale of two coactivators[J].Adv Drug Deliv Rev,2010,62:1149-1155.
[18]WARING C D,VICINANZA C,PAPALAMPROU A,etal.The adult heart responds to increased workload with physiologic hypertrophy cardiac stem cell activa-tion and new myocyte formation[J].Eur Heart J,2014,35(39):2722-2731.
[19]ZAIDI A,SHARMA S.The athlete's heart[J].Br J Hosp Med,2011,72(5):275-281.
[20]ZIMMER S N,ZHOU Q,ZHOU T,etal.CBP haploinsufficiency in mice alters the bone marrow microenvironment,leading to loss of stem cells and excessive myelopoiesis[J].Blood,2011,118(1):69-79.
Effect of Aerobic Exercise on Cardiomyocyte Proliferation and Regulation of CBP
HU Yu-long1,XU Hui1,2,LIU Yan-qiu3,LI Ning-chuan1,CHEN Zhi-jun1,ZAN Xiao1
Objective:To explore the effect of aerobic exercise on the activation of cardiomyocyte proliferation in cardiac hypertrophy and the role of cyclic-AMP-responsive element binding protein binding protein (CBP) in it by in vivo and in vitro experiments.Method:The exercise-induced cardiac hypertrophy model was made by swim training for 2 wks,and the pathological model was made by transverse aortic constriction (TAC) for 2 wks.12-week-old C57Bl/6J mice were divided randomly into control group,swim group,sham group and transverse aortic constriction (TAC) group.By the end of experiments,cardiac hypertrophy,contractility were evaluated by echocardiography.The expression level of myocardial proliferating cell nuclear antigen (PCNA) were examined by Western Blot to evaluate the degree of cardiomyocytes proliferation.The expression level of myocardial CBP were examined by RT-PCR,Western Blot and immunohistochemical methods.To verify the effect of CBP on activation of cardiomyocytes proliferation,we did in vitro experiment on primary cardiomyocytes.In this experiment,cardiomyocyte hypertrophy was induced by phenylephrine (PE),and C646 was used to inhibit the expression of CBP.The primary cardiomyocytes were divided randomly into 4 groups in vitro,control,PE,C646 and PE+C646 groups.Meanwhile,cardiomyocyte hypertrophy was detected by α-actin immunofluorescence,CBP mRNA expression was detected by RT-PCR,and the expression level of Ki67 was detected by immunofluorescence to evaluate the degree of cardiomyocytes proliferation.Results:1) Compared with corresponding control groups,inter ventricular septum thickness (IVS),left ventricular posterior wall thickness (LVPW),left ventricle volume (LV Vol) and ejection factor (EF) of exercise-induced and pathological cardiac hypertrophy models were significantly increased (P<0.05).2) The protein expression level of PCNA in swim group was higher than that of control group (P<0.05) and TAC group (P<0.01).3) CBP mRNA expression of swim group was increased significantly than that of control (P<0.01) and TAC group (P<0.05).CBP protein expression of TAC was decreased significantly than that of Sham (P<0.05),and the level of swim were higher obviously than those of control (P<0.05) and TAC (P<0.01).The immunohistochemistry of CBP showed that CBP-positive cells of Swim was significantly more than Control (P<0.01) and TAC group (P<0.01).4) The results of in vitro experiment were that primary cardiomyocytes performance hypertrophy induced by PE (P<0.05),and use of C646 could decrease cardiomyocyte hypertrophy (P<0.05) significangtly than that of PE.CBP mRNA expression of PE was significantly increased compared with Control (P<0.05),and this level was obviously inhibited by C646 (P<0.01).The immunofluorescence of Ki67 showed that PE could increase Ki67-positive cells obviously (P<0.01),and cardiomyocytes proliferation were inhibited (P<0.05) when CBP activity were suppressed.Conclusion:Aerobic exercise could promote myocardial proliferation through activating CBP.Cardiomyocytes proliferation was inhibited when CBP activity were suppressed.CBP plays an important role in the process of aerobic exercise promote cardiomyocytes proliferation.
aerobicexercise;cardiachypertrophy;cardiomyocyteproliferation;CBP
1002-9826(2016)05-0052-07
10.16470/j.csst.201605008
2015-07-18;
2016-06-01
胡玉龙(1975-),女,湖南临武人,副教授,博士,硕士研究生导师,主要研究方向为运动对心血管疾病的干预机制,Tel:(0514)87997109,E-mail:ylhu@yzu.edu.cn。
1.扬州大学 体育学院,江苏 扬州 225127; 2.镇江市体育科研所,江苏 镇江 212000;3.扬州市第一人民医院,江苏 扬州 225001 1.Yangzhou University,Yangzhou 225127,China;2.Zhenjiang Research Institute of Sport Science,Zhenjiang 212000,China;3.Yangzhou First People’s Hospital,Yangzhou 225001,China.
G804.2
A
