油菜 Bna-miR169d基因的分离与过表达初步分析
2017-01-03靳丰蔚孙万仓刘自刚徐妙云
董 云,王 毅,靳丰蔚,孙万仓,刘自刚,方 彦,徐妙云,王 磊
(1.甘肃省农科院 作物研究所,兰州 730070; 2. 甘肃省油菜工程技术研究中心,兰州 730070;3.中国农科院 生物技术研究所,北京 100081)
油菜 Bna-miR169d基因的分离与过表达初步分析
董 云1,王 毅1,靳丰蔚1,孙万仓2,刘自刚2,方 彦2,徐妙云3,王 磊3
(1.甘肃省农科院 作物研究所,兰州 730070; 2. 甘肃省油菜工程技术研究中心,兰州 730070;3.中国农科院 生物技术研究所,北京 100081)
miRNA是一类长度约为21~24 nt的内源性非编码RNA,在基因表达调控网络中起着重要作用。miR169家族是植物中最大的miRNA家族,其成员在植物的生长发育过程中发挥重要的调控作用。但至今仍缺乏系统研究,为了探究油菜miR169的功能,本研究从油菜栽培种‘Westar’中克隆了miR169d前体基因,并构建了miR169d的过表达载体,通过农杆菌介导法将其转化到甘蓝型油菜‘Westar’品种中,经PCR法鉴定获得4株阳性株,其中2株T0代表现早花,较对照生育期缩短10~12 d。初步推测,油菜miR169d可能通过调控靶基因的表达参与了油菜的早花发育。
油菜;开花;早熟;miR169;遗传转化
油菜(Brassicanapus)是重要的油料作物,对油菜性状的改良是育种家们长期追求的目标。早熟是许多油菜产区和多熟制地区的育种目标之一,早熟油菜成熟早,可以避免生育后期的高温逼熟或干热风等灾害的危害,或减轻受害程度,且能为后茬作物及早腾地,保证后茬作物的高产稳产,从而提高粮油周年产量。甘蓝型油菜产量高、适应性强,在世界各地广泛种植,其种植面积已占全国油菜总种植面积的85%以上[1],培育甘蓝型早熟油菜是当前油菜育种的一个主攻方向。近十几年来,随着分子生物学和生物技术的飞速发展,FPF1(flowering promoting factor 1)、CO(CONSTANS)、LFY(LEAFY)和AP1(APETALA1)等一些控制植物开花时间的基因相继被克隆[2]。已有文献[2-3]报道,前人用农杆菌介导法将外源的FPF1、AP1基因导入甘蓝型油菜品种中,获得的转基因油菜株较野生型油菜提前开花。谭小力等[4]用农杆菌介导的方法将克隆的蓝细菌血红蛋白基因SLR2097转化到甘蓝型油菜中,使油菜的生育期缩短,引起早熟。
miRNAs是一类在进化上保守的长约21~24 nt的非编码单链RNA,在生物体生长发育过程、抗生物或者非生物胁迫中起着非常重要的作用,在基因表达调控的网络中处于核心位置[5-6],通过有效地抑制其靶基因编码的蛋白质的合成,或以其他调节机制来抑制靶基因的表达。miR169家族在植物的生长发育过程中处于重要的调控地位,但至今仍缺乏系统研究,到目前为止,只有部分miR169家族成员的功能被解析。在拟南芥中,miR169家族有14个成员,即:miR169a-miR169n,其中miR169a靶向NF-YA5,在抗旱方面表现负反馈作用[7];miR169d在拟南芥中过表达能引起提前开花1~2周[8];还有研究表明拟南芥miR169参与调控脂肪酸的合成代谢和氮代谢[9-10]。对水稻的17个miR169家族成员分析发现,一些成员与干旱诱导、盐胁迫相关[11]。豆科植物中,miR169通过靶向MtHAP2-1调控共生瘤的生长发育[12]。XU等[13]对油菜miRNA测序分析发现油菜miR169家族有 16 个成员,是油菜miRNA家族中成员最多的家族。油菜miR169家族基因克隆和功能研究均未见报道。前期研究表明,拟南芥miR169d参与植物逆境诱导的开花调控[14],鉴于油菜和拟南芥较高的同源性和研究油菜早熟的重要意义,本研究分离克隆了油菜miR169d前体序列,并构建植物过表达载体转化甘蓝型春油菜品种,以期阐明Bna-miR169d表达调控机制。
1 材料与方法
1.1 材 料
1.1.1 油菜品种 甘蓝型油菜(BrassicanapusL.)栽培品种‘Westar’。
1.1.2 菌株和载体 根癌农杆菌LBA4404、植物表达载体pPZP212均由中国农业科学院生物技术研究所植物代谢工程实验室提供。克隆载体pEASY-T1 Cloning Vector (10 ng/μL)和大肠杆菌(Escherichiacoli)感受态细胞Trans 1-T1购自北京全式金生物公司。
1.1.3 酶、试剂盒和主要的化学试剂TaqDNA聚合酶购自北京泽星生物公司;各种限制性内切酶购自NEB公司;Toyobo 反转录试剂盒购自广州美津生物技术有限公司;Go3S 柱离心式PCR产物回收试剂盒V3.1 K141购自申能博彩生物科技公司;Trizol购自上海生物工程有限公司; IPTG、X-gal、RQ1 RNase-Free DNase、T4DNA连接酶购自Promege公司。普通的化学药品均为国产分析纯试剂。
1.2 方 法
1.2.1 油菜Bna-miR169d基因的扩增 根据Bna-miR169d前体序列设计引物(图1),上游引物5′端添加BamHⅠ酶切位点,下游引物5′端添加SacⅠ酶切位点,引物序列分别为Bna-miR169dFw:GGATCCTAGAAGGAGATGTC; Bna-miR169dRv: GAGCTCTTGCTAGCGAAG-GT,引物由上海生工生物工程有限公司合成。以CTAB法从油菜幼苗中提取的DNA为模板,PCR扩增243 bp的Bna-miR169d前体序列片段。PCR反应体系:Taq(2 U/μL) 0.5 μL,10×Taqreaction buffer 2.0 μL,dNTP mix (10 mmol/L each) 0.5 μL,Bna-miR169d Fw (10 μmol/L) 0.5 μL,Bna-miR169d Rv (10 μmol/L) 0.5 μL,油菜DNA 1.0 μL,dH2O 15 μL。PCR反应条件:94 ℃预变性4 min;94 ℃变性40 s,55.9 ℃退火40 s,72 ℃延伸40 s,共35个循环;72 ℃延伸10 min。

红色碱基为 miR169d成熟序列 Mature nucleotides of miR169d are red nucleotides
1.2.2 油菜Bna-miR169d基因的过表达载体构建 取2.0 μL PCR产物进行15 g/L的琼脂糖凝胶电泳,粗略估计PCR产物的扩增量。根据PCR产物量,按照载体pEASY - T1 Cloning Vector使用说明进行T连接反应,反应结束后转化大肠杆菌Trans1-T1。通过蓝白斑筛选得到的单克隆经PCR和双酶切鉴定后送北京中科希林生物公司用引物M13+进行测序验证。用限制性内切酶BamH Ⅰ和SacⅠ对pPZP212质粒和测序正确的pEASY-T1-miR169d质粒进行双酶切,凝胶电泳切胶回收10 099 bp和243 bp的DNA片段,胶回收后的Bna-miR169d基因前体片段和pPZP212载体片段用T4DNA连接酶按照摩尔比6∶1,在恒温16 ℃条件下连接过夜。取2 μLBna-miR169d基因前体片段与pPZP212载体片段连接的溶液,转化大肠杆菌感受态Trans1-T1,再PCR和酶切鉴定阳性重组子35S∷Bna-miR169d(图2),对鉴定正确的阳性重组子摇菌后送北京中科希林生物公司用引物NOS70进行测序验证。测序验证正确的阳性重组子35S∷Bna-miR169d 电击转化农杆菌LBA4404。
1.2.3 油菜的转化及阳性植株鉴定 按照Bhalla等[15]的方法(略有改变),通过农杆菌介导浸染油菜子叶柄法转化油菜。经Kanamycin不同梯度培养筛选到的生根壮苗炼苗移栽后,用CTAB法提取其DNA,以35SFw/Bna-mi-R169dRv2和35S50/ Bna-miR169dRv1两对鉴定引物分别进行PCR扩增,15 g/L琼脂糖凝胶电泳检测,扩增出555 bp和305 bp条带的为阳性株,PCR阳性对照模板为质粒35S∷Bna-miR169d;阴性对照为未经转化的油菜基因组DNA。鉴定引物序列分别为35SFw:GGATTCCATTGCCCAGCTATCTGTC;Bna-miR169dRv2:GCT- AGCGAAGGTAAAATGTCTG;35S50:CAAGACCCTTCCTCTATATAAGG;Bna-miR169dRv1:GAGCTCTTGCTAGCGAAGGT。
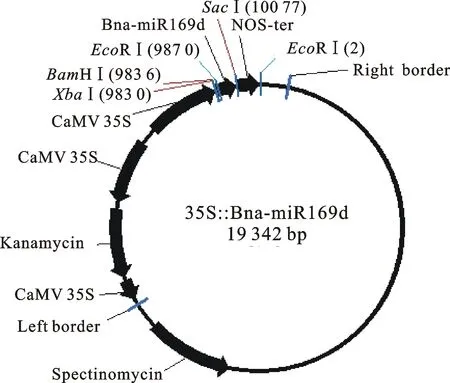
图2 表达载体35S∷Bna-miR169d T-DNA区结构
1.2.4 过表达35S∷Bna-miR169d的T0代转化株表型分析 以野生型油菜作对照,对PCR鉴定呈阳性的过表达35S∷Bna-miR169d的T0代转化株进行生育期记载和表型观察,包括叶片形态、花器结构、株型等,并统计分析株高、分枝数、主花序长度、全株有效角果数、单株生产力和千粒质量等。
2 结果与分析
2.1 油菜Bna-miR169d基因的分离
选取Bna-miR169d(MI0006460)为研究对象。以油菜DNA为模板,Bna-miR169dFw为正向引物,Bna-miR169dRv为反向引物进行PCR扩增Bna-miR169d基因的前体序列,片段长243 bp,电泳结果如图3-a。PCR产物与pEASY - T1 Cloning Vector连接后,利用引物Bna-miR169dFw/Bna-miR169dRv、酶EcoRⅠ/HindⅢ分别对质粒pEASY-T1-miR169d进行PCR、双酶切鉴定,结果质粒PCR条带243 bp(图3-b),酶切条带大小均为264 bp(图3-c),说明Bna-miR169d基因的前体序列PCR产物成功连接到克隆载体。并对pEASY-T1-miR169d测序验证,序列长243 bp,与miRbase 21.0中比对结果一致,证明PCR扩增产物为Bna-miR169d基因的前体序列。
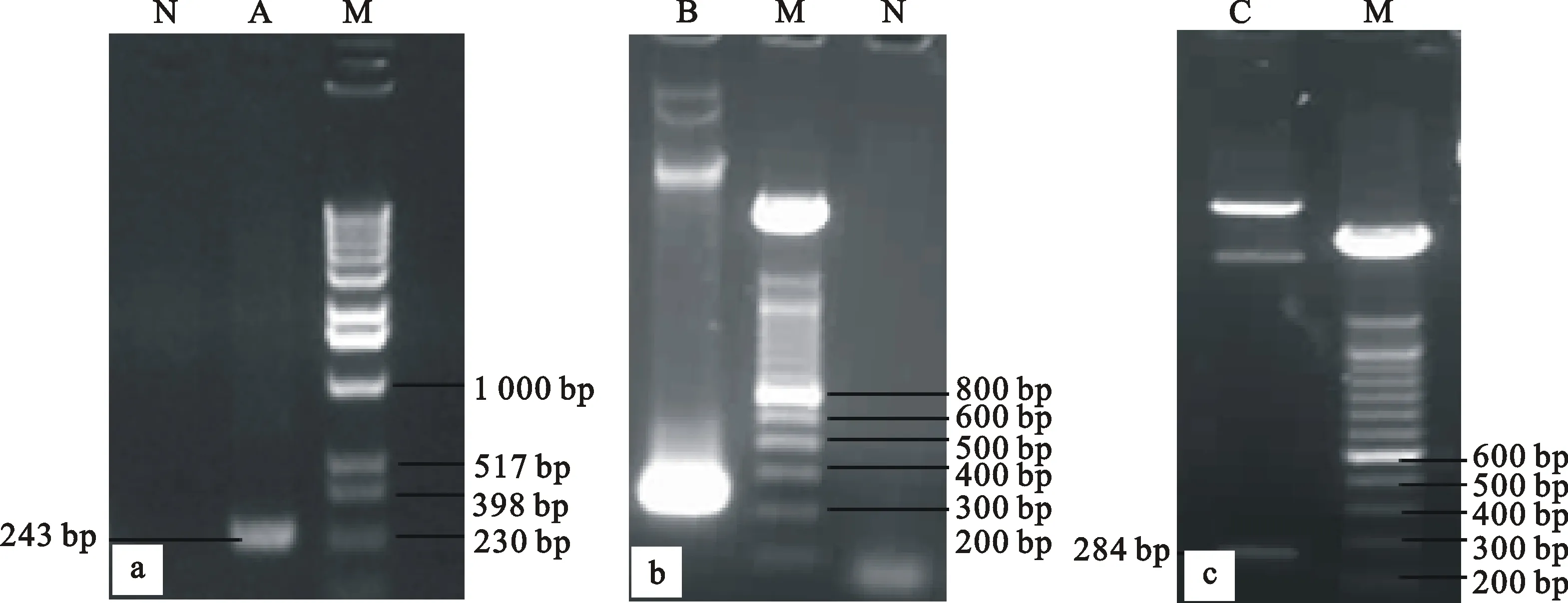
a.以油菜DNA为模板扩增 Bna-miR169d基因片段 PCR amplification for precursor fragments of Bna-miR169d from DNA of Brassica napus;b.pEASY-T1-miR169d的PCR鉴定 Identification of pEASY-T1-miR169d by PCR;c.EcoRⅠ/HindⅢ双酶切鉴定 pEASY-T1- miR169d Identification of pEASY-T1- miR169d by EcoRⅠ/Hind Ⅲ double enzyme digestion;A、B.PCR扩增产物 PCR fragments;C.酶切产物 Enzyme digestion fragments;M.DNA分子量标准 Marker;N.阴性对照 Negative control
2.2 油菜Bna-miR169d基因植物过表达载体的构建
用BamH Ⅰ和SacⅠ分别双酶切植物表达载体质粒pPZP212和测序验证正确的克隆质粒pEASY-T1-miR169d,切胶回收目的片段(图4-a、4-b),并连接。先用引物Bna-miR169d Fw和Bna-miR169d Rv 进行PCR扩增,再用酶EcoR Ⅰ,SacⅠ/XbaⅠ分别进行单酶切和双酶切,酶切鉴定结果见图5-a、5-b。EcoR Ⅰ单酶切产生的片段大小为474 bp,SacⅠ/XbaⅠ双酶切产生的片段大小是247 bp,两次酶切片段大小符合理论值。PCR和酶切均鉴定为阳性的重组子35S∷Bna-miR169d经测序验证获得最终的植物表达载体pPZP212-Bna-miR169d。
2.3 农杆菌介导浸染油菜子叶柄转化油菜
带有植物表达载体35S∷Bna-miR169d的农杆菌LBA4404(OD650nm=0.5)悬浮液共计浸染200个附带2 mm叶柄的油菜子叶(表1,图6-a),在恢复培养3 d后,进行愈伤诱导,总共诱导出愈伤155个(表1,图6-b),出愈率77.5%。选取无褐化、无污染的培养皿中的愈伤120个,在低质量浓度25 mg/L Kanamycin抗性的芽诱导培养基中生长,诱导出芽47个(表1,图6-c),芽诱导率 39.2%。挑取40个生长健壮、无污染和无褐化的发生芽在低质量浓度25 mg/L Kanamycin抗性的芽生长培养基中继续生长4周,然后转移至高质量浓度50 mg/L Kanamycin抗性的筛选培养基中生长4周,筛选出绿苗数20个,白化苗17个,坏死和污染的苗3个。将所有绿苗转接到生根培养基上,1月后发生根的苗数为14株(表1,图6-d),出根率为70%。通过高质量浓度50 mg/L Kanamycin抗性筛选后,将初步确定为阳性的14株抗性转化植株苗炼苗后,移栽在花盆中进行培养。
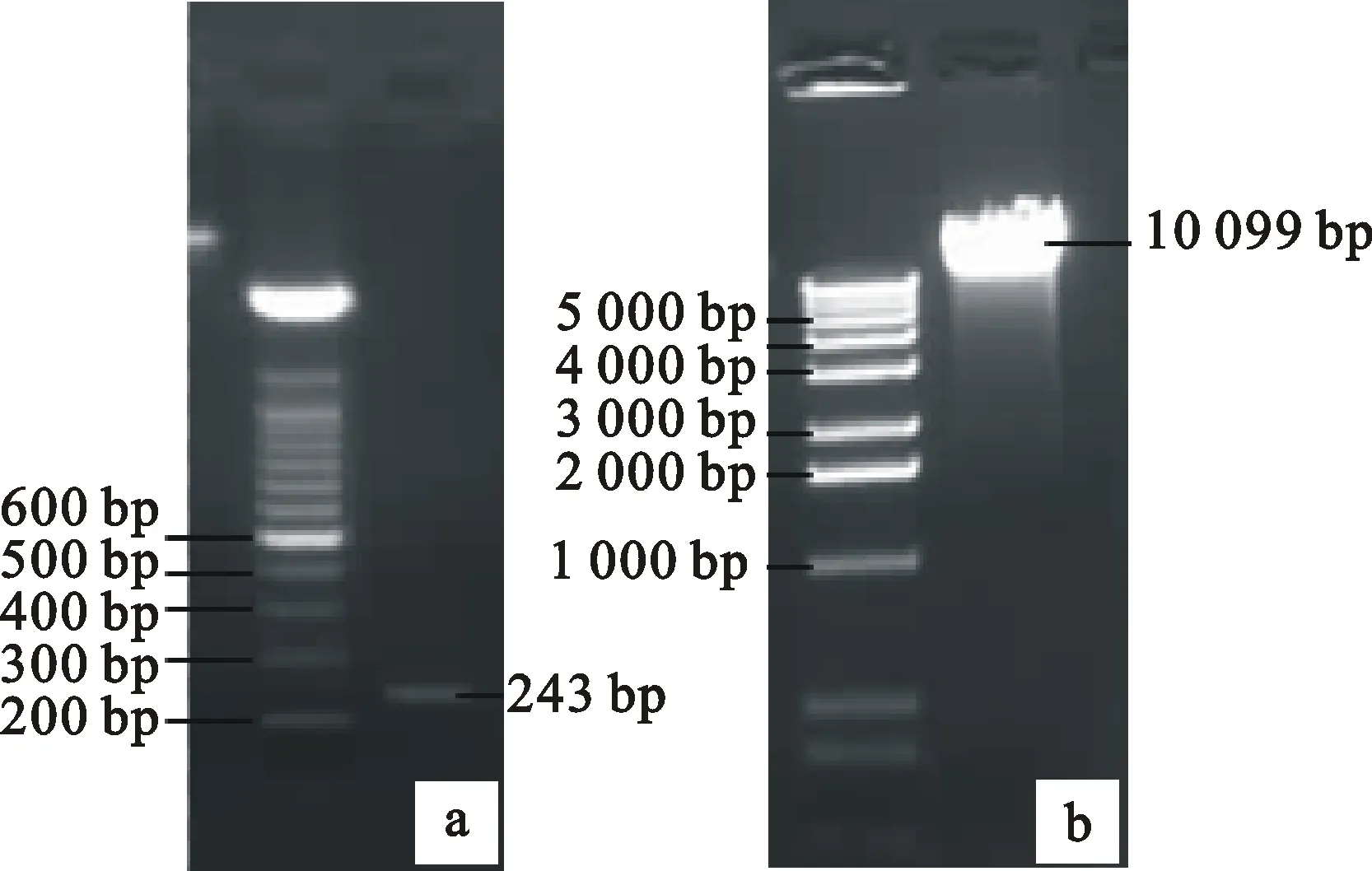
a.pEASY-T1-miR169d酶切后胶回收的 Bna-miR169d片段 Fragment of Bna-miR169d recovered from pEASY-T1-miR169d after enzyme digestion;b.pPZP212酶切片段的胶回收 Fragment of pPZP212 recovered after enzyme digestion
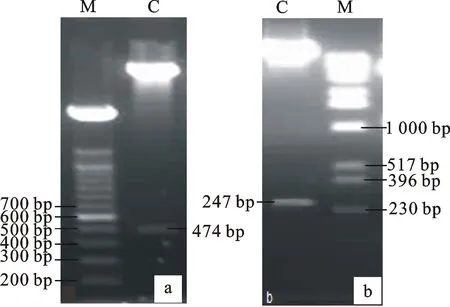
a.EcoRⅠ单酶切鉴定35S∷Bna-miR169d Identification of 35S∷Bna- miR169d by EcoR Ⅰ digestion;b.SacⅠ/XbaⅠ双酶切鉴定35S∷Bna-miR169d Identification of 35S∷Bna-miR169d by SacⅠ/Xba Ⅰ digestion;C.酶切产物 Enzyme digestion fragments;M.分子量标准 Marker

表1 农杆菌介导浸染油菜子叶柄转化油菜效率统计

a.恢复培养 Recovery culture;b.愈伤诱导 Callus induction;c.芽诱导 Bud induction;d.根诱导 Root induction
2.4 转化35S∷Bna-miR169d油菜株的PCR鉴定
以提取的14株转化35S∷Bna-miR169d的油菜苗基因组DAN为模板,利用35SFw/ Bna-miR169d Rv2和35S50/ Bna-miR169d Rv1两对引物分别对这些DNA进行PCR扩增,结果表明,35SFw/Bna-miR169d Rv2和35S50/Bna-miR169d Rv1均有4株扩增出目的条带(图7-a,7-b),条带大小分别为预期的555 bp和305 bp,从而最终确定过表达Bna-miR169d基因的转基因油菜共4株。
2.5 转化35S∷Bna-miR169d油菜株T0代表型分析
以野生型油菜作对照,对PCR鉴定呈阳性的过表达35S∷Bna-miR169d的T0代转化株进行表型观察,结果显示过表达Bna-miR169d油菜株叶片形态、花器结构与对照相比没有明显变化,其中有2株过表达Bna-miR169d油菜株开花期提前(图8),较其他2株转Bna-miR169d油菜株及野生型对照株生育期缩短10~12 d。
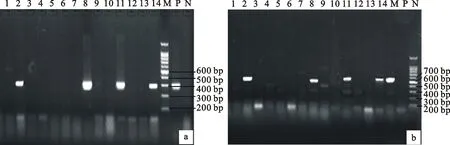
a.35SFw/ Bna- miR169dRv2扩增 PCR amplification by primers 35SFw/Bna- miR169dRv2;b.35S50/ Bna- miR169dRv1扩增 PCR amplification by primers 35S50/Bna- miR169dRv1;P.阳性对照 Positive control;N.阴性对照 Negative control;M.DNA分子量标准 Marker

图8 转基因油菜表型
3 讨论与结论
miRNA是一类长度约为21~24 nt的内源性非编码RNA,在转录后水平切割mRNA或抑制翻译来调控靶基因的表达,几乎参与了动植物体内所有重要的生命活动,调控相关基因的表达[16],目前发现植物miRNA靶标中的50%左右是在发育模式中起重要作用的转录调控因子[17]。目前miRBase中油菜miR169家族有 16 个成员,关于油菜miR169家族基因克隆和功能研究均未见报道。虽然对油菜进行了早熟相关基因的克隆与转化研究,并在拟南芥中也已鉴定了几个参与调控早花发育的miRNAs,如miR156、miR169d,但是目前的研究结果仍是支离破碎,各个靶基因是独立的,还没有建立起miRNA调控早花的遗传控制网络。相对于模式植物拟南芥,miRNA参与油菜早花发育的分子机制研究几乎是一片空白,目前还没有从油菜中克隆出任何控制早熟相关的miRNA,这与早熟在油菜育种中的重要地位极不相符。因此,亟需进一步探索油菜早熟相关miRNA基因表达的调控机制。
本研究克隆了油菜Bna-miR169d基因前体序列,并将构建的植物表达载体35S∷Bna-miR169d在油菜中进行了转化研究,初步鉴定了油菜Bna-miR169d基因的功能。转化35S∷Bna-miR169d的4株T0代油菜阳性株中有2株表现早花现象,生育期缩短,其他2株阳性株与野生型油菜表型一致。至于该2株过表达35S∷Bna-miR169d未表现变异的阳性株油菜,分析可能是35S∷Bna-miR169d在受体中插入位点不同或转化拷贝数低,具体原因还须通过Northern blotting等分子实验手段进一步验证,并继续进行遗传转化,以获得更多的阳性株系,最终确定miR169d过表达引起的表型变化。通过表型分析,初步推测油菜miR169d可能通过调控靶基因的表达参与油菜的早花发育。利用生物信息学预测到一个Bna-miR169d的靶基因NF-YA,是一种结合转录因子,与NF-YB和NA-YC结合形成三聚体,参与下游基因的调控。在拟南芥中,miR169家族有14个成员,有4种不同的序列。miR169靶向的NF-YA基因,是NF-YA的家族成员,是一类CCAAT-box结合转录因子,据报道[18],在拟南芥中过表达HAP3b (NF-YB)、HAP2a(NF-YA)会延迟开花时间。油菜中NF-YA是否为Bna-miR169d真正的靶基因,过表达NF-YA是否会延迟油菜开花,还有待于进一步研究。
Reference:
[1] 梅德圣,李云昌,王汉中.作物产量性状QTL定位的研究现状及应用前景[J].中国农学通报,2003,19(5):83-88.
MEI D SH,LI Y CH,WANG H ZH.The present situation and prospects of mapping QTL controlling yield traits in crops[J].ChineseAgriculturalScienceBulletin,2003,19(5):83-88(in Chinese with English abstract).
[2] 黄琼华,杨光伟,李德谋,等.农杆菌介导法将FPF1基因导入油菜的研究初报[J].西南农业大学学报,2002,24(2):124-127.
HUANG Q H,YANG G W,LI D M,etal.Preliminary studies on transgenic rapeseed (BrassicanapusL.) withFPF1mediated by agrobacterium tumefacien[J].JournalofSouthwestAgriculturalUniversity,2002,24(2):124-127(in Chinese with English abstract).
[3] 杨郁文,张保龙,倪万潮,等.花分生组织决定基因APETALA1转化油菜[J].江苏农业学报,2007,23(6):564-567.
YANG Y W ,ZHANG B L,NI W CH,etal.Transformation of floral meristem identity geneAPETALA1intoBrassicanapus[J].JiangsuJournalofSouthwestAgriculturalScience,2007,23(6):564-567(in Chinese with English abstract).
[4] 谭小力,孔凡明,张丽丽,等.蓝细菌血红蛋白基因的克隆及其向甘蓝型油菜中的转化[J].作物学报,2009,35(1):66-70.
TAN X L,KONG F M,ZHANG L L,etal.Cloning and analysis of hemoglobin gene in cyanobacterium and transformation intoBrassicanapusL[J].ActaAgronomicaSinica,2009,35(1):66-70(in Chinese with English abstract).
[5] WANG J W,SCHWAB R,CZECH B,etal.Dual effects of miR156-targetedSPLgenes and CYP78A5/KLUH on plastochron length and organ size inArabidopsisthaliana[J].PlantCell,2008,20:1231-1243.
[6] GUO H S,XIE Q,FEI J F,etal.MicroRNA directs mRNA cleavage of the transcription factors NAC1 to downregulation auxin signals forArabidopsislateral root development[J].ThePlantCell,2005,17(5):1376-1386.
[7] LI W X ,Youko Oono,ZHU J H,etal.TheArabidopsisnfya5 transcription factor is regulated transcriptionally and posttranscriptionally to promote drought resistance[J].ThePlantCell,2008,20:2238-2245.
[8] 李微微.植物中miR169靶基因分离及功能分析[D].贵阳:贵州大学,2010.
LI W W.Isolation and functional analysis ofmiR169target gene in plants[D].Guiyang:Guizhou University,2010(in Chinese with English abstract).
[9] BARGMANN B,LAXALT A M,RIET B,etal.Reassessing the role of phospholipase D in theArabidopsiswounding response[J].PlantCellandEnvironment,2009,32:837-850.
[10] PANG B D,MUSIALAK-LANGE M,NUC P,etal.Identification of nutrient-responsiveArabidosisand rapeseed microRANs by comprehensive real-time polymerase china reaction profiling and small RNA sequencing[J].PlantandPhysiology,2009,150(3):1541-1555.
[11] ZHAO B,GE L,LIANG R,etal.Members of miR-169 family are induced by high salinity and transiently inhibit the NF-YA transcription factor[J].BMCMolecularBiology,2009,10:29-38.
[12] COMBIER J P,FRUGIER F,BILLY F,etal.MtHAP2-1isakey transcriptional regulator of symbiotic nodule development regulated by microRNA169 inMedicagotruncatula[J].Genes&Development,2006,20:3084-3088.
[13] XU M Y,DONG Y,ZHANG Q X,etal.Identification of miRNAs and their targets fromBrassicanapusby high-through put sequencing and degradome analysis [J].BMCGenomics,2012,13:421-436.
[14] XU M Y,ZHANG L,LI W W,etal.Stress-induced early flowering is mediated bymiR169inArabidopsisthaliana[J].JournalofExperimentalBotany,2014,65(1):89-101.
[15] BHALLA P L,SINGH M B.Agrobacterium-mediated transformation ofBrassicanapusandBrassicaoleracea[J].NatureProtocols,2008,3(2):181-189.
[16] PAUL S,KUNDU A,PAL A.Identification and expression profiling ofVignamungomicroRNAs from leaf small RNA transcriptome by deep sequencing[J].JournalofIntegrativePlantBiology,2014,56(1):15-23.
[17] CHUCK G,CANDELA H,HAKE S.Big impacts by small RNAs in plant development[J].CurrentOpinioninPlantBiology,2009,12:81-86.
[18] CHEN N Z,ZHANG X Q,WEI P C,etal.AtHAP3b plays a crucial role in the regulation of flowering time in arabidopsis during osmotic stress[J].JournalofBiochemistryandMolecularBiology,2007,40(6):1083-1089.
(责任编辑:潘学燕 Responsible editor:PAN Xueyan)
Isolation and Preliminary Overexpression ofBna-miR169dGene in Oilseed Rape
DONG Yun1,WANG Yi1,JIN Fengwei1,SUN Wancang2,LIU Zigang2, FANG Yan2, XU Miaoyun3and WANG Lei3
(1.Crop Research Institute, Gansu Academy of Agricultural Sciences, Lanzhou 730070, China; 2. Research Center for Rapeseed Engineering Technology of Gansu, Lanzhou 730070, China; 3.Biotechnology Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China)
Micrornas (miRNAs) are endogenous 21-24 nt nucleotide of non-coding RNA, which play an important role in regulating gene expression.miR169family is the largest plant miRNA family and its family members can regulate plant growth and development. But little systematic research has done in this area. In order to explore the regulating functionmiR169in rape, the pre-miR169dwas cloned from rape variety ‘Westar’ by PCR , and successfully constructed the plant expression vector of pre-miR169dinto vector pPZP212, and then was transformed into variety ‘Westar’ by Agrobacterium tumefaciens mediated approach. Four positive transgenic lines were obtained, two of them flowered early, growth period was 10-12 days’ shorter than the control. The results showwed thatBna-miR169dmay regulate the expression of target genes by flowering pathways.
Rapeseed; Flowering;Early maturity;miR169; Genetic transformation
DONG Yun, male,Ph.D,associate research fellow.Research area:rapeseed breeding. E-mail:dongyungs@163.com
XU Miaoyun,female,Ph.D,associate research fellow.Research area:maize functional genomics of flowering and seed development.E-mail:xumiaoyun76@163.com
2016-02-18
2016-03-20
国家自然科学基金(31260334);甘肃省自然科学基金(1308RJZA205);甘肃省农科院创新专项(2013GAAS16);甘肃省油菜工程技术研究中心项目(1306NTGA022)。
董 云,男,博士,副研究员,主要从事油菜育种研究。E-mail:dongyungs@163.com
徐妙云,女,博士,副研究员,从事植物开花时间和种子发育调控机制研究。E-mail:xumiaoyun76@163.com 王 磊,男,博士,研究员,从事玉米抗逆与生殖发育调控及玉米基因工程研究。E-mail:caaswlwl@163.com
日期:2016-12-12
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161212.1114.018.html
S565.4
A
1004-1389(2016)12-1809-07
Received 2016-02-18 Returned 2016-03-20
Foundation item The National Science Foundation of China (No.31260334);Science Foundation of Gansu Province(No.1308RJZA205);the Special Innovation Program of Gansu Academy of Agricultural Sciences(No.2013GAAS16);the Program of Research Center for Rapeseed Engineering Technology (No.1306NTGA022).
WANG Lei,male, Ph.D,research fellow.Research area:functional genomics of stress resistance and reproductive development.E-mail:caaswlwl@163.com
