QuEChERS结合HPLC-MS-MS测定鲮体内孔雀石绿及其代谢物残留及消除规律
2017-01-03刘书贵尹怡李丽春单奇朱新平马丽莎戴晓欣郑光明
刘书贵,尹怡,李丽春,单奇,朱新平,马丽莎,戴晓欣,郑光明
(中国水产科学研究院珠江水产研究所,农业部热带亚热带水产种质资源利用与养殖重点实验室,农业部水产品质量安全风险评估实验室(广州),广东 广州510380)
QuEChERS结合HPLC-MS-MS测定鲮体内孔雀石绿及其代谢物残留及消除规律
刘书贵,尹怡,李丽春,单奇,朱新平,马丽莎,戴晓欣,郑光明*
(中国水产科学研究院珠江水产研究所,农业部热带亚热带水产种质资源利用与养殖重点实验室,农业部水产品质量安全风险评估实验室(广州),广东 广州510380)
通过对干燥剂、分散吸附剂的种类及质量进行对比及优化,对鲮体内孔雀石绿(MG)及其代谢物的分散固相萃取/高效液相色谱-串联质谱(QuEChERS-HPLC-MS/MS)联用方法进行了优化。方法以乙腈为萃取溶剂,无水硫酸镁为干燥剂,乙二胺-N-丙基硅烷(PSA)与石墨化炭黑(GCB)为分散吸附剂,电喷雾正离子模式(ESI+),多反应监测模式,内标法定量。结果显示,无水硫酸镁对样品中水分干燥效果良好,50 mg PSA+10 mg GCB可达到净化效果。在优化条件下,MG和无色孔雀石绿(LMG)在1~50 ng/mL范围内呈现良好的线性相关,相关系数r分别为0.999 21和0.999 37;方法检测限(LOD,S/N=3)为0.5 μg/kg。采用该方法对鲮空白样品进行检测及加标回收率的测定,在2.0、10、25 μg/kg 3个浓度水平下,MG的加标回收率为82.5%~92.6%,LMG的加标回收率为84.6%~95.1%。将该方法用于鲮体内MG及LMG残留消除规律研究,得到MG和LMG的消除半衰期分别为13.6、178.3 h,表明MG在鲮体内消除相对较快,但是其主要代谢产物LMG消除缓慢,直到40 d后低于检测限。本研究可为鲮等水产品中MG和LMG的检测提供支持技术,为水产品质量安全监管提供参考数据。 [中国渔业质量与标准,2016,6(5):45-51]
QuEChERS;高效液相色谱-串联质谱;鲮;孔雀石绿;无色孔雀石绿;残留;消除
孔雀石绿(C23H25ClN2, malachite Green, MG)又名碱性绿,是一类具有较强杀菌能力的染料类药物,被广泛用于纺织业、制陶业、皮革业及作为食品染色剂和细胞化学染色剂等[1],应用于预防或治疗水产动物多种疾病,如水霉病、烂鳃病和小瓜虫病等,特别在治疗水霉病上具有非常显著的作用[2-3]。MG被水产动物吸收后,大部分会快速地代谢为亲脂性的无色孔雀石绿(leuco-malachite Green, LMG)。由于MG及其代谢产物LMG在鱼体内残留时间较长,且均具有高毒性、高残留性和“三致”(致癌、致畸、致突变)等副作用[4-7],为美国、日本和英国等国家所禁用[8-11]。
中国农业部于2002年5月发布的《食品动物禁用的兽药及其化合物清单》文件(农牧发[2002]1号)中明确规定,所有可食用动物组织中不得检出MG及LMG。但是由于MG抗菌效果好、价格便宜等原因,偶有部分养殖户在鳜(Sinipercachuatsi)及其饵料鱼鲮(Cirrhinusmolitorella)的孵化及养殖过程中违规使用。若鳜食用了经MG药浴的鲮,有可能会造成其体内MG及LMG的残留。
目前水产品中MG及LMG的检测方法主要依据国家标准GB/T19857—2005[12],该方法萃取方式简单、但耗时较长,某些水产品中色素和脂肪等杂质无法有效去除。分散固相萃取法(QuEChERS)是一种快速、简易的前处理方法[13],即提取液中直接加入吸附剂粉进行净化,离心后对上清液进行上机检测。该方法最初用于多种农药在水果、蔬菜基质中同时测定时的前处理[14-15],近年来也用于动物源食品的前处理[16-17]。为了研究鳜体内MG的可能来源,本研究首先以鲮为受试对象,用药浴的方式模拟自然养殖条件,研究MG及LMG在鲮体内的蓄积和消除规律,旨在为水产品中MG和LMG的检测提供支持技术,为水产品质量安全监管提供参考数据。
1 材料与方法
1.1 材料
1.1.1 实验材料与养殖场所
实验用鲮(Cirrhinusmolitorella)由中国水产科学研究院珠江水产研究所良种基地提供,平均体重为(2.0±0.5)g,体长为(4.0±0.5)cm,约5 000尾,经测定无MG及LMG残留;养殖场所位于广州市中国水产科学研究院珠江水产研究所内的0.2 hm2池塘,挂网箱养殖。
1.1.2 试剂与药品
MG和LMG标准品由德国Dr.Ehrenstorfer公司提供,纯度≥95%;孔雀石绿-D5(D5-MG)和无色孔雀石绿-D6(D6-LMG)标准品由德国Witega公司提供,纯度>99%。乙腈和甲醇(色谱纯,德国Merck公司),甲酸(色谱纯,日本TCI公司),乙二胺-N-丙基硅烷(PSA)、石墨化炭黑(GCB)、中性氧化铝(Alumina-N)、弗罗里硅土(Florisil)(Technologies,Agela公司),无水硫酸镁、无水乙酸铵、冰乙酸均为分析纯,水为超纯水。
1.1.3 主要仪器和设备
Waters e2695-Quattro Micro API三重四级杆液质联用仪(美国Waters 公司);旋转蒸发仪(日本Eyela公司);离心机(上海飞鸽公司);匀浆机(德国IKA T18);超声波水浴(宁波新芝公司);漩涡振荡器(德国IKA MS3)。
1.2 残留消除实验
1.2.1 实验分组及给药
实验鱼购回后放入养殖网箱中,实验设1个空白对照组与2个实验组,暂养7 d。待鲮正常摄食后,将2个实验组鲮分别置于质量浓度理论值为1 000 μg/L孔雀石绿水溶液中药浴1 min后捞出,并再次分别放入2个网箱中喂养。实验期间水温约为(28±2)℃,每天投喂3次饲料。
1.2.2 样品采集
药浴后于0、6、24、48、120、360、480、720、960、1 200和2 160 h取全鱼样品,每个时间点从2个实验组中分别采3个平行样,每个样品重量以满足检测为宜,共6个平行。样品于-20 ℃条件下保存,待测。根据实验需要可能需要采集更长时间点样品。
1.3 方法
1.3.1 标准溶液配制
标准储备液和标准工作液根据参考文献[12]进行。
1.3.2 样品前处理
称取5.0 g已绞碎样品于50 mL离心管中,加入200 μL混合内标标准溶液,加入5 g无水硫酸镁和11 mL乙腈,超声波振荡提取2 min,8 000 r/min匀浆提取30 s,4 200 r/min离心5 min,上清液转移至25 mL比色管中;另取一50 mL离心管加入11 mL乙腈,洗涤刀头10 s,洗涤液移入前一离心管中,用玻璃棒捣碎离心管中沉淀,涡旋振荡30 s,超声波振荡5 min,4 200 r/min离心5 min,上清液合并至25 mL比色管中,用乙腈定容至25 mL,摇匀备用。
准确移取5.00 mL样液于磨口玻璃管中,45 ℃旋转蒸发至干,用乙腈-5 mmol/L乙酸铵溶液(1∶1,V/V)定容至2.00 mL后转移至5 mL离心管中,加入50 mg PSA+10 mg GCB,涡旋混合1 min,12 000 r/min离心5 min,上清液过0.22 μm滤膜后供HPLC-MS/MS测定。
1.3.3 色谱条件
色谱柱为XTerra MS C18柱,100 mm×2.1 mm(i.d.),粒度3.5 μm。流动相A为乙酸铵缓冲溶液(5 mmol/L,pH=4.5),流动相B为乙腈,流速0.20 mL/min,柱温35 ℃,进样量20 μL,梯度洗脱条件如表1。
表1 梯度洗脱条件
Tab.1 Conditions of gradient elution
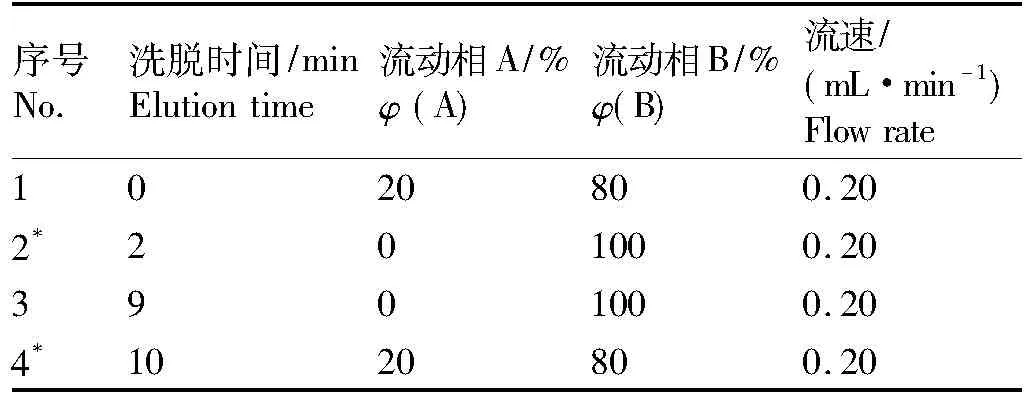
序号No.洗脱时间/minElutiontime流动相A/%φ(A)流动相B/%φ(B)流速/(mL·min-1)Flowrate1020800.202*201000.203901000.204*1020800.20
注:*表示上一梯度结束立即改变流动相百分比。
1.3.4 质谱条件
采用大气压电喷雾离子源(ESI),正离子模式;电离电压3.5 kV;离子源温度120 ℃;脱溶剂气温度350 ℃;脱溶剂气流速700 L/h;扫描模式为反应监测(MRM)。质谱参数见表2。
1.4 数据处理
MG和LMG在鲮体内的残留数据均采用平均值±标准差表示。通过PKSolver 2.0软件将浓度平均值-时间数据进行分析,计算出平均消除速率和消除半衰期。
表2 质谱参数
Tab.2 MS parameters
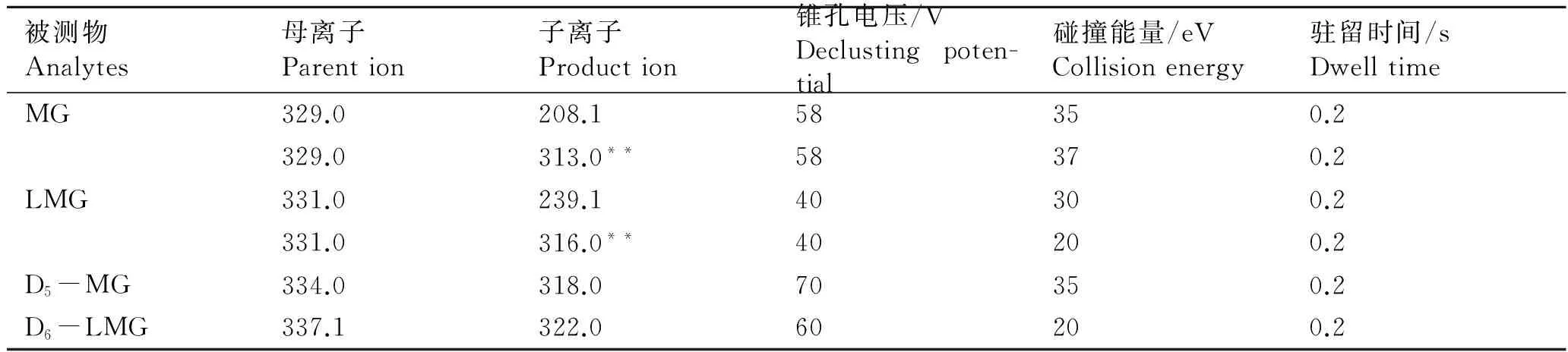
被测物Analytes母离子Parention子离子Production锥孔电压/VDeclustingpoten-tial碰撞能量/eVCollisionenergy驻留时间/sDwelltimeMG329.0208.158350.2329.0313.0**58370.2LMG331.0239.140300.2331.0316.0**40200.2D5-MG334.0318.070350.2D6-LMG337.1322.060200.2
注:带**的子离子用作定量分析。
2 结果与分析
2.1 提取方法的优化
实验中鲮作为鳜的饵料鱼,因体积小,难以只取肌肉,所以多条饵料鱼一起绞碎成肉糜。采用加入无水硫酸镁的方式消除样品中水分,使旋转蒸发效率比没添加时提高40%。实验表明采用该方式提取,蒸发效率更高,耗时更少。
2.2 净化条件的优化
QuEChERS方法常用到的净化剂有PSA、GCB、Alumina-N和Florisil等。本研究考察这4种吸附剂对目标化合物的吸附效果及回收率情况。取适量10 ng/mL MG及LMG的基质混合标准工作液,与其内标标准工作液混合配成标样为5 ng/mL和内标为2 ng/mL的混合标准液,分别加入50 mg PSA、GCB、Alumina-N和Florisil,经振荡离心后,过0.22 μm滤膜后上机测定,由图1可知,除GCB外,经PSA、Alumina-N和Florisil处理后MG和LMG的回收率均介于86.7%~95.4%之间,但Alumina-N和Florisil处理后的样品色素、油脂等杂质仍然较多。经PSA处理后,能有效去除样品中脂肪酸、有机酸、酚类及少量色素等极性杂质[18],但谱图上依然有少许杂质干扰。用GCB可以去除样品中色素及非极性杂质[18],实验发现前处理过程中加入适量GCB粉末,净化效果更好。故本实验选择PSA和GCB混合粉末作为吸附净化剂。
本研究对PSA和GCB的添加量进行优化。结果显示,添加量为5 μg/kg的MG样品溶液中加入50 mg PSA+10 mg GCB即可达到净化效果。若继续增加PSA回收率仍然维持在84.5%~96.2%;若继续增加GCB造成基质效应增大直至检测不到,添加GCB到50 mg后回收率如图2。故实验选择50 mgPSA+10 mg GCB对样品进行净化。
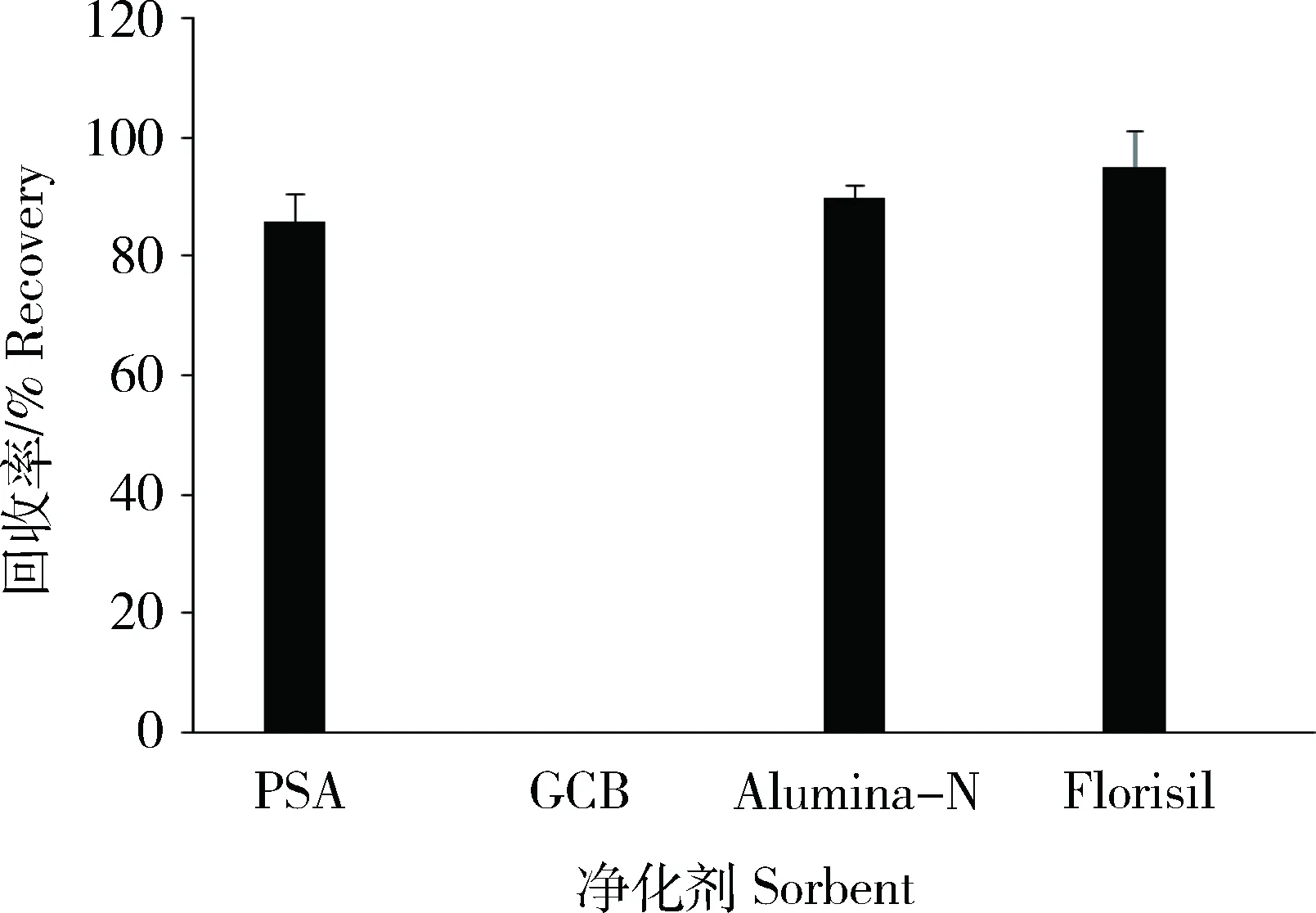
图1 不同吸附剂对MG及LMG回收率的影响Fig.1 Effects of different sorbents on the recovery of MG and LMG(n=4 )

图2 继续添加PSA或GCB对MG及LMG回收率的影响Fig.2 Effects of continuing adding PSA or GCB on the recovery of MG and LMG (n=4 )
2.3 无色孔雀石绿及孔雀石绿检测色谱图
如图3所示,LMG和MG标准品基线走动平稳,无杂峰干扰,保留时间分别为3.46和1.20 min。图4中B1和B2分别为鲮药浴30 d后LMG和MG在肌肉中的检测色谱图。

图3 无色孔雀石绿和孔雀石绿标准品检测色谱图 A1:无色孔雀石绿色谱图;A2:孔雀石绿色谱图。Fig.3 Detection chromatograms of LMG and MG standards (10 ng·mL-1) A1: Detection chromatograms of LMG; A2: Detection chromatograms of MG.

图4 药浴30 d后鲮的无色孔雀石绿和孔雀石绿检测色谱图 B1:无色孔雀石绿色谱图;B2:孔雀石绿色谱图。Fig.4 Detection chromatograms of LMG and MG of Cirrhina molitorella medicated bath after 30 d B1: Detection chromatograms of LMG; B2: Detection chromatograms of MG.
2.4 标准曲线与线性范围
在质量浓度1~50 ng/mL范围内以响应值(Y)与标样质量浓度(X)绘制标准工作曲线,MG和LMG的标准曲线方程分别为Y=2.736 24X+0.234 70和Y=2.365 74X+0.274 30,相关系数r分别为0.999 21和0.99937,因而在该浓度范围内MG和LMG的浓度和峰面积呈现良好的线性相关。信噪比(S/N)为3时计算检测限(LOD),结果得到MG和LMG的LOD均为0.5 μg/kg。
2.5 回收率和精密度
在加标水平2.0~25 μg/kg时,MG和LMG的回收率及相对标准偏差见表3。
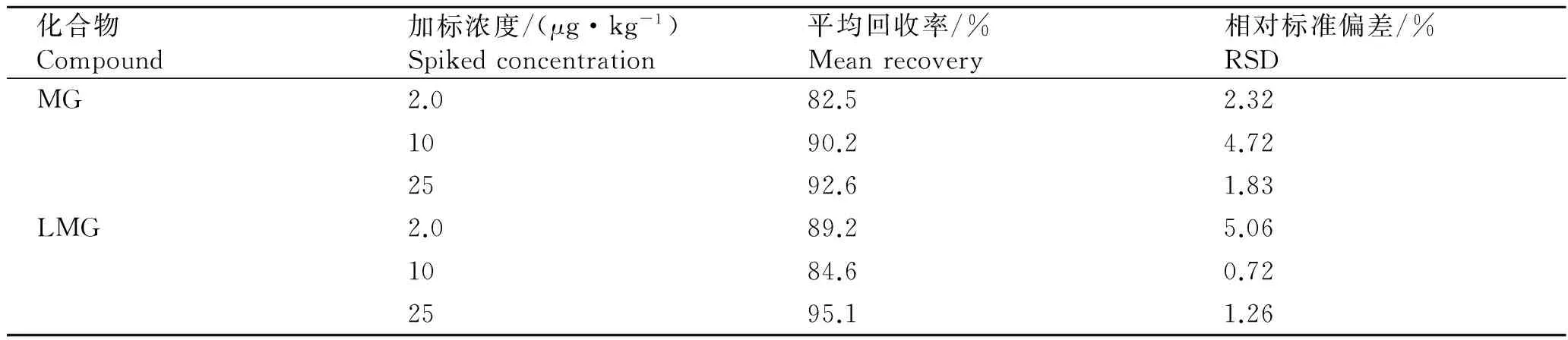
表3 空白基质加标回收率和精密度
2.6 鲮体内MG及LMG随时间的残留变化情况
药浴后鲮体内MG和LMG在不同时间点的残留量变化见表4和图5。研究结果显示,停止药浴后,MG和LMG在鲮体内呈现递减趋势。在0~6 h范围内,鲮体内的MG和LMG的残留量都急剧下降。MG由(36.40±3.45)μg/kg急剧下降到(7.30±4.12) μg/kg,LMG由(41.50±4.21) μg/kg 急剧下降到(13.90±2.76) μg/kg。随后MG缓慢下降至2 d后低于检测限,而LMG在鲮体内的消除时间更长,呈现波动式下降至40 d后低于检测限。本实验MG在鲮体内的消除半衰期为13.6 h,平均消除速率为3.81 μg/(kg·h),而LMG的消除半衰期为178.3 h,平均消除速率为0.58 μg/(kg·h),表明MG在鲮体内消除相对较快,但是其主要代谢产物LMG消除缓慢,直到40 d后低于检测限。

表4 鲮体内MG和LMG的残留量
注:ND表示未检出。
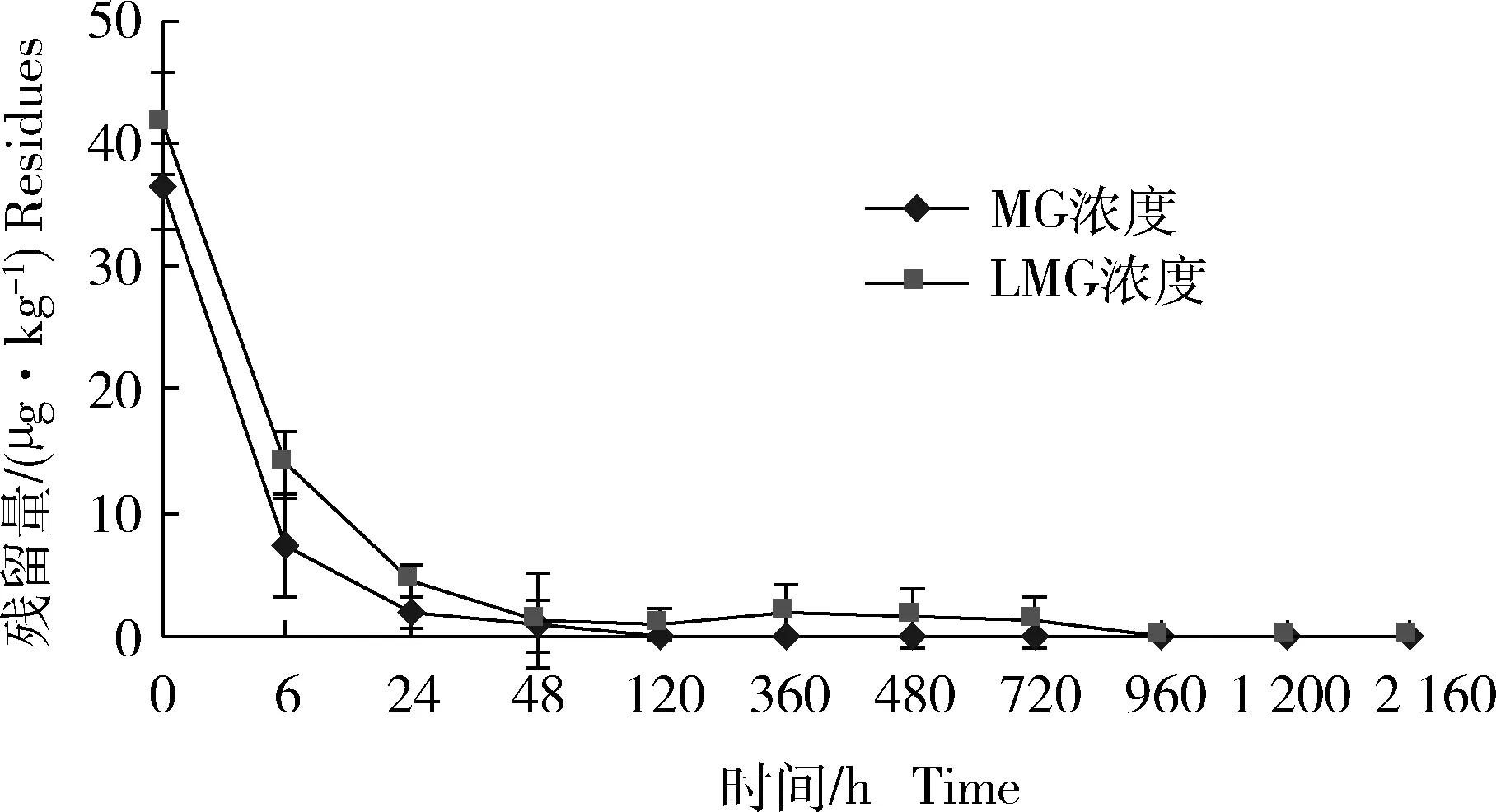
图5 MG和LMG残留量的变化Fig.5 Changes of MG and LMG residues in Cirrhina molitorella (n=6)
3 讨论
本研究中鲮在全鱼绞碎成糜后存在大量水分,在前处理方法中添加干燥剂无水硫酸镁,可有效消除样品中的水分,与国标方法[12]相比,能够有效提高旋转蒸发效率,缩短前处理时间。选择净化组合50 mg PSA+10 mg GCB,PSA能有效去除样品中脂肪酸、有机酸、酚类及少量色素等极性杂质[18], GCB可以去除样品中色素及非极性杂质[18],使仪器基线噪音降低,目标物的灵敏度上升。传统的样品前处理通常采用液液分配或固相萃取等方法净化样品,这些方法耗时长,有机溶剂消耗量大,不利于环保。与传统方法相比,本研究方法节省了有机溶剂用量,缩短样品前处理时间,方法快速、简便、易行,可满足复杂基质样品中的MG分析。
本实验将鲮置于1 000 μg/L MG水溶液中药浴1 min后捞出,因MG浓度较大、药浴时间短暂,药浴期间的样品采集没有进行。药浴后样品中MG在2 d后低于检测限,而LMG在其体内的消除时间更长至40 d后才低于检测限。尹怡等[19]研究报道,将经 1 mg/L MG 溶液浸泡 2 min 后的鲮连续喂鳜10 d后,到6 d时鳜体内的LMG残留量为(5.88±0.13) μg/kg,由此可知养殖过程中阳性饵料鱼体内的MG 会通过食物链传递给鳜,造成鳜体内 LMG 检出。但由于受药物浓度、药浴时间或受试对象的种类等因素影响,MG及LMG在受试对象体内的消除时间不尽相同。杨贤庆等[20]用 0.5 和 2 mg/L两个质量浓度的 MG 溶液分别对大、小规格淡水养殖罗非鱼药浴 1 h,同时用2 mg/L MG 溶液分别对小规格的淡水和小规格的咸淡水养殖的罗非鱼药浴 1 h,到第60天时所有组罗非鱼肌肉中都检测不到 MG,而LMG 依然可以检到;大规格罗非鱼MG和LMG代谢快于小规格的罗非鱼;药浴浓度与MG和LMG 残留浓度及残留时间呈正相关。刘永涛等[21]用7 mg/L MG 溶液对斑点叉尾鱼苗浸泡5 min,斑点叉尾肌肉中45 d 时未能检测到 MG,90 d 时未能检测到 LMG。高露姣等[22]研究报道欧洲鳗鲡在200 μg/L的MG溶液中药浴12 h,至清水中120 d时MG的残留量为(6.0±4.7) μg/kg,LMG的残留量为(12.0±6.7) μg/kg。因此鱼的种类、大小以及药浴时间等因素都会影响到MG的代谢及消除规律,但总体规律相似。
4 结论
本研究以无水硫酸镁为干燥剂,经50 mg PSA+10 mg GCB净化,有效去除上机样品中的基质杂质。优化后的方法快速、简单和准确,适用于基质脂肪和色素含量大、水分含量多的样本检测。鲮体内MG的残留消除实验表明,MG消除较快,代谢产物LMG在鲮体内的消除期较长,直到40 d后低于检测限。如果将含有MG或LMG的鲮喂养鳜,可能会造成鳜中MG或LMG的残留,因此必须严禁MG在水产养殖中使用。
[1] Culp S J, Beland F A. Malachite green: a toxicological review[J]. J Am Coll Toxicol, 1996(15):219-238.
[2] 王声瑜. 怎样有效选用含氯消毒剂和孔雀石绿[J]. 北京水产,1999(3):16.
[3] Plakas S M, Said K R, Stehly G R,et al. Uptake tissue distribution and metabolism of malachite green in the channel catfish (IctalurusPunctatus) [J]. Can J Fish Aquat Scj, 1996,53:1427-1433.
[4] 刘峰延, 葛家春, 朱晓华. 孔雀石绿在水产动物体内的分布及新陈代谢规律[J].中国水产, 2006(1): 58-59.
[5] Fernandes C, Lalitha1 V S, Rao K V K. Enhancing effect of malachite green on the development of hepatic pre-neoplastic lesions induced by N-nitrosodiethylamine in rats [J]. Carcinogenesis, 1991, 12(5):839-845.
[6] Rao K V K.Inhibition of DNA synthesis in primary rat hepatocyte cultures by malachite green: a new liver tumor promoter [J]. Toxicol Lett, 1995, 81(2/3): 107-113.
[7] Gouranchat C.Malachite green in fish culture (state of the art and perspectives ) [R]. Nantes, France:Ecole Natl. Veterinaire ENVT, 2000: 142.
[8] U.S. FDA Animal Drugs Research Center. LIB4363: Quantitative and confirmatory analysis of malachite green and leucomalachite green residues in fish and shrimp[S]. Denver: Animal Drugs Research Center, 2005.
[9] Amendment: application of laboratory information bulletins 4333 and 4334 for the determination of leucomalachite green and malachite green residues in catfish, basa, tilapia, trout and shrimp[S]. Denver: Animal Drugs Research Center, 2005.
[10] U.S. FDA, Animal Drugs Research Center. LIB4333: Determination and confirmation of Leucomalachite Green in Salmon [S]. Denver: Animal Drugs Research Center, 2004.
[11] U.S. FDA, Animal Drugs Research Center. LIB4334: Determination of malachite green and leucomalachite green in salmon with in-situ oxidation and liquid chromatography with visible detection [S]. Denver: Animal Drugs Research Center, 2004.
[12] 国家质量监督检验检疫总局. GB/T19857—2005 水产品中孔雀石绿和结晶紫残留量的测定[S]. 北京:中国标准出版社, 2005.
[13] Anastassiades M, Lehotay S J, Stajnbaher D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce [J]. J AOAC Int, 2003, 86(2):412-431.
[14] 徐娟,陈捷,叶弘毅,等. QuEChERS提取与高效液相色谱-电喷雾电离串联质谱联用法检测茶叶中的19种农药残留[J]. 分析测试学报, 2011,30(9):990-995.
[15] 戴廷灿,李伟红,廖且根,等. 改进的QuEChERS-液相色谱法检测蔬菜中的苯并(α)芘[J]. 分析测试学报, 2011, 30(5):570-572.
[16] 尹怡,郑光明,朱新平,等. 分散固相萃取/气相色谱-质谱联用法快速测定鱼、虾中的16种多环芳烃[J]. 分析测试学报, 2011, 30(10):1107-1112.
[17] 尹怡,朱新平,郑光明,等. 基质固相分散法与固相萃取法在检测水产品中己烯雌酚残留中的应用[J]. 分析测试技术与仪器, 2011, 17(4):211-216.
[18] 尹怡,李平杰,林晨,等. 超声辅助-分散固相萃取/高效液相色谱法串联质谱法联用测定鱼肝脏中喹烯酮的残留量 [J]. 分析测试学报, 2013, 32(11):1349-1353.
[19] 尹怡,白野,刘书贵,等. 阳性饵料鱼投喂模式下孔雀石绿及代谢物无色孔雀石绿在鳜体内的残留消除规律[J]. 中国渔业质量与标准, 2015, 5(5):50-55.
[20] 杨贤庆,孙满义,岑剑伟,等. 孔雀石绿及其代谢产物在罗非鱼肌肉中残留规律的研究[J]. 热带海洋学报, 2010,29(4):107-111.
[21] 刘永涛,艾晓辉,索纹纹,等. 浸泡条件下孔雀石绿及其代谢物隐色孔雀石绿在斑点叉尾鮰组织中分布及消除规律研究[J]. 水生生物学报, 2013,37( 2) : 269-280.
[22] 高露姣,蔡友琼,姜朝军,等. 孔雀石绿及其主要代谢物在欧洲鳗鲡肌肉中的蓄积及消除规律[J]. 水产学报, 2007, 31(9):104-108.
Studies on the residue and elimination rules of malachite green and its primary metabolite in mud carp (Cirrhina molitorella) by QuEChERS extraction and high performance liquid chromatography tandem mass spectrometry
LIU Shugui,YIN Yi,LI Lichun, SHAN Qi,ZHU Xinping,MA Lisha,DAI Xiaoxin,ZHENG Guangming*
(Ministry of Agriculture/Ministry of Agriculture Laboratory of Quality & Safety Risk Assessment for Aquatic Product (Guangzhou ),Key Laboratory of Tropical & Subtropical Fishery Resource Application & Cultivation, Pearl River Fisheries Institute, Chinese Academy of Fishery Sciences, Guangzhou 510380,China)
QuEChERS (quick, easy, cheap, effective, rugged and safe) extraction and high performance liquid chromatography tandem mass spectrometry (QuEChERS-HPLC-MS/MS) were optimized by comparing and optimizing desiccants and adsorbents for determination of malachite green (MG) and its primary metabolite (i.e. leuco-malachite green, LMG) in mud carp (Cirrhinamolitorella) in the study. The extraction method of mud carp tissues adopted acetonitrile as extractants, anhydrous magnesium sulfate as a desiccant, and the mixture of primary secondary amine (PSA, 50 mg) and graphitized carbon blacks (GCB, 10 mg) as adsorbents. The identification of malachite green (MG) and leuco-malachite green (LMG) was achieved by using electrospray ionization in positive ion mode (ESI+) under multiple reaction monitoring mode. The quantitative analysis of MG and LMG was performed by the internal standard method. Under the optimized condition, MG and LMG showed a good linearity in their concentration range of 1~50 ng/mL with the correlation coefficient of 0.998 77 and 0.997 32, respectively. Both of their detection limits(LOD,S/N=3)were 0.5 μg/kg. The recoveries of MG and LMG at three spiked levels of 2, 10 and 25 μg/kg were ranged of 82.5%~92.6% and 84.6%~95.1% respectively. By applying the proposed method to study the residues and elimination rules of malachite green and its primary metabolite in mud carp, results showed that the elimination half life of MG and LMG were 13.6 and 178.3 h, respectively. It suggested that MG was depleted relative faster in mud carp. In contrast, the elimination of LMG, as the main metabolite of MG, was slower, and the content of LMG was below the detection limit until 40 d. The study would provide technical supports for detection of MG and LMG and reference data for quality safety of aquatic products. [Chinese Fishery Quality and Standards, 2016, 6(5):45-51]
QuEChERS; HPLC-MS/MS;Cirrhinamolitorella; malachite green; leuco-malachite green; residue; elimination
ZHENG Guangming,zgmzyl1964@163.com
2016-05-21;接收日期:2016-07-28
水产品养殖禁限用药物调查与产品安全性评估(GJFP201501001);广东省质量安全专项项目
刘书贵(1985-),男,助理研究员,研究方向为水产品质量安全,liu19851218@126.com
郑光明,研究员,研究方向为水产种质资源学和水产品质量安全,zgmzyl1964@163.com
S94
:A
:2095-1833(2016)05-0045-07
