黄颡鱼肌肉腐烂病研究及治疗技术初探
2016-12-30刘方孟丽华杨淑英时彦民孟蝶徐毅
刘方,孟丽华,杨淑英,时彦民*,孟蝶,徐毅
(1.济宁市渔业监测站,山东 济宁272000; 2.任城区水产局,山东 济宁 272000;3. 北京市水产技术推广站鱼病科,北京100001)
黄颡鱼肌肉腐烂病研究及治疗技术初探
刘方1,孟丽华1,杨淑英2,时彦民1*,孟蝶3,徐毅1
(1.济宁市渔业监测站,山东 济宁272000; 2.任城区水产局,山东 济宁 272000;3. 北京市水产技术推广站鱼病科,北京100001)
以肌肉腐烂的黄颡鱼(Pelteobagrusfulvidraco)为研究对象,从发病鱼体的肝、脾中分离出了一株致病菌(命名为JY-03),经革兰氏染色、显微观察、API生理生化实验24~48 h,最终鉴定该病原菌为温和气单胞菌(Aeromonassobria)。通过感染实验再次证实黄颡鱼肌肉腐烂的致病菌为温和气单胞菌。对发病池塘水质分析表明,养殖水体中存在大量微囊藻,加速了水体中致病菌繁殖速度,致使发病池塘中黄颡鱼暴发肌肉腐烂病。药物的治疗实验表明,10%诺氟沙星与10%恩诺沙星分别与饲料按照1∶1 000(m/m)比例拌料,每日按照鱼体重1%投喂饲料1次,两种药物对该病均有明显治疗效果,鱼体皮肤溃烂征状逐步消失,死亡数量显著下降,疫病得到有效控制,用药2周后基本治愈;同等的用药剂量下,恩诺沙星治疗效果相对更好。本研究提供了黄颡养殖生产过程中肌肉腐烂病发病原因的鉴定方法和治疗方案,对黄颡鱼的健康养殖及相关研究均具有一定的参考意义。[中国渔业质量与标准,2016,6(1):63-70]
黄颡鱼;温和气单胞菌;API生理生化实验;鉴定;腐烂;治疗
黄颡鱼(Pelteobagrusfulvidraco)是中国江河湖泊中常见的一种小型经济鱼类。它无肌间刺,肉质细嫩鲜美,广泛受到消费者的青睐,市场价格一直居高不下[1]。黄颡鱼对环境的适应性强,在中国很多省、市均可养殖,且在国内市场上属中档鱼中价格较高的淡水养殖品种,经济效益较高,具有较大的发展潜力。肌肉腐烂病(溃疡病)是鱼类疾病中最常见的一种细菌性疫病,也是黄颡鱼养殖过程中常见的疫病,但有关黄颡鱼体表溃疡病研究的报道相对较少。2013年9月25日,济宁市某黄颡鱼养殖场养殖的黄颡鱼暴发肌肉腐烂病,主要表现为嘴部、背部、尾部等处的皮肤出现不同程度腐烂,大批黄颡鱼因病死亡,经济损失严重。本研究针对黄颡鱼肌肉腐烂病原菌进行了分离鉴定与治疗技术初探,以期为黄颡养殖过程有效防治该疫病提供参考。
1 材料与方法
1.1 仪器与材料
仪器:显微镜及显微成像系统(Olympus Cx31)、恒温培养箱(三海三发DNP-9082)、高压灭菌锅(上海博讯YXQ-LS-50SII)、连续注射器、4-5号无菌针头、25#浮游生物网。
材料:MHA、MHB培养基(北京路桥)、革兰氏染色试剂盒(北京路桥)、API20NE试剂条(法国梅里埃)、0.65%无菌生理盐水、氧化酶试剂、鲁戈试剂、恩诺沙星(北京渔经生物技术有限公司,其恩诺沙星含量为10%)、鱼菌净(商品名,其诺氟沙星含量为10%,北京渔经生物技术有限公司)、温和气单胞菌标准菌株(国家微生物菌种保藏中心)、沉型料(山东德海三易生物科技有限公司,颗粒直径为2.5 mm)。
1.2 致病菌的分离和鉴定
1.2.1 池塘水体调查及病鱼样本采集
首先对发病池塘进行现场调查,测量水温并记录,取5 L水样用25#浮游生物网过滤浓缩至10 mL,并添加0.1 mL鲁哥氏液固定,带回实验室进行显微观察。病鱼样本由发病池塘(济宁市某水产养殖场)现场采集,典型症状的黄颡鱼(Pelteobagrusfulvidraco)5尾用于解剖实验,经测量体长(12±1.5)cm。
1.2.2 病鱼的观察与解剖
取具有典型病症的发病黄颡鱼,进行解剖,对发病样本体表特征及脏器进行观察。
1.2.3 细菌的分离纯化
用75%酒精棉消毒体表后,无菌操作剪开其腹部,用接种环挑取脾、腹水,分别划线于MHA琼脂培养基,28 ℃培养24~48 h,挑取形态特征一致的优势菌落进行分离纯培养2~3次,获得纯化的可疑致病菌JY-03,保种后于4 ℃冰箱保存,备用。
1.2.4 镜检观察
将分离纯化的出的JY-03进行革兰染色,并在1 000倍油镜下进行显微观察[2-4]。
1.2.5 生理生化实验
将分离出的纯培养株,制成0.5麦氏浊度菌悬液,接种于API细菌分析鉴定试剂条中,28 ℃恒温培养箱培养24~48 h,观察并记录实验结果,通过apiwebTM软件(法国梅里埃)进行鉴定。
1.2.6 致病菌人工感染实验
市场购得黄颡鱼(110±10)g在水族箱暂养15 d,确认健康无疫病后,作为感染实验的实验用鱼。实验水族箱规格:长80 cm,宽60 cm,高70 cm。水族箱盛水90 L,水温保持在(25±1)℃,暂养期间保持充气,少量投食,每2~3天换水1次,每次换水量1/3。感染实验中共设有4个水族箱,每个水族箱养殖黄颡80尾左右,包括1个作为对照组(2号水族箱)和3个实验组(即1号、3号、4号水族箱)。
将无菌操作挑取培养24~36 h的JY-03,制成约0.5麦氏浊度菌悬液,将1 mL菌悬液接种于100 mL MHB液体培养基,于28 ℃扩大培养24~36 h,取新鲜的菌液,5 000 r/min离心30 min去培养基,细菌沉淀用0.65%无菌生理盐水充分的混匀,制成0.5麦氏浊度的菌悬液。使用无菌的连续注射器注射实验鱼背部肌肉,注射剂量为每尾0.2 mL,观察鱼体发病情况。对照组只注射0.65%无菌生理盐水,3个实验组全部进行感染注射。连续观察7 d,观察发病征状。背部注射完成后如发现实验鱼发病,取病样进行解剖并进行病原菌的再分离及鉴定。
1.2.7 发病鱼体治疗实验
取3个水族箱(1号、3号、4号)进行发病鱼体治疗实验。将3号水族箱作为阳性对照组,即黄颡在注射致病菌发病后,不添加任何药物,投饵料量根据鱼吃食情况而定,尽量不增加水体负担,死鱼及时捞出,不采取其他治疗措施。1号水族箱拌料药物为鱼菌净(含10%诺氟沙星),4号水族箱拌料药物为恩诺沙星(含量10%),拌料方法按照每1 kg饲料中添加1 g实验药物,进行充分拌匀。饲料选择沉型料,饲料每日投喂1次,投喂量为实验鱼总体重的1%,不可过量投喂。实验连续观察14 d,每日观察鱼体康复情况,并及时记录实验结果。治疗时间选择实验鱼出现轻微发病症状2 d后,开始拌料投喂。
2 结果与分析
2.1 养殖池塘环境调查
2013年9月25日实地调查发病养殖池塘,中午11时现场测量池塘水温为(26±0.1) ℃,另见池塘内大量饵料漂浮于水面,池塘内部分黄颡鱼死亡并漂浮于水面(图1中A、B、C处均为死亡的黄颡鱼),同时池塘内有大量藻类出现。水样采集固定后经显微观察,藻类以微囊藻居多(图2E),同时伴有裸藻出现(图2F)。水体表面漂浮有鱼体的粪便,颜色青绿,成条状,经显微观察为不易被消化吸收而排出体外的微囊藻。

图1 黄颡鱼养殖发病池塘外观图A、B和C:死亡的黄颡鱼;D:漂浮的鱼粪便。Fig.1 The appearance of pondsfarming the yellow catfishA、B and C :The yellow catfish of death. D: Floating fish feces.
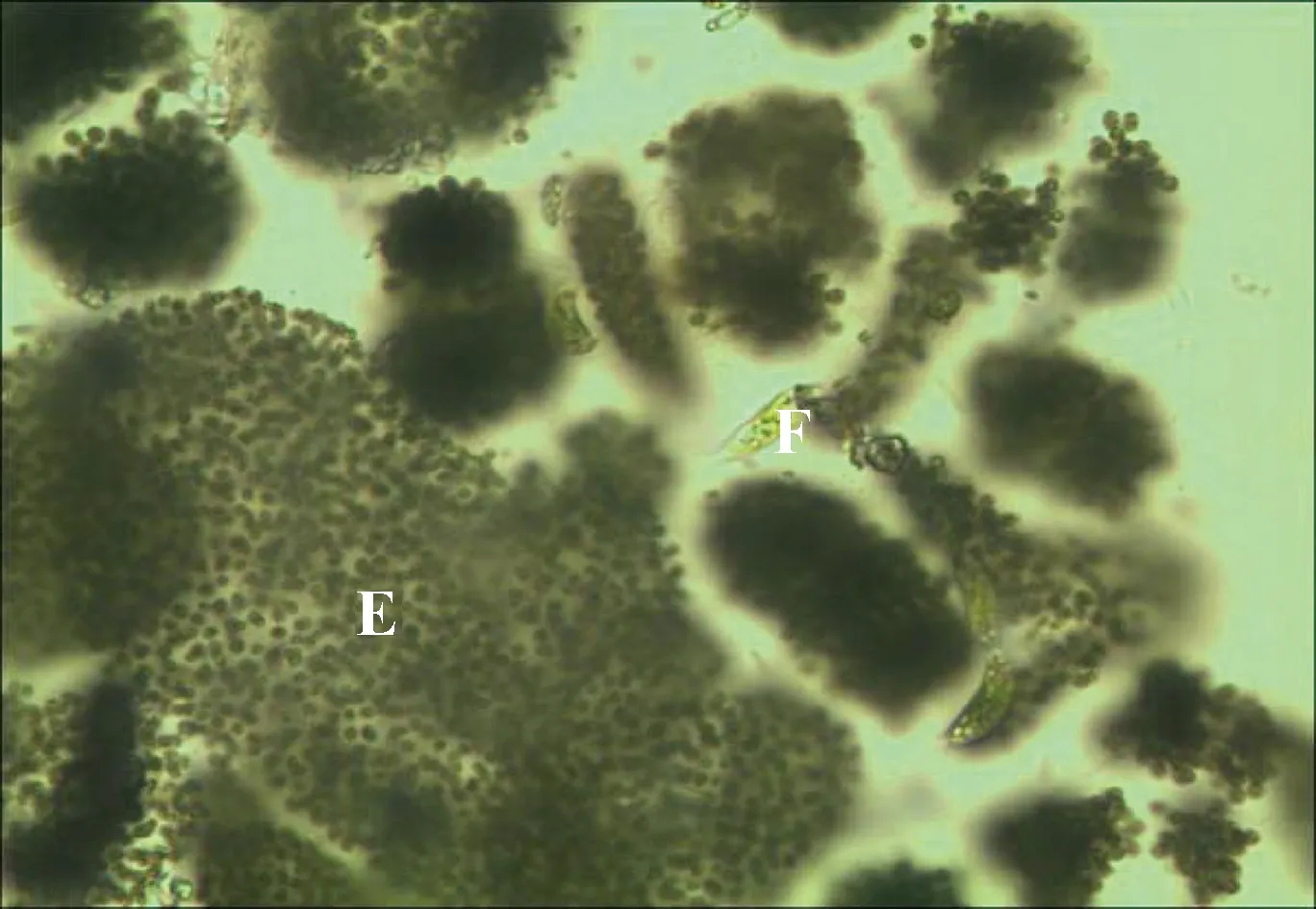
图2 发病池塘水体中漂浮藻类显微观察图E:微囊藻;F:裸藻。Fig.2 Microscopic observation offloating algae in pond waterE:Microcystis;F:Euglena.
2.2 病鱼的观察与解剖
发病的黄颡鱼皮肤和鳍上会出现了针状小点的充血,病鱼眼球外凸、浑浊,大部分病鱼口腔周围溃烂(图3-1);背部肌肉腐烂,部分病样鱼骨外漏,同时伴随腹部膨大,鳍条、下颌、鳃盖、腹部可见充血;剪开腹腔内有大量清亮的液体,肝肿大变白,肝上毛细血管肿大充血,血管变大外漏明显(图3-2)。
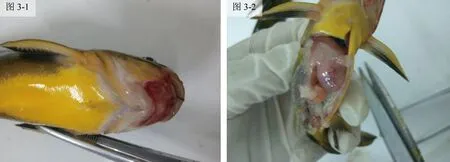
图3 发病黄颡鱼的形态特征图3-1:外观形态;图3-2:解剖后的腹腔。Fig.3 The morphological characteristics of the sick yellow catfishFig.3-1:Appearance shape; Fig.3-2:The abdominal cavity after dissection.
2.3 致病菌分离纯化与显微观察
从肝、脾及以及腹水中分离得到一批形态一致的优势菌株(命名为JY-03),将该菌株在MHA培养基上划线并于28 ℃培养24 h后,观察菌落形态为圆形、光滑、湿润、半透明灰白色的小菌落(图4-1);经过革兰氏染色和油镜显微观察,确定该菌为革兰氏阴性短杆菌(图4-2)。
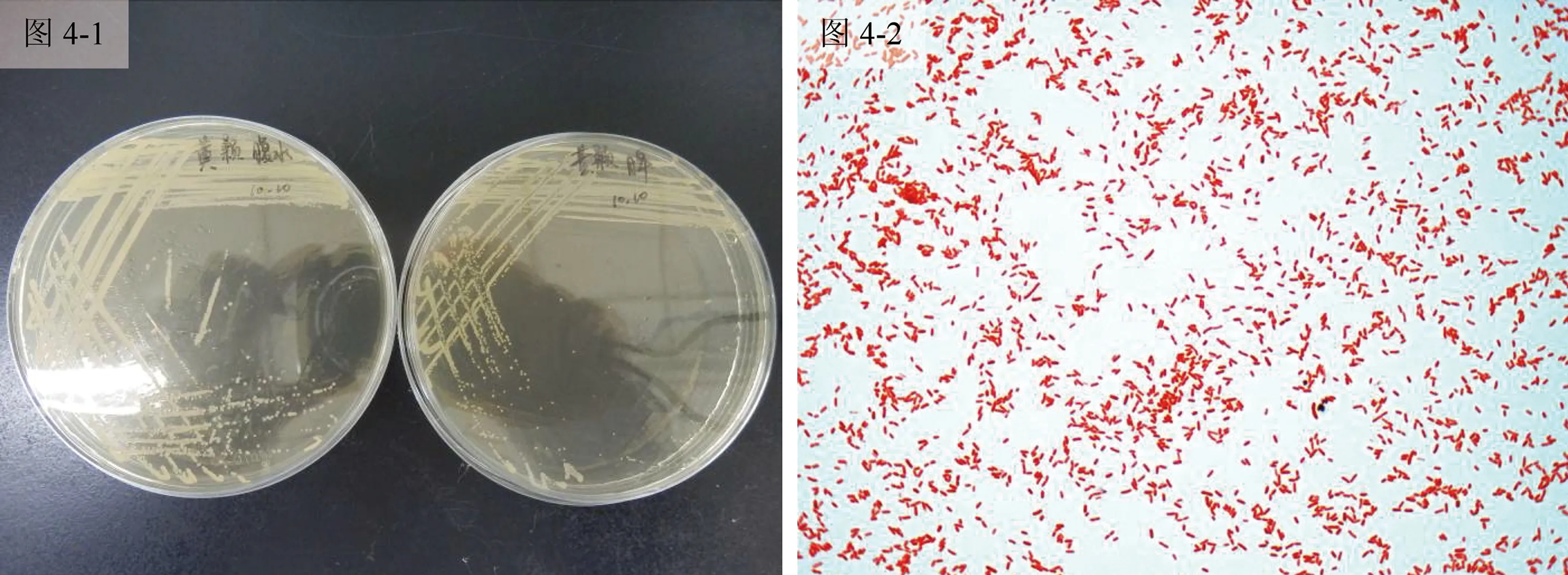
图4 致病菌分离纯化及显微观察图图4-1:分离纯化的菌落;图4-2:革兰染色后显微镜下菌体。Fig.4 The isolation and purification of pathogenic bacteria and microscopic observationFig.4-1: The colonies of isolation and purification; Fig.4-2:The Gram-staining bacteria in microscope.
2.4 生理生化实验
通过对分离的菌株JY-03进行氧化酶实验,如图5-1中A、B所示显示该菌株氧化酶实验为阳性。根据氧化酶实验结果选用API20NE细菌分析鉴定试剂条进行鉴定培养,在28 ℃培养24~36 h,记录实验结果,鉴定结果为:7177755(图5-2)。经apiwebTM软件分析,确定分离的菌株JY-03为温和气单胞菌(Aeromonassobria),软件显示鉴定准确率(ID)达到99%,说明济宁某养殖场内黄颡鱼肌肉腐烂病是由温和气单胞菌感染引起的,具体鉴定结果见表1。
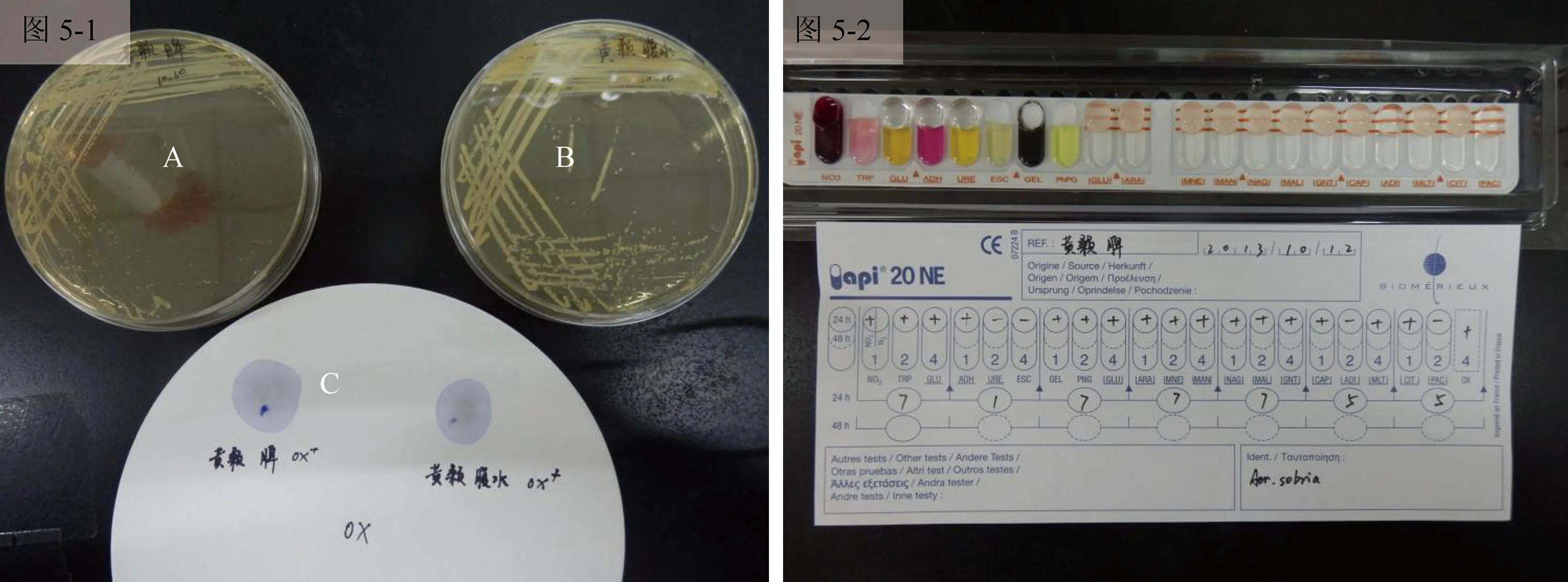
图5 氧化酶实验及API细菌鉴定结果图5-1:A为脾中分离的菌落,B为腹水中分离的菌落,C氧化酶试剂反应结果;图5-2:API试剂条鉴定结果。Fig.5 The results of oxidase test and API bacteria identification Fig.5-1:A:The colonies isolated from the spleen,B:The colonies isolated from the ascites,C:The results of oxidase test; Fig.5-2:The resultsof API bacteria identification.
表1 API细菌鉴定结果
Tab.1 The results of API bacteria identification
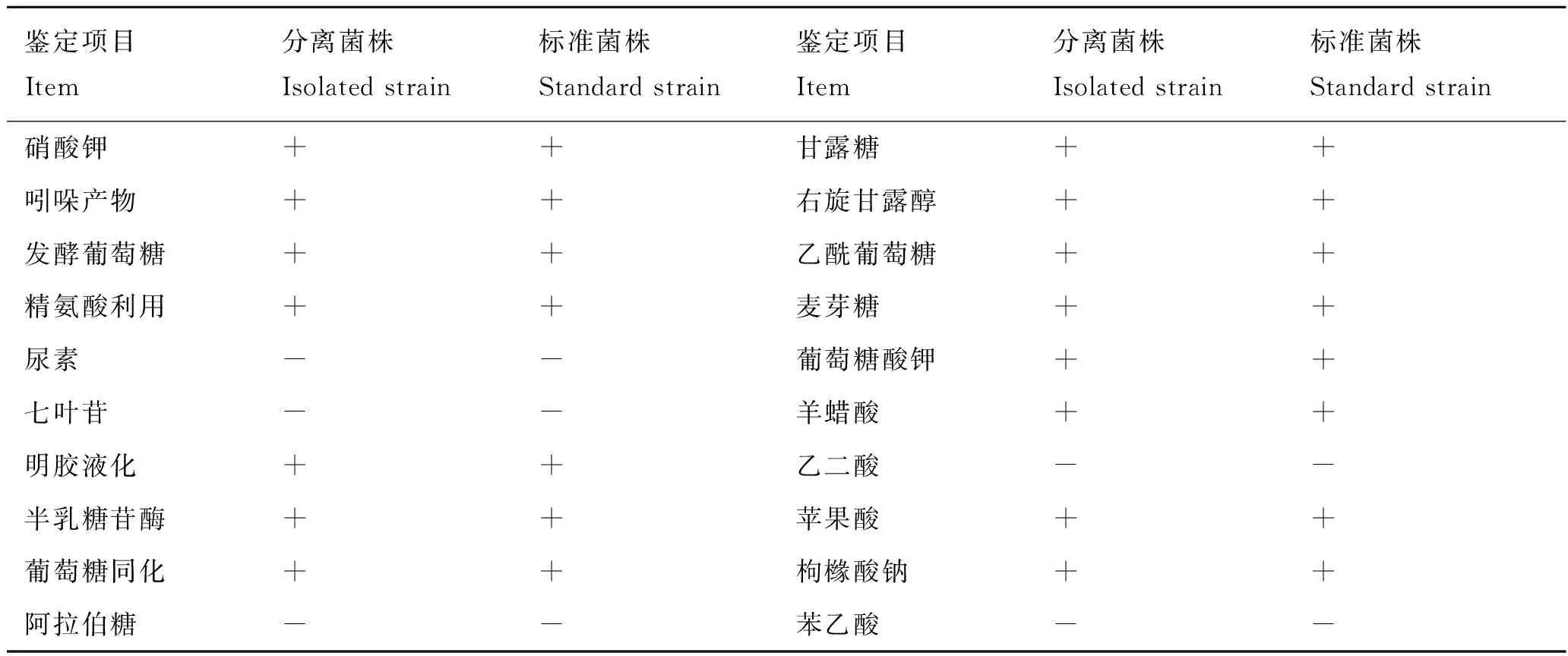
鉴定项目Item分离菌株Isolatedstrain标准菌株Standardstrain鉴定项目Item分离菌株Isolatedstrain标准菌株Standardstrain硝酸钾++甘露糖++吲哚产物++右旋甘露醇++发酵葡萄糖++乙酰葡萄糖++精氨酸利用++麦芽糖++尿素--葡萄糖酸钾++七叶苷--羊蜡酸++明胶液化++乙二酸--半乳糖苷酶++苹果酸++葡萄糖同化++枸橼酸钠++阿拉伯糖--苯乙酸--
注:+表示阳性,-表示阴性。
2.5 致病菌感染实验
在致病菌感染实验中,对照组(2号水族箱)内的黄颡鱼没有出现异常症状,吃食正常。在1号、3号、4号水族箱3个感染组中,感染2 d后,黄颡鱼吃食量明显下降,活动迟缓;背部及尾部出现白色腐皮(图6),且嘴部、鳍条充血;感染3 d后水族箱内实验鱼陆续出现死亡现象;感染实验鱼7 d, 1号、3号、4号等3个水族箱实验鱼死亡率分别达到91.50%、91.10%、90.40%,3个感染组死亡率均达到90%以上,可见该致病菌毒力较高。

图6 致病菌感染健康黄颡鱼结果Fig.6 The results of health yellow catfishinfected by pathogenic bacteria
2.6 治疗实验
在治疗实验中,3个水族箱内黄颡鱼随用药时间延长的变化情况见表2。两种治疗药物同时治疗发病的黄颡鱼,在同等浓度的药物剂量下,通过14 d的治疗观察,病情都能得到有效控制并逐步好转,其中4号水族箱在养殖7 d后已经无病鱼继续死亡;通过诺氟沙星治疗的1号水族箱,病情也得到好转和控制,但实验鱼仍有个别死亡现象,在养殖14 d时仍有1条实验鱼背部皮肤仍有轻微腐皮征状。综合比较两种用药方案,在同等药物剂量下,在治疗黄颡鱼肌肉腐烂病选择恩诺沙星比诺氟沙星的治疗效果要明显。如图7-1中A所示用药治疗前,1号水族箱内大部分黄颡鱼发病,体表出现白色腐皮的典型症状;图7-2中B所示用药10 d治疗后,1号鱼缸大部分黄颡鱼发病典型症状消失,鱼体活力充沛。
表2 发病鱼体随用药时间延长的变化情况
Tab.2 The occurrence of the sick fish with the extension of time under the drug treatment

水族箱Aquari-um养殖数量/尾Breedquanti-ty水温/℃Watertemper-ature感染后发病数量/尾Morbidfishnumbersafterinfec-tion发病率/%Mor-bidity养殖3dCulturefor3d养殖7dCulturefor7d养殖10dCulturefor10d养殖14dCulturefor14d1号7025±16992.8死亡1条,其征状表现为肌肉严重溃烂。其他皮肤溃烂较轻。死亡1条,征状表现为皮肤溃烂严重。其他体表鱼明显好转,表现为体表发病面积缩小。死亡2条。大部分治疗情况明显,3条体表仍有轻微发病症状。1条实验鱼背部仍有轻微腐皮征状,其他体表发病症状消失,巡游正常。4号7225±17198.6死亡2条,其征状表现为肌肉严重溃烂。其他皮肤溃烂较轻。大部分体表正常,活力充沛,腐皮明显好转,皮肤溃烂严重者仍能巡游,无死亡现象。有1条表现为皮肤溃烂,其他体表发病征状消失,巡游正常。实验鱼发病症状消失,正常巡游,也无死亡现象发生。3号8425±17690.4死亡5尾,其征状表现为肌肉严重溃烂。死亡70条,其症状表现为肌肉溃烂,部分严重者脊椎骨外漏。实验鱼全部死亡,及时清理并消毒。无
注:1号水族箱为使用含10%诺氟沙星与饲料1∶1 000比例混合后,按照体重1%的量连续投喂黄颡鱼14 d;4号水族箱为使用含10%恩诺沙星与饲料1∶1 000比例混合后,按照体重1%的量连续投喂黄颡鱼14 d;3号水族箱为阳性对照对照组,按同样的量投喂饲料,但饲料中不添加任何药物。

图7 药物治疗前与治疗10 d后的实验鱼体态特征对比图7-1:药物治疗前的发病实验鱼;图7-2:治疗10 d后的实验鱼。Fig.7 Comparison of the experimental fish between before and after 10 d drug treatmentFig.7-1:The experimental fish before drug treatment; Fig.7-2: The experimental fish after 10 d drug treatment.
3 讨论
3.1 发病原因分析
现场调查发病池塘,测量水温为26 ℃,池塘周围无树木遮荫,阳光直射,水深保持1.5 m,放养黄颡“水花”密度达到30尾/m2。发病池塘亩投放黄颡鱼“水花”密度过大,早期由于“水花”体积和食量偏小对水体的种群结构影响不是太大,但随着黄颡鱼逐渐长大,水体中的浮游动物被作为饵料而大量消灭[5],浮游动物的缺失致使浮游植物因缺少天敌而暴发性生长。因此,该池塘内疫病的暴发与水体内生态系统的破坏存在密切的关系,正是由于生态系统的破坏,致使微囊藻大量繁殖,水华暴发。潘高山等[6]发现,产毒微囊藻培养液和微囊藻毒素粗提液均能促进致病微生物中VBNC(活的不可培养状态)细菌与可培养细菌之间的状态转换,说明微囊藻的出现为水环境中细菌VBNC状态的转换提供了条件。本研究中水质观察结果显示,水体中微囊藻大量存在,分析认为由于微囊藻的存在致使致病菌由VBNC(活的不可培养状态)向可培养状态进行了转换,致病菌大量繁殖使水体中病菌浓度进一步增高,黄颡鱼染病机率大大提高。另外,关于温和气单胞菌致病机理的文献也有报道,温和气单胞菌对机体细胞的侵袭起始于细菌对上皮细胞的黏附,紧接着是细菌的内化和繁殖,进而会引起细胞的溶解和组织的损伤[7]。致病菌在侵入到机体内之后,大量繁殖,夺取机体的营养物质,使得机体的抵抗力进一步下降,造成更多细菌的侵入;同时大最繁殖的细菌会产生大量的毒力因子,破坏机体。这些毒力因子发挥毒性作用,使肠道积液分泌增多,红细胞裂解,吞噬白细胞,损坏毛细血管,从而引起了败血、出血,细胞毒素侵入实质组织器官,使组织细胞溶解[8]。
3.2 温和气单胞菌对水产养殖业的危害分析
温和气单胞菌属于嗜温有动力气单胞菌,是一种典型的人、兽、鱼共患病原菌,是中国养殖淡水鱼类最常见的气单胞菌属的条件致病菌,具有发病率高、感染快、传播快、死亡快的特点[9]。其外毒素是温和气单胞菌的重要致病因子之一,包括有溶血素(hemolysin)、气溶素(aemlysin)、细胞毒性肠毒素(cytolyticenterotoxin)等[10]。近年来由温和气单胞菌引起的各种渔业病害报道日益增多,给中国淡水养殖业造成惨重的经济损失。陈言峰等[11]报道了广东佛山某养殖场内高体革暴发体表溃烂病,经分离鉴定致病菌为温和气单胞菌;张晓君等[12]报道了江苏连云港东海县多家渔场泥鳅大量溃烂死亡,经形态特征、生理生化及分子水平鉴定致病菌为温和气单胞菌;蔡完其等[13]报道了由温和气单胞菌引起的罗非鱼出血性败血病;刘敏等[14]报道了温和气单胞菌引起鲤体表溃烂病;王永坤等[17]报道了温和气单胞菌引起的鳖红底板病、红脖子病;陈晓风等[15]报道了温和气单胞菌引起的鳖肝水肿病;王斌等[16]对温和气单胞菌引起红鳍东方鲍发病进行了报道。可见,该病原菌对中国水产动物的危害相当广泛,对淡水养殖的鱼类、蛙类和龟鳖类[18]等均有很强的致病性,具有流行区域广、流行季节长、暴发性流行和死亡率高等特点,是淡水养殖中最为常见的病原菌之一,应该引起足够重视。
本研究分离鉴定了黄颡肌肉腐烂病的致病菌为温和气单胞菌,并对染病鱼体进行了相应的治疗研究,结果发现恩诺沙星和诺氟沙星均能有效控制该病情,同等的用药剂量恩诺沙星效果相对较好。与文献[5,19]报道的用药治疗情况进行分析比较,其多侧重池塘内用药情况,没有药物之间的效果比较,对治疗效果也没有达到量化分析和比较。
综上所述,本研究具有以下3个特点。首先,在调查发病原因时侧重从发病池塘的养殖环境进行调查,推断微囊藻大量出现对水体中致病菌繁殖速度的影响。其次,另外在治疗实验过程中详细记录了黄颡鱼发病的整个过程,黄颡发病率均在90%以上(表2),说明该致病菌的致病力较高。另外,与同类报道[19]相比,本研究中使用的鉴定方法用时较短(一般需要24~48 h),效率高,更有利于快速指导生产实践。但本研究中,由于实验条件原因,未采取分子水平(如16sRNA)进行补充验证,这有待进一步完善。
4 结论
本研究从患病黄颡鱼体内分离纯化到一株致病菌,并通过形态学特征以及API细菌分析鉴定为温和气单胞菌,API技术的应用大大提高了致病菌鉴定的效率(一般需要24~48 h),为渔业养殖病害的诊断和及时治疗赢得了时间,对渔业养殖生产具有很好的现实意义。抗生素治疗实验证明当黄颡发生肌肉腐烂病时,可以选择恩诺沙星或诺氟沙星拌料投喂进行治疗,有利于避免发生大规模的渔业经济损失。但值得注意的是,渔业养殖的疫病预防过程中应该侧重生态系统的综合调控,应以预防为主,而不应把抗生素作为鱼体发病后治疗的唯一手段而滥用,从而避免对水产品质量、生态环境及人体健康造成危害。
[1] 王文彬, 罗玉双, 曾伯平. 黄颡鱼的微生物病及其防治[J]. 内陆水产, 2006,31 (9):35-37.
[2] 郑福涛, 陈绍铭. 水生微生物学实验法[M]. 北京:海洋出版社, 1990.
[3] 东秀株, 蔡妙英. 常见细菌鉴定手册[M]. 北京:科学出版社, 2001.
[4] 周德庆. 微生物学实验手册[M]. 上海:上海科技出版社, 1986.
[5] 刘德建. 夏季黄颡鱼“一点红”的诊断与防治[J]. 科学养鱼, 2013(12):59-60.
[6] 潘高山, 胡章立, 雷安平, 等. 微囊藻毒素粗提物对水环境中温和气单胞菌活的非可培养状态的影响[J]. 湖泊科学, 2008,20(1):105-109.
[7] 朱大玲, 李爱华, 汀建国, 等. 嗜水气单胞菌毒力与毒力基因分布的相关性[J]. 中山大学学报(自然科学版), 2006,45(1):82-85.
[8] Galindo C L, Fadl A A, Sha J, et al.AeromonashydroPhilacytotoxic enterotoxin activates mitogen- activated protein kinases and induces apoptosis in murine macrophages and human intestinal epithelial cells [J]. Biol Chem, 2004,279(36):37597-37612.
[9] 胡琳琳, 房文红, 梁思成, 等. 金鱼温和气单胞菌的分离鉴定及药敏试验[J]. 上海水产大学学报, 2008,17(3):285-290.
[10] Donta S T, Haddow A D. Cytotoxic activity ofAeromonashydroPhila[J]. Infect Immun, 1978,21(3):989-993.
[11] 陈言峰, 冯伟强, 张辉华, 等. 高体革鯻温和气单胞菌的分离鉴定及药敏试验[J]. 安徽农业科学, 2015,43(3):133-135.
[12] 张晓君, 邴旭文, 姚东瑞, 等. 泥鳅溃疡病及病原温和气单胞菌生物学及分子特征研究[J]. 水产科学, 2010,29(12):696-702.
[13] 蔡完其, 孙佩芳. 罗非鱼温和气单胞菌病病原研究及药敏试验[J]. 中国水产科学, 2002,9 (3):223-246.
[14] 刘敏, 韩英. 鲤鱼温和气单胞菌的分离鉴定和药敏试验[J]. 东北农业大学学报,2002 , 36 (4):486-489.
[15] 陈晓风, 周常义. 稚鳖“肝水肿症”病原及防治研究[J]. 厦门水产学院学报, 1996,19, 18(2):13-17.
[16] 王斌, 于兰萍, 胡亮. 红鳍东方鲍皮肤溃烂病病原菌的分离与鉴定[J]. 中国水产科学,2008,15(2):352-358.
[17] 王永坤, 李智健, 朱国强. 甲鱼爆发性传染病的病原研究[J]. 鱼类病害研究,1997, 19(1/2):18-24.
[18] 韩继卫, 罗文, 郑大恒. 黄颡鱼温和气单胞菌的分离鉴定与药敏试验[J]. 绍兴文理学院学报, 2011,31(9):19-21.
[19] 何义进, 钱源磊. 黄颡鱼细菌性溃疡病的综合治疗对策[J]. 科学养鱼,2010(8):57.
The study of yellow catfish muscle decay and its therapy technique
LIU Fang1, MENG Lihua1, YANG Shuying2, SHI Yanmin1*, MENG Die3, XU Yi1
(1.Fisheries Monitoring Stationof Jining, Jining 272000, China;2.Bureau of Aquatic Products of Rencheng District,Jining 272000, China;3.Fisheries Technology Extension Station of fish diseases of Beijing City, Beijing 100001, China)
The muscle decay of yellow catfish (Pelteobagrusfulvidraco) was studied in this experiment. A strain of pathogenic bacteria (named JY-03) was isolated from the fish liver and spleen. The pathogenic bacteria was finally identified to be theAeromonassobriaby Gram staining, microscopy, API physiological and biochemical experiments. Furthermore, this bacteria caused yellow catfish muscle decay was also confirmed to beAeromonassobriaby the infection experiment. The analysis of water quality showed that numerious microcystis accelerated pathogenic bacteria proliferation in aquacultural water, which caused muscle decay ofPelteobagrusfulvidracoin the incidence pond. The therapeutic trial was implemented using norfloxacin and enrofloxacin in fish tanks. 10% norfloxacin and 10% enrofloxacin were mixed separately with feed in accordance with 1∶1000 scale, and the fish were fed once a day according to the 1% fish weight, It was found that both drugs had obvious therapeutic effects. The results showed that the symptom of skin decay disappeared gradually, the number of death was markedly decreased, and the spread of epidemic disease was prevented. The fish were almost cured after 2 weeks drugs treatment. Thereinto, enrofloxacin has a better effect than norfloxacin at the same dose. This study offered the identification and therapy method of muscle decay ofPelteobagrusfulvidracoin aquaculture process, and provided some references for healthy aquaculture of yellow catfish and other related research.[Chinese Fishery Quality and Standards, 2016, 6(1):63-70]Key words:yellow catfish;Aeromonassobria;API; identification;decay; therapyCorresponding author:SHI Yanmin,shiyanmin000@163.com
2015-08-12;接收日期:2015-12-10
2012年山东省级常规专家项目(370020120042)
刘方(1983-),男,硕士研究生,工程师,研究方向为渔业病害防治和水产品安全分析,liufang123f@163.com 通信作者:时彦民,研究员,研究方向为渔业病害防治和水资源及生态环境监测,shiyanmin000@163.com
S942
A
2095-1833(2016)01-0063-08
