牛樟芝菌丝体和子实体三萜含量测定及Se和Mvd基因表达分析
2016-12-29林雄杰何静敏林占熺
李 晶,林雄杰,何静敏,蔡 璨,林占熺*
(1. 国家菌草工程技术研究中心,福建 福州 350002;2. 福建省农业科学院果树研究所,福建 福州 350013;3.福建农林大学生命科学学院,福建 福州 350002)
牛樟芝菌丝体和子实体三萜含量测定及Se和Mvd基因表达分析
李 晶1,3,林雄杰2,何静敏3,蔡 璨3,林占熺1,3*
(1. 国家菌草工程技术研究中心,福建 福州 350002;2. 福建省农业科学院果树研究所,福建 福州 350013;3.福建农林大学生命科学学院,福建 福州 350002)
为探讨牛樟芝子实体和不同培养时期的菌丝体中三萜含量及鲨烯环氧酶基因(Se)和甲羟戊酸焦磷酸脱羧酶基因(Mvd)的表达情况,采用香草醛-冰醋酸法测定菌丝体和子实体的三萜含量,并利用实时荧光定量PCR(qRT-PCR)分析甲羟戊酸途径(MVA)中Se和Mvd基因表达水平。结果表明,随着培养时间的推移,当生长至21 d时牛樟芝菌丝体干重逐渐趋于稳定。当培养时间小于28 d时,菌丝体中三萜含量随着培养时间的延长而逐渐增加,且28 d时菌丝体的三萜含量最高,达(39.192±2.025)mg/g,仅次于牛樟芝子实体三萜含量(49.391±2.675)mg/g,玉米芯栽培的牛樟芝子实体三萜含量最低,为(11.530±0.733)mg/g,各样品间三萜含量差异达到显著水平(P<0.05)。qRT-PCR分析结果表明,培养7 d的菌丝体中Se和Mvd的表达量均为最高,但随着培养时间的继续延长而呈现下降趋势;牛樟芝子实体中Se和Mvd的表达量均较低,与培养28~42 d的菌丝体表达量相当。本研究结果表明牛樟芝的三萜含量可能与其合成途径中相关基因的表达量、培养条件和累积时间有关。
三萜;实时荧光定量PCR;鲨烯环氧酶;甲羟戊酸焦磷酸脱羧酶
牛樟芝(Antrodiacinnamomea,A.cinnamomea)最早发现于我国台湾,是当地特有的珍稀药用菌品种,属担子菌门(Basidiomycota)、多孔菌目(Polyporales)、白肉迷孔菌科(Fomitopsidaceae)、薄孔菌属(Antrodia),野生牛樟芝子实体生长在腐烂空心的牛樟树(Cinnamomumkanehirai)内壁[1]。牛樟芝具有圆柱形的担孢子,菌丝呈棕黄色或至红色,子实体呈棕红色,具有马蹄状或不规则状。研究发现牛樟芝子实体、菌丝体和发酵液中都存在大量的三萜类化合物,它对酒精肝损伤有保护作用[2-3]。三萜类化合物(triterpenoids)是自然界中常见的一类天然产物,在药用真菌、药用植物中大量存在[4-5]。研究表明,三萜类化合物的生物合成途径主要有甲羟戊酸途径(mevalonic pathway, MVA)和脱氧木糖磷酸酯途径(1-deoxy-D-xylulose-5-phosphate pathway, DXP)[6-7]。Lu等[8]通过基因组和转录组测序技术揭示了三萜类化合物生物合成的MVA途径及各种酶在途径中的位置和作用,同时还发现牛樟芝子实体和菌丝体中的三萜成分并不相同,如antrocamphins仅存在于菌丝体中,麦角甾烷类仅存在于子实体中,而羊毛甾醇类在子实体和菌丝体中均存在,并且牛樟芝中三萜合成途径与灵芝三萜合成途径相似。早期研究者已成功克隆灵芝三萜合成途径中多种关键酶、限速酶,包括3-羟基-3-甲基戊二酸单酰CoA还原酶(3-hydroxy-3-methylglutaryl-CoA reductase, HMGR)[9],法呢酯焦磷酸合酶(famesyl diphosphate synthase,FPS)[10],鲨烯合酶(squalene synthase,SQS)[11]和甲羟戊酸焦磷酸脱羧酶(Mevalonate pyrophosphate decarboxylase,MVD)等[12-13],并证实这些酶在三萜合成过程中起到关键的作用。牛樟芝三萜合成途径中香叶基焦磷酸合酶,(Geranyl diphosphate synthase, GPP)和法尼基焦磷酸合成酶(Farnesyl diphosphate synthase,FPP)是合成三萜类化合物的重要底物[8],其中参与GPP合成的催化酶为甲羟戊酸焦磷酸脱羧酶(Mevalonate pyrophosphate decarboxylase,MVD);而鲨烯环氧酶(squalene synthase,SE)则是牛樟芝三萜途径中最后一步关键的限速酶,催化鲨烯(Squalene)合成2,3-氧化角鲨烯(2,3-oxido squalene),从而合成羊毛甾醇等物质。
牛樟芝子实体在人工和自然条件下生长极缓慢,但牛樟芝中三萜类化合物显著的药理作用让其在国内外受到消费者青睐,而液体发酵技术是较常见的真菌培养技术[14-15],因此利用液体培养牛樟芝菌丝体逐渐成为解决牛樟芝市场产业化发展的主要方法之一。为进一步探讨牛樟芝在液体发酵培养菌丝体的不同时期三萜含量的变化和菌丝体中鲨烯环氧酶基因(Se)和甲羟戊酸焦磷酸脱羧酶基因(Mvd)表达量的关系,通过实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)检测不同培养时期的牛樟芝菌丝体和子实体中Se和Mvd的表达情况,为探究牛樟芝菌丝体中三萜合成的重要机制奠定基础。
1 材料与方法
1.1 材料
牛樟芝菌株AC001(GenBank NO.:KM925002)、牛樟木栽培牛樟芝子实体(36个月)(ACFB-CK)、玉米芯栽培牛樟芝子实体(36个月)(ACFB-CC)均由台湾神农真菌生物技术有限公司惠赠,保存于国家菌草工程技术研究中心。
1.2 主要试剂及引物
TRIzol试剂购于Invitrogen公司,Reverse Transferation试剂盒购于TOYOBO公司,胶回收试剂盒购于OMEGA公司,SYBR Premix ExTaqTM、Easy dilution,E.coliDH5α感受态细胞和pMDTM18-T载体购于Takara公司,高保真酶HiFiTaqMix购于Genstar公司,齐墩果酸购于福建省药品检验所,葡萄糖、冰醋酸、香草醛、高氯酸等均为分析纯,购自国药集团。
参照已克隆的牛樟芝Se(GenBank No.:KT070558)和Mvd(GenBank No.:KR364808)基因的mRNA保守区序列设计qRT-PCR引物,所涉及引物均由铂尚生物技术(上海)有限公司合成(表1)。
1.3 方法
1.3.1 牛樟芝菌丝体液体培养 挑取在PDA培养基上活化好的牛樟芝菌种,将其切成0.5 cm × 0.5 cm大小的菌块,接种至100 mL灭菌后的基础培养基(葡萄糖25 g/L,蛋白胨5 g/L,麦芽糖3 g/L)中振荡培养14 d后作为液体菌种,按3 %的比例将其接种到牛樟芝液体培养基GPM中,28 ℃,120 r/min,黑暗培养7、14、21、28、35和42 d后备用。
1.3.2 牛樟芝菌丝体及子实体三萜含量测定 收集上述培养7、14、21、28、35和42 d的新鲜菌丝体和ACFB-CK、ACFB-CC新鲜子实体,分别在55 ℃条件下烘干至恒重,参考陆震鸣的三萜提取方法[15],分别称取粉碎好的牛樟芝菌丝体及子实体粉末0.5g,按料液比1∶40(w/v)的比例加入80 %乙醇,作为提取溶剂,70 ℃超声提取1 h,重复提取1次,将2次的提取液合并,过滤,浓缩,离心后取上清液并定容到50 mL。
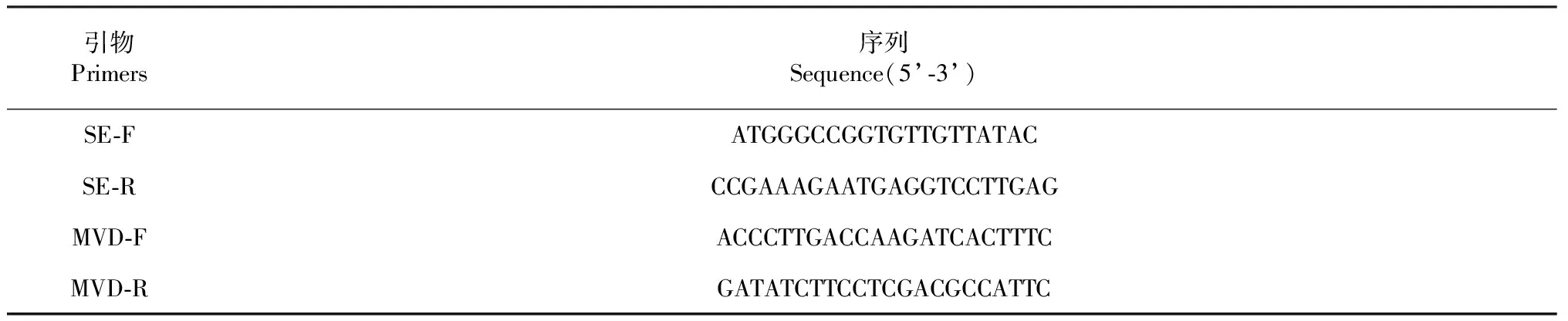
表1 qRT-PCR引物
称取干燥至恒重的齐墩果酸标准品10.08 mg于25 mL容量瓶中,用80 %乙醇溶解并定容,其终浓度为0.4032 mg/mL。精确吸取齐墩果酸标准品溶液0.00、0.10、0.20、0.30、0.40、0.50、0.60、0.70、0.80 mL至刻度试管中,置于50~60 ℃的水浴中,待溶剂蒸干后分别加入0.3 mL 5 %香草醛-冰醋酸溶液和1 mL的高氯酸,60 ℃水浴反应20 min,冰水冷却后加入10 mL冰醋酸,摇匀后,以空白为对照,于300~800 nm扫描确定最大吸光值,以齐墩果酸浓度(mg/g)为横坐标,吸光值为纵坐标,绘制标准曲线,得出回归方程。
取待测样品溶液0.5 mL按上述操作方法测定其吸光值,分别计算其三萜含量, ACFB-CK设为对照。
1.3.3 牛樟芝菌丝体及子实体RNA提取及cDNA合成 收集上述培养7、14、21、28、35和42 d的新鲜菌丝,ACFB-CK和ACFB-CC新鲜子实体,分别采用TRIzol法提取RNA[17],经1 %琼脂糖凝胶电泳和NanoDrop C2000进行纯度和浓度测定合格后,按Reverse Transferation试剂盒使用说明进行cDNA的合成,反应体系为20 μl,每管含RNA样品500 ng。
1.3.4 重组质粒荧光定量PCR标准曲线建立 利用高保真HiFiTaqMix从牛樟芝的cDNA分别扩增Se和Mvd基因,目的片段经0.8 %琼脂糖凝胶回收,加A尾后进行TA克隆,挑取经菌液PCR验证的单克隆扩大培养后提取重组质粒。将该质粒按10倍梯度稀释,共稀释5个浓度,再分别以稀释后的质粒为模板,用表1的引物分别进行qRT-PCR扩增,根据公式Eq. 1计算重组质粒DNA中基因拷贝数,以基因拷贝数的对数值(Log Starting quantity,LogSQ)为横坐标(X),以测定的Cq值为纵坐标(Y),绘制标准曲线。
目的基因拷贝数(copies/μl)=6.02×1023×RNA浓度(ng/μl×10-9)/(目的DNA长度×660)(Eq. 1)
1.3.5 牛樟芝中Se和Mvd基因表达分析 采用SYBR荧光染料法,分别检测牛樟芝菌丝体的不同时期及子实体中Se和Mvd基因的表达情况。PCR反应体系为20 μl,包括10 μl 2×SYBR Premix ExTaqTM,1 μl cDNA模板,上下游引物各1 μl和7 μl ddH2O。PCR反应条件为95 ℃ 3 min,39个循环95 ℃ 10 s,58.2/62.5 ℃ 40 s。以ddH2O代替cDNA为模板的为空白对照,按标准曲线形成公式及Eq.1计算基因拷贝数。
1.3.6 数据处理 每组样品设3个重复,采用SPSS 20和Excel进行数据统计分析和作图。
2 结果与分析
2.1 不同培养时期的牛樟芝菌丝体生物量比较
牛樟芝菌丝体在液体培养基中,28 ℃,120 r/min,黑暗培养4~5 d后开始萌发,7 d后菌丝呈淡黄色的均匀圆球状,菌丝体干重(Dry weight,DW)仅(0.239±0.029)g/100 mL;培养14 d后菌丝体呈乳白色圆球状,菌丝体重(0.550±0.074)g/100 mL(DW);培养21 d后菌丝体明显增多,培养液由淡黄色转变成金黄色,菌丝体重(0.840±0.059)g/100 mL(DW);培养28 d后,菌丝球不再继续生长,而是在瓶壁上长出环状菌皮,培养液由金黄色逐渐变成深黄色,菌丝体重(0.826±0.098)g/100 mL(DW);培养35 d后培养液由深黄色到橘黄色,菌丝球几乎停止生长,菌丝体重(0.787±0.022)g/100 mL(DW);当培养42 d后,菌丝体重(0.658±0.074)g/100 mL(DW),培养液的颜色由淡黄色逐渐转为棕红色(图1~2)。
2.2 牛樟芝子实体及不同生长时期菌丝体总三萜含量
牛樟芝子实体及液体培养的菌丝体收集干燥后进行总三萜的提取及含量测定。扫描结果表明,548 nm处为溶液最大吸收峰,牛樟芝菌丝体培养7、14、21、28、35和42 d后的总三萜含量分别为(15.170±1.400)、(17.574±2.015)、(26.400±2.259)、(39.192±2.025)、(28.907±0.619)和(30.074±0.684)mg/g。当培养时间小于28 d时,菌丝体的总三萜含量随着培养时间的增加而增加,而当培养时间为28~42 d时,菌丝体三萜含量随着培养时间的增加而下降,但培养42 d的牛樟芝菌丝体三萜含量略高于35 d。ACFB-CK和ACFB-CC的总三萜含量的测定结果表明,ACFB-CK的总三萜含量显著高于ACFB-CC和菌丝体(P<0.05),达(49.391±2.675)mg/g;而ACFB-CC的总三萜含量最低,仅为(11.530±0.733)mg/g。

图1 液体培养牛樟芝不同生长时期的菌丝形态Fig.1 Mycelium morphology of A. cinnamomea culture in surbmerge medium during different stages

图2 液体培养牛樟芝不同时期的菌丝体生物量(不同字母代表P<0.05)Fig.2 Biomass of mycelium of A. cinnamomea in surbmerge medium during different stages

图3 牛樟芝子实体及液体培养不同生长时期菌丝体的总三萜含量(vs ACFB-CK “*”表示差异显著,P<0.05)Fig.3 Triterpeniods content of A. cinnamomea foodbody and mycelium in surbmerge medium during different stages
2.3 qRT-PCR标准曲线制作
利用PCR分别扩增Se和Mvd基因,纯化后连到pMDTM18-T载体上,经转化,筛选和验证后,用Easy dilution 10倍梯度稀释后,采用优化的实时荧光定量PCR进行扩增,以测定的Cq值为纵坐标(Y),以样品拷贝数的对数值(Log Starting quantity)(LogSQ)为横坐标(X),绘制标准曲线,根据标准曲线和Eq. 1计算待测样品的基因拷贝数。由图4可知,2条标准曲线均具有良好的线性关系,通过Excel作图获得Se基因的标准曲线方程为y=-3.4704x+47.231(R2=0.994);Mvd基因的标准曲线方程为y=-3.1854x+43.264(R2=0.996)。
2.4 qRT-PCR扩增产物特异性
Se和Mvd基因PCR扩增的产物经1 %琼脂糖凝胶电泳检测无引物二聚体及其它非特异性扩增条带,溶解曲线为单峰,且峰值单一,产物特异性良好(图5)。
2.5 不同生长时期牛樟芝菌丝体中Se和Mvd基因表达量分析
通过qRT-PCR测定并分析液体培养牛樟芝不同生长阶段和三萜合成途径中2个重要的基因(Se和Mvd)的表达水平。由图6可知,牛樟芝体内Se基因表达量略高于Mvd。液体培养7 d后的牛樟芝菌丝体中2个基因的表达量最高,但随着培养时间的推移,Se和Mvd的基因表达量随着牛樟芝菌丝体的生长发育不断下降;而ACFB-CK和ACFB-CC中2个基因的表达量均较低(图6)。
3 讨论与结论
三萜类化合物结构复杂、种类多样,大部分由30个碳原子或27个碳原子组成的萜类物质,目前所发现的品种有200余种[2, 18]。牛樟芝的苦味主要来自三萜类化合物,到目前牛樟芝子实体、菌丝体、发酵液中分离到的泛醌衍生物、马来酸衍生物、三萜类化合物、生育酚等物质70余种,其中三萜类物质达30余种[19],且被证实具有保肝[20]、抗氧化[21]等显著效果,因此,提高三萜类化合物的合成效率和研究其形成的通路逐渐受到关注。

图4 qRT-PCR标准曲线Fig.4 Standard curve obtained by plotting the starting copy numbers of recombinant plasmid against the cycle numbers

图5 实时荧光定量溶解曲线Fig.5 Melting curves obtained by plotting fluorescence data against the cycle numbers

图6 不同培养时间的牛樟芝菌丝体中Se和Mvd基因拷贝数(vs ACFB-CK “*”和“**”表示差异显著,P<0.05)Fig.6 Se and Mvd gene copy numbers in A. cinnamomea mycelium under different culture time
牛樟芝中三萜合成途径复杂,SE和MVD是已被证实在牛樟芝三萜合成途径中是重要的催化酶[7]。Lu等[7]研究表明MVD催化甲羟戊酸-5-焦磷酸(Mevalonate-5PP)合成3-异戊烯基焦磷酸(Isopentenyl-PP),是合成单萜化合物的底物。Se是三萜合成途径中的关键酶,它催化鲨烯(Squalene)合成2,3-氧化角鲨烯(2,3-oxido squalene),作为合成羊毛甾醇的主要底物。研究还表明,MVD催化的反应发生在SE催化反应之前,通过MVD催化形成的Isopentenyl-PP可分别经IDI和FPPS催化形成DMAPP和Farnesyl-PP,只有后者可通过鲨烯合酶(SQS)和SE进一步催化形成羊毛甾醇类三萜化合物,从而进一步证实MVD和SE所在酶促反应是羊毛甾醇类三萜化合物形成途径中的关键反应,而Se和Mvd基因表达量的直接影响这两个反应的进行,从而进一步影响羊毛甾醇类三萜化合物的含量。
通过对牛樟芝不同时期Se和Mvd两个基因的表达量分析,结果表明培养7 d后的牛樟芝菌丝体中两个基因都表现出较高的活性;而在菌丝体生长7~42 d时主要是合成MVD,从而大量积累Isopentenyl-PP用于生成单萜类化合物,所形成的单萜化合物可进一步经辅酶Q(CoQ)等催化形成安卓奎诺尔(Antroquinonol)和泛醌等化合物;而Isopentenyl-PP亦可通过SE的催化形成羊毛甾醇,羊毛甾醇是合成众多三萜类化合物的重要底物,并通过细胞色素P450作用催化合成麦角甾烷类和羊毛甾醇类的三萜化合物。三萜类化合物种类繁多,在植物、真菌生长不同阶段能大量产生和积累,培养7 d的牛樟芝菌丝体,细胞各方面活性较旺盛,Se和Mvd基因的表达量也相对最高;而ACFB-CK和ACFB-CC中的细胞生理活性上不如培养7 d的牛樟芝菌丝体,Se和Mvd表达量显著低于培养7 d的菌丝体,但随着生长时间的推移,ACFB-CK中三萜含量的积累却远高于其他时期,但随着液体培养时间的延长,牛樟芝菌丝体中的三萜含量呈下降趋势,其原因还有待研究。
研究还发现不同培养时间的牛樟芝菌丝体和牛樟芝子实体中Se和Mvd两个基因的表达量与其三萜含量的变化趋势并不一致。在菌丝体生长7~42 d时,Se的表达量始终高于Mvd可进一步推定SE催化反应发生在牛樟芝菌丝体形成的初期;而MVD催化的反应产物不仅用于合成三萜类化合物,同时还可生成Antroquinonol和泛醌等重要化合物质。对灵芝中MVD的研究发现其培养时间为12 d时,灵芝甲羟戊酸焦磷酸脱羧酶(Gl-mvd)的表达量最高,随着时间的推移也逐渐下降,它与牛樟芝菌丝体中的研究结果相一致[13]。Han等[22]利用RNAi技术对人参中PgSE1和PgSE2进行沉默发现,人参三萜皂苷含量急剧下降,但PgSE2含量上调,甾醇含量增加,表明Se对甾醇和三萜皂苷的合成起到关键作用。
SE和MVD作为牛樟芝三萜合成途径中2种重要的酶在不同的反应阶段对三萜类化合物的合成起着重要的作用,而Se和Mvd基因的表达量与2种酶的活性直接相关,通过对不同培养时期的牛樟芝菌丝体中Se和Mvd基因的表达量的研究,进一步明确合成三萜类物质的影响因素,从而为促进牛樟芝菌丝体内三萜类化合物的合成奠定良好基础。
[1]Chang T, Chou W.Antrodiacinnamomeasp. nov. onCinnamomumkanehiraiin Taiwan[J]. Mycological Research, 1995, 99(6): 756-758.
[2]Shi L S, Chao C H, Shen D Y, et al. Biologically active constituents from the fruiting body of Taiwanofungus camphoratus[J]. Bioorganic & Medicinal Chemistry, 2011, 19(1): 677-683.
[3]Kumar K J, Chu F H, Hsieh H W, et al. Antroquinonol from ethanolic extract of mycelium of Antrodia cinnamomea protects hepatic cells from ethanol-induced oxidative stress through Nrf-2 activation[J]. J Ethnopharmacol, 2011, 136(1): 168-177.
[4]Bishayee A, Ahmed S, Brankov N, et al. Triterpenoids as potential agents for the chemoprevention and therapy of breast cancer[J]. Front Biosci (Landmark Ed), 2011, 16: 980-996.
[5]游 昕,熊大国,郭志斌,等.茯苓多种化学成分及药理作用的研究进展[J].安徽农业科学,2014,43(35):12782-12785.
[6]王 莉, 史玲玲, 张艳霞. 植物次生代谢物途径及其研究进展[J]. 武汉植物学研究, 2007(25): 500-508.
[7]Goodwin T. Biosynthesis of carotenoids and plant triterpenes[J]. Biochemical Journal, 1971, 123(3): 293.
[8]Lu M Y J, Fan W L, Wang W F, et al. Genomic and transcriptomic analyses of the medicinal fungusAntrodiacinnamomeafor its metabolite biosynthesis and sexual development[J]. Proceedings of the National Academy of Sciences, 2014, 111(44): E4743-E4752.
[9]Shang C H, Zhu F, Li N, et al. Cloning and characterization of a gene encoding HMG-CoA reductase fromGanodermalucidumand its functional identification in yeast[J]. Bioscience, Biotechnology, and Biochemistry, 2008, 72(5): 1333-1339.
[10]Ding YX, Ou-Yang X, Shang C H. Molecular cloning, characterization, and differentialexpression of a farnesyl-diphosphate synthase gene from the basidiomycetous fungusGanodermalucidum[J]. Bioscience, Biotechnology, and Biochemistry, 2008, 72(6): 1571-1579.
[11]Zhao M W, Liang W Q, Zhang D B. Cloning and characterization of squalene synthase (SQS)gene fromGanodermalucidnm[J]. Journal of Microbiology and Biotechnology, 2007, 17(7): 1106.
[12]秦 磊. 灵芝甲羟戊酸焦磷酸脱羧酶基因的克隆及表达特性研究[D]. 南京:南京农业大学硕士论文, 2009: 15-28.
[13]Shi L, Qin L, Xu Y, et al. Molecular cloning, characterization, and function analysis of a mevalonate pyrophosphate decarboxylase gene fromGanodermalucidum[J]. Molecular biology reports, 2012, 39(5): 6149-6159.
[14]Kapich A, Prior B, Botha A, et al. Effect of lignocellulose-containing substrates on production of ligninolytic peroxidases in submerged cultures ofPhanerochaetechrysosporiumME-446[J]. Enzyme and Microbial Technology, 2004, 34(2): 187-195.
[15]Jordaan J. Isolation and Characterization of a Novel Thermostable and Catalytically Efficient Laccase fromPeniophorasp[J]. Strain UD4. Doctor Thesis of Philosophy of Rhodes University, 2005.
[16]陆震鸣. 樟芝深层液态发酵及其三萜类化合物的研究[D]. 无锡: 江南大学博士学位论文, 2009: 70-87.
[17]Chrostek E, Teixeira L. Mutualism Breakdown by Amplification of Wolbachia Genes[J]. PLoS biology, 2015, 13(2): e1002065.
[18]Xu R, Fazio G C, Matsuda S P. On the origins of triterpenoid skeletal diversity[J]. Phytochemistry, 2004, 65(3): 261-291.
[19]Lu M C, El-Shazly M, Wu T Y, et al. Recent research and development ofAntrodiacinnamomea[J]. Pharmacol Ther, 2013, 139(2): 124-156.
[20]Lin W C, Kuo S C, Lin W L, et al. Filtrate of fermented mycelia fromAntrodiacamphoratareduces liver fibrosis induced by carbon tetrachloride in rats[J]. World journal of gastroenterology: WJG, 2006, 12(15): 2369-2374.
[21]Huang S J, Mau J L. Antioxidant properties of methanolic extracts fromAntrodiacamphoratawith various doses of γ-irradiation[J]. Food chemistry, 2007, 105(4): 1702-1710.
[22]Han J Y, In J G, Kwon Y S, et al. Regulation of ginsenoside and phytosterol biosynthesis by RNA interferences of squalene epoxidase gene inPanaxginseng[J]. Phytochemistry, 2010, 71(1): 36-46.
(责任编辑 李 洁)
Determination of Triterpenoids and Expression Analysis ofSeandMvdGene in Mycelium and Fruiting Body ofAntrodiacinnamomea
LI Jing1, 3, LIN Xiong-jie2, HE Jing-min3, CAI Can3, LIN Zhan-xi1, 3 *
(1.China National Engineering Research Center of JUNCAO Technology, Fujian Fuzhou 350002, China; 2.Fruit Research Institute of Fujian Academy of Agricultural Sciences, Fujian Fuzhou 350013, China; 3.School of Life Science, Fujian Agriculture and Forestry University, Fujian Fuzhou 350002, China)
The relationship between triterpenoids content and squalene synthase gene (Se) and mevalonate pyrophosphate decarboxylase gene (Mvd) expression were analyzed during different culture stages ofAntrodiacinnamomea(A.cinnamomea) mycelium and fruiting bodies ofA.cinnamomea(ACFB-CK), which grew in the hay ofC.kanehiraeand the other one grew in corncob (ACFB-CC). Triterpenoids content of mycelium and fruiting bodies were detected by Vanillin-glacial acetic acid. The expressions ofSeandMvdgenes were detected using the quantitative Real-time PCR. The dry weight ofA.cinnamomeamycelium was increased gradually as incubation time was stable in culture for 21 days. The triterpenoids content ofA.cinnamomeain mycelium was gradually increased along with the culture time as the incubation time was less than 28 days, and it was the highest on the 28thday, which was (39.192±2.025)mg/g. It was next to the triterpenoids content of ACFB-CK (49.391±2.675)mg/g. The triterpenoids content of ACFB-CC was the lowest, which was only (11.530±0.733)mg/g. There was significant difference (P<0.05) between all the samples. It was showed in the qRT-PCR results that the expression ofMvdandSegenes was the highest inA.cinnamomeaon the 7thday, and it showed a declining trend as it submerged culture from 7 to 42 days. The expressions ofSeandMvdgenes were the highest in mycelium ofA.cinnamomeaon the 7thday in submerged culture. While the triterpenoids content in mycelium ofA.cinnamomeaon the 28thday in submerged culture was next to ACFB-CK. The triterpenoids content in ACFB-CC was the lowest. The expressions ofSeandMvdgenes in both ACFB-CK and ACFB-CC were low. They were almost the same as the expression of the mycelium which was in submerged culture for 28-42 days. The triterpenoids content was associated to the expression of the related genes in synthesis pathway of triterpenoids,the culture condition and accumulation time.
Triterpenoids; Quantitative Real-time PCR; Squalene synthase; Mevalonate pyrophosphate decarboxylase
1001-4829(2016)09-2206-06
10.16213/j.cnki.scjas.2016.09.033
2015-10-12
福建省菌草生态产业协同创新中心(K80ND8002);福建农林大学科技发展基金(KF2015111);国家菌草工程技术研究中心组建项目(2011FU125X12)
李 晶(1985-),女,湖北武汉人,博士,蔬菜学专业食用菌方向,*为通讯作者,E-mail: lzxjuncao@163.com。
S567.39
A
