半滑舌鳎伪雄鱼性腺发育的组织学研究
2016-12-26王伟峰李恒德中国水产科学研究院生物技术中心北京004中国水产科学研究院营口增殖实验站辽宁营口5000上海海洋大学水产与生命学院上海0306华中农业大学水产学院湖北武汉430070
蒋 丽,李 爽,崔 瑜,3,王伟峰,4,李恒德* (.中国水产科学研究院生物技术中心,北京 004;.中国水产科学研究院营口增殖实验站,辽宁营口 5000;3.上海海洋大学水产与生命学院,上海 0306;4.华中农业大学水产学院,湖北武汉 430070)
半滑舌鳎伪雄鱼性腺发育的组织学研究
蒋 丽1,李 爽2,崔 瑜1,3,王伟峰1,4,李恒德1*(1.中国水产科学研究院生物技术中心,北京 100141;2.中国水产科学研究院营口增殖实验站,辽宁营口 115000;3.上海海洋大学水产与生命学院,上海 201306;4.华中农业大学水产学院,湖北武汉 430070)
[目的]了解半滑舌鳎性逆转的生理发育过程。[方法]对5个家系的半滑舌鳎进行性腺发育的组织学观察、遗传性别鉴定和生理性别分析。[结果]半滑舌鳎性逆转有着明显的群体性,性逆转只发生在特定群体中,有些群体完全不逆转;半滑舌鳎发生逆转的遗传雌鱼在性腺发育过程中,会出现明显的兼性阶段,即雌雄兼有的特有过程。[结论]该研究结果可为剖析半滑舌鳎性逆转的分子、生理机理以及性逆转遗传因子的作用机理提供研究方向和研究线索。
半滑舌鳎;性别逆转;间性性腺;伪雄鱼
半滑舌鳎(CynoglossussemilaevisGunther),俗称龙利、鳎米、牛舌头,隶属蝶形目(Pleuronectiform)舌鳎科(Cynoglossidae)舌鳎属(Cynoglossus),为我国近海常见的大型暖温性底层鱼类,具有个体大、味道鲜美、营养丰富等特点,目前已经实现工厂化养殖和人工繁育[1]。半滑舌鳎雌鱼的生长速度是雄鱼的 2~4倍,而且雄鱼经过2年培育尚未达到商品上市规格[2]。在实际的工厂化养殖生产中,常常会出现雌性数量逐渐减少且远远少于雄性的现象,导致最终的半滑舌鳎养殖群体中雌雄比例差异很大。养殖场在购买苗种时雌性比例往往很低,通常低于 25%,最低时甚至不到20%,严重制约了生产效益的提高[3]。Otake等[4]研究表明半滑舌鳎在苗种期存在遗传雌鱼向表型雄鱼单向性逆转的现象,致使部分雌鱼性逆转为雄鱼,导致养殖生产中半滑舌鳎雄性占比很大。
性逆转是在一定条件下动物的雌雄个体相互转化的一种现象,性逆转现象在鱼类中比较常见[5]。许多鱼类的性别受基因和环境的双重调控,外部环境中的温度、pH、光照、盐度和内部遗传因素等都可能影响鱼类的性别分化[6-9]。一般鱼类性腺分化可分为雌雄同体和雌雄异体2类[10]。雌雄同体性逆转鱼类有黄鳝(Monopterusalbus)[11]和石斑鱼(Epinephelus)[12]等,它们有的是雌性性腺发育成熟后逆转为雄性,有的是雄性性腺发育成熟后逆转为雌性[11,13]。雌雄异体鱼类的性腺分化又可划分为分化型和未分化型[14-15]。在未分化类型中,未分化的性腺最初发育成类似卵巢样的性腺,然后约有一半个体变成雄性,而另一半变成雌性,如斑马鱼(Brachydaniorerio)[16];在分化型中,未分化的性腺直接分化成精巢或卵巢,如青鳉(Oryziaslatipes)[17]。只有在性腺发育的特定时期用性类固醇激素、温度、光照等条件进行人工诱导,分化型的雌雄异体性别的人工控制才能获得成功。半滑舌鳎雌雄异体,人为地控制温度等外部条件可使雌鱼逆转为雄鱼[9],属于分化型;半滑舌鳎只有一种逆转方向,即从遗传雌鱼向生理雄鱼转化,未发现有从遗传雄鱼向生理雌鱼方向转化。Orban等[3]研究发现半滑舌鳎的性逆转也受遗传因子的调控,其伪雄鱼作为父本,其后代的遗传雌鱼全部逆转为生理雄鱼,这可能与表观遗传有关。然而,关于正常雄鱼作为亲本其后代发生性逆转的分子遗传机制尚未阐明[3]。
在实际生产中半滑舌鳎雌性率低一直是制约半滑舌鳎发展的最重要因素[18]。如何提高半滑舌鳎在生产中的雌性率,进而提高半滑舌鳎在人工养殖中的经济效益是研究重点之一。利用性逆转的分子遗传特性进行遗传选育是解决半滑舌鳎雌性率低的一种很好的方法[19]。半滑舌鳎在性逆转过程中的组织变化特征可以为进一步了解性逆转的遗传机制提供丰富的生理学信息。笔者利用组织学观察研究了半滑舌鳎在性逆转过程中的性腺组织和细胞形态的变化,旨在为今后的分子遗传研究提供理论基础。
1 材料与方法
1.1 材料2014年5月育苗的5个半滑舌鳎家系,分别为2、3、7、8、9号家系,各家系在工厂化养殖模式下同池养殖。
1.2 方法
1.2.1样品采集。2013年9月和2014年11月各采集样品1次。每次每个家系随机捞取50尾,共500个样本。在解剖镜下将鱼的性腺取出,置于波恩(Bouin)固定液中(苦味酸饱和液∶甲醛∶冰醋酸=15∶5∶1)固定,24 h后将样品转移至70%乙醇中,并做好标记,常温下可长期保存。剪取适量的组织样品置于离心管中,恒温4 ℃下保存,并做好标记,备用。
1.2.2性别鉴定。
1.2.2.1遗传性别鉴定。采用海洋动物组织基因组DNA快速提取试剂盒(北京艾德莱生物科技有限公司)提取半滑舌鳎DNA,溶解于50 μL TE 中,进行1% 琼脂糖凝胶电泳检测,-20 ℃下保存备用。设计1对引物序列,上游序列为GAGGCCGACAGGATCGTAC,下游序列为TACGACGTACTCCGGTGGTTTT。引物由上海生工生物技术有限公司合成。PCR 反应体系(20 μL)为:2×PCR mix 10 μL、上下游引物各1 μL、DNA模板(原液稀释20倍)1 μL,添加ddH2O 补足20 μL。PCR反应程序为:95 ℃预变性5 min;95 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃延伸7 min。对PCR产物进行3%琼脂糖凝胶电泳检测,电压 140 V,电泳时间 30 min,检测出现2条带(218和206 bp)的为雌鱼(ZW),出现1条带(206 bp)的为雄鱼(ZZ)。
1.2.2.2生理性别鉴定。采用石蜡组织切片的方法,进行生理性别鉴定。切片步骤如下:①脱水。70%乙醇(45 min)、 80%乙醇(45 min)、90%乙醇(45 min)、95%乙醇(45 min)、100%乙醇(40 min);②透明。1∶1苯醇(40 min)、二甲苯(30 min);③浸蜡。1∶1苯蜡(45 min)、纯蜡1(45 min)、纯蜡2(45 min);④包埋;⑤切片。使用切片仪SYD-S2020 型切片,厚度6 μm;⑥展片。Leica HI1220 型展片仪,40 ℃下展平并烘干;⑦HE染色。展片后12 h进行HE染色;⑧树胶封片。最后对切片进行镜检并保存。
2 结果与分析
2.1 各家系雌鱼、雄鱼以及伪雄鱼所占比例由表1可知,不同家系间雌鱼逆转率存在较大的差异。在5个家系中遗传性别雌雄比例为40%~60%,除3号家系的遗传雌性远低于遗传雄性外,其余4个家系的遗传雌性略低于遗传雄性。2号、3号、7号家系分别有1尾、15尾、2尾雌鱼发生性逆转,8号、9号家系雌鱼没有发生性逆转,5个家系逆转率分别为2.3%、39.5%、 4.3%、 0和 0。各家系中伪雄鱼所占比例分别为1%、15%、2%、0和0。

表1 各家系雌鱼、雄鱼和伪雄鱼所占比例
2.2 性逆转的性腺变化及间性性腺发育阶段半滑舌鳎性腺组织切片中可见性腺分化后形成的精巢和卵巢(图1 A、图1B)。在精巢中分布有大量的精小囊,同一个体的精小囊内可能包含不同时期的生殖细胞,有些精小囊中有大量成熟的精子,有些精小囊中有许多处于分裂期的初级精母细胞和次级精母细胞,有的甚至存在精原细胞(图1C)。卵巢中,卵巢腔清晰可见,存在大量的卵原细胞以及处于分裂期的初级卵母细胞、次级卵母细胞和卵细胞(图1D)。对比遗传性别鉴定结果和生理性别鉴定结果,发现发生性逆转的部分雌性完全逆转为雄性,卵巢也完全转化为精巢,转化后的伪雄鱼精巢结构与遗传雄鱼精巢的结构基本相似(图1E)。此外,发现在半滑舌鳎性逆转的部分个体中存在间性性腺,即在类似卵巢的性腺中除了存在雌性生殖细胞外还存在雄性生殖细胞(图1F、图1J)。在间性性腺中雌雄生殖细胞的比例不尽相同,在以雌性生殖细胞为主的间性性腺中雄性生殖细胞均匀分布(图1G),而以雄性细胞为主的间性性腺中雌性生殖细胞零星的分布于整个性腺或集中分布于某一块区域(图1H、图1I)。
3 讨论
3.1 不逆转家系与生产利用通过对遗传性别鉴定结果和生理性别鉴定结果进行对比,发现在5个半滑舌鳎家系中8号和9号家系198尾鱼都没有发生性逆转,而另外3个家系都有伪雄鱼出现,这说明在半滑舌鳎家系中存在不发生性逆转的家系。在实际生产中,养殖不逆转家系可以有效降低养殖成本,提高经济效益。由于雄性半滑舌鳎生长速度慢,其体型较雌性小,在生产中会占据雌鱼的生存空间和资源,经济价值较低。利用分子标记来直接鉴定大生产群体中的遗传雌鱼和雄鱼需要耗费大量的人力和物力。如何利用性逆转性状的遗传规律开展不逆转品系的培育是半滑舌鳎养殖生产中亟需解决的问题之一。
3.2 部分逆转家系与选种或选配策略对比5个家系的逆转率,发现部分家系存在性逆转,而不同家系的性逆转率差别很大。5个家系中2号、3号、7号家系都存在性逆转,其中3号家系的逆转率最高达到39.5%,2号和7号家系的逆转率较低,分别为2.3%和4.3%,8号和9号家系不发生性逆转。结合对性逆转性状的遗传研究结果[3],利用不同分离群体对性逆转性状进行精细遗传解析,有希望找出控制或与之关联的遗传因子或相关位点,揭示相关遗传因子在性逆转决定过程中的作用机理,对于今后选种或者选配以获得全雌或者高雌性苗种意义重大。
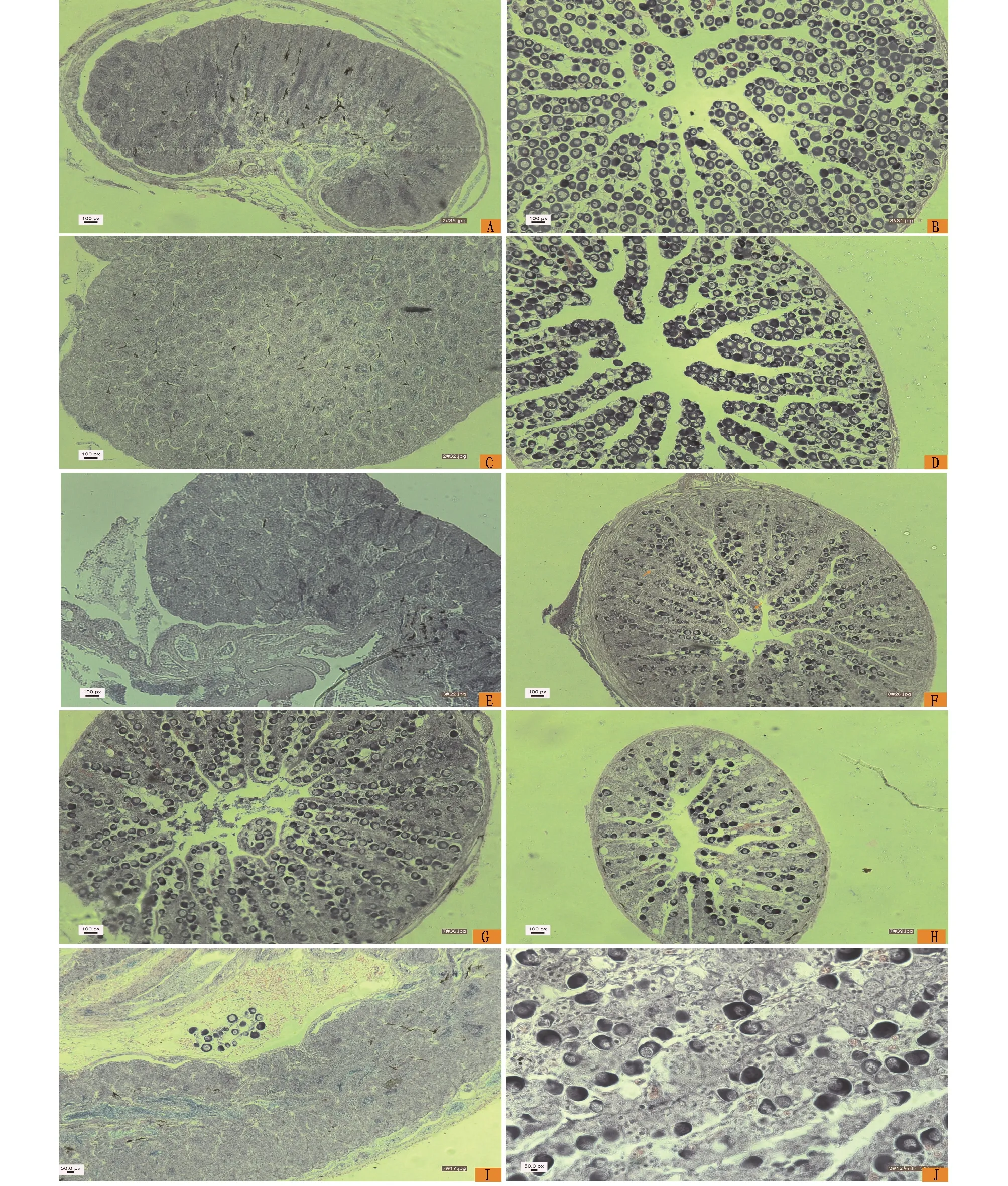
注:A.精巢;B.卵巢;C.精巢内精小囊及生殖细胞;D.卵巢内生殖细胞; E.遗传雌鱼性逆转为伪雄鱼形成的精巢;F.类似卵巢的间性性腺(箭头为性腺内雌雄生殖细胞);G.雌性生殖细胞为主的间性性腺雄性生殖细胞均匀分布;H.雄性细胞为主的间性性腺雌性生殖细胞零星的分布于整个性腺;I.雄性细胞为主的间性性腺中雌性生殖细胞集中分布于某一块区域;J.类似卵巢的间性性腺(细部图)。
3.3 兼性生殖阶段与性逆转半滑舌鳎由于其雌雄生长的差异、雌性性逆转为生理雄鱼、基因组小、易于遗传操作等特点,有望使其成为研究性逆转的理想遗传材料。Chen等[20]研究发现半滑舌鳎性逆转与基因组水平的甲基化有关,但是对于性逆转性状的遗传解析报道较少。笔者研究了半滑舌鳎性逆转过程中性腺及生殖细胞的变化,试验发现性逆转过程中有间性性腺出现,说明遗传雌性个体在遗传因素和外界环境因子共同作用下,生殖干细胞逐步分裂分化是受精细调控的,这为半滑舌鳎性逆转的遗传机制研究提供了表型鉴定的组织学依据。
4 结论
利用遗传性别鉴定和生理性别鉴定研究性逆转时,不同家系的性逆转率差别很大,在所研究的家系中既有不发生性逆转的家系,又有部分性逆转的家系;在发生性逆转的家系中,逆转率差异很大,最低至2.3%,最高达到39.5%;半滑舌鳎性逆转时性腺除了分化成精巢和卵巢外,部分个体存在间性性腺,间性性腺的发现为研究性逆转机制提供了组织学表型证据。
[1] LIU H Q,GUAN B,XU J,et al.Genetic Manipulation of sex ratio for the large-scale breeding of YY super-male and XY all-male yellow catfish(Pelteobagrusfulvidraco(Richardson))[J].Marine biotechnology,2013,15(3): 321-328.
[2] MEI J,GUI J F.Genetic basis and biotechnological manipulation of sexual dimorphism and sex determination in fish [J].Science China life sciences,2015,58(2):124-136.
[3] ORBAN L,SREENIVASAN R,OLSSON P E.Long and winding roads: Testis differentiation in zebrafish [J].Molecular and cellular endocrinology,2009,312(1/2): 35-41.
[4] OTAKE H,SHINOMIYA A,MATSUDA M,et al.Wild-derived XY sexreversalmutants in the Medaka [J].Genetics,2006,173(4): 2083-2090.
[5] ZHANG Q,SUN X H,QI J,et al.Sex determination mechanisms in fish [J].Journal of ocean university of China,2009,8(2): 155-160.
[6] 邓景耀,孟田湘,任胜民,等.渤海鱼类种类组成及数量分布[J].海洋水产研究,1988(9): 11,91.
[7] 邓思平,陈松林,田永胜,等.半滑舌鳎的性腺分化和温度对性别决定的影响[J].中国水产科学,2007,14(5): 714-719.
[8] 季相山,陈松林,马洪雨,等.半滑舌鳎养殖群体中自然性逆转伪雄鱼的发现[J].水产学报,2010,34(2): 322-327.
[9] 梁卓,陈松林,张静.半滑舌鰨养殖群体雌雄比例与自然性逆转率[J].中国水产科学,2013(1): 44-49.
[10] 罗杰,施鹏.鱼类性逆转研究最新进展[C]//全国生物遗传多样性高峰论坛会刊.昆明:中国遗传学会,2012.
[11] 马学坤,柳学周,温海深.半滑舌鳎性腺分化的组织学观察[J].海洋水产研究,2006,27(2): 55-61.
[12] 孟田湘,任胜民.渤海半滑舌鳎的年龄与生长[J].海洋水产研究,1988(9): 173-185.
[13] 沈志刚.黄颡鱼与蓝鳃太阳鱼性别控制及性别决定机制研究[D].武汉:华中农业大学,2014.
[14] 宋超,蒋丽,王景伟,等.半滑舌鳎性逆转的遗传特性研究[J].生物技术通报,2015,31(3): 207-212.
[15] 陶亚雄,林浩然.黄鳝自然性反转的研究[J].水生生物学报,1991,15(3): 274-278.
[16] 王美玉.半滑舌鳎性别决定机制证明及生长相关微卫星标记筛选[D].哈尔滨:东北农业大学,2013.
[17] 邢晨光,金姗,袁思平.石斑鱼性逆转研究现状[J].水产科学,2006,25(4): 214-216.
[18] 铃木克美,熊国强.硬骨鱼类的雌雄同体现象[J].水产科技情报,1990,17(5): 151-154.
[19] 游秀容,蔡明夷,姜永华,等.大黄鱼性腺性别分化的组织学观察[J].水产学报,2012,36(7): 1057-1064.
[20] CHEN S L,ZHANG G,SHAO C,et al.Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle [J].Nature genetics,2014,46(3):253-260.
Histological Research on Gonadal Development of Pseudo-male Fish inCynoglossussemilaevis
JIANG Li1, LI Shuang2, CUI Yu1,3, LI Heng-de1*et al (1. Research Center of Biotechnology, Chinese Academy of Fishery Sciences, Beijing 100141; 2. Yingkou Aquaculture Experimental Station, Chinese Academy of Fishery Sciences, Yingkou, Liaoning 115000; 3. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306; 4. College of Fisheries, Huazhong Agriculture University, Wuhan, Hubei 430070)
[Objective] To better understand the physiological development of the sex-reversal ofCynoglossussemilaevis. [Method] This study focus on the observation of gonadal development histologically among five families ofCynoglossussemilaevis, the genetic-sex identification and the analysis for physiological sex. [Result] The sex-reversal only occurs among the specific population which characterized with population, no sex-reversal occurs among some particular population; There exists a particular obvious chimeric stage, which is a stage while the female and male gonadal cells coexist. [Conclusion] The above founds will give light for the future research on molecularly, physiologically mechanisms of the sex-reversal ofCynoglossussemilaevis, even the action mode with the genetically factors of the sex-reversal.
Cynoglossussemilaevis; Sex-reversal; Chimeric gonadal; Pseudo-male fish
中央公益性基本科研业务费专项(2016B005)。
蒋丽(1976- ),女,河南淮阳人,副研究员,博士,从事鱼类性别控制和水产养殖学研究。*通讯作者,副研究员,博士,硕士生导师,从事动物数量遗传学研究。
2016-08-22
S 931.1
A
0517-6611(2016)30-0123-04
