凝集反应对大鼠组织因子、D-二聚体及内皮细胞的影响*
2016-12-26贾睿奕
许 洁, 贾睿奕, 张 庆
(承德医学院附属医院呼吸内科,河北 承德 067000)
凝集反应对大鼠组织因子、D-二聚体及内皮细胞的影响*
许 洁, 贾睿奕, 张 庆△
(承德医学院附属医院呼吸内科,河北 承德 067000)
目的: 探讨血凝素诱发的凝集反应对血浆组织因子(TF)、D-二聚体及内皮细胞的影响。方法:42只SPF级SD大鼠(雌雄不限,体重180~200 g),随机分为生理盐水对照组、不同浓度(5、10和20 g/L)植物血凝素组及灭活的植物血凝素组,每组6只。通过尾静脉向大鼠体内注入生理盐水、植物血凝素及灭活植物血凝素,用ELISA法检测大鼠血浆TF和D-二聚体的水平,透射电镜观察大鼠肺部毛细血管内皮细胞形态。结果:5、10和20 g/L植物血凝素组大鼠血浆TF和D-二聚体含量均显著高于生理盐水对照组及相应浓度的灭活植物血凝素组(P<0.05)。电镜下,与生理盐水对照组相比,各浓度植物血凝素组出现肺毛细血管内皮细胞损伤,表现为内皮细胞肿胀、溶解,胞质疏松,边界不清,线粒体肿胀,基膜增厚。各灭活植物血凝素组内皮细胞结构正常。结论:体内发生的凝集反应可破坏毛细血管内皮细胞,导致凝血纤溶系统紊乱。
凝集反应; 组织因子; D-二聚体; 内皮细胞
流感病毒严重威胁着人类,每年有5%~15%的人感染流感病毒[1],据估计在发达国家,流感每年可致25~50万人口死亡,而发展中国家远远超过这个数字[2]。感染症状多样,由轻度呼吸道症状,到重症肺炎、多器官功能障碍甚至导致致死性呼吸衰竭[3]。流感病毒的致病机制尚不完全明确,近期动物实验及临床研究报道[4-5],流感病毒感染后在全身多个器官脏器可检测到病毒RNA,表明流感病毒感染存在病毒血症,且病毒血症与临床表现的严重程度及高死亡率密切相关。重症致死性流感以微循环障碍为特点[6]。血凝素(hemagglutinin,HA)是位于病毒颗粒表面的糖蛋白,是流感病毒致病力的关键决定因素,具有使红细胞发生凝集的特性[7]。本研究通过应用植物血凝素(phytohemagglutinin,PHA)引发体内的红细胞发生凝集反应[8],探索凝集反应对大鼠血浆组织因子(tissue factor,TF)、D-二聚体及内皮细胞的影响。
材 料 和 方 法
1 实验动物和试剂
SPF级健康SD大鼠42只,雌雄不限,体重180~200 g,购自北京维通利华实验动物技术有限公司 [SCXK(京)2012-0001]。本实验中动物处置方法符合动物伦理学标准。
大鼠 TF ELISA 试剂盒和大鼠 D-dimer ELISA 试剂盒均购自上海酶联生物科技有限公司;植物血凝素(每支10 mg)购自上海金穗生物技术有限公司。
2 方法
2.1 动物分组 SPF级SD大鼠(雌雄不限,体重180~200 g)42只,随机分为生理盐水(normal saline)对照组, 5、10和20 g/L PHA组及相应浓度的灭活PHA组,每组6只。
2.2 动物给药 按15 mL/kg体重沿尾静脉向大鼠体内注射生理盐水及不同浓度的植物血凝素(生理盐水稀释)及灭活植物血凝素(生理盐水稀释成不同浓度的PHA溶液,沸水浴1 h),注射完毕后,做好标记,将大鼠放于饲养笼中,自由进水、进食。
2.3 指标检测 ELISA法检测大鼠血浆中TF、D-二聚体的水平。大鼠给药4 h后,10%水合氯醛腹腔麻醉(3 mL/kg),下腔静脉取血,2 800×g离心10 min,取上清分装于EP管中,-80 ℃冰箱冻存。应用酶联免疫吸附法测定大鼠血浆中TF、D-二聚体的含量,操作步骤严格按照试剂盒说明书进行。
2.4 电镜标本留取及制备 上述实验大鼠,右中肺组织外周部位切成体积约1 mm×1 mm×1 mm的组织块,每例留取10块,用2%戊二醛前固定、1%锇酸后固定,常规脱水、浸透和包埋、聚合、切片、电子染色,透射电镜下观察肺部毛细血管内皮细胞形态。
3 统计学处理
使用SPSS 17.0统计软件分析,计量资料以均数±标准差(mean±SD)表示,样本均数正态性检验用Shapiro-Wilk检验,多个样本均数比较采用完全随机设计的单因素方差分析,方差不齐时采用Kruskal-Wallis H检验,以P<0.05为差异有统计学意义。
结 果
1 TF和D-二聚体的含量
5、10和20 g/L PHA组大鼠血浆TF和D-二聚体含量均显著高于生理盐水对照组和相应浓度的灭活PHA组(P<0.05),见表1。
表1 不同剂量的PHA对大鼠血浆TF和D-二聚体含量的影响
Table 1. The effects of PHA at different concentrations on the levels of serum TF and D-dimer (Mean±SD.n=6)
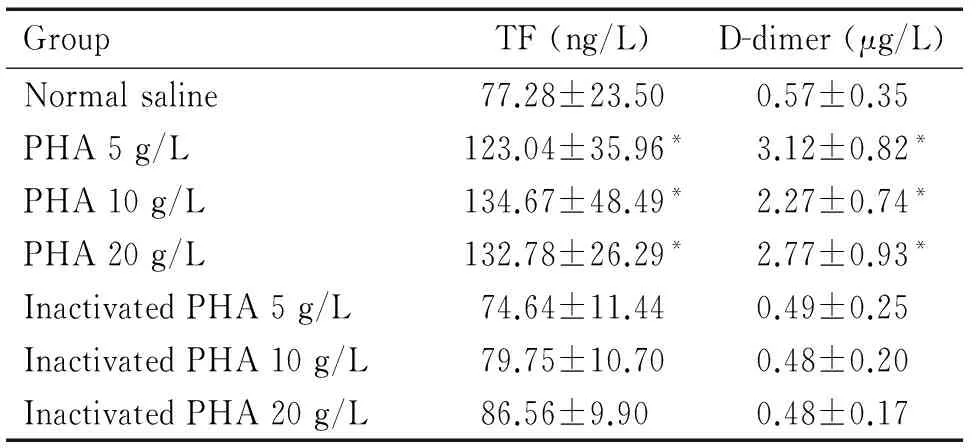
*P<0.05 vs normal saline.
2 电镜观察
与生理盐水对照组相比,各浓度植物血凝素组大鼠肺毛细血管内皮细胞出现损伤,表现为内皮细胞肿胀,边界不清,胞质疏松、溶解,基膜增厚、中断,线粒体肿胀、溶解,含气小泡减少,并随浓度的升高内皮细胞损伤程度加重。灭活植物血凝素组内皮细胞扁平,边界清楚,细胞器结构正常,含气小泡丰富,见图1。
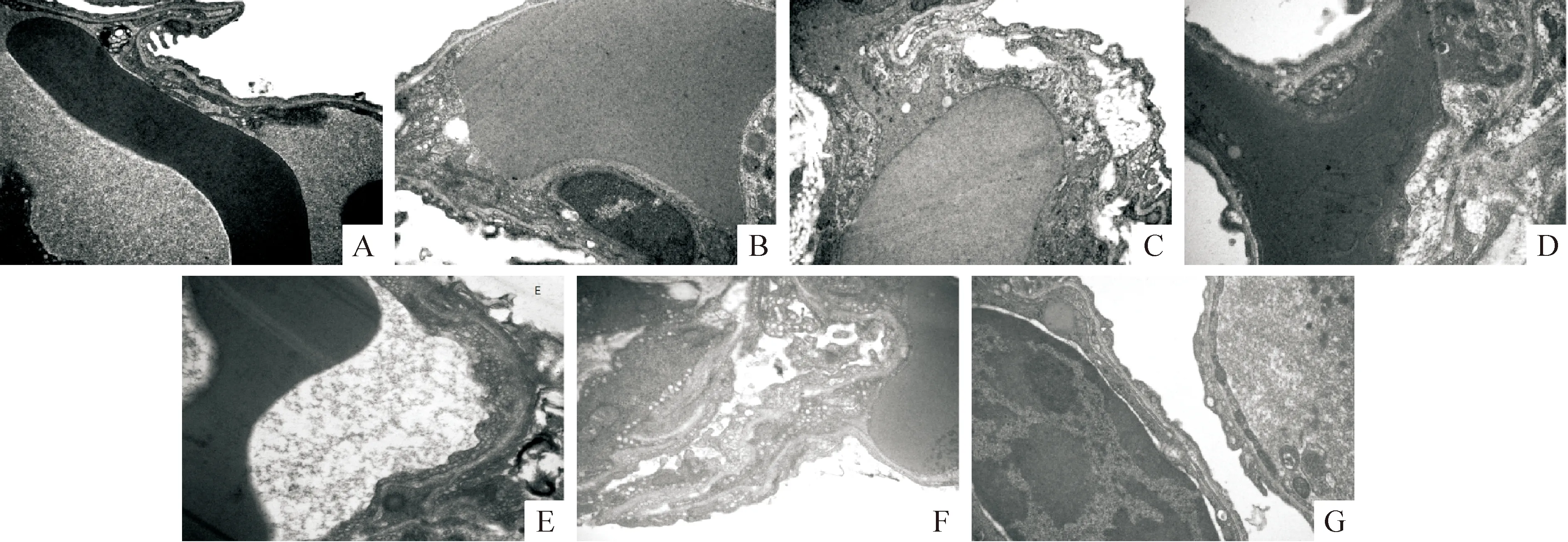
Figure 1. Observation of pulmonary capillary endothelial cells under TEM (H-7650, 80 kV, ×30 000). A: normal saline group; B: 5 g/L PHA group; C: 10 g/L PHA group; D: 20 g/L PHA group; E: 5 g/L inactivated PHA group; F: 10 g/L inactivated PHA group; G: 20 g/L inactivated PHA group.
图1 大鼠肺毛细血管内皮细胞透射电镜图片
讨 论
流感病毒为正黏液病毒科,依据核蛋白可分为A、B、C三型,根据其表面糖蛋白——HA(H1~H18)和神经氨酸酶(NA,N1~N9)又分为不同的亚型,依据致病性可分为高致病性(highly pathogenic avian influenza,HPAI)、低致病性(low pathogenic avian influenza,LPAI)和无致病性3种。HPAI感染发病率和死亡率极高,该病毒种类多,变异性强,新的病毒株不断的进化、侵袭,严重威胁着人类的健康[9]。
流感病毒表面的糖蛋白HA与病毒致病力密切相关,可以使体内红细胞发生凝集反应。凝集反应与凝血不同,凝集反应是颗粒性抗原,可以是细菌、红细胞等天然颗粒性抗原,也可以是吸附有可溶性抗原的非免疫相关颗粒,与相应抗体在电解质参与下相互作用形成肉眼可见的凝块,称凝集反应。而凝血则是一系列酶解反应的过程,在这一过程中,各种凝血因子相继激活,直至最终形成凝血酶,裂解纤维蛋白原使之形成纤维蛋白,纤维蛋白再级联形成凝块。研究发现,重症流感病毒感染往往存在凝血功能异常、微血栓形成从而导致弥散性血管内凝血[10]。我们推测,凝集反应可能导致机体凝血系统发生异常。研究发现,流感病毒依附其凝集活性而向全身播散[11],因此,对凝集反应的研究更为重要。
本实验应用透射电镜直观地观察到体内发生凝集反应的大鼠肺毛细血管内皮细胞肿胀,边界不清,胞质疏松、溶解,基膜增厚甚至断裂,且随体内凝集反应的增强损伤程度加重。血浆中TF和D-二聚体水平显著升高。Visseren等[12]研究发现流感病毒感染大鼠模型中,大鼠凝血时间显著减少,且血浆中TF因子水平呈3~4倍升高,表明流感病毒通过内皮细胞释放组织因子而呈现促凝血状态。据文献报道[13],在A型流感病毒H3N2感染的患者存在D-二聚体的显著升高,并且经抗凝治疗有效。应用流感病毒感染雪貂过程中存在D-二聚体水平升高,进一步证实体内存在血液高凝状态[14]。
TF是一种分子量为42 kD的跨膜糖蛋白,是体内凝血的主要启动者[15]。TF与血液中的凝血因子Ⅶ/Ⅶa结合形成TF-Ⅶa复合物,进一步激活凝血因子Ⅹ和Ⅸ,导致凝血酶的形成并最终形成交联的纤维蛋白[16]。D-二聚体是体内纤维蛋白降解的特异性产物,是体内高凝状态及纤溶亢进的特异性标志物之一。血凝素与红细胞受体结合,红细胞凝集成团,可能在通过毛细血管时其变形能力下降,损伤血管内皮细胞,内皮细胞释放大量TF入血,从而启动外源性凝血途径[17]。进而激发纤溶亢进,纤维蛋白降解,产物D-二聚体水平升高。因此,由血凝素诱发的凝集反应可能是流感病毒感染微血栓形成、体内血液高凝状态及纤溶系统紊乱的机制之一。
综上所述,由血凝素引发的红细胞凝集反应,能够破坏内皮细胞,引发体内凝血及纤溶系统的异常,对进一步探究流感病毒的致病机制具有重要意义。
[1] Herfst S, Schrauwen EJ, Linster M, et al. Airborne transmission of influenza A/H5N1 virus between ferrets[J]. Science, 2012, 336(6088):1534-1541.
[2] Stöhr K. Preventing and treating influenza[J]. BMJ, 2003, 326(7401):1223-1224.
[3] Whitley RJ, Monto AS. Seasonal and pandemic influenza preparedness: a global threat[J]. J Infect Dis, 2006, 194(Suppl 2):S65-S69.
[4] Wang X, Zhao J, Tang S, et al. Viremia associated with fatal outcomes in ferrets infected with avian H5N1 influenza virus[J]. PLoS One, 2010, 5(8):e12099.
[5] Tse H, To KK, Wen X, et al. Clinical and virological factors associated with viremia in pandemic influenza A/H1N1/2009 virus infection[J]. PLoS One, 2011, 6(9):e22534.
[6] Salgado DR, Ortiz JA, Favory R, et al. Microcirculatory abnormalities in patients with severe influenza A (H1N1) infection[J]. Can J Anaesth, 2010, 57(10):940-946.
[7] Bottcher-Friebertshauser E, Garten W, Matrosovich M, et al. The hemagglutinin: a determinant of pathogenicity[J]. Curr Top Microbiol Immunol, 2014, 385:3-34.
[8] Jia RY, Zhang Q, Ding XX, et al. Agglutination reaction induced by phytohemagglutinin and its effects on coagulation system[J]. J Chengde Med Coll, 2016, 33(1):12-14.
[9] Ei Zowalaty ME, Bustin SA, Husseiny MI, et al. Avian influenza: virology, diagnosis and surveillance[J]. Future Microbiol, 2013, 8(9):1209-1227.
[10]Zhou C, Fang P, Liu YN, et al. A retrospective study of one case of human infection by the highly pathogenic avian influenza A (H5N1)[J]. Zhonghua Jie He He Hu Xi Za Zhi, 2006, 29(1):9-13.
[11]Mori I, Komatsu T, Takeuchi K, et al. Viremia induced by influenza virus[J]. Microb Pathog, 1995, 19(4):237-244.
[12]Visseren FL, Bouwman JJ, Bouter KP, et al. Procoagulant activity of endothelial cells after infection with respiratory viruses[J]. Thromb Haemost, 2000, 84(2):319-324.
[13]Ohrui T, Takahashi H, Ebihara S, et al. Influenza A virus infection and pulmonary microthromboembolism[J]. Tohoku J Exp Med, 2000, 192(1):81-86.
[14]Goeijenbier M, van Gorp EC, Van den Brand JM, et al. Activation of coagulation and tissue fibrin deposition in experimental influenza in ferrets[J]. BMC Microbiol, 2014, 14:134.
[15]Mackman N, Tilley RE, Key NS. Role of the extrinsic pathway of blood coagulation in hemostasis and thrombosis[J]. Arterioscler Thromb Vasc Biol, 2007, 27(8):1687-1693.
[16]Manly DA, Boles J, Mackan N. Role of tissue factor in venous thrombosis[J]. Annu Rev Physiol, 2011, 73:515-525.
[17]Witkowski M, Landmesser U, Rauch U. Tissue factor as a link between inflammation and coagulation[J]. Trends Cardiovasc Med, 2016, 26(4):297-303.
(责任编辑: 陈妙玲, 罗 森)
Effects of agglutination on tissue factor, D-dimer and endothelial cells in rats
XU Jie, JIA Rui-yi, ZHANG Qing
(DepartmentofRespiratoryMedicine,AffiliatedHospital,ChengdeMedicalCollege,Chengde067000,China.E-mail:zhangqing0668@sina.com)
AIM: to explore the effects of agglutination on tissue factor (TF), D-dimer and endothelial cellsinvivo. METHODS: Forty-two SPF SD rats (male and female, 180~200 g) were randomly divided into normal saline control group, and different concentrations (5, 10 and 20 g/L) of phytohemagglutinin (PHA) groups and inactivated PHA groups, with 6 rats in each group. The rats were injected with normal saline, PHA and inactivated PHA through the tail vein respectively. The plasma contents of TF and D-dimer were detected by ELISA. The pulmonary capillary endothelial cells of the rats were observed under electron microscope. RESULTS: The plasma levels of TF and D-dimer were significantly higher in all PHA groups than those in normal saline group and 3 corresponding inactivated PHA groups. Compared with normal saline group, the pulmonary capillary endothelial cells of the rats in each PHA group were damaged, characterized by endothelial cell swelling and dissolution, cytoplasm osteoporosis, unclear boundary, mitochondrial swelling and thick basement membrane. In all inactivated PHA-groups, the structures of the endothelial cells were normal. CONCLUSION: PHA-induced agglutination damages capillary endothelial cells and causes the disorders of the coagulation-fibrinolysis system.
Agglutination; Tissue factor; D-dimer; Endothelial cells
1000- 4718(2016)11- 2088- 04
2016- 07- 04
2016- 09- 01
河北省重大实验课题(No. ZD2013047)
R363
A
10.3969/j.issn.1000- 4718.2016.11.029
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 15633142668; E-mail: zhangqing0668@sina.com
