高丽参提取液对大鼠自身免疫性脑脊髓膜炎的保护作用①
2016-12-26龚业莉李佳楠黄丽霞
龚业莉 李佳楠 黄丽霞
(江汉大学,武汉430056 )
高丽参提取液对大鼠自身免疫性脑脊髓膜炎的保护作用①
龚业莉 李佳楠 黄丽霞②
(江汉大学,武汉430056 )
目的:探讨高丽参提取液(Korean red ginseng extract,KRG)对实验性自身免疫性脑脊髓膜炎(EAE)的治疗作用及相关免疫调节机制。方法:取SD大鼠30只,随机分为空白对照组、模型组(实验性自身免疫性脑脊髓炎模型)和实验组(高丽参提取液治疗),每组10只,对EAE大鼠进行神经功能评分及体重测量,通过病理学HE染色和免疫组化观察25 d脑和脊髓炎症浸润,流式细胞术检测大鼠脊髓和淋巴结CD4+、CD4+/IFN-γ+(Th1)、CD4+/IL-17+(Th17)和CD4+/Foxp3+T细胞数量,实时荧光定量q-PCR检测大鼠脊髓和淋巴结IFN-γ、IL-17、IL-23和Foxp3 mRNA水平的表达。结果:治疗组大鼠神经功能评分明显改善,体重明显增加;与模型组比较,实验组神经症状和病理改变减轻;与模型组相比,治疗组中大鼠脊髓和淋巴结CD4+、CD4+/IFN-γ+、CD4+/IL-17+T细胞数量减少,而CD4+/Foxp3+T细胞数量增多(P<0.05);大鼠脊髓和淋巴结IFN-γ、IL-17、IL-23 mRNA表达下降,而Foxp3 mRNA表达增加(P<0.05)。结论:高丽参提取液通过调节免疫系统的CD4+、CD4+/IFN-γ+、CD4+/IL-17+和CD4+/Foxp3+T细胞数量和CD4+T细胞分泌细胞因子的水平对EAE起保护作用。
高丽参提取液;自身免疫性脑脊髓膜炎;白介素-17;白介素-23
实验性自身免疫性脑脊髓膜炎(Experimental autoimmune encephalomyelintis, EAE)是一种主要由T细胞介导的,以中枢神经系统(Central nervous system,CNS)脱髓鞘以及炎症浸润为主要特征的自身免疫性疾病。目前关于EAE发病机制并不明确,也缺乏理想药物进行治疗。研究发现,高丽参提取液(Korean red ginseng extract,KRG)在预防糖尿病以及动脉硬化、高血压等方面具有明显的效果,此外,高丽参还具有促进血液循环,防止疲劳,增强免疫力以及抗癌等方面的疗效[1-3]。近年来也有研究表明,高丽参提取液对神经系统也具有保护作用[4,5]。本研究采用豚鼠全脊髓匀浆制备大鼠EAE模型,探讨高丽参提取液对EAE的作用,并观察大鼠行为学变化和CNS的病理学改变,试图为临床用药提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 大鼠30只,雌性,6~8周,150~200 g。豚鼠6只,雌雄不拘,250~300 g,均由华中科技大学动物实验中心提供。
1.1.2 材料和试剂 高丽参提取液,浓度为1 ml含生药3 g,湖北中医药大学药学院提供。髓鞘少突胶质细胞糖蛋白(MOG)多肽片段由联美生物科技有限公司合成;结核菌素、百日咳毒素(Difco公司,美国);完全弗氏佐剂(Sigma公司,美国);Real-time PCR试剂盒(TaKaRa公司,日本);荧光团标记的抗小鼠单克隆抗体(mAb):APC-CD4、FITC-IFN-γ、PE-IL-17、APC-Foxp3及同型对照均购自eBiosciences公司。ABI 7500 PCR仪(ABI公司,美国)。
1.2 方法
1.2.1 动物模型的制备 30只SD大鼠随机分为3组:正常组,模型组和实验组(每组10只),实验组与模型组:实验组大鼠分别于背侧中线两侧皮下四点髓鞘少突胶质细胞糖蛋白(MOG)与完全弗氏佐剂(CFA)混合的乳化抗原(100 μg/只),免疫当天及第2天给小鼠皮下注射百日咳疫苗(BPV)0.1 ml(含菌量为1010个/ml)。正常组:大鼠脚垫皮内注射CFA和0.9%NaCl溶液制成的乳剂,注射部位和剂量同模型组。实验组在免疫前,灌胃高丽参提取液50 mg/kg,连续给予7 d预处理;模型组和正常对照组在造模前用等量的0.9%NaCl溶液灌胃7 d预处理。免疫当日计算为0 d。
1.2.2 临床EAE症状评分 从免疫当天起,每天对大鼠进行称重,并对其精神状况和活动情况等行为学指征进行观察,并进行评分,评分标准采用国际通用的Correar 6分[6]评分法:无明显异常为0分,大鼠摆尾无力为1分,后肢无力为2分,后肢瘫痪3分,前、后肢全瘫痪4分,濒死状态或死亡5分。将评分≥1分视为EAE发病大鼠。
1.2.3 组织学检测 大鼠称重后,腹腔注射10%的水合氯醛4 ml/kg。麻醉后,固定于解剖板上,备皮,消毒,迅速取出脑组织和腰髓节段。中性福尔马林缓冲溶液固定72 h,分别取脑干及腰髓节段石蜡切片,然后进行HE染色。并根据文献[7]进行组织学评分。
1.2.4 流式细胞仪检测CD4+、CD4+/IFN-γ+、CD4+/IL-17+和CD4+/Foxp3+T细胞表达 25 d处死各组大鼠,无菌条件下分别获取大鼠脊髓和淋巴结,通过机械研磨、裂解红细胞后,PBS洗3次,制成单个核细胞悬液。加入APC-CD4、FITC-IFN-γ、PE-IL-17、APC-Foxp3 抗大鼠mAb及同型对照抗体三标记细胞,利用流式细胞仪进行检测。
1.2.5 Real-time PCR(q-PCR)检测IFN-γ、IL-17、IL-23和Foxp3 mRNA表达 25 d提取各组大鼠脊髓和淋巴结,加入Trizol 试剂提取总RNA,用Real-time PCR Kit(TaKaRa 公司)逆转录成cDNA,利用SYBR green Ⅰ Real-time PCR Kit(TaKaRa 公司)试剂盒扩增目的基因,引物由上海生工生物工程有限公司合成,GAPDH作为内参。各基因引物序列见表1。
2 结果
2.1 临床EAE症状评分 体重方面,空白对照组至25 d体重持续增长,皮毛光滑,未见异常。模型组和实验组大鼠体重均有不同程度下降,起病8 d明显下降,进食少,活动少,皮毛粗糙,至第15天体重达最低点,而后体重逐渐增长,实验组较模型组体重下降程度轻,实验组与模型组免疫后8~25 d体重变化差异均有统计学意义(P<0.05)。神经功能评分方面,空白对照组平均评分为0分,模型组大鼠在免疫后第6天开始发病,至第14天达到高峰,表现为双下肢瘫痪,肌力下降,二便失禁;实验组大鼠表现为相对缓慢的起病过程,临床症状也相对较轻,实验组与模型组免疫后6~25 d神经功能评分差异均有统计学意义(P<0.05),见图1,各组大鼠发病和转归情况见表2。
2.2 组织学变化 HE染色显示,对照组大鼠脑和脊髓未发现炎症浸润,而模型组大鼠脑和脊髓均有不同程度的炎症浸润,以血管周围为主,尤其静脉周围明显,呈“袖套状”变化,病症多发性,炎症细胞浸润以脑干最明显,脊髓次之。实验组较模型组脑和脊髓炎症浸润显著减轻,其病灶数和“袖套状”均显著低于模型组。组织学评分,与模型组脑和脊髓组织学评分分别为(3.96±0.93)和(3.06±0.81),实验组脑和脊髓组织学评分分别为(2.59±0.49)和(1.88±0.57)。与模型组比较,实验组在脑和脊髓的炎症细胞浸润明显下降,差异具有统计学意义(t=13.696,P=0.000;t=10.483,P=0.000)。见图2。
表1 各基因引物序列
Tab.1 Primer sequences for target genes

TargetgenesPrimersequencesIFN⁃γUpstreamGAAAGCCTAGAAAGTCTGAATAACDownstreamGCAGCGACTCCTTTTCCGCTTCCTIL⁃17UpstreamCTCAGACTACCTCAACCGTTCCDownstreamAGGATCTCTTGCTGGATGAGAACIL⁃23UpstreamGACCTGCTGGCAATAGCTTCDownstreamGGGTCTCCCAAGGAAAGGTAFoxp3UpstreamTGCATCAGCTCTCCACTGTADownstreamCTGTCTTTCCTGGGTGTACCTGAGCGGAPDHUpstreamAGGTCATCCCAGAGCTGAACGDownstreamCACCCTGTTGCTGTAGCCGTAT
2.3 各组大鼠脊髓及淋巴结CD4+、CD4+/IFN-γ+、CD4+/IL-17+和CD4+/Foxp3+T细胞表达 流式细胞仪检测结果显示,第25天,与正常对照组比较,模型组大鼠脊髓和淋巴结CD4+、CD4+/IFN-γ+、CD4+/IL-17+T细胞数量上调,而CD4+/Foxp3+T细胞数量减少(P<0.05)。与模型组相比,实验组中大鼠脊髓和淋巴结CD4+、CD4+/IFN-γ+、CD4+/IL-17+T细胞数量减少,而CD4+/Foxp3+T细胞数量增多(P<0.05)。见图3。

图1 免疫后各组大鼠平均体重和症状评分变化Fig.1 Changes of average weight and symptom scoring after immunizationNote: *.P<0.05,vs control group;#.P<0.05,vs model group.
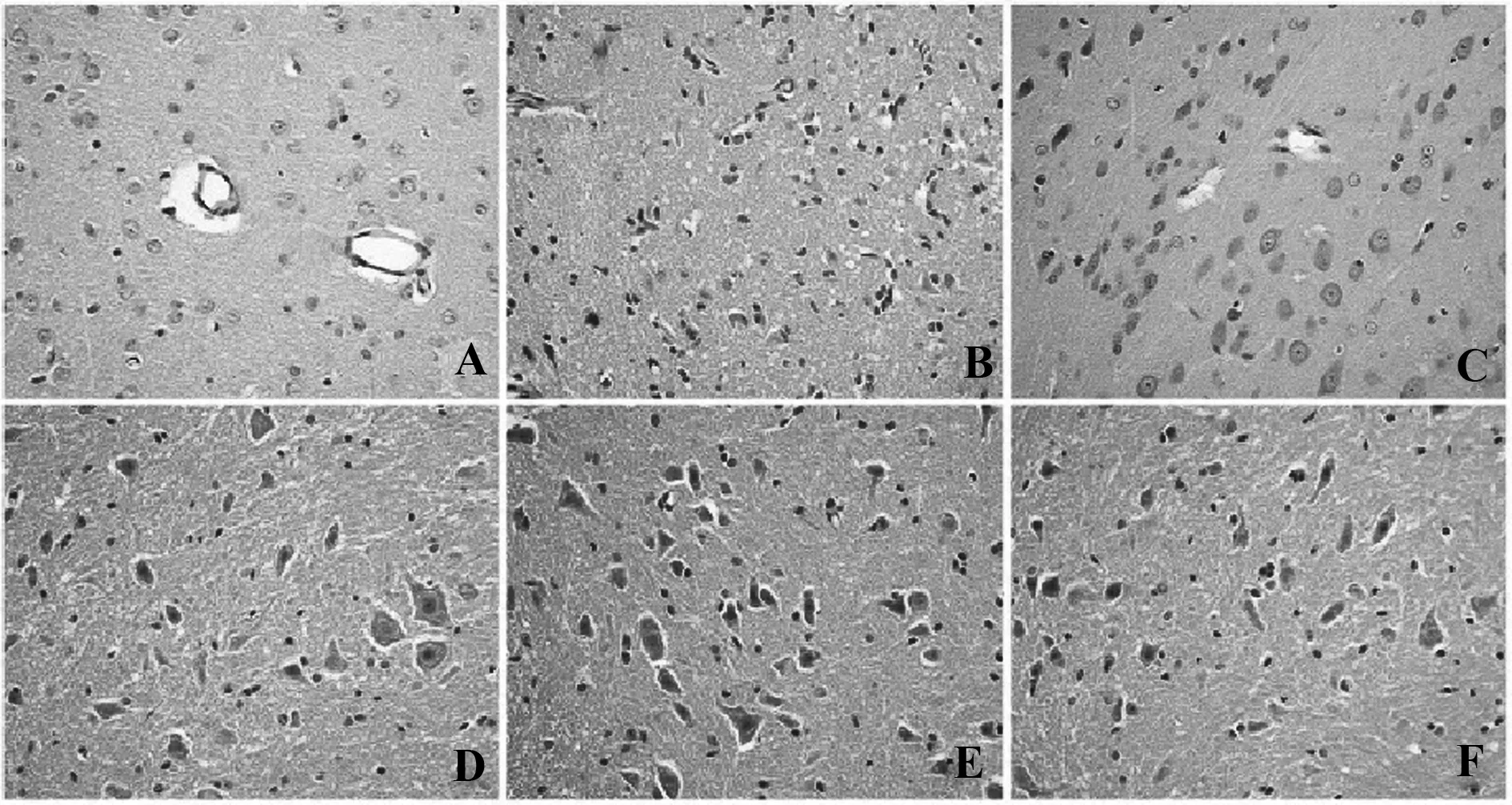
图2 大鼠脑及脊髓组织学观察(HE,×200)Fig.2 HE staining of brain and spinal cord(HE×200)Note: A.Control group of the brain;B.Model group of the brain;C.Test group of the brain;D.Control group of the spinal cord;E.Model group of the spinal cord;F.Test group of the spinal cord.
表2 各组动物发病和转归情况
Tab.2 Incidence and prognosis of rats in all groups

GroupsNumberIncidenceLatency(d)MortalityControlgroup100/1000±000/10Modelgroup1010/1067±071)0/10Testgroup1010/1078±062)0/10
Note:1)P<0.05,vs control group,2)P<0.05,vs model group.
2.4 各组大鼠脊髓及淋巴结IFN-γ、IL-17、IL-23和Foxp3 mRNA表达 q-PCR结果显示,第25天,与正常对照组比较,模型组脊髓和淋巴结IFN-γ、IL-17、IL-23 mRNA表达上调,Foxp3 mRNA表达增高(P<0.05)。而与模型组相比,实验组大鼠脊髓和淋巴结IFN-γ、IL-17、IL-23 mRNA表达下降,而Foxp3 mRNA表达增加(P<0.05)。见图4。
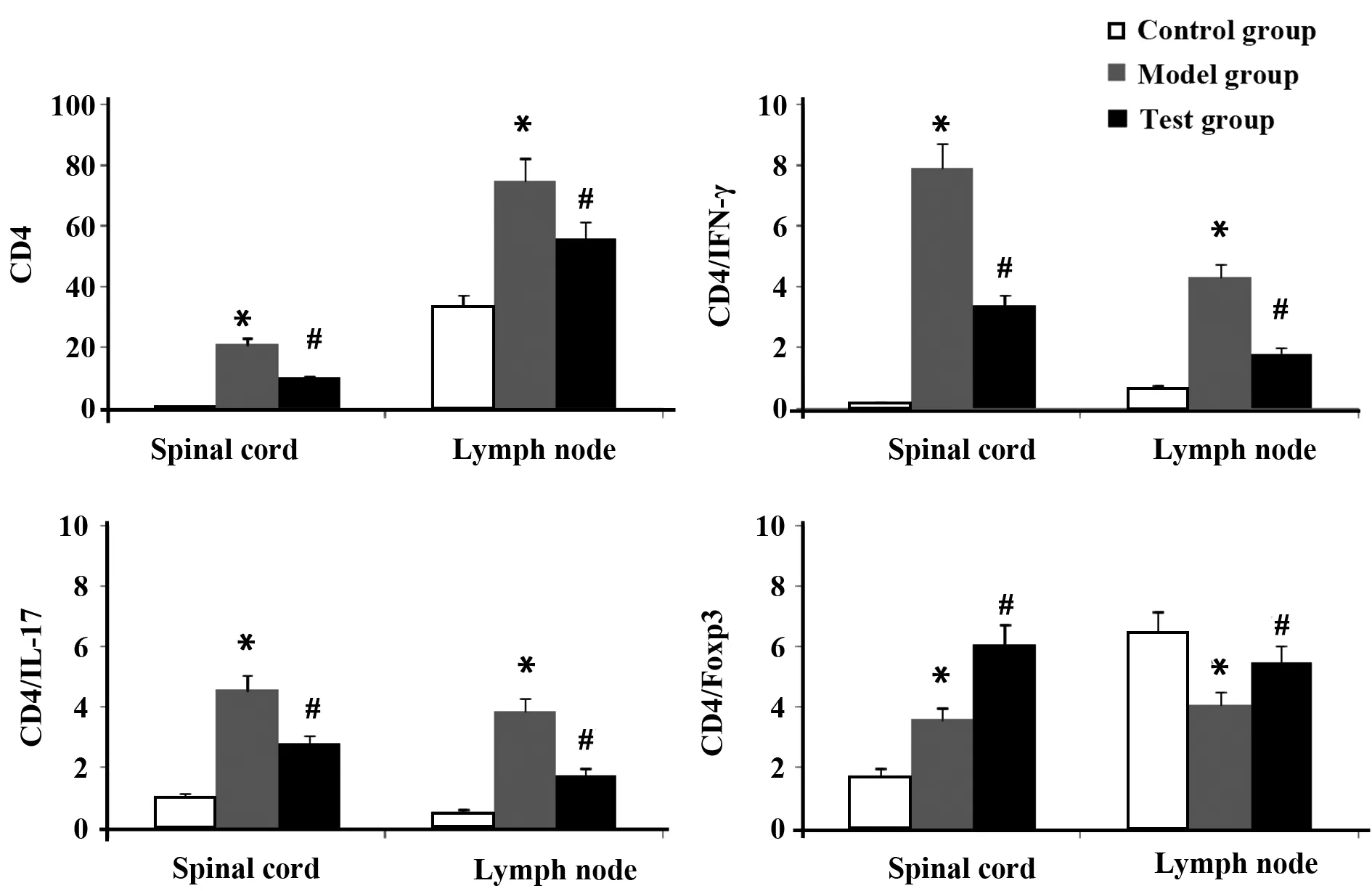
图3 各组大鼠脊髓及淋巴结CD4+、CD4+/IFN-γ+、CD4+/IL-17+和CD4+/Foxp3+ T细胞表达Fig.3 Expression of CD4+,CD4+/IFN-γ+,CD4+/IL-17+ and CD4+/Foxp3+ T cells in spinal cord and lymph nodeNote: *.P<0.05,vs control group;#.P<0.05,vs model group
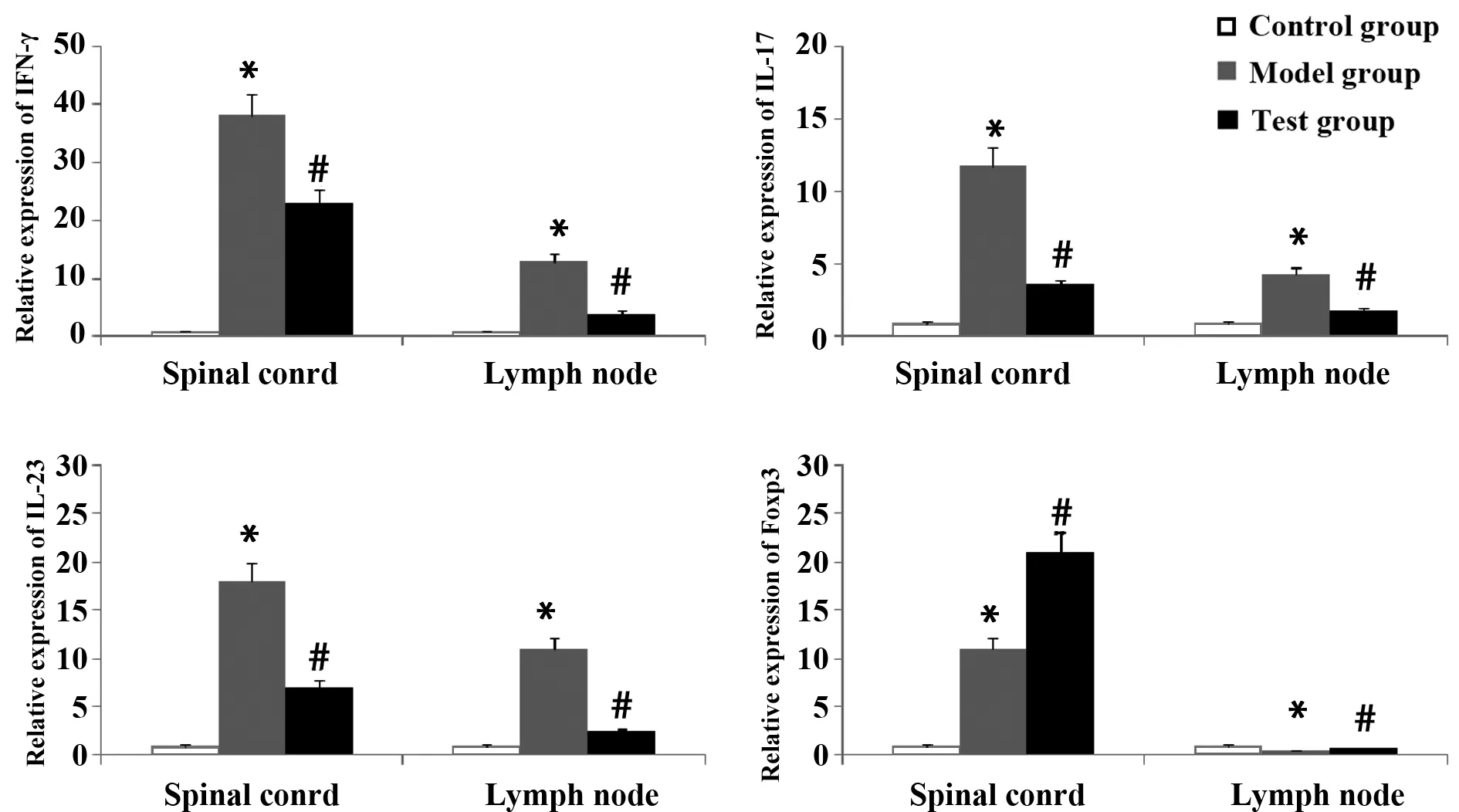
图4 各组大鼠脊髓及淋巴结IFN-γ、IL-17、IL-23和Foxp3 mRNA表达Fig.4 mRNA expression of IFN-γ,IL-17,IL-23 and Foxp3 in spinal cord and lymph nodeNote: *.P<0.05,vs control group;#.P<0.05,vs model group.
3 讨论
EAE中枢神经系统脱髓鞘病变与效应性T细胞过度活化以及炎症细胞在CNS中过度浸润相关,也与炎症细胞因子和介质的高表达密切相关。本实验通过MOG成功诱导大鼠建立的EAE模型,行为学上表现为发病期行动迟缓,步态异常,体重下降,尾巴及肢体瘫痪;病理见脑干以及脊髓炎性细胞浸润和血管“袖套”样改变等,验证了文献报道[8],经KRG预处理后,实验组大鼠体重及症状评分明显改善,且脑干以及脊髓炎性细胞浸润和血管“袖套”样改变也得到明显减轻,炎症细胞数量明显下调,提示KRG可通过抑制CNS中炎性反应从而发挥神经保护作用。
大多数研究认为在EAE的免疫机制中,特异性抗原如MBP诱导CD4+T细胞发生免疫应答,CD4+Th细胞由Th0向Th1、Th2或Th3细胞分化[9,10]。Th1细胞分泌的IFN-γ以及Th17细胞分泌IL-17和IL-23,促进细胞介导的免疫应答,诱导EAE;而Th2细胞主要有IL-4所驱动诱发,主要分泌IL4、IL-10、TGF-13等,促进B细胞增生,增强抗体介导的体液免疫,抑制EAE[11]。IL-17能够刺激多种细胞,诱发炎性细胞分泌细胞因子及化学因子等,IL-17主要由活化的T细胞产生,其致炎性较强,缺失Th17的细胞能够显著缓解一些自身免疫疾病的发生,如EAE等[12]。研究发现,EAE大鼠模型中,IL-17高峰的出现较IFN-γ早;但IFN-γ高峰持续时间较IL-17长,提示Th1及Th17的分化表达的一个主要特点就是阶段性[13]。EAE大鼠早期CNS的发病中Th17细胞发挥着至关重要的作用,而后期组织炎症反应中Th1细胞发挥着至关重要的主导作用[14,15];本实验中,通过KRG预处理后,EAE大鼠CD4+、CD4+/IFN-γ+(Th1)、CD4+/IL-17+(Th17)T细胞数量减少,而CD4+/Foxp3+T细胞数量增多。为了从分子水平验证以上结果,我们通过实时荧光定量PCR检测IFN-γ、IL-17、IL-23和Foxp3 mRNA的表达水平,结果发现,与正常对照组比较,模型组脊髓和淋巴结IFN-γ、IL-17、IL-23 mRNA表达上调,Foxp3 mRNA表达增高,与文献报道相一致[16]。而与模型组相比,大鼠脊髓和淋巴结IFN-γ、IL-17、IL-23 mRNA表达下降,而Foxp3 mRNA表达增加。综上可知,KRG可通过下调IFN-γ、IL-17、IL-23 mRNA表达抑制CD4+/IFN-γ+(Th1)、CD4+/IL-17+(Th17)T细胞的表达,而通过上调Foxp3 mRNA表达增强CD4+/Foxp3+T细胞表达,提示KRG可通过上调Treg数量,调节Th1/Th17细胞比例,从而增强其免疫抑制活性,影响EAE进展,改善实验动物的临床相关症状。
综上所述,高丽参提取液可通过对Th1、Th17、Foxp3基因以及相关细胞因子进行调节,有效降低大鼠EAE的临床症状,改善神经中枢系统的炎症浸润,从而发挥神经保护作用。
[1] Nguyen CT,Luong TT,Lee SY,etal.Panax ginseng aqueous extract prevents pneumococcal sepsis in vivo by potentiating cell survival and diminishing inflammation[J].Phytomedicine,2015,22(11):1055-1061.
[2] Park HR,Lee SE,Yang H,etal.Induction of thioredoxin reductase 1 by Korean red ginseng water extract regulates cytoprotective effects on human endothelial cells[J].Evid Based Complement Alternat Med,2015,2015:972040.
[3] Im EJ,Yayeh T,Park SJ,etal.Antiatherosclerotic effect of korean red ginseng extract involves regulator of g-protein signaling 5[J].Evid Based Complement Alternat Med,2014,2014:985174.
[4] Jung JM,Park SJ,Lee YW,etal.The effects of a standardized acanthopanax koreanum extract on stress-induced behavioral alterations in mice[J].J Ethnopharmacol,2013,148(3):826-834.
[5] Ko HM,Joo SH,Kim P,etal.Effects of Korean red ginseng extract on tissue plasminogen activator and plasminogen activator inhibitor-1 expression in cultured rat primary astrocytes[J].J Ginseng Res,2013,37(4):401-412.
[6] Correa JO,Aarestrup BJ,Aarestrup FM.Effect of thalidomide and pentoxifylline on experimental autoimmune encephalomyelitis[J].Exp Neurol,2010,226(1):15-23.
[7] Yin JX,Tu JL,Lin HJ,etal.Centrally administered pertussis toxin inhibits microglia migration to the spinal cord and prevents dissemination of disease in an EAE mouse model[J].PLoS One,2010,5(8):e12400-e12401.
[8] 尚晓峰,席娜娜,王 潭,等.MOG诱导的实验性自身免疫性脑脊髓炎小鼠中枢及外周神经系统CD4+T及CD8+T调节性细胞变化[J].细胞与分子免疫学杂志,2010,26(8):746-749.
[9] Van Kaer L,Wu L,Parekh VV.Natural killer T cells in multiple sclerosis and its animal model,experimental autoimmune encephalomyelitis[J].Immunology,2015,146(1):1-10.
[10] Robinson AP,Harp CT,Noronha A,etal.The experimental autoimmune encephalomyelitis (EAE) model of MS:utility for understanding disease pathophysiology and treatment[J].Handb Clin Neurol,2014,122:173-89.
[11] Kalinke U,Prinz M.Endogenous,or therapeutically induced,type I interferon responses differentially modulate Th1/Th17-mediated autoimmunity in the CNS[J].Immunol Cell Biol,2012,90(5):505-509.
[12] Chen SJ,Wang YL,Fan HC,etal.Current status of the immunomodulation and immunomediated therapeutic strategies for multiple sclerosis[J].Clin Dev Immunol,2012,2012:970789.
[13] Guo W,Wang C,Wang X,etal.A novel human truncated IL12rβ1-Fc fusion protein ameliorates experimental autoimmune encephalomyelitis via specific binding of p40 to inhibit Th1 and Th17 cell differentiation[J].Oncotarget,2015,6(30):28539-28555.
[14] Miller NM,Wang J,Tan Y,etal.Anti-inflammatory mechanisms of IFN-γ studied in experimental autoimmune encephalomyelitis reveal neutrophils as a potential target in multiple sclerosis[J].Front Neurosci,2015,9:287.
[15] Knier B,Rothhammer V,Heink S,etal.Neutralizing IL-17 protects the optic nerve from autoimmune pathology and prevents retinal nerve fiber layer atrophy during experimental autoimmune encephalomyelitis[J].J Autoimmun,2015,56:34-44.
[16] 姚汉云,文 芳,董新宇.实验性自身免疫性脑脊髓炎小鼠模型视神经炎发病机制:与辅助性T细胞亚群的关系[J].中国组织工程研究杂志,2014,42(18):6763-6768.
[收稿2016-03-24 修回2016-04-28]
(编辑 许四平)
Protective effect of korean red ginseng extract in experimental autoimmune encephalomyelitis rats
GONG Ye-Li ,LI Jia-Nan,HUANG Li-Xia,
Jianghan University,Wuhan 430056 China
Objective:To establish experimental autoimmune cerebral spinal cord inflammation (EAE) model rats,and observe the pathological changes and effect of korean red ginseng extract on EAE model. Methods: 30 SD rats were randomly divided into control group,EAE (model group) group and KRG group.The EAR symptom score and body weight were used to evaluate the rats after the model.The inflammation of the brain and spinal cord demyelinating changes were observed by HE staining.The frequency of CD4+,CD4+/IFN-γ+,CD4+/IL-17+and CD4+/Foxp3+T cells were measured by flow cytometry,and the expression of Foxp3,IFN-γ,IL-17 and IL-23 mRNA were evaluated by Real time-PCR in spinal cord and lymph node. Results: KRGE significantly attenuated symptom score and loss of body weight.Compared with model group,neurological impairment and pathological change were alleviated in KRG group.The number of CD4+,CD4+/IFN-γ+,CD4+/IL-17+were down-regulated in KRG,and the number of CD4+/Foxp3+was up-regulated in the spinal cord and lymph node compared with the model group(P<0.05).The levels of Foxp3 mRNA was also significantly increased,while the levels of IFN-γ,IL-17,IL-23 mRNA were markedly decreased(P<0.05). Conclusion: KRG could have an effect on prevention on EAE in SD rats,may be related to its ability to the regulations the expression levels of CD4+,CD4+/IFN-γ+,CD4+/IL-17+and CD4+/Foxp3+.
Korean red ginseng extract;Experimental autoimmune encephalomyelitis;Interleukin-17;Interleukin-23
10.3969/j.issn.1000-484X.2016.11.014
①本文受国家自然科学基金青年项目(81302528)和武汉市青年科技晨光计划项目(2015071704011601)资助。
龚业莉(1985年-),女,博士,讲师,主要从事自身免疫病研究,E-mail:lilygreen66@163.com。
R285.5
A
1000-484X(2016)11-1632-04
②通讯作者,E-mail:hlxgw2011@163.com。
