二氢槲皮素与二氢杨梅素的抗肿瘤活性对比①
2016-12-26王佳奇宋明铭王月亮黄宝亮丁传波郑毅男刘文丛
王佳奇 宋明铭 陈 凯 王月亮 黄宝亮 丁传波 郑毅男 刘文丛
(吉林农业大学 中药材学院,长春130118)
·生物治疗·
二氢槲皮素与二氢杨梅素的抗肿瘤活性对比①
王佳奇 宋明铭 陈 凯 王月亮 黄宝亮 丁传波 郑毅男 刘文丛
(吉林农业大学 中药材学院,长春130118)
目的:研究二氢槲皮素和二氢杨梅素对H22荷瘤小鼠抑瘤作用。方法:建立小鼠H22移植性肿瘤模型(除空白外)。造模24 h后分成6组:模型组,阳性对照组(环磷酰胺25 mg/kg),二氢槲皮素和二氢杨梅素高、低剂量组(30、10 mg/kg),除阳性对照组腹腔给药,其余各组均灌胃给药,测定其对H22荷瘤小鼠抑瘤率、免疫器官指数、生化指标和细胞因子含量的影响,并通过HE染色,观察瘤组织内坏死程度。结果:二氢槲皮素和二氢杨梅素高、低剂量组(30 mg/kg、10 mg/kg)均对肿瘤具有一定抑制作用,且均可提高H22荷瘤小鼠胸腺指数和脾指数,其中二氢槲皮素高剂量组(30 mg/kg)抑瘤效果最佳,其抑瘤率为58.8%。二氢槲皮素和二氢杨梅素高、低剂量组均可升高H22荷瘤小鼠细胞因子白细胞介素-2(IL-2)和肿瘤坏死因子-α(TNF-α)的水平,升高超氧化物歧化酶(SOD)的水平,降低丙二醛(MDA)水平。此外,二氢槲皮素和二氢杨梅素高、低剂量组对H22荷瘤小鼠肝肾功能没有毒理作用。结论:二氢槲皮素和二氢杨梅素高、低剂量组均对肿瘤具有一定抑制作用,其中二氢槲皮素组的作用较明显,且呈剂量依赖性,其作用机制可能与增强抗氧化能力、提高机体免疫功能和升高细胞因子水平有关。
二氢槲皮素;二氢杨梅素;抗肿瘤
二氢槲皮素(Dihydroquercetin)的化学式为 C15H12O7,分子量为304.25,又名紫杉叶素、黄杉素、花旗松素。二氢槲皮素是作为高档食品的原材料,主要来自松科植物如落叶松、花旗松等植物中。二氢槲皮素为白色粉末,不溶于水,易溶于乙醇甲醇等有机溶剂。二氢杨梅素(Dihydromyricetin)的化学式为C15H12O8,分子量为320.25,又名双氢杨梅树皮素、福建茶素、白蔽素、二氢杨梅黄酮。主要来源于藤茶中,具有极高的抗氧化和清除氧自由基活性。二氢杨梅素为白色针状结晶,25 ℃水中溶解度为 4%,热水中溶解度更大;易溶于乙醇及丙酮,极微溶于醋酸乙酯。
二氢槲皮素和二氢杨梅素是两种典型的类黄酮化合物,它们有相似的母体结构,其差别仅为B环5′位上是否存在酚羟基。它们的结构如图1所示:
类黄酮化合物(Flavonoids)是一类植物次级代谢产物,广泛存在于蔬菜、水果和药用植物中,是一类天然抗氧化剂,其色泽因多呈黄色而被称为类黄酮[1]。因其生物学功能,比如抗氧化性[2-5]、抗炎[6-8]、抗菌[9-12]、抗癌[11-14]、护肝[15,16]等在医药、食品工业领域得到广泛的开发和利用。国内研究表明,黄酮类化合物已成为新的抗肿瘤研究热点,目前已发现多种植物中黄酮类成分有抗肿瘤活性,如鸡血藤黄酮类成分可抑制乳腺癌细胞生长[17],木瓜总黄酮对死亡因子(PD)-1与其配体(PD-L1)的结合有抑制作用,使肿瘤细胞表面PD-L1的表达降低而促进机体对肿瘤的免疫应答,达到抑制肿瘤细胞生长的作用[18]。万寿菊茎叶中两种黄酮类化合物4′-甲氧基-泽兰素3-O-β-D-葡萄糖苷和山奈酚-3,7-O-α-L-双鼠李糖苷均可抑制人胃癌细胞SGC7901和人肝癌细胞SMMC7721的增殖,且呈现浓度与时间依赖性[19]。二氢槲皮素对体外人宫颈癌细胞(Hela)[20]、人胃癌细胞(MGC)、人盲肠癌细胞(Hce-8693)及人肝癌细胞(HepG-2)[21]均有抑制作用。二氢杨梅素对人肺癌A549细胞、人肝癌细胞(HepG-2)、人乳腺癌细胞MCF-7和MDA-MB-231有较强的抑制作用[22-24]。一般抗肿瘤的药物都能够增强机体免疫功能,清除自由基,分化癌细胞起到抗肿瘤的作用,且毒性较低。本文选用H22肝癌细胞为研究对象,建立荷H22肝癌移植瘤小鼠模型,将对两种类黄酮化合物二氢槲皮素和二氢杨梅素的抗肿瘤活性进行对比,以免疫器官胸腺及脾指数,细胞因子IL-2和TNF-α的含量为指标研究两种化合物对机体免疫功能的影响;以SOD含量和MDA水平为指标研究两种化合物对机体内自由基的影响;以ALT、AST、GRE和BUN为指标,研究了两种化合物对机体肝肾功能的影响,判定其毒性。
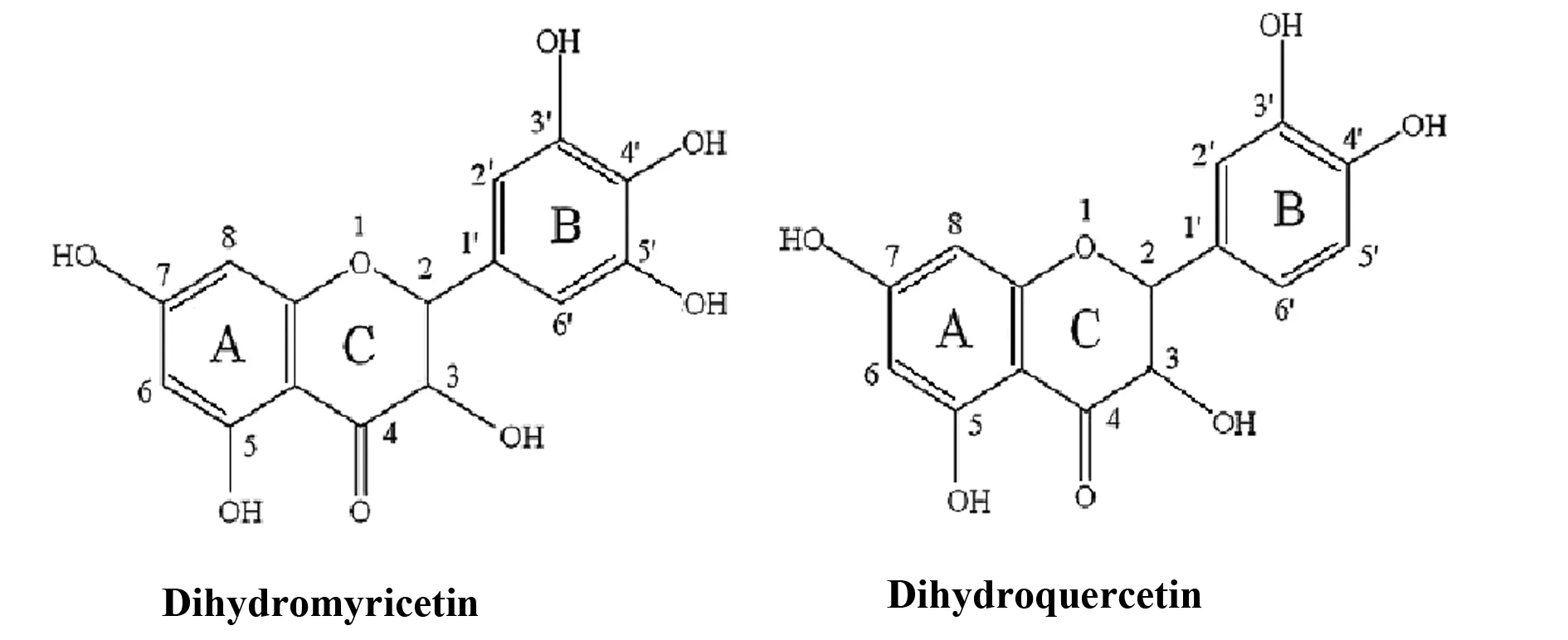
图1 二氢槲皮素和二氢杨梅素的结果示意图Fig.1 Structure sketch map of Dihydromyricetin and Dihydroquercetin
1 材料与方法
1.1 材料
1.1.1 药品与试剂 二氢槲皮素(Dihydroquer-cetin,as known as taxifolin,TF)、HPLC>97%、蒸馏水实验室自制;二氢杨梅素(Dihydromyricetin,DMY),HPLC>98%,西安开来生物工程有限公司;环磷酰胺,上海华联制药有限公司;H22肝癌细胞株,中国科学院上海生命科学研究院细胞库;羧甲基纤维素钠(CMC-Na),天津市科密欧化学试剂开发中心;肌酐(CRE)、血尿素氮(BUN)、谷氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、丙二醛(MDA)、超氧化物歧化酶(SOD)考马斯亮蓝蛋白测定试剂盒,南京建成生物工程研究所。
1.1.2 主要实验仪器 电子天平[梅特勒-托利多仪器(上海)有限公司];磁力搅拌器(江苏金坛市金城国胜实验仪器厂);电热恒温水浴锅(金坛市医疗仪器厂);TGL-20B高速台式离心机(上海安亭科学仪器厂);超低温冰箱(Haier);倒置显微镜(Olympus);全自动酶标仪(美国Bio-Tek公司)。
1.1.3 实验动物 SPF级雄性ICR小鼠,体质量(20±2) g,动物合格证号:SCXK(吉)2011-0004,购自长春亿斯实验动物技术有限公司。
1.2 方法
1.2.1 造模方法 复苏H22小鼠荷瘤细胞,取0.2 ml细胞悬液注射到雄性ICR小鼠腹腔内,进行传代。取腹腔接种7~9 d生长良好的H22肿瘤小鼠脱臼处死用75%乙醇全身消毒后,均在无菌条件下抽取小鼠腹水,置于盛有生理盐水的带塞试管中,混匀,1 000 r/min,离心3 min,弃去上清液,用生理盐水洗涤3次再用生理盐水调整细胞数为1.0×107个/ml的瘤细胞悬液,于ICR小鼠右前肢皮下接种0.2 ml 。
1.2.2 分组及给药 小鼠接种 24 h 后将种瘤成功小鼠随机分为6组(根据体重,将不同体重分开,然后随机分配),即:模型组(0.9%生理盐水)(Model control,MC),阳性对照组(环磷酰胺,25 mg/kg)(Positive control,PC),二氢槲皮素高、低剂量组(30 mg/kg,10 mg/kg),二氢杨梅素高、低剂量组(30 mg/kg,10 mg/kg)。每组10只,于分组第2天,除阳相对照组腹腔注射给药,其余各组灌胃给予相应的药物,空白对照组(未接瘤)(Normal control,NC)灌胃0.9%生理盐水,连续给药21 d,每日1次,给药体积均为0.1 ml/10 kg。
1.2.3 抑瘤率测定 末次给药后24 h,称体重,摘眼球取血,脱颈椎处死小鼠,用镊子镊住小鼠右肩肿瘤生长部位皮肤后,用手术剪子剪开皮肤,暴露肿瘤,用手术剪钝性剥离肿瘤,用滤纸吸干后用电子天平称瘤重,计算抑瘤率。抑瘤率( %) =(对照组平均瘤质量-实验组平均瘤质量)÷对照组平均瘤质量×100 %。
1.2.4 脏器指数 小鼠处死后,取出肝、脾、胸腺后,用0.9%生理盐水清除残血,用滤纸吸干后用电子天平称重,脏器指数计算公式如下:脏器指数=脏器重量/末次给药后体重。
1.2.5 生化指标检测 将小鼠血液室温静置2 h后,3 500 r/min离心10 min,分离血清放于-20℃备用。将小鼠肝脏约按1∶10加入冷的0.9%生理盐水,在冰浴上用组织匀浆机匀浆,匀浆液4 000 r/min离心10 min,上清液分装于-20℃保存备用。
1.2.5.1 肾功能和肝功能指标测定 通过测定血清肾功能指标如尿素氮(BUN)和肌酐(CRE),肝功能指标ALT和AST,检查二氢槲皮素和二氢杨梅素对肾和肝脏的潜在毒性。
1.2.5.2 肝组织中SOD活力和MDA含量的测定 MDA含量检测用硫代巴比妥酸(TBA)法,SOD活力检测用黄嘌呤氧化酶法,具体操作按试剂盒要求。
1.2.5.3 血清中TNF-α、IL-2含量测定 IL-2、TNF-α测定采用ELISA酶联免疫检测法,操作步骤按试剂盒说明进行。加入终止液后,轻轻混匀,在酶标仪上450 nm处读取吸收值OD,按标准品曲线,计算样品的IL-2和TNF-α含量。
1.2.6 病理形态学观察 切取小鼠瘤组织,10%甲醛固定,常规HE染色,观察病理改变。

2 结果
2.1 二氢槲皮素和二氢杨梅素对H22荷瘤小鼠的抑瘤作用 结果如表1所示,二氢槲皮素与二氢杨梅素高、低剂量组对肿瘤均具有一定抑制作用,虽然二氢槲皮素和二氢杨梅素低剂量组抑瘤率均大于20%,但与模型组相比没有显著性,二氢槲皮素高剂量组的抑瘤效果最佳,其抑瘤率为58.80%。二氢槲皮素高、低剂量组与二氢杨梅素高、低剂量组之间没有显著性差异。
2.2 二氢槲皮素和二氢杨梅素对H22荷瘤小鼠免疫器官的影响 从表2可以看出,与空白对照组相比,模型组的胸腺指数和脾指数均显著降低。与模型组相比,二氢槲皮素和二氢杨梅素高、低剂量组的脾指数均有不同程度的升高,且均具有统计学意义(P<0.01);二氢槲皮素和二氢杨梅素高、低剂量组的胸腺指数均有不同程度的升高,且二氢杨梅素高、低剂量组具有统计学差异(P<0.01)。与阳性对照组相比,二氢槲皮素和二氢杨梅素高、低剂量组的脾指数和胸腺指数均具有统计学意义。结果表明,二氢槲皮素和二氢杨梅素高、低剂量组均对H22荷瘤小鼠免疫器官有一定的保护作用,二氢槲皮素高、低剂量组与二氢杨梅素高、低剂量组无显著性差异。
2.3 二氢槲皮素和二氢杨梅素对H22荷瘤小鼠细胞因子的影响 如表3所示,与空白组比较,模型组血清中IL-2和TNF-α表达水平都显著降低;与模型组相比,IL-2和TNF-α的表达水平在二氢槲皮素高、低剂量组和二氢杨梅素高、低剂量组均高于模型组。与阳性对照组相比,二氢槲皮素低剂量组和二氢杨梅素高、低剂量组IL-2表达水平均显著升高,二氢槲皮素高剂量组TNF-α表达水平具有统计学意义。所有的数据表明,二氢槲皮素和二氢杨梅素可能是通过促进细胞因子分泌发挥抗肿瘤作用。
表1 二氢槲皮素和二氢杨梅素对H22荷瘤小鼠的抑瘤作用
Tab.1 Inhibitory effect of Dihydroquercetin and Dihydromyricetin on growth of transplanted H22tumor cells in mice

GroupsDosage(mg/kg)Tumorweight(g)Inhibitoryrate(%)MC-227±099-PC25068±0242)6972%TF10154±0793284%30094±0552)5880%DMY10178±1102185%30123±0951)4582%
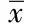
表2 二氢槲皮素和二氢杨梅素对H22荷瘤小鼠免疫器官的影响
Tab.2 Effect of Dihydroquercetin and Dihydromyricetin on immune organ index of transplanted H22mice

GroupsDosage(mg/kg)Spleenindex(mg/g)Thymusindex(mg/g)MC-43±06024±009PC-36±0053)19±0082)TF2520±0041)13±0121)1041±0031)4)21±0051)4)DMY3044±0121)4)24±0071)4)1040±0071)4)20±0064)MC3043±0101)4)22±0081)4)
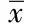
表3 二氢槲皮素和二氢杨梅素对H22荷瘤小鼠细胞因子影响
Tab.3 Effect of Dihydroquercetin and Dihydromyricetin on serum cytokines(IL-2 and TNF-α) levels of transplanted H22mice

GroupsDosage(mg/kg)TNF⁃α(pg/ml)IL⁃2(pg/ml)MC-14032±15117108±1076PC-12259±10761)3927±5952)TF2515797±15874)5360±1714)1016305±19094)6299±6884)5)DMY3017260±14214)5)6562±2874)6)1015576±10444)4957±2493)MC3016865±14324)6305±3624)5)
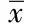
2.4 二氢槲皮素和二氢杨梅素对H22荷瘤小鼠SOD和MDA含量的影响 如表4所示,模型组小鼠肝脏组织中SOD活性与空白对照组相比显著降低(P<0.01);与模型组相比,二氢槲皮素高、低剂量组和二氢杨梅素高、低剂量组均能显著提高肝脏组织中SOD活性(P<0.01);二氢槲皮素高剂量组和二氢杨梅素高低剂量组与二氢槲皮素低剂量组相比均具有极显著性差异(P<0.01)。与阳性对照组相比二氢槲皮素高、低剂量组和二氢杨梅素高、低剂量组均能显著升高肝脏组织中SOD活性。与空白对照组相比模型组小鼠肝脏组织中MDA水平显著升高(P<0.01);与模型组相比,二氢槲皮素高、低剂量组和二氢杨梅素高、低剂量组均能显著降低肝脏组织中MDA水平(P<0.01);二氢槲皮素低剂量组和二氢杨梅素高、低剂量组与二氢槲皮素高剂量组相比均有显著性差异。
表4 二氢槲皮素和二氢杨梅素对H22荷瘤小鼠SOD和MDA含量的影响
Tab.4 Effect of Dihydroquercetin and Dihydromyricetin on SOD and MDA levels of transplanted H22mice

GroupsDosage(mg/kg)SODMDAMC-21695±17571033±111PC-12478±15064)1488±0924)TF2515998±8154)828±0804)1021517±7944)5)1120±0634)5)DMY3024263±18614)5)971±0514)5)1021055±14404)5)1124±0744)5)MC3022220±6924)5)1028±0614)5)
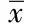
2.5 二氢槲皮素和二氢杨梅素对H22荷瘤小鼠肝肾功能的影响 如表5所示,模型组小鼠血清中BUN,CRE含量与空白对照组相比显著升高(P<0.01),AST,ALT含量显著降低;与模型组相比,二氢槲皮素高、低剂量组和二氢杨梅素高、低剂量组均能降低血清中BUN、CRE含量,升高AST、ALT含量。与阳性对照组相比,二氢槲皮素高、低剂量组和二氢杨梅素低剂量组血清中BUN、CRE、AST和ALT含量均有显著差异。在二氢槲皮素和二氢杨梅素治疗后,肾功能和肝功能指标均可恢复,表明二氢槲皮素和二氢杨梅素对H22荷瘤小鼠的肝肾功能无毒副作用。
2.6 肿瘤组织的HE染色 通过HE染色(图2)后的肿瘤细胞组织学形态显示:模型组(图2A)肿瘤细胞异型性明显,生长旺盛,并且肿瘤组织中没有或只有少量坏死;阳性对照组(图2B)肿瘤组织内微血管密度低,并出现大片固缩性坏死区域;二氢槲皮素低剂量组(图2C)和二氢杨梅素低剂量组(图2E)中细胞发生明显形态学变化,细胞变小,皱缩,染色质凝集,细胞出现片状坏死等凋亡征象。
表5 二氢槲皮素和二氢杨梅素对H22荷瘤小鼠肝肾功能的影响
Tab.5 Effect of Dihydroquercetin and Dihydromyricetin on liver and renal function indexes of transplanted H22mice

GroupsDosage(mg/kg)CRE(μmol/L)BUN(mmol/L)GPT(U/L)GOT(U/L)MC-1267±083770±0394050±1866701±062PC-1756±1891)1032±0551)3175±0841)5042±026TF251363±0432)931±0302)3060±1764789±130101255±0822)3)816±0362)4)4116±0952)4)6695±1292)4)DMY301264±1062)3)770±0182)4)4503±0892)4)7252±0882)4)101205±0802)4)791±0652)4)4024±0862)4)6685±1552)4)MC301350±0622)795±0332)4)4199±1262)4)7125±1332)4)
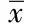

图2 肿瘤组织HE染色(×200)Fig.2 HE staining of tumor tissue (×200)Note: A.Model control;B.Positive control;C.TF(10 mg/kg Dihydroquercetin);D.TF(30 mg/kg Dihydroquercetin);E.DMY(10 mg/kg Dihydromyricetin);F.DMY(30 mg/kg Dihydromyri-cetin).
3 讨论
目前已经发现,在中药和许多植物中含有许多能抑制肿瘤生长的活性成分,分析和改造这些活性成分可为开发新的抗肿瘤药物提供重要来源[25]。国内研究表明,黄酮类化合物已成为新的抗肿瘤研究热点。二氢槲皮素和二氢杨梅素是两种典型的类黄酮化合物,本实验对二氢槲皮素和二氢杨梅素的抗肿瘤活性进行了对比研究,其中二氢槲皮素高剂量组的作用较明显,其抑制率高达58.8%。所以可以判断二氢槲皮素高剂量组是最为合适的抗肿瘤剂量。
目前,化疗通常作为一种治疗肿瘤的主要措施。然而适当的剂量在整个过程中可能会引起严重的不良影响,如骨髓抑制、肝肾功能紊乱、免疫功能降低等[26]。这可能会限制适当的剂量,从而降低治疗效果。作为肿瘤的发展,肿瘤衍生的因素也可能对宿主的免疫系统产生不利的影响[27]。因此机体的免疫功能状态与肿瘤的发生、发展、转移具有密切的联系,在治疗肿瘤的同时如何激发机体自身的抗肿瘤免疫反应引起了广泛的研究[28-30]。胸腺和脾脏作为机体重要的免疫器官,其指数常用于免疫效果的评价[31]。本试验中二氢槲皮素和二氢杨梅素各剂量与环磷酰胺组相比,在一定程度上提高了荷瘤小鼠的脾脏指数和胸腺指数,说明二氢槲皮素和二氢杨梅素均具有延缓荷瘤小鼠免疫器官衰退的作用。
IL-2和TNF-α是机体免疫网络中具有重要调节作用的细胞因子,在抗肿瘤方面发挥着重要作用。黄酮类化合物的抗肿瘤作用机制可能与促进淋巴细胞增殖及诱导IFN-γ和TNF-α等产生有关[32]。本实验观察了二氢槲皮素和二氢杨梅素对血清IL-2和 TNF-α 水平的影响。结果表明,二氢槲皮素高、低剂量组和二氢杨梅素高、低剂量组均可不同程度地提高荷瘤小鼠血清 IL-2 和 TNF-α水平。因此推测二氢槲皮素和二氢杨梅素通过诱导 IL-2、 TNF-α免疫相关因子的产生,调节或增强机体的免疫功能,从而阻遏肿瘤的发展。
自由基与肿瘤的发生、发展有一定的关系[33,34]。在正常生理状态下,机体代谢过程中产生的自由基可被抗氧化系统所清除。当自由基的产生与消除失衡时,过多的自由基可直接损伤 DNA,也可通过脂质过氧化作用间接损伤 DNA, 最终引起癌变。SOD是体内重要的抗氧化酶,对机体氧化和抗氧化平衡起着至关重要的作用。MDA是脂质过氧化代谢的毒性终产物,其含量直接反映体内脂质过氧化的速率和强度。本实验结果显示,二氢槲皮素和二氢杨梅素可以提高机体SOD活性,降低MDA的量,提示二氢槲皮素和二氢杨梅素可提高机体的抗氧化能力,以清除体内过多产生的自由基,进而保护DNA。一个好的化疗药物不仅包括抑制恶性肿瘤的生长,而且对它们正常的器官要具有最小的毒性。
本实验检测了肾功能指标如尿素氮(BUN)和肌酐(CR),肝功能指标包括谷丙转氨酶(ALT)和谷草转氨酶(AST)。结果表明,与模型组相比,二氢槲皮素高、低剂量组和二氢杨梅素高、低剂量组均能降低荷瘤小鼠血清中BUN、CR,提高肝脏中ALT、AST的水平。与阳性对照组相比,二氢槲皮素高、低剂量组和二氢杨梅素高、低剂量组血清中BUN,CRE,AST和ALT含量均有统计学意义。在二氢槲皮素和二氢杨梅素治疗后,肾功能和肝功能指标均可恢复,表明二氢槲皮素和二氢杨梅素对H22荷瘤小鼠的肝肾功能无毒副作用。
综上所述,二氢槲皮素和二氢杨梅素均具有一定的抗肿瘤作用,其中二氢槲皮素组的作用较明显,且呈剂量依赖性,其作用机制可能与抑制肿瘤的生长、提高宿主免疫功能、调节细胞因子水平和抗氧化有关。
[1] Burda.S,Oleszek J.Antioxidant and antiradical activities of flavonids[J].J Agr Food Chem,2001,49(6):2774-2779.
[2] 陈效忠,常 鑫,吕红梅,等.水飞蓟茎叶中具有抗氧化活性的黄酮类化学成分研究[J].黑龙江医药科学,2015,38(4):35-36.
[3] 罗宇倩,郭 辉,胡林福,等.竹叶黄酮的抗氧化活性研究[J].食品科技,2011,36(7):201-203.
[4] 李鹏婧,柳旭光,龙海荣,等.超声波辅助提取菱角壳总黄酮及抗氧化性研究[J].食品科技,2011,36(7):167-171.
[5] 王毅红,方玉梅,谭 萍,等.车前草黄酮类化合物清除DPPH自由基的作用[J].贵州农业科学,2010,38(8):50-52.
[6] 张蓓蓓,陈 岩,贲培玲,等.滁菊总黄酮的抗炎作用及部分机制研究[J].齐齐哈尔医学院学报,2015,36(17):2497-2499.
[7] 魏荷琳,曾邦国,肖隆祥,等.三叉苦叶中三个黄酮类化合物的体外抗炎活性研究[J].产业与科技论坛,2015,14(12):46-47.
[8] 侯晓丽,孙铭学,高焕焕,等.抗炎天然产物活性成分研究进展[J].药学实践杂志,2015,33(1):20-27.
[9] 王亚男,柳秉润,邓旭明,等.芦丁对金黄色葡萄球菌Sortase A 的抑制作用[J].吉林农业大学学报,2013,35(3):303-307.
[10] 张金杰,吕文文,翁远超,等.野菊花中黄酮类成分的抗菌活性及指纹图谱[J].国际药学研究杂志,2013,40(6):807-812.
[11] Bo Ra K,Young KJ,Myeong JN.A mechanism of apigenin-induced apoptosis is potentially related to anti-angiogenesis and anti-migration in human hepatocellular carcinoma cells [J].Food Chem Toxicol,2011,49(7):1626-1632.
[12] 王秋兰,高晓民,张 煦.白花蛇舌草总黄酮对BGC-823胃癌细胞增殖和凋亡的影响[J].现代中西医结合杂志,2015,24(21):2289-2292.
[13] Mou HB,Zheng Y,Zhao P,etal.Celatrol induces apoptosis in non-small-cell lung cancer A549 cells through activation of mitochondria and Fas/FasL-mediated pathways[J].Toxicol Vitro,2011,25(5):1027-1032.
[14] Wu JH,Wang YR,Huang WY,etal.Anti-proliferative and pro-apoptotic effects of tectorgenin on hepatic stellate cells[J].World J Gastroenterol,2010,16(31):3911-3918.
[15] Ilkay Erdogan Orhan,Bilge Sener,Syed Ghulam Mushar-raf.Antioxidant and hepatoprotective activity appraisal of four selected Fumaria species and their total phenol and flavonoid quantities[J].Exp Toxicolog Pathol,2012,64(3):208-209.
[16] 王 燕.玉米须总黄酮对四氯化碳诱使肝损伤的保护作用研究[J].现代中药研究与实践,2015,29(3):33-36.
[17] 南 楠,张甘霖,于明薇,等.鸡血藤黄酮类提取物SSCE安全性及抗肿瘤作用的研究[J].辽宁中医杂志,2014,41(3):580-582.
[18] 刘爱华,田慧群,覃晓琳,等.木瓜总黄酮抗肿瘤活性研究[J].中国药房,2014,25(7):599-601.
[19] 张 宇,曲佐寅,刘立新,等.万寿菊茎叶中2种黄酮类化合物的体外抗肿瘤活性[J].中国实验方剂学杂志,2013,19(13):233-237.
[20] 翟延君,程 飞,王添敏,等.花旗松素对人宫颈癌Hela细胞的体外抗肿瘤活性及其机理研究[J].中成药,2011,33(12):2052-2055.
[21] 翟延君,佟苗苗,程 飞,等.花旗松素和3,3′-二甲氧基鞣花酸-4-O-β-D-吡喃葡萄糖苷对肿瘤细胞的增殖的抑制作用[J].中成药,2012,34(2):217-220.
[22] 李 雪,赵明智,郭瑞霞.花旗松素对人肺癌细胞A549增殖的抑制作用及其机制研究[J].现代药物与临床,2015,30(3):249-252..
[23] Zhang QY,Liu J,Liu B,etal.Dihydromyricetin promotes hepatocellular carcinoma regression via a p53 activationdependent mechanism[J].Sci Rep,2014,doi:10.1038/srep04628.
[24] Zhou Y,Shu F,Liang X,etal.Ampelopsin induces cell growth inhibition and apoptosis in breast cancer cells through ros generation and endoplasmic reticulum stress pathway[J].PLoS One,2014,9(2):e89021.
[25] Lee KH.Novel antitumor agents from higher plangts[J].Med Res Rev,1999,19(6):569-596.
[26] Zhai Q,Li X,Yang Y,etal.Antitumor activity of a polysaccharide fraction from Laminaria japonica on U14 cervical carcinoma-bearing mice[J].Tumour Bio,2014,35(1):117-122.
[27] Frey AB,Monu N.Signaling defects in antitumor T cells[J].Immunol Rev,2008,222:192-205.
[28] Tsai JP,Chen HW,Cheng ML,etal.Analysis of host versus tumor interaction in cancer patients:Opposing role of transforming growth factor-beta 1 and interleukin-6 in the development of in situ tumor immunity [J].Immunobiol,2005,210(9):661-671.
[29] 张 丹,孙玉红,李 茂,等.美洲大蠊多肽提取物对荷瘤小鼠肿瘤生长及免疫功能的影响[J].中国新药杂志,2015,24(6):681-686
[30] 杨歆睿,王 刚,吉立宾,等.雪灵芝提取物对H22肝癌荷瘤小鼠免疫功能的影响[J].肿瘤防治研究,2015,42(7):662-665.
[31] Xiong Q,Jiao Y,Zhao X,etal.Purification,characterization and immunostimul-atory activity of polysaccharide from Cipangop-aludina chinensis[J].Carbohydrate Polymers,2013,98(1):217- 223.
[32] Aljanci I,Stankovi M,Tesevi V,etal.Protective effect on human lymphocytes of some flavonoids isolated from two Achillea species[J].Nat Prod Commun,2010,5(5):729-732.
[33] Jakhar R,Paul S,Pard YR,etal.3,5,7,3′,4′-Pentamethoxyflavone,a quercetin derivative protects DNA from oxidative challenges:potential mechanism of action[J].J Photochem Photobiol B,2014,131:96-103.
[34] 李富华,刘 冬,明 建.苦荞麸皮黄酮抗氧化及抗肿瘤研究[J].食品科学,2014,35(7):58-63.
[收稿2016-03-03 修回2016-03-17]
(编辑 许四平)
Antitumor activity of Dihydroquercetin and Dihydromyricetin
WANG Jia-Qi,SONG Ming-Ming,CHEN Kai,WANG Yue-Liang,HUANG Bao-Liang,DING Chuan-Bo,ZHENG Yi-Nan,LIU Wen-Cong.
College of Traditional Chinese Medicine,Jilin Agricultural University,Changchun 130118,China
Objective:To investigate the antitumor effect of Dihydroquercetin and Dihydromyricetin on H22-bearing mice (in addition to blank).Methods: To establish the H22implanted hepato-cellular carcinoma animal model which was used to analyze the effect of Dihydroquercetin and Dihydromyricetin on the growth of transplanted tumor.Mice were divided into six groups 24 h after modeling:model,positive control (gytoxan,25 mg/kg),low-,high-dose(10,30 mg/kg) Dihydroquercetin and Dihydromyricetin groups.In addition to the positive control group were administered,the other groups were administered orally,the effects of H22on tumor inhibition rate,immune organ index,biochemical index and factor in tumor bearing mice were determined.The degree of necrosis in tumor tissue was observed by Hematoxylin and Eosin (HE).Results: Both low(10 mg/kg) and high(30 mg/kg) doses of Dihydroquercetin and Dihydromyricetin inhibited tumor growth,could increase the thymus index and spleen index of H22tumor-beating mice.The inhibitory effect was most pronounced (58.8%) with high doses of Dihydroquercetin.Both low and high doses of Dihydroquercetin and Dihydromyricetin also incteased interleukin-2 (IL-2) and tumor necrosis factor-α(TNF-α) levels,elevated levels of SOD,reduced MDA level.In addition,no toxicological effects were observed on hepatic function and renal function in low and high doses of Dihydroquercetin and Dihydromyricetin.Conclusion: In summary TF and DMY has antitumor effect on H22transplanted tumor in mice,the inhibitory effect was most pronounced with of TF,and was dose dependent.The possible mechanisms may be due to enhanced antioxidant capacity,improve immune function and elevated cytokine levels.
Dihydroquercetin;Dihydromyricetin;Antitumor
10.3969/j.issn.1000-484X.2016.11.011
王佳奇(1991年-),女,硕士,主要从事中药新药研究与开发方面的研究,E-mail:loveyueyang3344@sina.cn。
及指导教师:刘文丛(1968年-),男,博士,教授,主要从事中药新药研究与开发方面的研究,E-mail:781083158@qq.com。
R730.52
A
1000-484X(2016)11-1614-07
①本文为吉林省科技发展计划项目(No.20150311050YY)。
