金黄色葡萄球菌诱导的乳腺炎小鼠脾脏Th细胞变化研究①
2016-12-26赵燕清张洪杰陈德坤
赵燕清 高 洋 张洪杰 方 琳 陈德坤
(西北农林科技大学动物医学院,杨凌712100)
金黄色葡萄球菌诱导的乳腺炎小鼠脾脏Th细胞变化研究①
赵燕清②高 洋 张洪杰 方 琳 陈德坤
(西北农林科技大学动物医学院,杨凌712100)
目的:在小鼠金黄色葡萄球菌性乳腺炎过程中,探讨脾脏内多种Th细胞亚群数量和相关细胞因子、转录因子的动态变化及其意义。方法:本研究首先建立S.aureus感染小鼠的乳腺炎模型,再利用流式细胞术和荧光定量PCR技术,分别检测脾脏中多种Th细胞亚群数量及相关因子mRNA水平。结果:在S.aureus感染小鼠乳房后的不同时间,脾脏内Th2细胞和Th17细胞占CD4+淋巴细胞的比例分别显著增加(P<0.05),而Treg细胞比例则明显降低(P<0.05)。并且,与Th细胞分化、活化和效应相关的多种细胞因子及转录因子,均在转录水平有明显升高(P<0.05)。结论:乳腺炎不只是发生于乳腺局部的一种炎症反应,机体还能够调动脾脏的多种Th淋巴细胞亚群,以分泌细胞因子的方式,组织有效的乳腺抗S.aureus感染免疫应答。
乳腺炎;Th细胞亚群;脾脏;金黄色葡萄球菌;小鼠
乳腺炎是人和其他多种哺乳动物泌乳期的常见疾病。全球约10%的哺乳期妇女患有乳腺炎[1],奶牛和奶山羊的乳腺炎发病率分别为10%~74%、9%~50%[2-4],骆驼、猫、狗、猪和家兔等哺乳动物均有报道患有乳腺炎[5-7]。乳腺炎不仅影响母体健康,还可能通过乳汁将病原菌传递给新生个体使其感染发病甚至死亡。牛羊患乳腺炎不仅泌乳量大大降低,且乳汁及乳制品质量下降。细菌感染是引发乳腺炎的主要原因,最常见的乳腺炎病原菌为金黄色葡萄球菌(Staphylococcusaureus,S.aureus),其感染常造成临床乳腺炎、隐性乳腺炎和慢性乳腺炎,偶尔引起坏疽性乳腺炎[8]。S.aureus能够形成菌膜并在上皮细胞和巨噬细胞内存活,抗生素疗法不能有效控制S.aureus乳腺炎。目前,针对S.aureus引起的乳腺炎,临床上仍然没有十分有效的预防和治疗方法,关键问题在于乳腺炎免疫应答机制不清楚。本研究首先建立小鼠的S.aureus乳腺炎模型,通过脾脏中多种Th细胞亚群数量及特异性细胞因子mRNA水平的检测,以探讨其在乳腺抗感染免疫中的动态变化意义,为从免疫学角度防治乳腺炎提供依据。
1 材料与方法
1.1 实验材料、试剂 雌性C57BL/6小鼠购自西安交通大学医学院实验动物中心。自由交配后,取分娩7~10日龄的母鼠建立S.aureus乳腺炎模型。S.aureus是本实验室保存菌株,从临床采集的奶山羊乳腺炎样品中分离得到。
小鼠淋巴细胞分离液购自上海华精生物高科技有限公司;RPMI1640培养基购自HyClone公司;胎牛血清购自Gibco公司;流式抗体FITC anti-CD4 antibody (Ab)、APC anti-CD25 Ab、PE anti-IL-17A Ab、APC anti-IFN-γ Ab、Percp/cy5.5 anti-IL-4 Ab及流式标记缓冲液购自Biolegend公司;总RNA提取试剂RNAiso Plus,反转录试剂盒PrimeScriptTMRT reagent kit with gDNA Eraser和荧光染料SYBR Premix Ex TaqTMⅡ均购自TaKaRa公司。FACSAria流式细胞仪购自BD Biosciences公司;iQ5荧光定量PCR仪购自Bio-Rad公司。
1.2 实验方法
1.2.1 建立小鼠乳腺炎模型S.aureus复壮培养后,挑取单克隆菌落接种至LB液体培养基扩大培养6 h。3 500 r/min离心5 min,收集菌体沉淀,PBS缓冲液重悬后平板菌落计数法计数CFU(Colony-forming units)。将S.aureus调整为4 × 107CFUs/ml菌体悬液,用于小鼠乳房注射。
为使乳房充盈乳汁,将分娩7~10日龄的母鼠与仔鼠分别饲养。1~2 h后,氯胺酮(100 mg/kg体重)腹腔注射,麻醉母鼠。75%酒精消毒母鼠腹部。将母鼠第四对乳房分别注射4 × 106CFUs/0.1 mlS.aureus悬液。在细菌感染6 h,将仔鼠放回,与母鼠共同饲养。设置对照组为麻醉后仅PBS缓冲液注射乳房的哺乳期母鼠。
1.2.2 病理组织学观察 分别在S.aureus感染乳房的1、3、5和7 d,脱颈椎处死小鼠。无菌解剖小鼠,观察乳腺局部病理变化。摘取一侧乳腺,4%多聚甲醛溶液固定,制作石蜡切片,苏木精-伊红染色后光学显微镜进行病理组织学的观察分析。
1.2.3 分离小鼠脾脏淋巴细胞 无菌摘取小鼠脾脏,研磨后200目不锈钢筛网过滤。将单细胞悬液叠加于等体积淋巴细胞分离液,2 000 r/min离心20 min。吸取中间云雾层的淋巴细胞,PBS洗涤两次,重悬于含10%胎牛血清的完全1640培养基。调整细胞密度为1 × 106个/ml,备用。
1.2.4 流式细胞术检测 在布雷菲德菌素A(10 μg/ml)存在时,以佛波酯(50 ng/ml)和离子霉素(1 μg/ml)共同刺激已经制备的脾脏淋巴细胞悬液,5%CO237℃培养6 h。收集并离心洗涤细胞一次,重悬于细胞标记缓冲液中,与FITC anti-CD4 Ab和APC anti-CD25 Ab室温避光孵育20 min,进行细胞表面分子染色标记。经细胞固定及破膜后,将脾脏淋巴细胞与PE anti-IL-17A Ab、APC anti-IFN-γ Ab和Percp/cy5.5 anti-IL-4 Ab室温避光共孵育20 min,进行细胞内分子染色标记。经细胞标记缓冲液洗涤并重悬,上机,流式细胞仪检测。设置同型阴性对照抗体为对照组。
1.2.5 荧光定量PCR检测多种细胞因子mRNA表达 无菌采集小鼠脾脏,研磨,RNAiso Plus裂解细胞后,经氯仿-异丙醇法分离得到总RNA。将1 μg 总RNA按照反转录试剂盒说明书制备为cDNA。按照SYBR Green荧光定量PCR试剂盒说明书,进行PCR反应。反应体系为:SYBR Mix 10 μl、cDNA 4 μl、上下游引物各0.4 μl、ddH2O 5.2 μl。反应条件为:95℃ 5 min,40个循环(95℃ 15 s、58℃ 30 s)或95℃ 5min,40个循环(95℃ 15 s、58℃ 15 s、72℃ 20 s)。以2-ΔΔCt表示试验数据。Real-time PCR引物见表1。
1.3 统计学方法 采用GraphPad Prism软件进行统计学分析,并作图。对照组和试验组数据运用一维方差分析或t检验进行差异分析,以P<0.05为差异显著,有统计学意义。
2 结果
2.1 乳腺炎模型小鼠组织病理学测定结果 病理解剖显示,对照组小鼠乳腺乳汁充盈,质地均一(见图1A)。试验组小鼠乳腺呈蜂窝状,有局限性脓液积聚(见图1B)。病理组织切片显示,S.aureus感染小鼠乳腺组织退化萎缩,腺泡壁增厚,腺泡上皮增生,上皮细胞排列紊乱甚至脱离基底膜进入腺泡腔。中性粒细胞和淋巴细胞侵入腺泡腔(见图1D)。结果表明,成功建立了小鼠乳腺炎模型。
2.2 Th1细胞及相关细胞因子、转录因子的检测结果 与对照组比较,脾脏Th1细胞(CD4+IFN-γ+)占CD4+淋巴细胞比例在S.aureus感染乳腺的3 d略有增加,IFN-γ mRNA在S.aureus感染乳房的5 d略有上升(P>0.05)。Th1细胞特异性转录因子T-bet mRNA在S.aureus感染乳房的3、5 d显著增加;促进Th1细胞分化并活化的细胞因子IL-12 mRNA在细菌感染乳房的3、5和7 d明显增加(P<0.05,图2)。
表1 Real-time PCR所用引物及扩增片段大小
Tab.1 Primers and respective amplified product size used for Real-time PCR

GeneGenBankaccessionNoSequence(5′⁃3′)Ampliconsize(bp)Reference2⁃stepPCRGapdhNM_008084F:ACCTGCCAAGTATGATGAC119[9]R:GGGAGTTGCTGTTGAAGTIl17NM_010552F:CTCCAGAATGTGAAGGTC89[9]R:GAACGGTTGAGGTAGTCTIl1bNM_008361F:GAATCTATACCTGTCCTGTGTAA130R:GCTCTTGACTTCTATCTTGTTGIl12aNM_001159424F:AACGCAGCACTTCAGAAT108R:CAGAGTCTCGCCATTATGATIl6NM_031168F:AGAAGGAGTGGCTAAGGA187R:GAGAACAACATAAGTCAGATACTbx21NM_019507F:ACCAGAGCGGCAAGTGGG69[10]R:TGGACATATAAGCGGTTCCCTGTgfb1NM_011577F:TGACGTCACTGGAGTTGTACGG169[11]R:GGTTCATGTCATGGATGGTGCIl10NM_010548F:AAGGACCAGCTGGACAACAT172[12]R:TCTCACCCAGGGAATTCAAACCR6NM_009835F:GGTTCATCTCCATCATCATCT81R:GCTCACAGACATCACGATIl4NM_021283F:TCAACCCCCAGCTAGTTGTC199[13]R:CGAGCTCACTCTCTGTGGTGRorcXM_005357024F:CCGCTGAGAGGGCTTCAC241[14]R:TGCAGGAGTAGGCCACATTACA3⁃stepPCRIfngNM_008337F:ATCTGGAGGAACTGGCAAAA246[13]R:TGAGCTCATTGAATGCTTGGIl23aNM_031252F:AGCGGGACATATGAATCTACTAAGAGA244[15]R:GTCCTAGTAGGGAGGTGTGAAGTTG
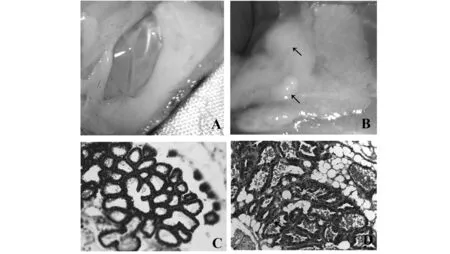
图1 小鼠乳腺解剖及组织切片观察(×40)Fig.1 Representative appearance of murine mammary gland(×40)Note: A.Mammary gland of healthy mice;B.S.aureus infected mice;C.Histological section of mammary gland from healthy mice;D.S.aureus infected mice;Arrows in figure B indicate abscesses,and arrow in figure D indicates neutrophil.
2.3 Th2细胞及相关细胞因子的检测结果 与对照组比较,脾脏Th2细胞(CD4+IL-4+)占CD4+淋巴细胞比例在S.aureus感染乳房的1 d显著增加,在1 d 后递减。IL-4 mRNA在细菌感染乳房的5 d明显高于正常对照组(P<0.05,图3)。
2.4 Th17细胞及相关细胞因子、转录因子的检测结果 脾脏Th17细胞(CD4+IL-17+)占CD4+淋巴细胞比例在S.aureus感染乳房的3 d显著增加(P<0.05)。Th17细胞特异性的转录因子RORγt mRNA在细菌感染乳房的5 d显著升高(P<0.05),但促炎性细胞因子IL-17 mRNA在细菌感染乳房的5 d显著低于正常对照组(P<0.05)。与Th17细胞分化、活化相关的细胞因子,如TGF-β、IL-6和IL-1β,分别在细菌感染乳房的不同时间显著增加转录的mRNA(P<0.05)。虽然细胞因子IL-23也参与Th17细胞活化,促进IL-17产生,但是试验组与对照组在转录水平比较无明显差异。此外,CCR6是表达于Th17细胞膜表面、与Th17细胞的趋化募集有关的蛋白,本研究脾脏中CCR6 mRNA在S.aureus感染乳腺的5 d显著高于对照组(P<0.05)。见图4。

图2 被感染小鼠脾脏中Th1细胞占CD4+淋巴细胞比例与相关细胞因子、转录因子mRNA水平的动态变化Fig.2 Dynamics of proportion of Th1 cells in CD4+ lymphocytes and mRNA expression of Th1-related cytokines and transcription factor in spleen of infected mice

图4 被感染小鼠脾脏中Th17细胞占CD4+淋巴细胞比例与相关细胞因子、转录因子mRNA水平的动态变化Fig.4 Dynamic change of proportion of Th17 cells in CD4+ lymphocytes and mRNA expression of Th17-related cytokines and transcription factor in spleen of infected mice
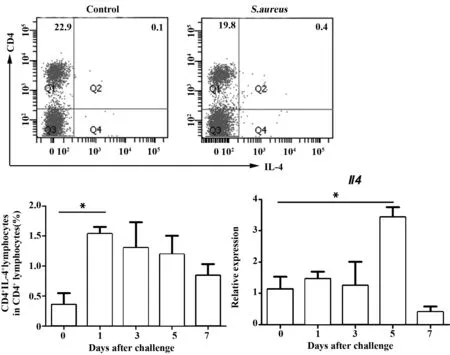
图3 被感染小鼠脾脏中Th2细胞占CD4+淋巴细胞比例与IL-4 mRNA水平的动态变化Fig.3 Dynamics of proportion of Th2 cells in CD4+ lymphocytes and IL-4 mRNA expression in spleen of infected mice

图5 被感染小鼠脾脏中Treg细胞占CD4+淋巴细胞比例与IL-10 mRNA水平的动态变化Fig.5 Dynamics of proportion of Treg cells in CD4+ lymphocytes and IL-10 mRNA expression in spleen of infected mice
2.5 Treg细胞数量及分泌细胞因子的检测结果 与对照组比较,脾脏Treg细胞(CD4+CD25+)占CD4+淋巴细胞比例在S.aureus感染乳房的3、5和7 d显著降低(P<0.05)。而IL-10 mRNA在S.aureus感染乳房的5 d显著高于对照组(P<0.05,图5)。
3 讨论
脾脏是机体最重大的外周免疫器官,也是适应性免疫应答发生的主要场所。脾脏内定居着大量成熟的T淋巴细胞,其中的Th细胞在接受抗原肽-MHC复合物刺激后,当细胞因子微环境合适时,能够分别分化为Th1细胞、Th2细胞、Th17细胞和Treg细胞[16],然后迁移至病原体所在部位,执行清除病原体的免疫功能。通常机体被病原体感染后,脾脏Th细胞数量和亚群比例首先会发生显著变化,这种变化也基本反映了机体免疫系统对特定病原体感染的防御机制。因此,要研究机体抗御病原感染的免疫机理,有必要搞清楚脾脏T细胞,尤其是Th细胞的数量和所占比例在炎症过程中的变化。基于此,本研究探讨乳腺抗S.aureus感染的免疫机制,首先对脾脏的Th细胞亚群变化进行了测定。本研究结果显示,小鼠乳腺感染S.aureus一周内的不同时间段, Th2和Th17亚群比例明显升高,与其分化相关的细胞因子mRNA水平也显著升高,提示Th2和Th17亚群可能是乳腺抗S.aureus感染的主要效应T细胞亚群,Th1亚群可能也参与了这一免疫应答,但它可能处于辅助者的地位。
Th17细胞以分泌IL-17为特征,介导炎症反应,在多种自身免疫病和清除寄生虫、胞内细菌感染过程中发挥重要作用[17]。Th17细胞是否参与乳腺炎特别是S.aureus引起的乳腺炎尚不清楚。本研究揭示,脾脏Th17细胞占CD4+淋巴细胞的比例在S.aureus感染乳房的3 d显著增加,促进Th17细胞发育分化的细胞因子TGF-β、IL-6和IL-1β在mRNA转录水平明显升高,介导Th17细胞产生IL-17的重要转录因子RORγt mRNA明显增加。这表明S.aureus感染乳房后,脾脏中成熟Th细胞向Th17细胞发生了明显的分化。但与此变化不一致的是脾脏IL-17 mRNA含量明显减少。我们推测,脾脏产生的Th17细胞尚未分化成Th17效应细胞,受趋化因子影响募集至乳腺组织后,才能够转化为大量分泌IL-17的效应Th17细胞。与这一假设相一致的是,我们的检测结果表明,促进Th17细胞活化分泌IL-17的细胞因子IL-23 mRNA转录水平没有显著变化,而与Th17细胞趋化募集相关的细胞表面受体CCR6 mRNA在S.aureus感染乳房的5 d明显增加。并且,已有研究报道称,S.aureus感染乳房引起乳腺炎后,IL-17 在乳腺组织腺泡、乳导管、乳池、乳头管和乳汁内的mRNA转录水平及蛋白水平显著增加[18-20]。验证这一假设,需要开展进一步的研究。
Th1/Th2是经典的辅助性T细胞亚群,Th1细胞介导细胞免疫,而Th2细胞在体液免疫中发挥重要作用。本研究结果表明,Th2细胞而非Th1细胞占CD4+淋巴细胞的比例在S.aureus感染乳房后显著增加,细胞因子IL-4而非IFN-γ mRNA转录水平明显升高,揭示体液免疫而非细胞免疫在乳房抗S.aureus感染免疫应答中发挥重要作用。但是,促进Th1细胞发育分化的细胞因子IL-12及其关键转录因子T-bet,在S.aureus感染乳房的3、5 d显著增加转录表达,意味着Th1细胞发育分化可能是发生在S.aureus感染乳房的炎症后期,继而募集至乳腺局部发挥清除胞内细菌的作用。S.aureus是兼性胞内寄生菌,在上皮细胞和巨噬细胞内存活,由Th1细胞介导的细胞免疫可能是机体彻底清除S.aureus感染的重要途径。
Treg细胞被认为是免疫应答的负调节者。本研究结果表明,脾脏中Treg细胞占CD4+淋巴细胞的比例在S.aureus感染乳房的3 d后显著降低,暗示对T淋巴细胞分化活化的抑制作用减弱,提示机体增强了抗S.aureus感染免疫应答的炎症反应。脾脏中抑炎性细胞因子IL-10 mRNA的显著升高,可以解释为由Th2细胞产生,适当抑制炎性反应,避免因过度炎症反应而造成组织病理性损伤。已有研究报道,IL-10能够严格地调控IL-17产生,进而控制中性粒细胞的募集,调节机体发挥有效的免疫保护作用而非造成免疫病理性损伤[21]。
综上所述,乳腺炎并不只是发生于乳腺局部的一种炎症反应,机体还能够调动脾脏的多种辅助性T淋巴细胞亚群,以分泌细胞因子的方式,组织有效的乳腺抗S.aureus感染免疫应答。
[1] Rebeca Arroyo,Virginia Martin,Antonio Maldonado,etal.Treatment of infectious mastitis during lactation:antibiotics versus oral administration of lactobacilli isolated from breast milk[J].Clin Infect Dis,2010,50(12):1551-1558.
[2] Zeryehun T,Aya T,Bayecha R.Study on prevalence,bacterial pathogens and associated risk factors of bovine mastitis in small holder dairy farms in and around Addis Ababa,Ethiopia[J].J Anim Plant Sci,2013,23(1):50-55.
[3] Marogna G,Pilo C,Vidili A,etal.Comparison of clinical findings,microbiological results,and farming parameters in goat herds affected by recurrent infectious mastitis[J].Small Ruminant Res,2012,102(1):74-83.
[4] Contreras A,Sierra D,Sánchez A,etal.Mastitis in small ruminants[J].Small Ruminant Res,2007,68(1-2):145-153.
[5] 幸奠权.家兔乳房炎的防治[J].科学种养,2013,3:51-52.
[6] 刘 茹.浅谈母猪乳房炎的诊治[J].中国畜牧兽医文摘,2013,29(1):179.
[7] Regassa A,Golicha G,Tesfaye D,etal.Prevalence,risk factors,and major bacterial causes of camel mastitis in Borana Zone,Oromia Regional State,Ethiopia[J].Trop Anim Health Prod,2013,45(7):1589-1595.
[8] Pisoni G,Moroni P,Genini S,etal.Differentially expressed genes associated withStaphylococcusaureusmastitis in dairy goats[J].Vet Immunol Immunopathol,2010,135(3-4):208-217.
[9] Jing XQ,Cao DY,Liu H,etal.Pivotal role of IL-17-producing γδ T cells in mouse chronic mastitis experimentally induced withStaphylococcusaureus[J].Asian J Anim Vet Adv,2012,7(12):1266-1278.
[10] Harrington LE,Hatton RD,Mangan PR,etal.Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J].Nat Immunol,2005,6(11):1123-1132.
[11] Choi EH,Kim MJ,Yeh B-I,etal.Iontophoresis and sonophoresis stimulate epidermal cytokine expression at energies that do not provoke a barrier abnormality:lamellar body secretion and cytokine expression are linked to altered epidermal calcium levels[J].J Invest Dermatol,2003,121(5):1138-1144.
[12] Zhang X,Edwards JP,Mosser DM.Dynamic and transient remodeling of the macrophage IL-10 promoter during transcription[J].J Immunol,2006,177(2):1282-1288.
[13] Schroppel B,Zhang N,Chen P,etal.Differential expression of chemokines and chemokine receptors in murine isletallografts:the role of CCR2 and CCR5 signaling pathways[J].J Am Soc Nephrol,2004,15(7):1853-1861.
[14] Ivanov II,McKenzie BS,Zhou L,etal.The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+T helper cells[J].Cell,2006,126(6):1121-1133.
[15] Uhlig HH,McKenzie BS,Hue S,etal.Differential activity of IL-12 and IL-23 in mucosal and systemic innate immune pathology[J].Immunity,2006,25(2):309-318.
[16] Jiang S,Dong C.A complex issue on CD4(+) T-cell subsets[J].Immunol Rev,2013,252(1):5-11.
[17] Bedoya SK,Lam B,Lau K,etal.Th17 cells in immunity and autoimmunity[J].Clin Dev Immunol,2013,2013:986789.
[18] Whelehan CJ,Meade KG,Eckersall PD,etal.ExperimentalStaphylococcusaureusinfection of the mammary gland induces region-specific changes in innate immune gene expression[J].Vet Immunol Immunopathol,2011,140(3-4):181-189.
[19] Tao W,Mallard B.Differentially expressed genes associated withStaphylococcusaureusmastitis of Canadian Holstein cows[J].Vet Immunol Immunopathol,2007,120(3-4):201-211.
[20] Jing XQ,Zhao YQ,Shang CC,etal.Dynamics of cytokines associated with IL-17 producing cells in serum and milk in mastitis of experimental challenging withStaphylococcusaureusand Escherichia coli in dairy goats[J].J Anim Vet Adv,2012,11(4):475-479.
[21] Slight SR,Monin L,Gopal R,etal.IL-10 restrains IL-17 to limit lung pathology characteristics following pulmonary infection with live vaccine strain[J].Am J Pathol,2013,183(5):1397-1404.
[收稿2016-01-25 修回2016-03-07]
(编辑 倪 鹏)
Dynamics of T helper cell subsets in spleen in a murine Staphylococcus aureus mastitis model
ZHAO Yan-Qing,GAO Yang,ZHANG Hong-Jie,FANG Lin,CHEN De-Kun.
College of Veterinary Medicine,Northwest A&F University,Yangling 712100,China
Objective:To study the dynamics of T helper cell subsets and related cytokines and transcription factors and its significance in spleen in mice during experimentally inducedStaphylococcusaureusmastitis .Methods: We firstly established a murine mastitis model by challenge with an inoculum ofStaphylococcusaureus,and then,the number of each T helper cell subset and the mRNA level of their associated factors were assessed in spleen by flow cytometry and quantitative real-time PCR,respectively.Results: At the indicated time points afterStaphylococcusaureusinfection,the proportion of Th2 cells and Th17 cells in CD4+lymphocytes were significantly increased,respectively,whereas,the proportion of regulatory T cells was significantly decreased (P<0.05).Moreover,the mRNA expression of genes encoding cytokines and transcription factors involved in the differentiation and function of various T helper cells,was greatly elevated in spleen (P<0.05).Conclusion: Mastitis is not only a local inflammation of the mammary gland,but also involved in various T helper cell subsets in spleen via pro-inflammatory cytokine production to mediate effective immune responses againstStaphylococcusaureusinfection in mastitis.
Mastitis;T helper cell subsets;Spleen;Staphylococcusaureus;Mouse
10.3969/j.issn.1000-484X.2016.11.004
①本文受陕西省科技统筹创新工程计划项目(2015KTTSNY04-04)资助。
赵燕清(1986年-),女,博士,讲师,主要从事感染与免疫及分子免疫学方面研究,E-mail:zhaoyq619@163.com。
及指导教师:陈德坤(1964年-),男,博士,教授,博士生导师,主要从事预防兽医学与分子免疫学方面研究,E-mail:chendekun163@163.com。
R392
A
1000-484X(2016)11-1583-06
②湖北医药学院基础医学院,十堰 442000。
