产紫杉醇真菌Pestalotiopsismicrospora NK17适合遗传筛选的培养基优化
2016-12-24陈龙飞朱项阳李莹莹朱旭东
陈龙飞, 朱项阳, 李莹莹, 张 倩, 潘 皎, 朱旭东
(南开大学 生命科学学院微生物系, 天津 300071)
产紫杉醇真菌PestalotiopsismicrosporaNK17适合遗传筛选的培养基优化
陈龙飞, 朱项阳, 李莹莹, 张 倩, 潘 皎, 朱旭东*
(南开大学 生命科学学院微生物系, 天津 300071)
小孢拟盘多毛孢菌株NK17被证明能够产生多种具有药物开发价值的紫杉烷类似物以及冠心病治疗药物的前导物pestalotiollide B等次级代谢产物。由于是天然分离的菌株,该菌的营养要求未知,特别是缺少合适的全合成基础培养基,制约了实验室对其性状和基因水平的操作。尤其是在使用营养缺陷型菌株进行遗传转化时,全合成基础培养基是筛选工作的前提。对各种基础培养基进行筛选比较,最终确定酵母氮源加乳糖和硫酸铵的全合成基础培养基最适合NK17菌丝生长和营养缺陷型筛选。同时对该培养基的发酵产物进行了研究,成功应用该培养基进行了缺陷型回补筛选,效果较好。
拟盘多毛孢;基础培养基;营养缺陷型;酵母氮源;次级代谢
拟盘多毛孢属(Pestalotiopsisspp.)真菌是一种常见的植物内共生菌或者病原菌[1],在自然界中与多种植物有着内共生关系,其中比较有代表性的如小孢拟盘多毛孢(Pestalotiopsismicropora)。据报道,佛罗里达榧树(Torreyataxifolia)、欧洲红豆杉(Taxusbaccata)、西藏红豆杉、落羽杉(Taxodiumdistichum)和石斛(Dendrobiumspeciosum)都有共生的拟盘多毛孢存在[2-4]。该属的内生真菌一直被作为植物病原菌来研究的[5]。1996年,Strobel等从西藏红豆杉中分离得到了一株能够产抗癌药物紫杉醇的小孢拟盘多毛孢[3],引起了很多研究小组对拟盘多毛孢的兴趣,1997年Strobel的研究小组又发现另1株产紫杉醇的拟盘多毛孢属(Pestalotiopsisguepinii)真菌[6]。本实验室的多株产紫杉烷真菌中,就有2株拟盘多毛孢属真菌,其中1株小孢拟盘多毛孢NK17,被证明能够在发酵产物中检测到紫杉醇和pestalotiollide B[7-8]。随后对其进行了全基因组测序,但是由于拟盘多毛孢与构巢曲霉及粗糙脉孢菌等模式丝状真菌有着较大的差异,其分子生物学工具无法通用,并且还有对外源转化进入的DNA添加端粒重复序列的特性[9],因而对其进行基因水平的研究遇到很大障碍。据我们的研究发现,常见的实验室抗真菌药中只有潮霉素对其有明显的抑制效果,因此目前实验室常用的抗性基因中只有潮霉素抗性基因可以用来作为NK17的筛选标记,对其进行基因水平的操作。这使得基因回补和多基因敲除受到了极大地限制,因此尝试通过5氟乳清酸(5-FOA)及无标记基因的无痕敲除方法将其pm-ura3基因无痕删除,得到了营养缺陷型菌株[10],再通过扩增野生型种的pm-ura3基因来回补缺陷型菌株,从而证明此方法的可行性。但是由于NK17在多种丝状真菌常见基础培养基上的生长状况非常差,无法进行营养缺陷型菌株的回补筛选,因此本研究系统地筛选比较了各种合成的基础培养基,得到了最适合用来培养NK17的YNB乳糖培养基,并成功应用该培养基对营养缺陷型回补菌株进行了筛选,比较了NK17在YNB乳糖培养基和天然培养基上发酵产物的区别。本研究对Pestolatiopsisspp.的分子生物研究提供基本培养方法和可参考的发酵条件。
1 材料与方法
1.1 材料
1.1.1 菌株 小孢拟盘多毛孢菌株NK17由本实验室分离并保存于-80 ℃冰箱中。
1.1.2 药品 各种化学药品均为分析纯和色谱纯。
1.1.3 培养基 ①构巢曲霉基础培养基ANmm(Aspergillusnidulansminimal medium)成分参照文献[11];②ANmmC:在ANmm的基础上加入⑨中的氨基酸和核酸混合物;③粗糙脉孢菌培养基NCmm (Neurosporacrassaminimal medium. Vogel’s)参照文献[12];④NCmmC:在NCmm的基础上加入⑨中的氨基酸和核酸混合物;⑤NCmmP:在NCmm的基础上加入10 g/L蛋白胨;⑥PLB(Potato lactose broth)培养基:削皮马铃薯200 g,加入蒸馏水煮沸30 min,过滤后取滤液,加乳糖20 g,pH自然,其固体培养基名称为PLA;⑦YNB (Yeast nitrogen base)培养基:不含氨基酸和硫酸铵的酵母氮源1.7 g,硫酸铵 5 g,乳糖20 g,调pH 6.2~6.4;⑧乳糖蛋白胨培养基:乳糖10 g,酵母膏5 g,硫酸镁 0.2 g,蛋白胨10 g;磷酸二氢钾 3 g,调pH 6.2~6.4(以上8种培养基均为1 L液体培养基,固体则加质量分数为2%的琼脂粉。其中PLB为天然完全培养基。乳糖蛋白胨和NCmmP为半合成完全培养基,其他5种均为合成基础培养基。);⑨氨基酸核苷酸混合物(μg/mL): 硫酸腺嘌呤20,尿嘧啶20,L-色氨酸20,L-组氨酸20,L-精氨酸20,L-甲硫氨酸20,L-酪氨酸30,L-亮氨酸30,L-异亮氨酸30,L-赖氨酸盐酸盐30,L-苯丙氨酸50,L-谷氨酸100,L-天门冬氨酸100,L-缬氨酸150,L-苏氨酸200,L-丝氨酸400。
1.2 方法
1.2.1 培养条件 接种菌丝或孢子的平板置于28 ℃恒温培养箱中培养。接种菌丝或孢子的摇瓶置于28 ℃恒温摇床中培养,每个500 mL摇瓶装培养基200 mL,转速为180 r/min。
1.2.2 发酵液获取与高效液相色谱(HPLC)分析方法 通过抽滤分离发酵液与菌丝,再用1倍体积的二氯甲烷或乙酸乙酯萃取发酵液,取有机相通过旋转蒸发仪将有机相浓缩后,使用70%的甲醇作为流动相进行HPLC检测,具体过程参照文献[13]。
1.2.3 营养缺陷型转化方法 使用携带有标记基因T-DNA载体的农杆菌LBA4404作为农杆菌转化的工具,在诱导培养基上铺一层纤维素膜,再涂布NK17孢子与农杆菌的混合液,36 h后将纤维素膜转移到筛选培养基上,2 d左右揭开纤维素膜,再培养1~2 d即有肉眼可见的转化子,具体请参照文献[10]。
2 结果与分析
2.1 丝状真菌基础固体培养基效果比较
NK17为一种丝状真菌,首先选用模式丝状真菌——粗糙脉孢菌和构巢曲霉中广泛使用的基础培养基培养,并观察和记录平板上的菌落生长情况。结果如图1所示,这两种基础培养基(NCmm和ANmm)上的NK17菌丝生长缓慢,并在生长3 d后就基本不再生长,而天然培养基PLA上的菌丝则继续快速生长,直到6 cm以上时由于培养皿本身直径的制约而开始减慢菌丝外扩速度。而且从培养基表面菌落状态来看,2 d后这两种基础培养基上的菌丝生长不健康,表面发干、发硬,老化现象严重,并产生大量黑色素,停止生长。另外,尝试在两种基础培养基中添加各种必需氨基酸和核酸混合物,但仍然是完全合成的培养基(NCmmC和ANmmC),混合物的加入对菌丝的生长并没有很强的促进作用,反而在NCmm中加入氨基酸和核酸混合物3 d后有轻微抑制生长的现象(图1)。因此可以得到结论,这两种丝状真菌常用基础培养基并不适合NK17使用。

图1 NK17在5种培养基上的生长对比Fig.1 The growth comparison of NK17 on 5 kinds of medium柱状图上字母不同则差异显著(P<0.05),图2同Different letters above bars indicate significant differences(P<0.05),Figure 2 with
2.2 酵母用固体培养基效果比较
NK17是一种子囊菌,除粗糙脉孢菌和构巢曲霉等丝状真菌之外,酵母菌也是子囊菌中研究最为广泛的生物种类,本研究尝试使用酵母氮源(YNB)中加上硫酸铵和最适合NK17生长并产孢子的乳糖作为碳源,配置基础培养基。同时以两种半合成培养基(乳糖蛋白胨培养基、ANmmP)和天然培养基PLA作为对照。由图2可知,使用菌丝尖端接种法,NK17的菌丝在YNB上和PLA上保持了相近的生长速率,且没有明显的生长停止现象,菌丝比较健康,但是由于基础培养基上的营养并不丰富,菌丝比较薄,气生菌丝相对比较少,生物量也较少,但是却更适合用来观察菌丝生长情况,而且作为筛选用的基础培养基,反而可以更容易分辨出单菌落,为其纯化提供方便。
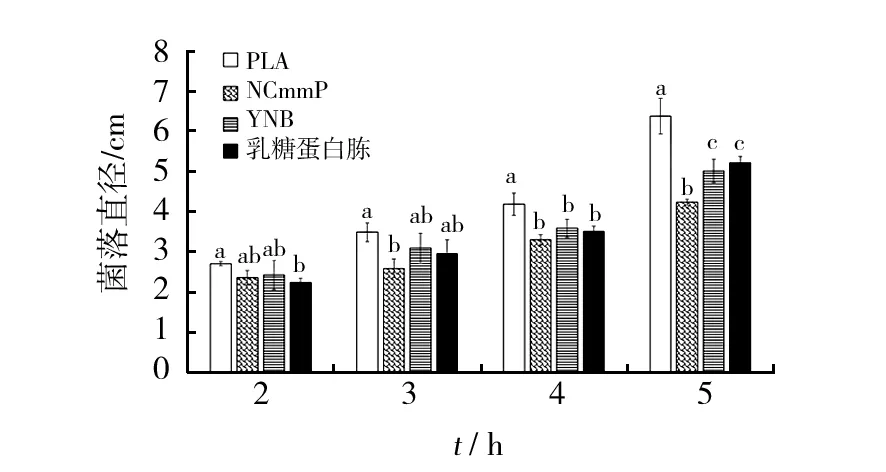
图2 NK17在4种培养基上的生长对比Fig.2 The growth comparison of NK17 on four different medium
2.3 YNB培养基和PLA培养基对营养缺陷型的培养效果比较
通过无痕敲除方法得到的营养缺陷型菌株Δura-1失去了pm-ura3基因,从而失去合成尿嘧啶的能力[10]。因为YNB乳糖培养基中不含尿嘧啶,所以Δura-1在该基础培养基上应该无法生长,结果也符合预期。如图3A所示,YNB培养基中心处接种黑色的Δura-1孢子4 d后仍然无法萌发,没有观察到明显的菌丝。同样的培养基上接种野生型的菌株在接种的第2天时就可以观察到明显的菌丝,随后的生长也十分良好(图3B)。而将YNB中添加200 μg/mL的尿嘧啶后,Δura-1生长基本恢复,只是孢子的萌发时间会稍微延迟(图3C)。YNB培养基上培养的野生型NK17菌丝生长良好,但并不适合产生孢子。如图3D所示,7 d后仍然没有明显的黑色孢子,而3~4 d左右时PLA上的NK17便开始逐渐产生大量黑色孢子,最终整个培养基表面都呈黑色(图3E、F)。综上可知,YNB培养基适合用于缺陷型标记筛选及菌丝形态观察,也有可能作为一种诱导孢子产生的初始培养基使用。
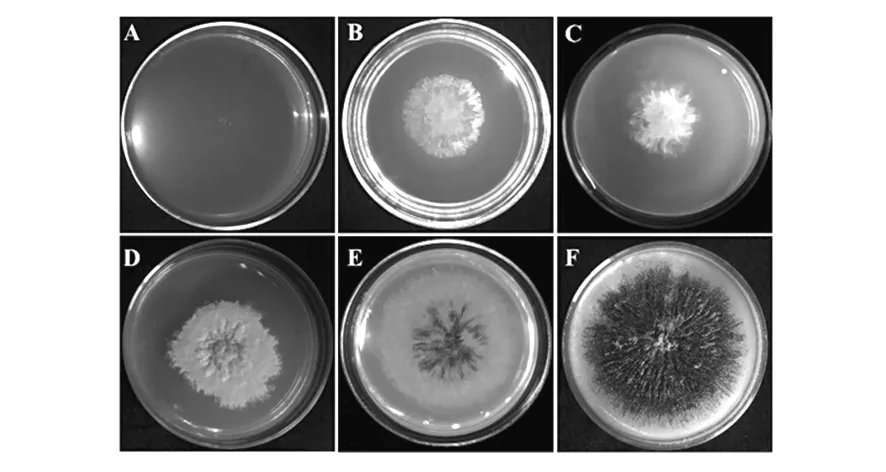
图3 NK17野生型和营养缺陷型在YNB和PLA上的生长对比Fig.3 The growth comparison of wild type strain of NK17 and its auxotrophic strain on YNB and PLA
A:接种营养缺陷型Δura-1孢子在YNB培养基上4 d未萌发;B:接种野生型NK17孢子到YNB培养基上3 d的生长情况;C:含200 μg/mL尿嘧啶的YNB培养基上Δura-1孢子3 d时的生长情况;D:接种野生型NK17孢子在YNB培养基上7 d的生长情况;E:接种野生型NK17孢子在PLA培养基上3 d的生长情况;F: 接种野生型NK17孢子在PLA培养基上7 d的生长情况
A:The conidia of auxotrophic strainΔura-1 can’t germinate on YNB even after being plated for 4 days;B:The growth of wild type strain on YNB after 3 days;C:The growth ofΔura-1 after 3 days on YNB,added with uracil of 200 μg/mL;D: The growth of wild type strain on YNB after 7 days;E:The growth of wild type strain on PLA after 3 days;F:The growth of wild type strain on PLA after 7 days
2.4 基础培养基YNB与天然完全培养基PLB发酵液比较
在使用1.2.2中描述的方法处理培养7 d的发酵液后,使用70%的甲醇作为流动相检测发酵液中萃取出来的物质,可以从图4中看到,使用YNB培养基与PLB培养基产生的可检测到的次级代谢产物出峰时间基本一致,但总体每个物质浓度都会低很多。另外,图4中箭头所指的物质在YNB中的产量比PLB中产量高。由此可见,YNB能够保证NK17的基本生长和次级代谢,但是由于营养不够丰富,产生的绝大部分次级代谢产物浓度会比天然培养基PLB少很多。因此建议在获得转化子之后的其他发酵产物研究中,使用合适的丰富培养基如PLB。
2.5 YNB筛选效果验证
根据NK17在各种基础培养基上的生长状况,最终选择YNB作为营养缺陷型菌株回补的筛选培养基。由于农杆菌介导的真菌转化需要足够的孢子萌发率才能保证转化效率,为了提高营养缺陷型的NK17的农杆菌转化效率,对1.2.3中描述的野生型NK17的农杆菌转化方法做了一些细节上的修改,向诱导培养基IM中添加50 μg/mL的尿嘧啶来增加孢子萌发效率[10],最终的筛选培养基使用结果如图5所示,重新获得pm-ura3基因的菌株在纤维素膜被揭去1~2 d内就会形成明显的单菌落,而未成功导入pm-ura3基因的孢子则完全无法生长,大大减少了菌落间混合的可能性,方便了分离纯化。

图4 NK17在PLB和YNB中的发酵产物HPLC检测对比Fig.4 The comparison of secondary metabolites produced by NK17 in PLB and YNBA:PLB中的发酵产物检测结果;B:YNB中的发酵产物检测结果A:The HPLC analysis of secondary metabolites in PLB;B:The HPLC analysis of secondary metabolites in YNB
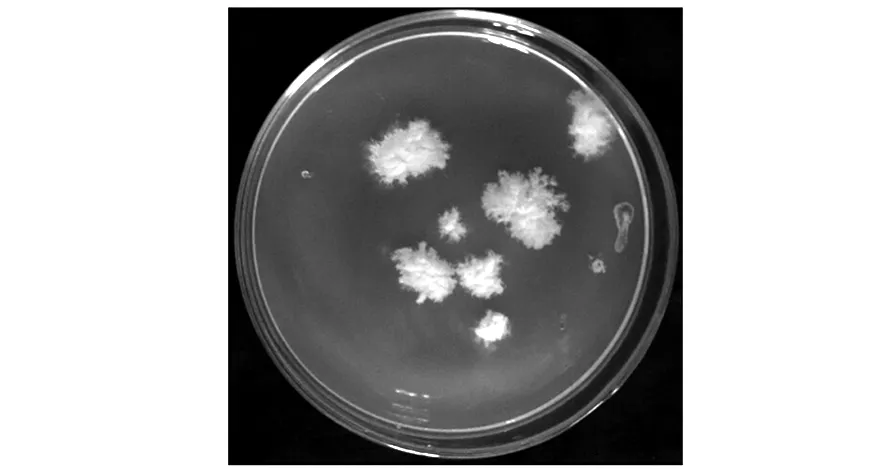
图5 YNB作为尿嘧啶营养缺陷型NK17的筛选培养基Fig.5 The utilization of YNB as selection medium for uracil deficient NK17
3 讨 论
通常情况下丝状真菌由于生长所需的营养比酵母菌苛刻,需要配置含有丰富无机盐的基础培养基来保证其生长,如模式丝状真菌构巢曲霉和粗糙脉孢菌等的基础培养基中包含了一系列的微量元素。但适合这些容易培养的丝状真菌的条件并不都适合于从自然环境中分离得到的其他种属。对于一些有应用价值的种属,常用条件往往并不合适,例如NK17就在这些培养基上生长情况较差,必须通过一系列的条件摸索得到适合其生长和研究的培养条件。本研究发现,NK17更适合生长在通常用来配置酵母用基础培养基的YNB上,再加上乳糖和硫酸铵就构成了适合NK17的完全合成基础培养基,这与粗糙脉孢菌和构巢曲霉等不一致。作为一种完全合成培养基,YNB乳糖培养基可以满足NK17菌丝生长基本需求,而且配置简单,有商业化的产品使用,可以节省配置组分复杂的NCmm和ANmm所耗费的时间。而且由于其成分简单,在添加相应的营养物质后又可以让营养缺陷型菌株生长,从而得以方便地对NK17进行遗传改造。
[1] Petrini O. Fungal endophytes of tree leaves, Microbial ecology of leaves[J].Springer,1991:179-197.
[2] Li J, Harper J K, Grant D M, et al. Ambuic acid, a highly functionalized cyclohexenone with antifungal activity fromPestalotiopsisspp. andMonochaetiasp.[J]. Phytochemistry,2001, 56(5):463-468.
[3] Strobel G, Yang X, Sears J, et al. Taxol fromPestalotiopsismicrospora, an endophytic fungus ofTaxuswallachiana[J]. Microbiology,1996, 142(2):435-440.
[4] Strobel G, Li J, Ford E, et al.Pestalotiopsisjesterisp. nov. an endophyte fromFragraeabodenii, a common plant in the southern highlands of Papua New Guinea[J]. Mycotaxon,2000, 76:257-266.
[5] Guba E F.Monograph ofMonochaetiaandPestalotia[M].Massachusetts,Harvard University Press,1961:340-342.
[6] Strobel G A, Hess W, Li J-Y, et al.Pestalotiopsisguepinii, a taxol-producing endophyte of the wollemi pine,Wollemianobilis[J]. Australian Journal of Botany,1997, 45(6):1073-1082.
[7] Bi J, Ji Y, Pan J,et al. A new taxol-producing fungus (Pestalotiopsismalicola) and evidence for taxol as a transient product in the culture[J]. Afr. J. Biotech,2011, 10(34):6647-6654.
[8] Xueliang Niu, X H, Zhangyong Hong, et al. A putative histone deacetylase modulates the biosynthesis of pestalotiollide B and conidiation inPestalotiopsismicrospora[J]. Journal of Microbiology and Biotechnology,2015,25(5):579-588.
[9] Long D M, Smidansky E D, Archer A J, et al.InVivoAddition of Telomeric Repeats to Foreign DNA Generates Extrachromosomal DNAs in the Taxol-Producing FungusPestalotiopsismicrospora[J]. Fungal Genet. Biol,1998, 24(3):335-344.
[10]Chen L, Wei D, Zhang Q, et al. Orotidine 5′-phosphate decarboxylase-based reusable in situ genetic editing system: Development and application in taxol-producingPestalotiopsismicrospora[J]. Engineering in Life Sciences,2015,15(5):542-549.
[11]Barratt R, Johnson G, Ogata W. Wild-type and mutant stocks ofAspergillusnidulans[J]. Genetics,1965, 52(1):233-246.
[12]Vogel H. A convenient growth medium forNeurospora(medium N)[J]. Microb. Genet. Bull,1956, 13(4):2-43.
[13]牛学良, 南杰, 于溪, 等. 产紫杉醇真菌发酵液脱色处理方法[J]. 南开大学学报(自然科学版),2014, 3:22-28.
Medium Optimization Suitable for Genetic Screening of Taxol-Producing Fungus Pestalotiopsis microspora NK17
CHEN Long-fei, ZHU Xiang-yang, LI Ying-ying, ZHANG Qian, PAN Jiao, ZHU Xu-dong
(Dept.ofMicrobiol.,Coll.ofLifeSci.,NankaiUni.,NankaiDist.Tianjin300071)
PestalotiopsismicrosporaNK17 has been proved could produce many useful secondary metabolites that possesses values in medicine development, including parallel of yew alkane as well as preceding substance for coronary treatment, paclitaxel and pestalotiollide B etc. Since the nutritional requirement of the strain remains unknown, and the lack of an appropriate totally synthetic minimal medium, these have limited the genetic manipulation in its characters and genetic levels. Especially a totally synthetic basic medium is the key prerequisite for screening works when using auxotrophic strains to carry out genetic transformation. In this study, the growth of NK17 on several minimal media and their improved versions were screened and compared. A totally synthetic minimal medium with yeast nitrogen source plus lactose and (NH4)2SO4was finally confirmed to be the most suitable for NK17 mycelial growth and screening for auxotroph. At the same time, the fermentation products of were studied, and successfully retro-mend screened the auxotroph using the medium with fairly good effects.
Pestalotiopsismicrospora; minimal medium; auxotroph; YNB; secondary metabolite
国家高技术研究发展计划“863计划”(2012AA022105)
陈龙飞 男,博士研究生。研究方向为分子真菌学。E-mail:flydream0417@126.com
* 通讯作者。男,教授,博士,博士生导师。研究方向为分子真菌学。Tel:022-23506510,E-mail: xudong82@nankai.edu.cn
2015-04-28;
2015-06-11
Q933
A
1005-7021(2016)01-0006-05
10.3969/j.issn.1005-7021.2016.01.002
