山茱萸环烯醚萜苷对蛋白磷酸酶2A催化亚基C磷酸化的调节机制
2016-12-23李雪莲杨翠翠石京山
李雪莲 杨翠翠 张 兰* 石京山
(1.遵义医学院基础药理省部共建教育部重点实验室,贵州遵义 563000;2.首都医科大学宣武医院药物研究室, 北京 100053; 3.北京脑重大疾病研究院, 北京 100053; 4.北京市神经药物工程研究中心, 北京 100053; 5.神经变性病教育部重点实验室, 北京 100053)
· 神经系统疾病的基础研究 ·
山茱萸环烯醚萜苷对蛋白磷酸酶2A催化亚基C磷酸化的调节机制
李雪莲1, 2,3,4,5杨翠翠2,3,4,5张 兰2,3,4,5*石京山1*
(1.遵义医学院基础药理省部共建教育部重点实验室,贵州遵义 563000;2.首都医科大学宣武医院药物研究室, 北京 100053; 3.北京脑重大疾病研究院, 北京 100053; 4.北京市神经药物工程研究中心, 北京 100053; 5.神经变性病教育部重点实验室, 北京 100053)
目的 探讨山茱萸环烯醚萜苷(Corneliridoidglycoside,CIG)上调蛋白磷酸酶2A(protein phosphatase 2A,PP2A),PP2A活性抑制tau蛋白磷酸化的作用机制。方法 ①确定最佳转染条件:将Src 质粒DNA(0.2、0.4、0.6、0.8 μg)瞬时转染入小鼠神经瘤母细胞(Neuro-2A cell,N2a 细胞),观察不同量Src对PP2A催化亚基C磷酸化和tau蛋白磷酸化的影响;②将0.6 μg Src 质粒DNA 转染入N2a细胞,24 h后加入CIG(50、100、200 μg/mL)共同孵育24 h,观察CIG对Src、蛋白酪氨酸磷酸酯酶1B(protein tyrosine phosphatase 1B,PTP1B)、p-PP2Ac及tau蛋白磷酸化的作用。结果 ①转染Src(0.2、0.4、0.6 μg)质粒DNA到N2a细胞,Src蛋白表达明显增加,p-PP2Ac水平上调,PP2Ac蛋白总量表达无变化,tau蛋白在Ser 199/202、Ser 396位点磷酸化显著增加;转染0.8 μg Src质粒DNA到N2a细胞与转染0.6 μg Src相比,p-PP2Ac表达下降,PP2Ac蛋白总量表达无变化,tau蛋白在Ser 199/202、Ser 396位点磷酸化降低。②转染0.6 μg Src质粒DNA到N2a细胞,Src蛋白表达增加,p-PP2Ac表达增加,tau蛋白在Ser 199/202、Thr 205、Thr 217以及Ser 396位点的磷酸化明显增加;CIG对Src蛋白表达无影响,能够抑制p-PP2Ac的表达,抑制tau蛋白在Ser 199/202、Thr 205、Thr 217以及Ser 396位点的磷酸化。此外,CIG能上调PTP1B蛋白表达。结论 CIG对Src蛋白无明显调节作用,但能通过增加PTP1B的表达,降低PP2A催化亚基C磷酸化,从而升高PP2A活性,进一步降低tau的过度磷酸化。CIG对tau蛋白过度磷酸化的抑制作用,将会给阿尔茨海默病的治疗带来广阔的应用前景。
山茱萸环稀醚萜苷;蛋白酪氨酸激酶Src;蛋白磷酸酶2A;蛋白酪氨酸磷酸酯酶1B;tau蛋白;阿尔茨海默病
阿尔茨海默病(Alzheimer’s disease,AD),是老年人中常见的神经系统退行性疾病,主要病理表现为神经元纤维缠结(neurofibrillary tangles,NFT)和老年斑。过度磷酸化的tau蛋白是NFT的主要成分[1],蛋白磷酸酶2A(protein phosphatase 2A,PP2A)是调节tau蛋白磷酸化的主要酯酶,AD患者脑内PP2A活性显著下降[2];降低PP2A活性,会引起tau蛋白过度磷酸化和记忆损伤[3-4]。PP2A是一个异源三聚化合物,由结构亚基A、调节亚基B以及催化亚基C构成PP2A全酶[5]。PP2A的活性,主要受其催化亚基C酪氨酸307位点的磷酸化调节。酪氨酸蛋白激酶Src和蛋白酪氨酸磷酸酯酶1B(protein tyrosine phosphatase 1B,PTP1B)能调节PP2A催化亚基C的磷酸化。激活Src途径,增加PP2A催化亚基C磷酸化,抑制PP2A活性,进而导致tau蛋白过度磷酸化[6-7];PP2A的活化因子PTP1B表达上调,可使PP2Ac发生去磷酸化,进而激活PP2A[8]。
山茱萸(CornusofficinalisSieb.etZucc)为传统的常用补益肝肾效果良好的药物。山茱萸环烯醚萜苷(cornel iridoid glycoside,CIG)是山茱萸的主要有效成分之一,主要成分包括马钱苷和莫诺苷[9]。本室前期实验研究[10-11]显示,CIG能增加PP2A活性,进而抑制tau蛋白过度磷酸化。本文将主要探讨CIG是否通过调节PP2A催化亚基C磷酸化修饰,进而提高PP2A活性,降低tau蛋白的过度磷酸化。
1 材料和方法
1.1 药品及试剂
山茱萸环稀醚萜苷,本实验室从山茱萸提取,纯度为71%(主要成分为马钱苷和莫诺苷);实验中采用干粉剂量,溶解于氯化钠溶液后使用。MEM/EBSS培养基(赛默飞十二生物化学制品有限公司,美国),胎牛血清(Gibco BRL公司,美国),胰蛋白酶[含0.25%(质量分数)EDTA,Gibco BRL公司,美国],青霉素/链霉素原液(Pen Strep Life公司,美国)。转染试剂盒(jetPRIME,Poly plus公司,法国),RC-DC protein assay(500-0122-MSDS,Bio-Rad公司,美国)。本实验主要抗体详见表1。
表1 本实验所用主要抗体
Tab.1 The main antibody used in this experiment
1.2 主要仪器
二氧化碳培养箱(Tc2323 型,美国SHELL/JB 公司),超净工作台(北京半导体设备一厂),倒置相差显微镜(Nikon eclipse TE300,日本Nikon公司),超声波细胞粉碎机(JY92-Ⅱ型,宁波新芝科器研究所),全波长酶标仪(Multiskan Spectrum,法国巴德斯公司),电子天平(BS210S,北京赛多利斯天平有限公司),低温高速台式离心机(Beckman 22R,美国Beckman公司),医用低速离心机(B320A,安新县白洋离心机厂),电泳仪(美国Bio-Rad公司),电转仪(美国Bio-Rad公司), 化学发光凝胶成像系统(美国ProteinSimple公司)
1.3 方法
1.3.1 N2a细胞培养及转染
小鼠神经瘤母细胞(Neuro-2A cell,N2a 细胞)在37 ℃、5% (体积分数)CO2细胞培养箱中进行培养,每2~3 d更换一次新鲜完全培养基[89%(体积分数) MEM EBSS, 10%(体积分数) FBS,1%(质量分数)青霉素/链霉素原液],FBS用0.22 μm滤器过滤除菌。转染的详细操作步骤参见Polyplus转染试剂盒说明书,大致步骤如下:①当细胞生长至80%丰度时,用胰酶消化后,以105个/mL接种于12 孔细胞培养板(每组2个复孔), 每孔1 mL完全培养基;②24 h后更换新鲜的完全培养基,用Polyplus转染试剂进行转染,Src质粒DNA∶转染试剂=1 μg∶2 μL,放入二氧化碳细胞培养箱继续培养;③24 h后更换新鲜的完全培养基,并加入50 μg/mL、100 μg/mL、200 μg/mL的CIG共同孵育;④继续培养24 h后,使用超声细胞粉碎机超声,裂解细胞提取蛋白。
1.3.2 蛋白免疫印迹法
①样品制备:将细胞培养板中的培养基吸出,加入DPBS冲洗2~3次,加RIPA裂解液(含PMSF)裂解细胞,轻轻吹打使细胞悬浮,吸出细胞悬浮液到1.5 mL EP管中;置于冰上20 min,超声7 s(3次),加入5×loading buffer,混匀,95 ℃金属浴,5 min;置于低温高速离心机中, 离心30 min(4 ℃,12 000 r/min);吸取上清。②蛋白定量:具体操作严格按照RC-DC protein assay蛋白定量方法进行。③SDS聚丙烯酰胺凝胶电泳:蛋白上样量10 μg,经10%(质量分数)SDS-PAGE胶电泳分离蛋白;用聚偏二氟乙烯(PVDF)膜电转:90 V,100 min;封闭:5%(质量分数)脱脂奶粉稀释于TBST溶液中,封闭2 h;加入一抗[用含5%(质量分数)脱脂奶粉的TBST溶液稀释],4 ℃孵育过夜;次日,置于摇床用TBST清洗3次,10 min/次,加入辣根过氧化物酶标记的山羊抗鼠或抗兔IgG 抗体(1∶2 000),置于摇床上摇动,室温孵育2 h;曝光:暗室中,将化学发光底物A 液和B 液按1∶1比例混合,加到PVDF膜上,约200 μL/膜,曝光时间根据蛋白的表达量多少以及抗体的效价确定,保存图片为Tiff File格式。免疫条带灰度值采用AlphaView SA软件进行分析。
1.4 统计学方法
用SPSS17.0 软件分析实验数据,各组实验数据以均值±标准误(mean±SE)表示,组间样本均数比较应用单因素方差分析(One-way ANOVA),以P<0.05为差异有统计学意义。
2 结果
2.1 Src质粒DNA转染条件的确定
实验采用不同量Src质粒DNA(0.2、0.4、0.6、0.8 μg)瞬时转染入小鼠N2a细胞,24 h后提取蛋白,蛋白定量后采用Western blotting 方法检测Src、p-PP2Ac及tau 蛋白在Ser 199/202、Ser 396位点的磷酸化。结果显示:转染0.2~0.6 μg Src质粒DNA,随Src质粒DNA转染量的增多,细胞内Src蛋白总量表达增加,p-PP2Ac表达增多,PP2Ac总蛋白量无明显变化,同时观察到tau蛋白在Ser 199/202、Ser 396位点磷酸化显著增加;但当Src质粒DNA转染量达到0.8 μg时,与对照组相比,p-PP2Ac表达增多,PP2Ac总蛋白量无明显变化,tau蛋白在Ser 199/202、Ser 396位点磷酸化增加,但与转染0.6 μg Src质粒DNA相比,p-PP2Ac表达下降,同时tau蛋白在Ser 199/202、Ser 396位点磷酸化表达减少。本实验采用0.6 μg Src质粒DNA进行转染(图1)。
2.2 CIG对Src转染N2a细胞内PP2Ac酪氨酸磷酸化修饰的影响
转染Src质粒DNA到N2a细胞24 h后,弃原有培养基,加入不同浓度CIG(50、100、200 μg/mL)与细胞共同孵育24 h,用Western blotting方法检测Src总蛋白、p-PP2Ac及PP2Ac总蛋白表达。结果显示:模型组与对照组相比,Src蛋白表达明显上调,PP2Ac在Y307位点磷酸化表达明显增加,PP2Ac总蛋白无明显变化。CIG对Src蛋白无明显调节作用,但给予CIG 100、200 μg/mL,能显著降低p-PP2Ac (P<0.001),对PP2Ac总蛋白没有明显影响(图2)。
2.3 CIG对Src转染N2a细胞内tau蛋白多个位点磷酸化的影响
转染Src质粒DNA到N2a细胞24 h后,弃原有培养基,加入不同浓度CIG(50、100、200 μg/mL)与细胞共同孵育24 h,检测 tau蛋白在Ser 199/202、Thr 205、Thr 217以及Ser 396位点的磷酸化水平。结果显示模型组与空白组相比,tau蛋白在Ser 199/202、Thr 205、Thr 217以及Ser 396位点的磷酸化明显增加(P<0.001),总tau蛋白表达没有变化。CIG能够显著降低tau蛋白Ser 199/202、Thr 205、Thr 217以及Ser 396位点的磷酸化;CIG大剂量200 μg/mL对N2a细胞无明显影响(图3)。
2.4 CIG对Src转染N2a细胞内PTP1B蛋白表达的影响
PTP1B通过使PP2Ac酪氨酸307去磷酸化而激活PP2A。为了进一步发掘CIG降低p-PP2Ac的作用机制,本实验在Src转染的N2a细胞内,采用Western blotting方法检测了PTP1B总蛋白表达水平。结果显示模型组与对照组相比,PTP1B蛋白表达无明显变化,给予CIG后,PTP1B蛋白表达明显上调(P<0.05,P<0.001)。CIG对正常细胞的PTP1B表达无影响(图4)。
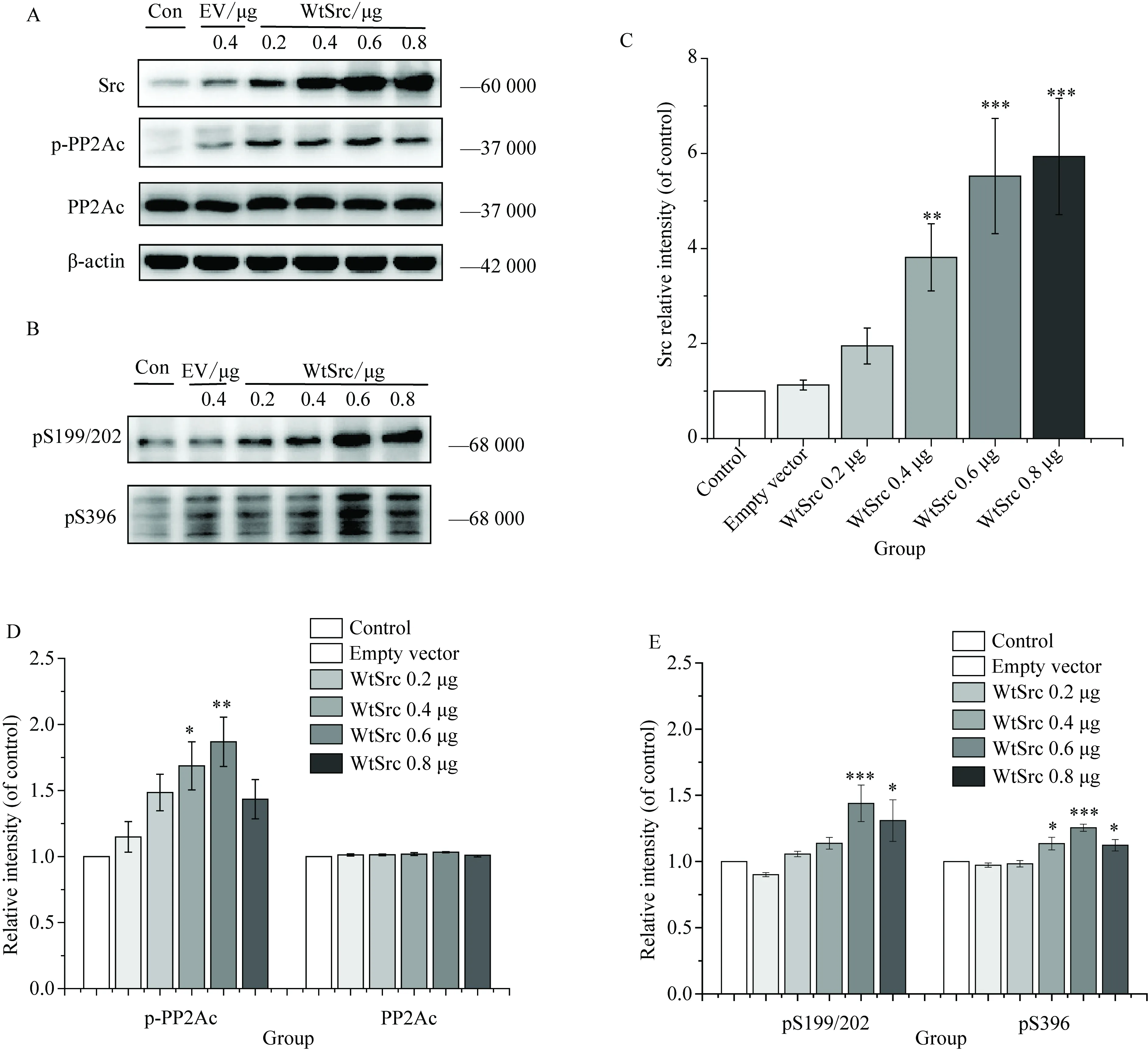
图1 Src质粒DNA转染条件的确定
Fig.1 To determine transfection conditions for Src plasmid
A and B: the expression level of Src,p-PP2Ac, PP2Ac, pS199/202, pS396 and tau5 in using Western blotting method; C, D and E: statistical results of Src,p-PP2Ac, PP2Ac, pS199/202, pS396.β-actin as internal control, and the control group was 100%. Results were shown as mean±SE,n=4,*P<0.05,**P<0.01 ,***P<0.001vscontrol; PP2Ac:protein phosphatase 2Ac;Con:control,untransfected group (blank control group); EV: empty vector, transfected empty vector GV386; WtSrc: wild type Src. Transfecting different quantity Src (0.2,0.4,0.6,0.8 μg)plasmid into N2a cells(Src plasmid and transfection reagent according to 1∶2 ratio).

图2 CIG对Src转染N2a细胞内Src总蛋白、PP2Ac磷酸化的影响
Fig.2 Effects of CIG on Src total protein and PP2A phosphorylation in N2a cells transfected with Src
A:The cells overexpressed Src were incubated with different concentrations of CIG (50, 100, 200 μg/mL) for 24 h, then detected the expression of total Src protein,total PP2Ac and phosphorylation of PP2Ac. B and C: β-actin as internal control, and the control group was 100%. Statistical results of Src,p-PP2Ac and PP2Ac are shown as mean±SE.n=4;###P<0.001vscontrol,***P<0.001vsWtSrc;WtSrc: wild type Src; PP2Ac:protein phosphatase 2Ac; CIG:cornel iridoid glycoside.

图3 CIG对Src转染N2a细胞tau蛋白多个位点磷酸化的影响
Fig.3 Effects of CIG on multiple sites of tau phosphorylation in N2a cells transfected with Src
A:The cells overexpressed Src were incubated with different concentrations of CIG (50, 100, 200 μg/mL) for 24 h, then detected the expression of tau phosphorylation at the sites of Ser 199/202, Thr 205, Thr 217 and Ser 396;B:β-actin as internal control, and the control group was 100%. Statistical results of Ser 199/202、Thr 205、Thr 217 and Ser 396 were shown as mean±SE.n=4;###P<0.001vscontrol,***P<0.001vsWtSrc; WtSrc: wild type Src; CIG:cornel iridoid glycoside.
3 讨论
微管相关蛋白tau与微管的组装以及解聚密切相关,在AD的病理改变中,tau蛋白的过度磷酸化发挥了重要作用[12]。 蛋白酯酶活性上升,降低tau蛋白磷酸化,其中PP2A是使tau蛋白去磷酸化的主要蛋白酯酶[13],活性比率高达近70%[14]。PP2A的活性受到催化亚基C酪氨酸307位点磷酸化修饰的调节,PP2Ac磷酸化,抑制PP2A活性,进而tau发生过度磷酸化,导致神经元纤维缠结的形成[15-17]。
Src是调节PP2Ac磷酸化的主要激酶,实验中发现,转染一定量Src,可使p-PP2Ac及p-tau 表达水平上升,这与文献[7]报道的Src可使PP2A催化亚基C和tau蛋白磷酸化增加一致。但同时又发现,当Src转染量继续增加时,p-PP2Ac及p-tau的表达不再增加,反而有所降低,原因可能是当Src蛋白表达到一定量后,对PP2Ac仍然发挥磷酸化作用,PP2Ac磷酸化短时间内上调到一定程度,但由于PP2A在细胞内作用广泛,当PP2Ac磷酸化修饰达到一定程度时,细胞立即启动多种信号通路减弱其磷酸化[18],使PP2A的活性得到部分恢复,进而PP2A对tau蛋白的去磷酸化作用增强,tau蛋白过度磷酸化降低。此现象目前未见更多的相关报道,具体作用机制还有待进一步研究探讨。
本室前期研究[19]显示,CIG能显著降低PP2Ac磷酸化提高PP2A活性,Src在调节PP2Ac酪氨酸307位点的磷酸化中发挥重要作用[20-21],为了明确CIG是否通过对Src的调节,上调PP2A活性,进而抑制tau蛋白磷酸化。本实验采取Src质粒DNA瞬时转染神经细胞N2a的方法,Src蛋白表达增加,PP2Ac酪氨酸307位点磷酸化增加,且tau蛋白在Ser 199/202、Thr 205、Thr 217以及Ser 396位点的磷酸化明显增加,以此模拟AD脑内部分蛋白变化。结果显示,CIG对Src蛋白无明显调节作用,但能使p-PP2Ac下调,并且明显降低tau蛋白在多个位点的磷酸化。由此推测,CIG可能通过作用于其他酶,抑制p-PP2Ac,提高PP2A活性。

图4 CIG对Src转染N2a细胞PTP1B蛋白表达的影响
Fig.4 Effects of CIG on the expression of PTP1B protein in N2a cells transfected with Src
A:The cells overexpressed Src were incubated with different concentrations of CIG (50, 100, 200 μg/mL) for 24 h, then detected the expression level of PTP1B total protein; B:β-actin as internal control, and the control group was 100%. Statistical results of PTP1B were shown as mean±SE,n=4,**P<0.01,***P<0.001vsWtSrc.CIG:cornel iridoid glycoside; PTP1B:protein tyrosine phosphatase 1B;WtSrc: wild type Src.
蛋白酪氨酸磷酸酯酶1B(protein tyrosine phosphatase 1B,PTP1B)主要存在于肝脏、脑等组织的细胞内质网表面,是第一个从人体细胞中被分离出来的蛋白质酪氨酸磷酸酶,能专一的水解蛋白质中磷酸化的酪氨酸上的磷酸化基团[22]。有研究[23]证实,上调PTP1B的mRNA和蛋白水平能降低PP2Ac 催化亚基C 307位点酪氨酸磷酸化。为了进一步探究CIG降低PP2Ac催化亚基C磷酸化的具体作用机制,本实验检测了PTP1B的蛋白表达,发现CIG能显著增加PTP1B的蛋白水平,证实了PTP1B对PP2Ac Y307位点磷酸化修饰的下调作用。
综上,CIG抑制tau蛋白过度磷酸化的机制可能是通过上调PIP1B的蛋白表达,进而下调p-PP2Ac,提高PP2A活性,从而降低tau蛋白多个位点的磷酸化水平。本文将为研究CIG对AD治疗的具体作用机制提供有意义的实验依据。
[1] Li B, Chohan M O, Grundkeiqbal I, et al. Disruption of microtubule network by Alzheimer abnormally hyperphosphorylated tau[J]. Acta Neuropathol, 2007, 113(5):501-511.
[2] Boutajangout A, Sigurdsson E M, Krishnamurthy P K. Tau as a therapeutic target for Alzheimer’s disease[J]. Curr Alzheimer Res, 2011, 8(6):666-677.
[3] Liu G P, Wei W, Zhou X, et al. Silencing PP2A inhibitor by lenti-shRNA interference ameliorates neuropathologies and memory deficits in tg2576 mice[J]. Mol Ther, 2013, 21(12):2247-2257.
[4] Zhu L Q, Zheng H Y, Peng C X, et al. Protein phosphatase 2A facilitates axonogenesis by dephosphorylating CRMP2[J]. J Neurosci, 2010, 30(10):3839-3848.
[5] 秦建全,沈晓云. 蛋白磷酸酶2A的亚基功能[J]. 生理科学进展,2011,42(3):229-233.
[6] Chen J, Martin B L, Brautigan D L. Regulation of protein serine-threonine phosphatase type-2A by tyrosine phosphorylation Science 257, 1261-1264[J]. Science, 1992, 257(5074):1261-1264..
[7] 熊艳. 锌离子对蛋白磷酸酯酶2A的调节及其在阿尔茨海默病中的作用[D]. 武汉:华中科技大学, 2013.
[8] Luo Y,Nie Y J,Shi H R,et al. PTPA activates protein phosphatase- 2A through reducing its phosphorylation at tyrosine- 307 with upregulation of protein tyrosine phosphatase 1B[J]. Biochim Biophys Acta,2013,1833(5):1235-1243.
[9] 张丽, 赵丽红, 张兰,等. 山茱萸环烯醚萜苷促进成体大鼠海马神经干细胞增殖和分化的影响[J]. 中国新药杂志, 2015,24(5): 550-553.
[10]褚燕琦, 李玮, 张兰,等. 山茱萸环烯醚萜苷对蛋白磷酸酶抑制剂冈田酸拟阿尔采末病细胞模型的作用[J]. 中国药理学通报, 2006, 22(8): 960-963.
[11]Yang C C, Kuai X X, Li Y L, et al. Cornel Iridoid glycoside attenuates tau hyperphosphorylation by inhibition of PP2A demethylation[J]. Evid Based Complement Alternat Med, 2013,2013:108486.
[12]Obulesu M, Venu R, Somashekhar R. Tau mediated neurodegeneration: an insight into Alzheimer’s disease pathology[J]. Neurochem Res, 2011, 36(8):1329-1335.
[13]Takashima A. GSK-3 is essential in the pathogenesis of Alzheimer’s disease[J]. J Alzheimers Dis, 2006, 9(3 Suppl):309-317.
[14]Liu F,Grundke-Iqbal I,Iqbal K,et al. Contributions of protein phosphatases PP1,PP2A,PP2B and PP5 to the regulation of tau phosphorylation[J]. Eur J Neurosci,2005,22(8):1942-1950.
[15]Liu R, Zhou X W, Tanila H, et al. Phosphorylated PP2A (tyrosine 307) is associated with Alzheimer neurofibrillary pathology[J]. J Cell Mol Med, 2008, 12(1):241-257.
[16]Nunbhakdi-Craig V, Schuechner S, Sontag J M, et al. Expression of protein phosphatase 2A mutants and silencing of the regulatory Bα subunit induce a selective loss of acetylated and detyrosinated microtubules[J]. J Neurochem, 2007, 101(4):959-971.
[17]杨巍巍, 杨慧,于顺. 蛋白磷酸酶2A活力增高减轻α-突触核蛋白引起的SK-N-SH细胞凋亡[J]. 首都医科大学学报,2013,34(6):835-839.
[18]刘蓉, 周新文, 王建枝. 阻断酪氨酸蛋白激酶Src表达对蛋白磷酸酯酶2A活性和tau蛋白磷酸化的影响[J]. 神经损伤与功能重建, 2007, 2(4): 203-206.
[19]杨翠翠, 张丽, 褚思娟,等. 山茱萸环烯醚萜苷通过抑制GSK-3β活性及提高PP2A活性降低tau蛋白过度磷酸化[C]. 中国药学大会暨第14届中国药师周, 石家庄,2014.
[20]Yang W, Wang X, Duan C, et al. Alpha-synuclein overexpression increases phospho-protein phosphatase 2A levels via formation of calmodulin/Src complex[J]. Neurochem Int, 2013, 63(3):180-194.
[21]Xiong Y, Jing X P, Zhou X W, et al. Zinc induces protein phosphatase 2A inactivation and tau hyperphosphorylation through Src dependent PP2A (tyrosine 307) phosphorylation[J]. Neurobiol Aging, 2013, 34(3):745-756.
[22]杨猛, 高天虹. 蛋白酪氨酸磷酸酶1B(PTP1B)抑制剂的研究进展[J]. 河南化工, 2015,32(1):11-15.
[23]聂运娟. PTPA对PP2A_c Y307磷酸化水平的作用及其机制[D]. 武汉:华中科技大学, 2011.
编辑 孙超渊
Regulatory mechanism ofCorneliridoidglycoside on protein phosphatase 2A catalytic subunit C phosphorylation
Li Xuelian1, 2,3,4,5,Yang Cuicui2,3,4,5,Zhang Lan2,3,4,5*,Shi Jingshan1*
(1.KeyLaboratoryforBasicPharmacologyofMinistryofEducation,ZunyiMedicalCollege,Zunyi563000,GuizhouProvince,China;2.DepartmentofPharmacology,XuanwuHospital,CapitalMedicalUniversity,Beijing100053,China; 3.BeijingInstituteforBrainDisorders,Beijing100053,China;4.BeijingEngineeringResearchCenterforNervousSystemDrugs,Beijing100053,China; 5.KeyLaboratoryforNeurodegenerativeDiseasesofMinistryofEducation,Beijing100053,China)
Objective To investigate the mechanism ofCorneliridoidglycoside (CIG) inhibiting tau phosphorylation by up-regulating protein phosphatase 2A (PP2A) activity. Methods ① To determine optimal transfection conditions: transfecting Src plasmid DNA (0.2, 0.4, 0.6, 0.8 μg) into mouse neuro-2A cell (N2a cells) was performed to observe the effects of different quantity Src on phosphorylation of PP2A catalytic subunit C and tau phosphorylation. ②After transfecting 0.6 μg Src plasmid DNA into N2a cells 24 hours,the cells were incubated with CIG (50, 100, 200 μg/mL) 24h,then the effects of CIG on Src, PTP1B, p-PP2Ac and tau phosphorylation were observed. Results ① Expression of Src protein was significantly increased, the expression of p-PP2Ac was up-regulated and the expression of PP2A did not change when Src (0.2, 0.4, 0.6 μg) plasmid transfected into N2a cells, and the tau phosphorylation at the sites of Ser 199 / 202, Ser 396 increased significantly; In the N2a cells transfected with 0.8 μg Src, the expression of p-PP2Ac was increased apparently, the expression of PP2A was not changed, and the phosphorylation of tau at Ser 199 / 202 and Ser 396 sites was decreased. ② In the N2a cells transfected with 0.6 μg Src, the expression of Src was significantly increased, the expression of p-PP2Ac was significantly increased, and the tau phosphorylation at the sites of Ser 199 / 202, Thr 205, Thr 217 and Ser 396 sites increased significantly; CIG could inhibit the expression of p-PP2Ac, the expression of tau phosphorylation at the sites of Ser 199 / 202, Thr 205, Thr 217, and Ser 396. In addition, CIG can up-regulate PTP1B protein expression. Conclusion CIG had no obvious regulation effect on Src, but it could decrease the phosphorylation of PP2A catalytic subunit C by increasing the expression of PTP1B, and then increases the activity of PP2A, and further reduces the level of tau hyperphosphorylation. The inhibition of CIG on tau hyperphosphorylation, will bring broad application prospects on the treatment of AD.
Corneliridoidglycoside;protein tyrosine kinase Src; protein phosphatase 2A;protein tyrosine phosphatase 1B; tau protein; Alzheimer’s disease
国家自然科学基金(81473373),北京市自然科学基金(7132110),“重大新药创制”科技重大专项(2015ZX09101016001),北京市卫生系统高层次卫生技术人才(2014-2-014),北京市新世纪百千万人才工程(008-0014),北京市教委新医药学科群(XK100270569)。This study was supported by National Natural Science Foundation of China(81473373),Natural Science Foundation of Beijing(7132110),Major Project for Essential Drug Research and Development(2015ZX09101016001),Beijing Health and Technical High-level Personal Plan(2014-2-014),Beijing New Century Talented Person Project(008-0014),New Medical Disciplines Project of Beijing Education Committee(XK100270569).
时间:2016-12-14 20∶10
http://www.cnki.net/kcms/detail/11.3662.r.20161214.2010.014.html
10.3969/j.issn.1006-7795.2016.06.012]
R 96
2016-10-14)
*Corresponding authors, E-mail:lanizhg@hotmail.com;shijs@zmc.edu.cn
