Fkbp51与应激相关疾病的研究进展
2016-12-23张玲玲杨志伟雍伟东
张玲玲,邱 彬,杨志伟,雍伟东
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
综述与专论
Fkbp51与应激相关疾病的研究进展
张玲玲,邱 彬,杨志伟,雍伟东
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
应激反应是对机体面对紧迫与危险时产生的一系列非特异性生理和心理应答反应的总称。下丘脑-垂体-肾上腺(HPA)轴作为神经调节的中枢系统,在应激反应引起的一系列神经内分泌的改变中具有重要的调控作用。糖皮质激素受体(GR)是HPA轴维持稳态的重要调节因子。FKBP51作为一种与FK506结合的共伴侣蛋白,对GR和HPA轴的功能具有负向调节作用,这一调节功能需要伴侣蛋白(热休克蛋白Hsp90/70等)和FKBP52的共同参与。近年来通过大规模人类基因组的研究发现,Fkbp51在由应激引发的一系列精神和代谢紊乱疾病中具有重要的调节作用。本文将对Fkbp51在应激相关精神疾病以及物质代谢紊乱中的作用和影响进行综述。
Fkbp51;应激反应;HPA轴;GR
1936年,内分泌学家Hans Selye将机体面对紧迫与危险时产生的一系列非特异性生理与心理应答反应的总和称为应激反应(stress)[1]。应激的基本反应为一系列神经内分泌的改变,而其中最主要的变化就是下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenocortical,HPA)轴的异常亢奋[2]。糖皮质激素受体(glucocorticoid receptors, GR)属于甾体激素受体超家族的成员之一,在体内广泛表达,并且介导糖皮质激素实现对机体行为和代谢等功能的调节,近年来的研究表明,GR对机体由应激引发的各种精神及代谢紊乱疾病具有调控作用。GR是HPA轴稳态维持的重要调节因子,其功能的发挥需要与伴侣蛋白(热休克蛋白Hsp90/70等)及共伴侣蛋白(FKBP51或FKBP52等)结合形成复合物,HPA功能受损时将引起多种精神和代谢性疾病的发生。其中FKBP51对GR和HPA的功能具有负性调节作用,而Fkbp51基因多态性也与应激相关的一系列精神和代谢紊乱调节相关。本文将对Fkbp51在应激相关精神疾病以及物质代谢紊乱疾病中的作用和影响进行综述。
1 HPA轴与应激刺激
HPA轴是神经内分泌系统的重要组成部分,参与调节机体许多重要活动,如消化、免疫、心境和情绪、以及能量储存和消耗,并且在人体的应激反应中发挥着核心作用。其生理机制为[2]:当应激信号经过中枢神经到达丘脑下部室旁核时,该信号作用于(1)室旁核内的神经元合成并释放促肾上腺皮质激素释放激素(corticotropin- releasing hormone,CRH);(2)CRH可以促进垂体前叶合成并分泌促肾上腺皮质激素(adrenocorticotropic hormone,ACTH);(3)ACTH再促进肾上腺皮质合成和分泌以皮质醇为中心的糖皮质激素(glucocorticoid,GC);(4)GC通过负反馈调节作用于海马中的GR,减少ACTH的释放;(5)同时,GC通过与垂体和肾上腺上分泌的GR相互作用,从而减少ACTH的释放并且阻断其兴奋的作用。HPA通过一系列正负反馈调节,促使机体的各个组织发生相应的应激防御反应,使机体保持和恢复内环境的稳定。
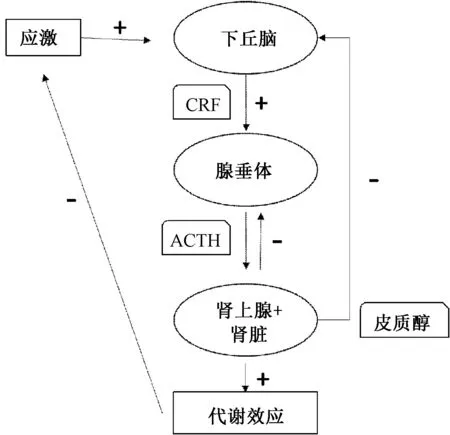
图1 下丘脑-垂体-肾上腺轴Fig.1 Hypothalamic-pituitary-adrenocortical axis
2 HPA轴在应激反应中的作用机制
在正常情况下,当机体受到强烈的外界刺激时,会发生相应的应激反应。按照应激假说,HPA轴是调节应激反应的关键系统,被认为是很多精神疾病症状和体征发生的共同通路[3]。有研究表明,抑郁症、PTSD患者血浆中GC浓度升高,出现HPA轴功能紊乱[4-8]。海马作为情绪整合和学习记忆的高级中枢,具有大量的GR表达,对HPA轴和应激刺激具有负性调节作用。但持续升高的GC与海马内的GR结合,将导致海马内GR数量和功能的降低,失去对HPA轴负性调节作用,引发HPA轴功能亢进,最终导致海马神经元的萎缩、凋亡及神经元再生减少等一系列神经可塑性损伤。海马组织的这一病理性改变,将引起学习、认知和情绪等意识功能的损伤,最终导致多种精神疾病的发生。
3 FKBP51对HPA轴的调节作用
FKBP51是一种FK506结合蛋白,广泛表达于各种组织中[9],也被称为FKBP5。FKBP5具有肽基-脯氨酰基顺-反异构酶(PPIase)结构域和蛋白-蛋白相互作用的三十四肽重复(TPR)结构域。PPIase结构域,也被称为FK506结合结构域,负责两个相互排斥的功能:当与FK506或雷帕霉素结合时,引起免疫抑制作用;当不与免疫抑制配体结合时,作为辅助分子伴侣蛋白通过TPR结构域,同细胞内其他分子伴侣蛋白(如热休克蛋白90(HSP90))结合形成复合体,通过其异构酶活性发挥调节作用。作为共伴侣蛋白直接与伴侣蛋白(热休克蛋白Hsp90/70等)结合并参与激素-受体复合物的形成和调控。通过体外生化实验发现,FKBP51参与GR复合体的形成,并将GR滞留于细胞质中,抑制GR的核转位及其转录活性。因此,FKBP51在功能上对GR活性起到负调节作用[10],并在HPA轴的调节和应激反应中发挥重要调节作用。FKBP51不仅对机体糖脂代谢刺激具有重要的调节作用,并且与多种由应激刺激引发的精神疾病的发生相关,例如焦虑、抑郁、PTSD、成瘾等[11]。
4 Fkbp51单核苷酸多态性与GR的关系
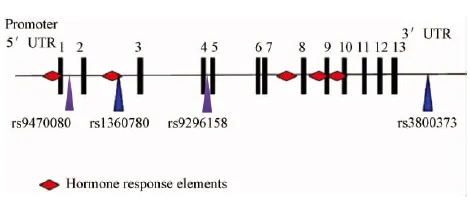
图2 Fkbp51基因多态性[11]Fig.2 The polymorphism of Fkbp51
单核苷酸多态性(single nucleotide polymorphisms, SNP)是指在基因组水平上由单个核苷酸的变异引起的DNA序列的多态性。SNP是目前发现的第三代遗传标志。如果染色体上某个位点单个碱基的变化频率在特定人群中超过1%,这种基因组上的碱基变化可以被称为SNP。在人类基因组水平,平均每1000个碱基对就有一个SNP。在个体基因组DNA中,少数甚至个别碱基的多态性,就可以导致特定基因相关病理过程的发生。因此,SNP对于研究疾病的发病机制、临床早期的诊断、个体化治疗以及预后都有重要的意义[12]。FKBP51作为一种在GR分子复合物中与Hsp90结合的共伴侣蛋白,影响着配体的结合、GR的信息交换以及GR由细胞质到细胞核中的迁移。FKBP51在功能上对GR起负向调节作用,因此很多文章对Fkbp51基因的SNPs与GR之间的相关性进行研究。
Binder等[13]在对正常个体的研究中发现,Fkbp51基因的4种功能性SNPs(rs9296158, rs3800373, rs1360780 和rs9470080)与GR的抗性具有相关性。随后的分析进一步证明相同的SNPs可以增强PTSD病人体内GC的敏感性,另外,这些SNPs对于在儿童时期遭遇虐待后预测成人是否患PTSD具有一定的影响[14]。同时有研究发现[15],携带Fkbp51基因SNP rs9296158等位基因A的PTSD病人,表现为GR的超敏感性,但是携带GG基因型的患者则具有更低的血清皮质醇水平。另外在该研究中还发现,PTSD的临床症状与特异性基因的表达相关,这表明PTSD的内在表型是由功能性的Fkbp51基因SNPs决定的。
5 FKBP51在应激相关精神疾病中的作用
FKBP51通过影响GR活性参与HPA轴功能的调节。通过对基因组和疾病相关性的研究发现,Fkbp51基因的SNPs与人类多种精神疾病的发生具有高度相关性,如PTSD、抗抑郁应答、社会心理应激障碍、自杀行为等[16]。
同时也发现,精神类应激刺激可引起Fkbp51表达水平的改变。例如,经历“911”事件后的PTSD幸存者,其体内外周血中Fkbp51 mRNA的表达明显降低[17],而经历创伤事件后几小时内个体Fkbp51 mRNA的表达变化情况与4个月后PTSD的建立也具有直接相关性[18]。抑郁症也是慢性应激下的一种病理性行为异常,这主要是应激后常常伴有抑郁而且应激后抑郁症发生率显著高于正常[19]。Binder等[20]通过对Fkbp51基因上的SNPs进行研究发现,Fkbp51基因上存在若干可能导致FKBP51蛋白表达水平改变的SNPs,他们与抑郁症的反复发作、抗抑郁疗效均存在显著相关性。也有研究发现,Fkbp51基因多态性与抑郁症病人的抗抑郁治疗效果具有很大的关联。如Fkbp51基因rs1360780位点TT基因型的患者抑郁症发病率高,但是对抗抑郁药物反应更快、疗效更好,携带rs38003763位点CC基因型的患者治疗预后较该位点其他基因型的患者更好。
利用基因工程技术敲除Fkbp51基因后,小鼠在生理和神经内分泌功能上出现对长期社会压力反应性的降低,表现为肾上腺比重的降低以及皮质酮水平的降低,以及对急性应激刺激和强力复苏反应的衰减[21-22]。通过我们前期研究和文献报道,Fkbp51基因敲除(Fkbp51 KO)小鼠在抑郁、焦虑、成瘾等行为学的改变,进一步证实FKBP51基因与多种应激刺激导致的精神类疾病发生具有直接联系。
6 FKBP51在代谢中的作用
6.1 HPA轴在代谢中的作用
HPA轴不仅在机体的神经调节中具有重要功能,还通过影响机体神经-内分泌-免疫调节系统,在物质代谢中发挥调节作用。例如,已发现II型糖尿病患者伴有HPA轴的功能紊乱,并且随着HPA轴紊乱程度的加重其糖脂代谢障碍进一步恶化[23]。HPA轴对代谢的调节作用,也依赖于GR的活性的变化,例如高脂诱导引起的肥胖与GR活性的改变具有直接联系,而抑制GR活性具有促使机体肥胖发生的作用。据文献报道,AgRP-特异性GR敲除小鼠(一种神经特异在AgRP神经元中敲除GR的条件性基因修饰小鼠)在经过高脂饮食后,相比于野生型小鼠,表现为能量消耗的增加,同时对高脂饮食诱导产生的肥胖具有显著的抵抗作用[24]。这表明,在高脂饮食条件下,GR在AgRP神经元调节通路中具有抑制能量消耗的作用,从而导致机体肥胖的产生。此外,GR可能通过调节脂肪细胞分化、脂肪细胞胰岛素敏感性在代谢中发挥作用。
6.2 FKBP51在代谢相关应激中的作用
高脂饮食诱导对于机体来说是一种慢性应激刺激,慢性应激也被认为是患精神疾病和代谢紊乱疾病的主要危险因素[25-26],因此机体需要相应的应激反应来抵抗或者适应这些刺激。有研究发现[27],相比于正常饮食,对小鼠进行为期8周的高脂饮食(high-fat diet,HFD)喂养后,小鼠的体重显著增加,并且下丘脑腹内侧核中Fkbp51 mRNA表达水平升高。这表明在高脂饮食刺激下,下丘脑中Fkbp51基因的表达情况与小鼠体重的增加具有显著的相关性。此外,我们的前期研究结果也发现,FKBP51 KO小鼠对高脂饮食诱导的肥胖具有明显的抵抗作用[28]。这些研究结果表明Fkbp51基因可能作为应激与代谢调节相关基因的靶点。
此外,脂肪诱导分化可以认为是一种对细胞的特殊刺激。通过细胞脂肪诱导分化实验,同样发现Fkbp51基因与脂肪诱导刺激具有显著的相关性。有文献报道[29],通过对3T3-L1和小鼠成纤维细胞进行脂肪诱导分化实验发现,敲除FKBP51后将抑制细胞向脂肪细胞的分化,并且减少脂质在细胞中的积累,表现出对该刺激的明显抵抗作用。
通过以上的研究结果,更加确定了Fkbp51基因可能是应激与代谢调节之间的一个潜在基因靶点。
7 小结
应激对机体生理功能、心理和行为活动有着极大的调节作用,是人类生活质量、身心健康和疾病的主要风险因素。一方面,应激促使机体在面对紧迫和危险时快速有效的重新分配生理和心理资源,从而使机体更好的适应并提高生存能力;另一方面,应激会影响我们的生活质量和身心健康,超负荷的应激更会引发一系列应激相关精神疾病和代谢疾病的发生。PTSD、抑郁症、社会心理应激障碍等应激相关疾病已经成为一类严重影响人类身心健康的精神疾病,而与应激相关的肥胖、糖尿病等代谢疾病同样成为阻碍人类健康的一大类疾病。因此对应激相关疾病的预防和治疗已经成为一个亟待解决的科学问题。
目前,人们大多将重点集中在应激所引发的精神障碍和心理疾病,而对应激所诱发的肥胖等代谢相关疾病的研究还相对较少。FKBP51作为免疫亲和蛋白家族的一员,通过对GR的负反馈作用来调节HPA轴对机体的调控,不仅与应激产生的精神疾病发生具有相关性,并且在多种应激产生的糖、脂代谢调节中具有重要的调节作用。因此我们可以推测,FKBP51对于各种精神类和物质类应激可能具有较为广谱的抵抗作应,调控Fkbp51基因的表达能够使机体更好的对抗不良环境、维持体内稳态。未来通过加深对Fkbp51基因在多种应激刺激下的相关研究,将为应激相关精神疾病和代谢疾病的研究和治疗提供新的思路和靶点。
[1] 罗跃嘉,林婉君,吴健辉,等. 应激的认知神经科学研究[J]. 生理科学进展. 2013(05): 345-353.
[2] 柴丽,赵博. 抑郁症与HPA轴关系及中药干预的研究进展[J]. 中国实验方剂学杂志. 2011(12): 268-271.
[3] 周江宁,闫雪波. 抑郁症发病的下丘脑中枢驱动调节机制[J]. 中国科学技术大学学报. 2008(08): 967-977.
[4] Yehuda R. Current status of cortisol findings in post-traumatic stress disorder[J]. Psychiatr Clin North Am. 2002, 25(2): 341-368.
[5] Munck A, Naray-Fejes-Toth A. Glucocorticoids and stress: permissive and suppressive actions[J]. Ann N Y Acad Sci. 1994, 746: 115-130, 131-133.
[6] Yehuda R. Advances in understanding neuroendocrine alterations in PTSD and their therapeutic implications[J]. Ann N Y Acad Sci. 2006, 1071: 137-166.
[7] de Kloet C S, Vermetten E, Geuze E,etal. Assessment of HPA-axis function in posttraumatic stress disorder: pharmacological and non-pharmacological challenge tests, a review[J]. J Psychiatr Res. 2006, 40(6): 550-567.
[8] Roy A, Hodgkinson C A, Deluca V,etal. Two HPA axis genes, CRHBP and FKBP5, interact with childhood trauma to increase the risk for suicidal behavior[J]. J Psychiatr Res. 2012, 46(1): 72-79.
[9] 陈鹏,陈崇宏,程元荣. FKBPs的研究进展[J]. 海峡药学. 2004(03): 6-10.
[10] Wochnik G M, Ruegg J, Abel G A,etal. FK506-binding proteins 51 and 52 differentially regulate dynein interaction and nuclear translocation of the glucocorticoid receptor in mammalian cells[J]. J Biol Chem. 2005, 280(6): 4609-4616.
[11] Tatro E T, Everall I P, Masliah E,etal. Differential expression of immunophilins FKBP51 and FKBP52 in the frontal cortex of HIV-infected patients with major depressive disorder[J]. J Neuroimmune Pharmacol. 2009, 4(2): 218-226.
[12] 季鑫,高春芳. TGFβ1基因单核苷酸多态性与疾病的关系[J]. 现代免疫学. 2009(02): 165-168.
[13] Binder E B, Bradley R G, Liu W,etal. Association of FKBP5 polymorphisms and childhood abuse with risk of posttraumatic stress disorder symptoms in adults[J]. JAMA. 2008, 299(11): 1291-1305.
[14] Castro-Vale I, van Rossum E F, Machado J C,etal. Genetics of glucocorticoid regulation and posttraumatic stress disorder-What do we know?[J]. Neurosci Biobehav Rev. 2016, 63: 143-157.
[15] Mehta D, Gonik M, Klengel T,etal. Using polymorphisms in FKBP5 to define biologically distinct subtypes of posttraumatic stress disorder: evidence from endocrine and gene expression studies[J]. Arch Gen Psychiatry. 2011, 68(9): 901-910.
[16] Kang H, Sayner S L, Gross K L,etal. Identification of amino acids in the tetratricopeptide repeat and C-terminal domains of protein phosphatase 5 involved in autoinhibition and lipid activation[J]. Biochemistry. 2001, 40(35): 10485-10490.
[17] Yehuda R, Cai G, Golier J A,etal. Gene expression patterns associated with posttraumatic stress disorder following exposure to the World Trade Center attacks[J]. Biol Psychiatry. 2009, 66(7): 708-711.
[18] Segman R H, Shefi N, Goltser-Dubner T,etal. Peripheral blood mononuclear cell gene expression profiles identify emergent post-traumatic stress disorder among trauma survivors[J]. Mol Psychiatry. 2005, 10(5): 500-513, 425.
[19] 安书成,安锋利. 5-羟色胺与应激反应及其抑郁症的关系[J]. 陕西师范大学继续教育学报. 2006(01): 122-124.
[20] Binder E B, Salyakina D, Lichtner P,etal. Polymorphisms in FKBP5 are associated with increased recurrence of depressive episodes and rapid response to antidepressant treatment[J]. Nat Genet. 2004, 36(12): 1319-1325.
[21] Touma C, Gassen N C, Herrmann L,etal. FK506 binding protein 5 shapes stress responsiveness: modulation of neuroendocrine reactivity and coping behavior[J]. Biol Psychiatry. 2011, 70(10): 928-936.
[22] Hartmann J, Wagner K V, Liebl C,etal. The involvement of FK506-binding protein 51 (FKBP5) in the behavioral and neuroendocrine effects of chronic social defeat stress[J]. Neuropharmacology. 2012, 62(1): 332-339.
[23] 张汝学,马海港,周珺,等. 慢性应激对大鼠糖代谢的影响及初步机制[J]. 西北国防医学杂志. 2013(03): 201-204.
[24] Shibata M, Banno R, Sugiyama M,etal. AgRP Neuron-Specific Deletion of Glucocorticoid Receptor Leads to Increased Energy Expenditure and Decreased Body Weight in Female Mice on a High Fat Diet[J]. Endocrinology. 2016: n20151430.
[25] Holsboer F. The corticosteroid receptor hypothesis of depression[J]. Neuropsychopharmacology. 2000, 23(5): 477-501.
[26] Tamashiro K L. Metabolic syndrome: links to social stress and socioeconomic status[J]. Ann N Y Acad Sci. 2011, 1231: 46-55.
[27] Balsevich G, Uribe A, Wagner K V,etal. Interplay between diet-induced obesity and chronic stress in mice: potential role of FKBP51[J]. J Endocrinol. 2014, 222(1): 15-26.
[28] 张曼,邱彬,曹勇,等. 共伴侣蛋白FKBP51在高脂诱导肥胖中的作用[J]. 中国比较医学杂志. 2015,25(7): 53-58.
[29] Stechschulte L A, Hinds T J, Khuder S S,etal. FKBP51 controls cellular adipogenesis through p38 kinase-mediated phosphorylation of GRalpha and PPARgamma[J]. Mol Endocrinol. 2014, 28(8): 1265-1275.
Regulation of the response to stress-related disorders byFkbp51
ZHANG Ling-ling, QIU Bin, YANG Zhi-wei, YONG Wei-dong
(Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences ( CAMS) &Comparative Medical Center,Peking Union Medical College ( PUMC); Key Laboratory of Human Disease Comparative Medicine, Ministry of Health;Key Laboratory of Human Disease Animal Models, State Administration of TraditionalChinese Medicine, Beijing 100021, China)
Stress response is the process that our body produces a series of nonspecific physiological and psychological response when dealing with pressureand dangers. The hypothalamus - pituitary - adrenal (HPA) axis, as the central nervous system, plays a critical functional role in regulating stress response.Glucocorticoid receptor (GR) is an important regulatory factor for HPA axis’s homeostasis, and its function needs to combine with heat shock protein(Hsp90/70) and co-chaperone proteins (FKBP51or FKBP52). FKBP51,a FK506-binding protein, is a negative regulatory of GR and HPA axis function. In recent years,Fkbp51 has been identified as a significant regulatory in the stress-related psychiatric and metabolic disorders. Here we will review the recent studies ofFkbp51on stress-related psychiatric and metabolic disorders.
Fkbp51; stress response; HPA axis; GR
国家重点基础研究发展( 973) 计划( 2013CB945001);协和青年创新基金(3332015054)。
张玲玲,女,研究方向:基因与发育生物学。E-mail: 1152156788@qq.com。
雍伟东,男,研究方向:生殖与发育生物学。Email: wyong@cnilas.org;杨志伟,男,研究方向:. 盐敏感性高血压。 Email:zhw_yang@hotmail.com。
R-332
A
1671-7856(2016)11-0090-05
10.3969.j.issn.1671-7856. 2016.11.017
2016-07-06
