生长激素基因在西藏小型猪不同生长阶段和不同组织器官中的表达
2016-12-23田雨光王玉珏
田雨光,王玉珏,岳 敏
(南方医科大学实验动物中心暨比较医学研究所,广州 510515)
研究报告
生长激素基因在西藏小型猪不同生长阶段和不同组织器官中的表达
田雨光,王玉珏,岳 敏
(南方医科大学实验动物中心暨比较医学研究所,广州 510515)
目的对西藏小型猪生长激素基因在不同脏器和不同年龄阶段的表达水平进行测定。方法采用Real-time PCR的方法,以GAPDH为内参,定量分析0岁(1日龄)、0.1岁(36日龄)、0.25岁(90日龄)、0.5岁(180日龄)、1岁(360日龄)、2岁(720日龄)、3岁(1080日龄)的西藏小型猪的心、肝、脾、肺、肾、肌肉、皮肤组织中生长激素基因mRNA表达水平,并且进行比较分析。结果生长激素基因在各个年龄阶段的西藏小型猪的心、肝、脾、肺、肾、肌肉、皮肤中均有表达。在不同脏器的表达中,生长激素基因在0岁、0.5岁时皮肤中的表达量最高,肌肉组织中的表达量最低。在0.25岁、1岁时肺组织中表达量最高,在0.1岁、3岁时肝脏表达量最高;在不同年龄阶段的表达中,生长激素基因在0.1岁时表达达到峰值。结论西藏小型猪的生长激素基因的表达呈现出明显的时空特异性。
西藏小型猪;生长激素基因;实时荧光定量PCR
生长激素(growthhormone,GH)是神经内分泌生长轴中调控动物生长发育的核心,是一种具有广泛生理功能的生长调节素,能影响几乎所有组织类型和细胞,甚至包括免疫组织、脑组织及造血系统[1]。猪的GH基因全长2231 bp,是由190个氨基酸残基组成的单链多肽[2],与牛的90%的氨基酸同源性,但两者与人的GH同源只有65%[3]。猪的GH基因由5个外显子和4个内含子构成。外显子大小分别为10、161、117、162和198 bp,内含子大小分别为242、210、197和278 bp,编码前导肽的为78 bp,编码成熟区的为570 bp,猪GH基因已被定于12号染色体[4-6]。不同种动物或同种不同个体之间的生长速度的显著差异与GH基因的结构和表达水平有着密切相关性[7]。猪生长激素通过其受体(GHR)实现信号的传递,猪GH只受一个因子即生长激素因子Ⅰ(GHF-Ⅰ)的调控,GHF-Ⅰ不仅维持GH基因的组织特异性表达,而且使表达具有发育阶段性[8]。对猪的GH基因在不同组织及年龄阶段的表达情况少有报道,本文旨在探讨西藏小型猪GH基因表达的变化情况。
1 材料和方法
1.1 实验动物及采样
选用0岁(1日龄)、0.1岁(36日龄)、0.25岁(90日龄)、0.5岁(180日龄)、1岁(360日龄)、2岁(720日龄)、3岁(1080日龄)的西藏小型猪,每个年龄段各3头,共21头。西藏小型猪来自南方医科大学实验动物中心【SCXK(粤)2011-0015】,相同的饲养环境。在南方医科大学实验动物中心大动物实验室【SYXK(粤)2011-0074】处死后,立即取其心、肝、脾、肺、肾、肌肉、皮肤组织,立即放入去除RNA酶的1.5 mL EP管中,迅速投入液氮中,带回实验室备用。
1.2 主要试剂和仪器
1.2.1 试剂
DEPC处理水:1000 mL ddH2O中加入0.1 mL DEPC,于37℃过夜温育后高压灭菌。TRIZOL Reagent,购自Invitrogen公司。无水乙醇、三氯甲烷、异丙醇,购自广东省化学试剂工程技术研究开发中心。引物由Invitrogen广州分公司合成。PrimeScript RT-PCR Kit、SYBR Premix DimerEraser(Perfect Real Time)购自Takara公司。
1.2.2 仪器
荧光定量PCR仪(美国伯乐),紫外分光光度计(美国热电),水平电泳仪(美国伯乐),凝胶成像系统(杭州朗基科学仪器有限公司),高温烤箱(上海一恒科学仪器有限公司),恒温水浴锅(上海一恒科学仪器有限公司)等。
1.3 实验方法
1.3.1 各种组织总RNA的提取及质量测定
各种组织中总RNA用酚-氯仿一步法提取,紫外分光光度计测定浓度。
1.3.2 反转录
使用Takara SYBR Premix DimerEraser(Perfect Real Time)试剂盒进行RT-PCR反应。反应体系为20 μL:包括5×PrimeScript Buffer 4 μL,PrimeScript RT Enzyme Mix 1 1 μL, Oligo Dt Primer(50 μmol/L)1 μL, Random 6 mers(100 μmol/L)1 μL, Total RNA 1 μg,加RNase free DH2O到20 μL。反应液配制在冰上进行。反转录反应条件为:37℃ 15 min(反转录反应),85℃ 5 s(反转录酶的失活反应)。
1.3.3 引物设计及PCR扩增条件
根据GenBank上猪的GH基因(X53325)、GAPDH基因(AF017079)设计引物为GHF: 5′-ATC ACATCCTCTTCGCATCTCTT-3′;GHR: 5′-TGAAATAA AAGCCCCTGTCTCC-3′;GAPDHF:5′-TTGGCTACAGC AACAGGG-3′;GAPDHR: 5′-CTGGGATGGAAACTGG AAGT-3′。以样品的cDNA第一链为模版,扩增GH基因,以GAPDH作为内参。于冰上避光加样操作,混匀,瞬时离心进行PCR扩增,扩增体系为20 μL,包括:SsoFast EvaGreen supermix(1×)10 μL;Forward primer(300 nmol/L)1 μL;Reverse primer(300 nmol/L)1 μL;RNase/DNase-free water 7 μL; cDNA template 1 μL。荧光定量PCR反应参数为:95℃ 30 s、40个循环(95℃ 1 min、55℃ 1 min,72℃ 30 s)、72℃ 10 min。1.4 荧光定量数据处理及统计学分析
每个时间点3个样本,每个样本设3个复孔。根据信噪情况的设定和调整基线和阈值,通过获得的荧光曲线和Ct值判定结果。根据GAPDH作为参照物,从而得出西藏小型猪GH在测定组织中的mRNA相对表达量。利用SPSS13.0统计学软件对数据进行重复测量数据的方差分析。
2 结果
2.1 组织样品中总RNA的提取效果鉴定

图1 RNA电泳图Fig.1 Detection of total RNA
提取好西藏小型猪各个组织总RNA后,采用琼脂糖凝胶电泳分析鉴定,鉴定结果见图1,18S和28S条带清晰,结果说明RNA具有较好的完整性。总RNA能够达到要求,进而反转录为cDNA。
2.2 西藏小型猪GH基因的实时荧光定量PCR检测分析
GH基因的扩增曲线及融解曲线如图2。扩增曲线标准,基线期、对数期和平台期三阶段分期明显,融解曲线均在一条直线上,图形为平滑的单峰曲线,且Tm温度附近无杂峰,表明引物特异性较好,没有因为引物二聚体及非特异性扩增而产生的杂带荧光干扰。说明实验结果可信度较高,能真实反应检测到的基因的表达水平。
2.3 GH基因在不同脏器及不同年龄阶段的组织表达分析
以GAPDH为内参,根据组织内基因扩增的域值循环数(Ct值),来计算GH基因的mRNA相对表达水平。从表4可以看出:在不同脏器的表达中,GH基因在0岁、0.25岁、0.5岁、1岁、2岁表达量最低都是肌肉,在0岁、0.5岁时在皮肤中的表达量最高,在0.25岁、1岁时在肺组织中表达量最高,在0.1岁、2岁、3岁时表达量最高的是肝脏。从图3、表5中可以看出,在不同年龄阶段的表达中,GH基因在0.1岁时达到峰值。所以西藏小型猪的生长激素基因的表达呈现出明显的时空特异性。
经统计学分析发现西藏小型猪GH基因在不同脏器中的表达有显著性差异(P<0.05),在不同年龄阶段的表达也均有显著性差异(P<0.05)。
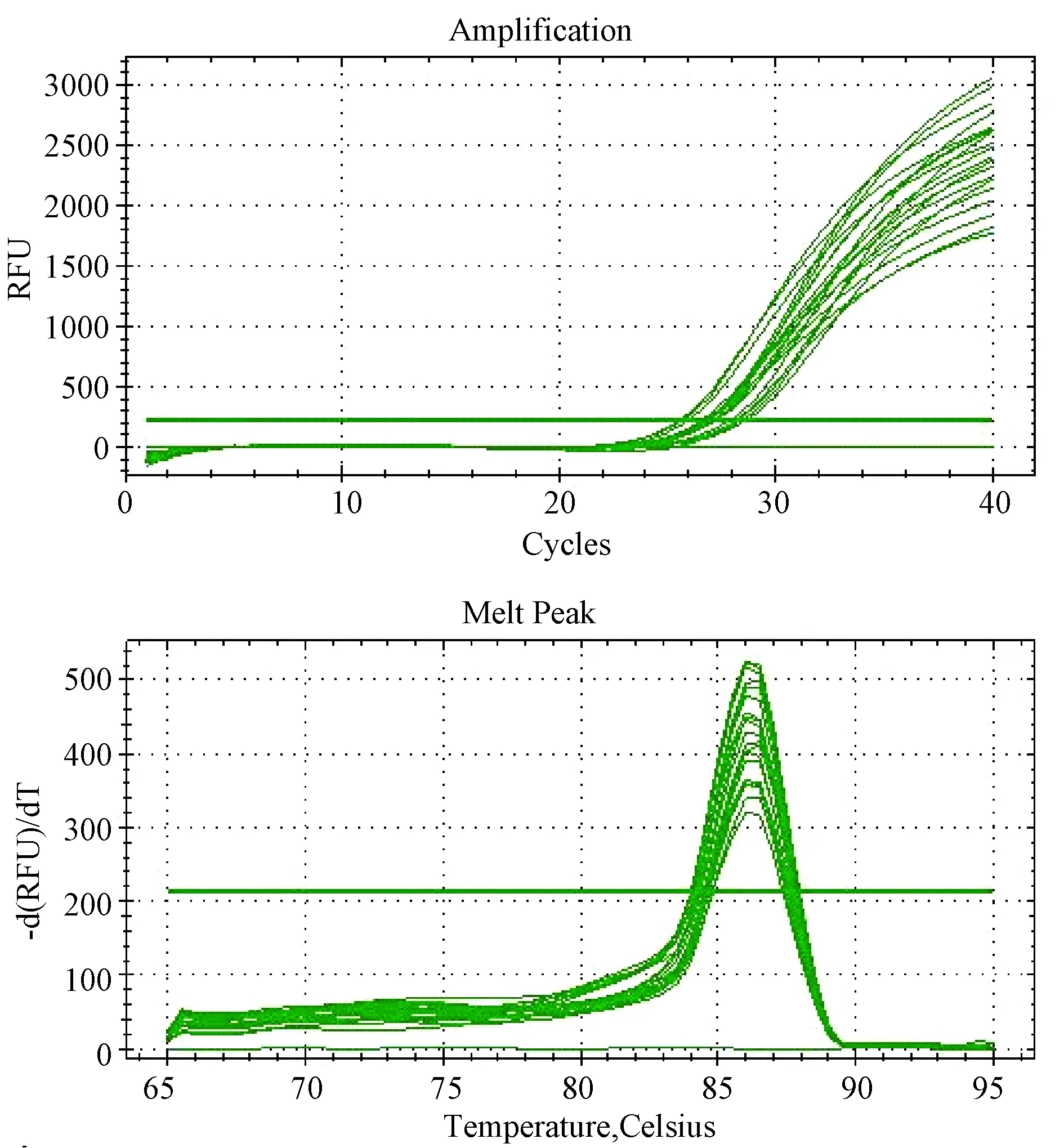
图2 西藏小型猪GH基因片段实时定量扩增曲线和融解曲线Fig.2 Amplification plots and dissociation curves of Tibet mini-pig GH gene

表4 西藏小型猪生长激素基因在不同脏器中的mRNA相对表达Tab.4 GH mRNA of Tibet mini-pig relative expression in different organs
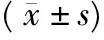
表5 西藏小型猪生长激素在不同年龄阶段中的mRNA相对表达Tab.5 GH mRNA of Tibet mini-pig relative expression in different age stages

图3 西藏小型猪生长激素基因 mRNA在不同年龄阶段的相对表达趋势图Fig.3 GH mRNA of Tibet mini-pig relative expression tendency in different age stages
3 讨论
对于动物来说,不同品种、不同生长发育阶段及不同脏器,基因表达差异都较大。本研究通过实时荧光定量PCR测定了西藏小型猪的GH基因在不同年龄阶段不同组织中的表达分布情况。
2013年单艳菊等[9]采用实时荧光定量PCR方法研究生长速度不同的高邮鸭和金定鸭13、17、21、25、27胚龄和出雏后7日龄时垂体GH基因mRNA的表达水平。结果表明两个鸭种垂体GHmRNA表达水平均随着胚龄(或日龄)的增加而增加,而本文就西藏小型猪GH基因在不同年龄阶段中同一脏器中的表达进行研究同样发现表达具有一定的规律,GH基因在所有脏器中均在0.1岁时达到了峰值,后不断降低。2015年闫云峰[10]等利用荧光定量PCR SYBR Green Ⅰ荧光染料法,对绵羊肠系膜淋巴结、心脏、肝脏、垂体、大脑、肾脏、骨骼肌、皮肤、肺脏、睾丸和脾脏11个组织中的GH基因的表达水平进行相对定量分析。结果表明,GH基因在睾丸、肠系膜淋巴结和脾脏中的表达量显著高于心脏、肝脏、大脑、肾脏和骨骼肌,同样本文研究GH基因在同一年龄阶段不同脏器的表达中,GH基因在0岁、0.25岁、0.5岁、1岁、2岁表达量最低都是肌肉,在0岁、0.5岁时在皮肤中的表达量最高,在0.25岁、1岁时在肺组织中表达量最高,在0.1岁、2岁、3岁时表达量最高的是肝脏。说明在同一年龄阶段,不同脏器表达量均不同。比较有特点是:在0岁、0.5岁时表达量最高的是皮肤,最低的是肌肉;0.25岁时表达量最高的是肺组织,最低的是肌肉。所以西藏小型猪的生长激素基因的表达呈现出明显的时空特异性。
[1] 郑茂恩,潘登科,马月辉,等.小型猪生长激素基因研究进展[J].实验动物科学,2007,24(6):107-110.
[2] Vize P D,Wells J R E. Isolation and characterization of the porcine growth hormone gene[J]. Gene,1987,55(2-3):339-344.
[3] 刘德武,杨关福,张细权.猪神经内分泌生长轴各因子及相关基因的研究进展[J].农业生物技术学报,2014,12(1):109-115.
[4] Yerle M,Lahbib-Mansais Y,Thomsen P D,etal. Localization of the porcine growth hormone gene to chromosome 12 pl.2—>p1.5[J].Anim Genet,1993,24(2):129-131.
[5] Larsen N J,Nielsen V H. ApaⅠ and CfoⅠ polymorphisms in the porcine growth hormone gene[J].Anim Genet,1993,24(1):71.
[6] 王玉珏,岳敏,顾阳,等.西藏小型猪GH基因部分序列的SNP分析[J].中国比较医学杂志,2015,25(1):50-54.
[7] 杨晓静.猪骨骼肌生长及肌纤维类型分布的分子机理研究[D].南京,南京农业大学,2004.
[8] Magri K A, Adano M, Leroith D,etal.The inhibition of insulin action and glucose metabolism by porcine growth hormone in porcine adipocytes is not the result of any decrease in insulin binding or insulin receptor kinase activity[J]. Biochem J,1990,226(1):107-113.
[9] 单艳菊,束婧婷,徐文娟,等. 不同鸭种胚胎期和岀雏早期生长轴GH、GHR和IGF-Ⅰ基因mRNA差异表达分析[J].农业生物技术学报,2013,21(4):421-427.
[10] 闫云峰,杨华,杨永林,等.萨福克羊GH和IGF-1基因组织表达水平的分析[J].家畜生态学报,2014,35(4):18-28.
Study on the expression of Growth Hormone gene in different tissues and different growth stages of Tibet-minipigs
TIAN Yu-guang, WANG Yu-jue, YUE Min
(Laboratory Animal Center, Southern Medical University, Guangzhou 510515,China)
Objective To study the expression of Growth Hormone (GH) gene in different tissues and different growth stages of Tibet-minipigs. Methods The expression level ofGHgene in heart, liver, spleen, lung, kidney, muscle, skin tissue of Tibet mini-pig was analyzed by Real-time PCR in 0 years old (1 days), 0.1 years old (36 days), 0.25 years old (90 days), 0.5 years old (180 days), 1 years old (360 days), 2 years old (720 days), and 3 years old (1080 days).ResultsThe expressions ofGHmRNA could be detected in various tissues (heart, liver, spleen, lung, kidney, muscle, skin) in different growth stages (0, 0.1, 0.25, 0.5, 1, 2, 3 years old) in Tibet mini-pigs. TheGHgene was most highly expressed in skin in 0, 0.5 years old and most lowly expressed in muscle comparing with other tissues. Moreover, theGHgene was also most highly expressed in lung and liver in 0.25, 1 years old and 0.1, 3 years old, respectively. The expression level ofGHgene reached the peak in 0.1 years old among different growth stages. Conclusion The expression ofGHgene in Tibet mini-pig showed an obvious temporal and spatial specificity.
Tibet-minipigs;GHgene;Real-time PCR
国家自然科学基金(801402625);中国博士后自然科学基金(2014M550439);广东省科技计划项目(2016A030303008);南方医科大学2015科研助手项目(C1032246)。
田雨光(1987-),男,理学博士,研究方向:比较医学和人类疾病动物模型。E-mail: yuguang.tian@qq.com。
岳敏(1982-),女,医学博士,实验师,研究方向:比较医学和人类疾病动物模型。E-mail: 343779791@qq.com。
R-332
A
1671-7856(2016)11-0001-05
10.3969.j.issn.1671-7856. 2016.11.001
2016-07-12
