早胜牛及其杂交类群GH基因遗传多态性研究
2016-12-23徐建峰容维中郭海龙
徐建峰,容维中,王 珂,郭海龙
(甘肃省畜牧兽医研究所,甘肃 平凉 744000)
早胜牛及其杂交类群GH基因遗传多态性研究
徐建峰,容维中*,王 珂,郭海龙
(甘肃省畜牧兽医研究所,甘肃 平凉 744000)
[目的]为深入探究早胜牛的分子遗传特性及潜力,重视和保护地方优秀种质资源,加快甘肃省肉牛新品种选育。[方法]以GH 基因作为影响早胜牛及其杂交类群生长发育性状的候选基因,采用PCR-SSCP方法和DNA测序技术分析了GH基因Exon2和Exon5两个位点的遗传多态性。[结果]表明:GH基因存在遗传多态性,其中,Exon2位点检测到C1059T和C1150A 两处SNPs,产生了AA、AB和BB 三种基因型;Exon5位点检测到C2258T、C2277T和 A2291C三处SNPs,产生了CC和CD两种基因型。[结论]为开展早胜牛GH基因遗传多态性与其生产性能的相关性研究提供了一定的理论依据。
早胜牛;GH基因;PCR-SSCP;品种;选育
早胜牛是在陇东早胜塬等沟壑山区特有的黄土高原自然环境下,引入秦川牛经过长期驯化和杂交选育形成的地方群体,具有培育现代肉牛的潜力和生产以沉积脂肪为特点的优质高档牛肉的潜质[1]。
随着分子生物学技术的快速发展,从分子水平上探索物种的遗传多样性,已成为群体遗传学和进化生物学研究的一个重要领域,也使得在人为选留地方群体优良特性的基础上,应用分子辅助标记选择技术培育以肉用性状为主的肉牛新类群(品种)成为可能。部分研究[2-5]表明,生长激素基因(growth hormone,GH)是动物生长发育和代谢的主要调节因子,具有促进蛋白质合成及骨骼肌肉生长、减少脂肪沉积、提高动物生长速度和参与动物免疫及泌乳等功能。
本研究以早胜牛及其杂交类群为试验对象,以GH基因作为影响生长发育性状的候选基因,采用 PCR-SSCP 技术对GH基因外显子2及外显子5进行多态性分析,旨在深入探究早胜牛的分子遗传特性及潜力,为重视和保护地方优秀种质资源,加快我省肉牛新品种选育提供分子水平上的依据和参考。
1 材料与方法
1.1 材料
1.1.1 血样的采集 在庆阳及平凉市规模养殖企业及散养户,采集早胜牛及其杂种牛血样240份,每份血样7 mL,低温条件下带回实验室,于-20℃超低温冰箱保存。
1.1.2 引物的设计与合成 参照已发表在Gen Bank上的GH基因核苷酸序列(登录号:M57764),采用Prime 5.0 软件设计2对引物,由北京三博远志生物技术有限责任公司进行合成,引物信息见表1。
1.1.3 主要试剂 Taq Master Mix反应混合液、GoldView (GV)染色剂、Tris-HC1缓冲液、N,N-二亚甲双丙烯酰胺、乙二胺四乙酸二钠等试剂均购自北京三博远志生物技术有限责任公司,血液DNA提取试剂盒购自Omegabiotek公司。
1.2 方法
1.2.1 基因组DNA提取 采用D3471型血液DNA提取试剂盒对牛冷冻血液DNA进行提取,然后用1%浓度的琼脂糖凝胶电泳检测DNA纯度和分光光度计检测OD260/OD280值。

表1 引物信息
1.2.2 PCR扩增 PCR反应体系:总体积50 μL,其中2×Taq Master Mix 混合液25 μL,上下游引物(10 pmol/μL)各2 μL,DNA模板(100 ng/μL)2 μL,ddH2O 19 μL。PCR反应条件::94℃预变性5 min,32个循环(GH-2:94℃变性5 min,60℃退火50 sec,72℃延伸50 sec;GH-5:94℃变性30 sec,51℃退火40 sec,72℃延伸50 sec),72℃延伸8 min,4℃保存。PCR 产物经1%琼脂糖凝胶电泳检测结果。
1.2.3 SSCP检测与测序 取2 μLPCR产物与6 μL变性缓冲液(98%甲酰胺、10 mmol/L EDTA、0.025%溴酚兰、0.025%二甲苯青)混匀,98℃变性10 min后置于冰水浴上5 min,然后分别上样于不同浓度(GH-2为8%、GH-5为12%)和交联度为29:1的非变性聚丙烯酰胺凝胶,在4℃、220 v的条件下预电泳20 min,然后将电泳槽接通电源后放在冰箱中(4℃、140v)恒温恒压电泳12~18h。电泳结束后,用优化后的银染法进行染色,根据染色后条带位置及数量判定不同基因型,并将不同基因型个体送至北京三博远志生物技术有限责任公司进行纯化和测序。
1.2.4 数据分析 利用PopGen32软件计算基因型频率、等位基因频率、有效等位基因数(Ne)、纯合度(Ho)、杂合度(He),利用PIC CALC V0.6软件计算多态性信息含量(PIC)。
2 结果
2.1 基因组DNA提取
采用试剂盒法提取的DNA条带清晰,无拖尾现象(图1)。经分光光度计检测,OD260/OD280值为1.7,纯度较好。

图1 血液基因组 DNA 凝胶电泳图
2.2 PCR扩增
对240头早胜牛及其杂交类群GH基因第2外显子及第5外显子进行PCR扩增,扩增产物用1%琼脂糖凝胶电泳检测(图2、图3)。结果显示,扩增片段与目的片段大小一致,条带特异性良好,可以进行SSCP分析。
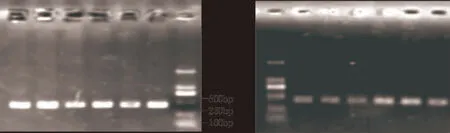
图2 Exon2 位点 PCR 扩增产物图3 Exon5 位点 PCR 扩增产物
2.3 SSCP多态性检测
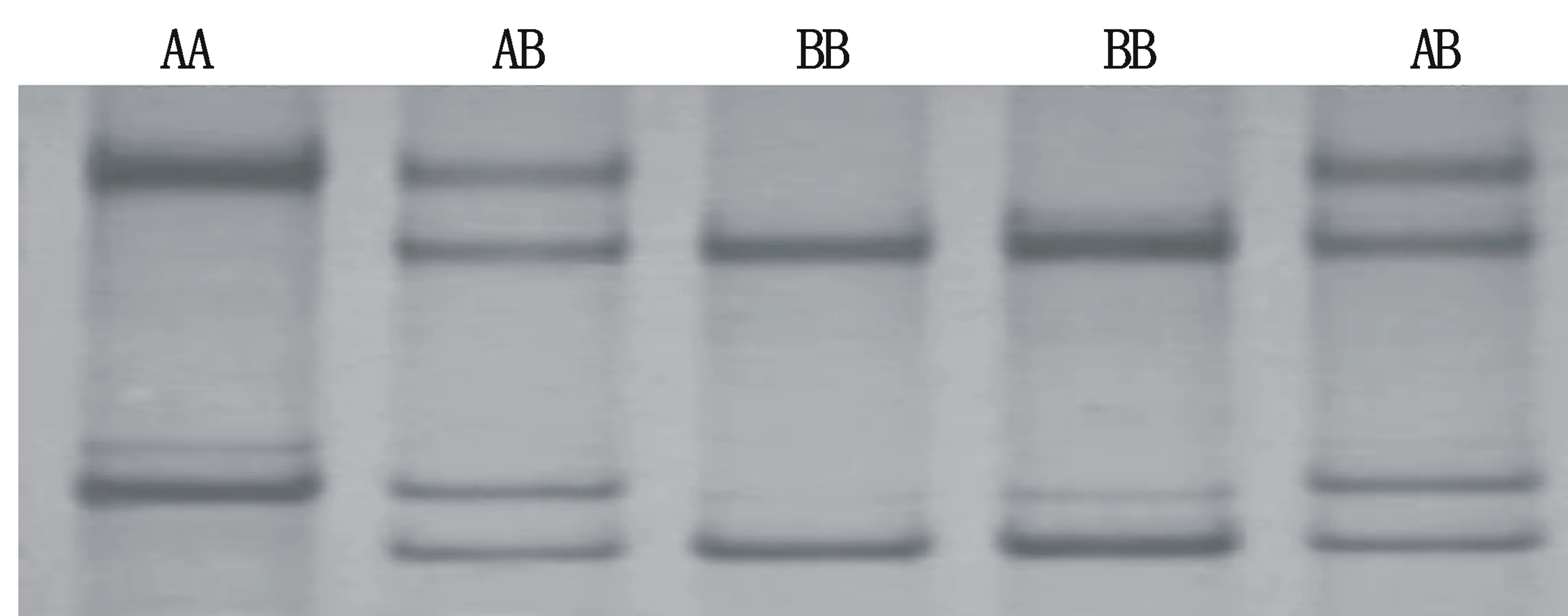
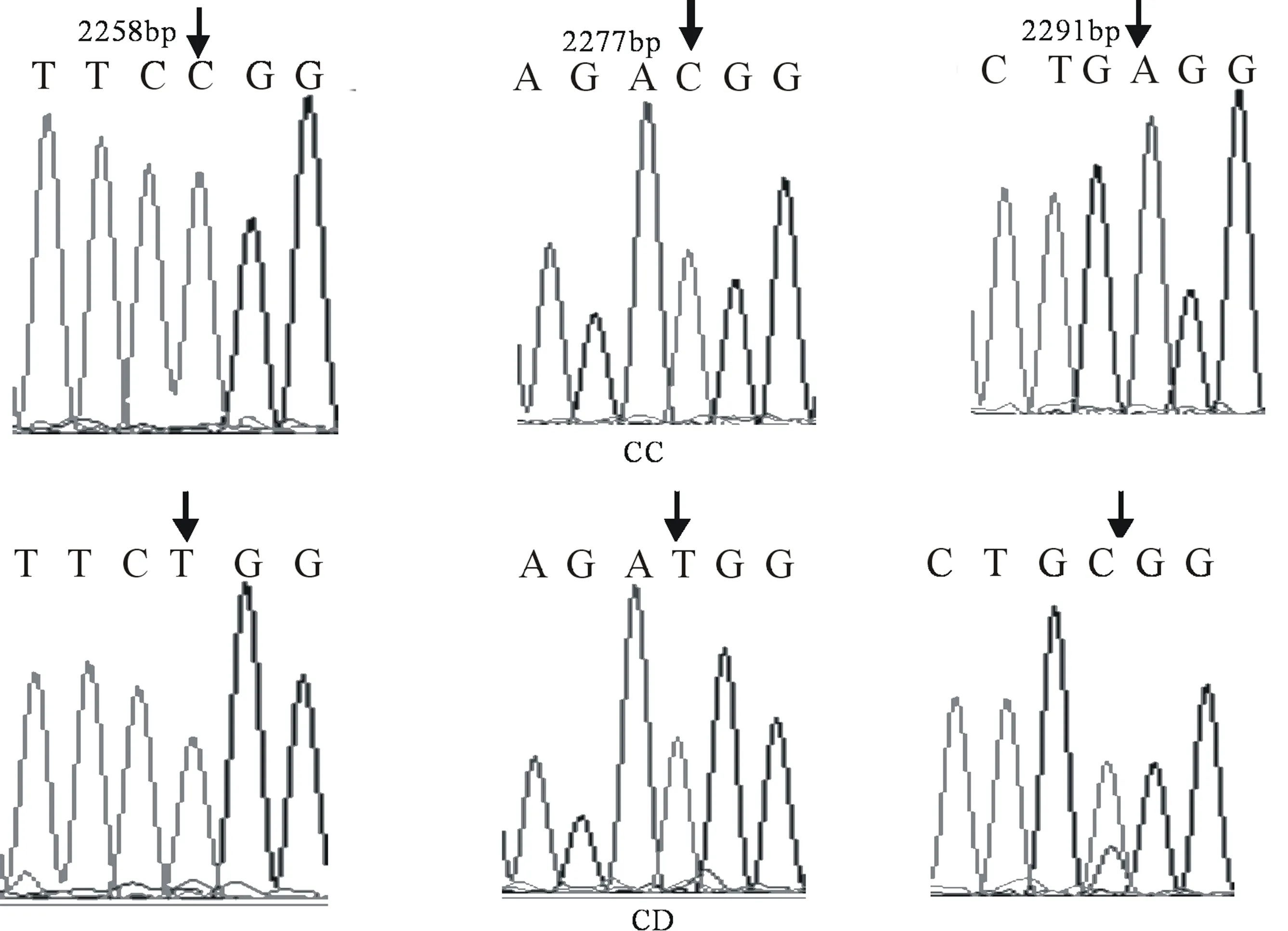
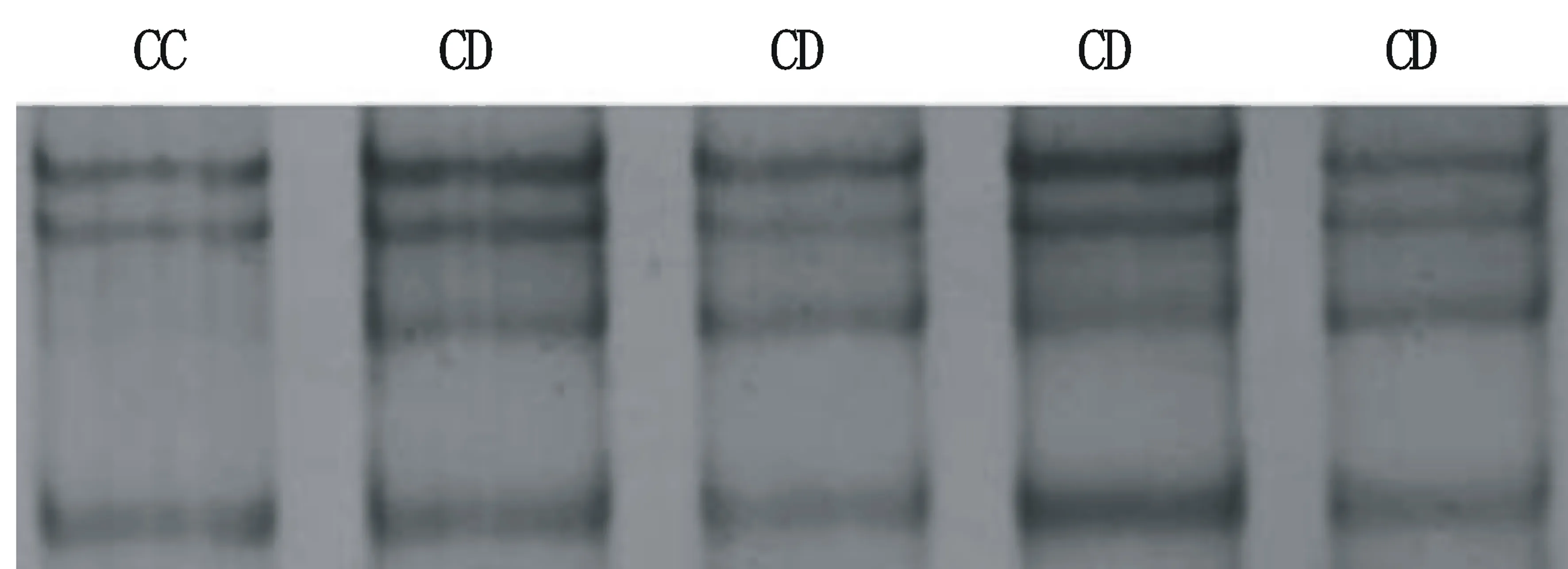
经PCR-SSCP检测,发现GH基因Exon2位点及Exon5位点均存在遗传多态性,其中,Exon2位点发现C1059T和C1150A 两处SNPs(图4),产生了A、B 两个等位基因和AA、BB、AB三种基因型(图5)。Exon5位点发现C2258T、C2277T、 A2291C三处SNPs(图6),产生了C、D两个等位基因和CC、CD两种基因型(图7)。
Exon2位点,早胜牛及其杂交类群体中等位基因A的基因频率高于等位基因B,为优势等位基因;基因型频率从大到小依次为AA、BB和AB型,AA型为优势等位基因型。该群体纯合度接近1,趋于纯合状态;PIC<0.25,属于低度多态(表2)。
Exon5位点,早胜牛及其杂交类群体中C为优势等位基因,CD型为优势等位基因型。该群体纯合度较高,且0.25 图4 Exon2 位点不同基因型测序图 图5 Exon2 位点 PCR-SSCP 检测结果 图6 Exon5 位点不同基因型测序图 图7 Exon5 位点 PCR-SSCP 检测结果 表2 GH基因Exon2位点遗传多态分析 表3 GH基因Exon5位点遗传多态分析 本研究采PCR-SSCP和DNA测序技术对早胜牛及其杂交类群GH基因不同位点的多态性进行了分析,发现GH基因Exon2位点上存在两处SNPs和3种基因型,这与王利明等[6]研究发现的信阳水牛第2外显子存在1处SNP(G413A)和产生了CC、CD和DD三种基因型的结果类似。Exon5位点上检测到三处SNPs,这与薛恺等[7]在南阳牛中发现的研究结果一致,除以上突变外,高雪等[8]、郝灵慧等[9]还在2141bp、2386bp处检测到C/G、T/C的替换,这表明在牛GH 基因第5外显子多态性丰富,属于高突变区。此外,高雪等[10]在第5外显子检测到3种基因型,而本研究发现两种基因型,这可能与牛种不同和样本量采集范围有关,有待进一步验证。 群体多态信息含量(PIC)与群体杂合度(He)都是反映群体遗传多样性的指标,其数值的大小表明群体中遗传变异水平的高低。本研究发现,GH基因Exon2和Exon5位点分别呈现出低度多态和中度多态,表明GH基因Exon5位点,早胜牛纯合度较高,群体遗传变异较大、可选择的空间很大,适合作为经济性状与基因型间连锁分析的候选标记,以便为早胜牛遗传资源的保护和肉用潜力的开发利用提供依据。 [1] 甘肃省畜牧厅主编.甘肃省畜禽品种志[M].兰州:甘肃人民出版社,1986. [2] Sweeney G,et al.Leptin signalling[J].Cell Signal,2002,14(8):655-663. [3] Malveiro E,PereiraM,Marques P X,Santos IC,Belo C,Renaville R,Cravador A. Polymorphisms at the five exons of the growth hormone gene in the algarvia goat possible association with milk traits[J].Small Ruminant Research, 2001,(41):163-170. [4] Yao J,Aggrey S E, ZadwornyD, Hayes J F, Kuhnlein U. Sequence variations in the bovine growth hormone gene characterized by single-strand conformation polymorphism (SSCP) analysis and their association with milk production traits in Holsteins[J].Genetics, 1996, 144 (4):1809-1818. [5] 黎 真,牛 冬,阮 晖,等.影响畜禽重要经济性状的主效基因研究进展[J].家态生态,2004,25(4):147-151. [6] 王利明,梁小娟,石亚飞,等.信阳水牛GH基因多态性与部分生长性状的相关性[J].安徽农学通报,2012,18(21):75-77. [7] 薛 恺.南阳牛Myf5 PouIf1以及GH基因多态性及其与生长发育性状关系的研究[D].杨凌: 西北农林科技大学, 2006. [8] 高 雪,徐秀容,许尚忠,等.中国地方黄牛GH基因遗传多态性研究[J].畜牧兽医学报,2005,36(10):991-995. [9] 郝灵慧.草原红牛GH和GHR基因遗传多态性研究及其与胴体性状的相关分析[D].沈阳:吉林大学,2008. [10] 高 雪,徐秀容,许尚忠,等.影响牛生长发育性状的GH 基因遗传效应分析[J].中国农业科学,2006,39(3):606-611. Polymorphism Analysis of Growth Hormone Gene(GH) in Zaosheng Cattle and Hybrid Groups XU Jian-feng, RONG Wei-zhong, WANG Ke, GUO Hai-long (AnimalhusbandryandVeterinaryResearchInstituteinGansuProvince,PingLiang,Gansu744000) GH gene were used as candidate gene which was influenced with growth and development traits in zaosheng cattle and hybrid groups. PCR-SSCP and DNA sequencing technologies were conducted to detect their single nucleotide polymorphism. The results showed that there were two SNPs (C1059T、C1150A) and three genotypes in the exon 2 of GH gene, and three SNPs (C2258T、C2277T、A2291C) and two genotypes in the exon 5 of GH gene. Therefore, the study result provided certain theoretical basis with association study of genetic polymorphism of GH gene and production performance in. Zaosheng cattle; GH gene; RCP-SSCP; breed; breeding 2015-12-21修改日期:2015-12-29 甘肃省技术研究与开发专项计划“分子遗传标记在早胜牛遗传多样性研究中的应用” (项目编号:1207TCYL016)。 徐建峰(1981-),男,汉,甘肃天水人,助理研究员,E-mail:710401384@qq.com。 容维中(1965-),男,汉,甘肃平凉人,副研究员,研究方向为动物营养及牛羊繁殖技术。 S823.2 A 1001-9111(2016)01-0006-04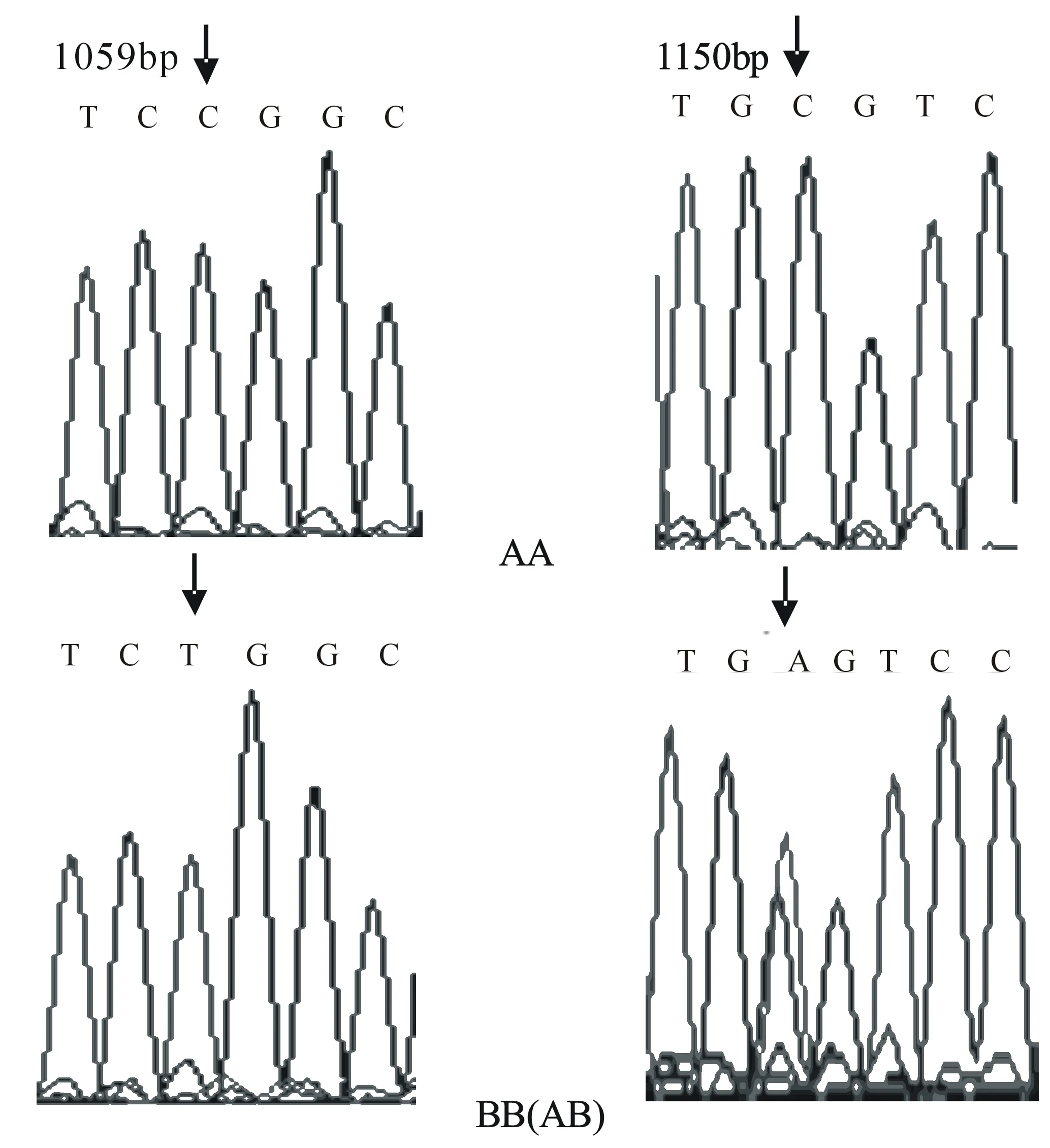


3 分析与讨论
