微波辅助提取酢浆草黄酮的工艺优化
2016-12-22杨文婷艾西韦琴
杨文婷,艾西,韦琴
(武汉工商学院环境与生物工程学院,湖北武汉430065)
微波辅助提取酢浆草黄酮的工艺优化
杨文婷,艾西,韦琴
(武汉工商学院环境与生物工程学院,湖北武汉430065)
采用单因素试验和正交设计对微波辅助提取酢浆草黄酮的工艺进行了优化,以总黄酮的得率为参考指标,考察微波作用时间、料液比、乙醇浓度、浸泡时间等因素对得率的影响。结果表明,酢浆草黄酮的最佳提取条件为微波小火处理2min、乙醇浓度30%、料液比1∶10(g/mL),在此条件下,黄酮得率为26.80mg/g。
微波提取法;酢浆草;黄酮;正交设计
酢浆草(Oxalis corniculata L.)亦称大酸叶草、铜锤草、紫花酢浆草,是一类长年生宿根性的阔叶草本植物。其繁殖力较强、生长能力旺盛,在南方地区以野生杂草生长[1]。其在中国古代医书中有记载用于水泻、痢疾、湿热黄疸、疟疾、咽喉肿痛等的治疗[2];现代药理研究表明,酢浆草提取物具有抗菌、抗氧化、抗炎、抗肿瘤、护肝、促进骨形成等作用[3-11]。成分分析表明酢浆草的活性成分主要包括多糖类、有机酸类、多酚类、黄酮类,其中黄酮类的药理作用最为显著[11-13]。目前文献中对酢浆草黄酮类化合物提取方面的研究报道较少,主要集中于对酢浆草的杂草治理及酢浆草提取物的活性研究方面。
本文以酢浆草全草为材料,探讨微波辅助乙醇提取总黄酮的最佳工艺,微波辅助提取具有高效、耗时短、操作简捷的优点[14],结合单因素试验和正交设计,对提取的关键条件进行优化,为酢浆草资源的深入开发利用提供一定基础。
1 材料与方法
1.1 材料与试剂
酢浆草:2015年3月采摘自武汉工商学院草坪;95%乙醇(分析纯):天津市百世化工有限公司;芦丁对照品(纯度≥95%):国药集团化学试剂有限公司;亚硝酸钠(分析纯):洛阳市化学试剂厂;硝酸铝(分析纯):天津市天力化学试剂有限公司;氢氧化钠(分析纯):天津市风船化学试剂科技有限公司。
1.2 仪器与设备
微波炉:佛山市顺德区美的微波电器制造有限公司;722E型可见分光光度计:上海光谱仪器有限公司;SHB-Ш循环水式多用真空泵:郑州长城科工贸有限公司;DG120型四两装中药材粉碎机:浙江省瑞安市春海药材器械厂。
1.3 方法
1.3.1 标准曲线的绘制
精密称取200mg芦丁于100mL容量瓶,加70mL 95%乙醇,水溶微热使其充分溶解,放冷,加95%乙醇定容至刻度,得0.2mg/mL芦丁标准溶液,4℃保存备用。分别精密吸取标准溶液0、1.0、2.0、3.0、4.0、5.0、6.0mL,置于7个25mL的容量瓶,各加水至6mL,加0.7mol/L氢氧化钠溶液1mL,摇匀,静置6min,加0.5 mol/L硝酸铝溶液1mL,摇匀,静置6 min,加入1.0mol/L氢氧化钠溶液10mL,蒸馏水定容至25mL,静置15min后,500 nm下测吸光度,以浓度C对吸光度A作标准曲线,得回归方程A=10.71C-0.000 8,R2= 0.999 4,在0.008mg/mL~0.048mg/mL范围内,吸光度与浓度呈良好线性关系[14-15]。
1.3.2 微波辅助提取酢浆草黄酮的步骤
酢浆草全草洗净,40℃烘干,粉碎,阴凉处保存备用。精确称量2.00 g酢浆草粉末,加入一定量的一定浓度乙醇,微波小火(功率240W)处理一定时间,提取液4 000 r/min离心15min,上清减压过滤,用于测定黄酮含量。
1.3.3 单因素试验
1.3.3.1 料液比
准确称取酢浆草2.00 g6份,加入一定量40%乙醇,料液比分别达到1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/mL),微波小火处理2min,4 000 r/min离心15min,上清减压过滤后,按1.3.4步骤测定黄酮得率。
1.3.3.2 乙醇浓度
准确称取酢浆草2.00 g6份,分别加入40mL20%、30%、40%、50%、60%、70%乙醇,微波小火处理2 min,4 000 r/min离心15min,上清减压过滤后,按1.3.4步骤测定黄酮得率。
1.3.3.3 微波时间
准确称取酢浆草2 g6份,加入浓度为40%乙醇40 mL,分别微波小火处理1.25、1.50、1.75、2、2.25、2.5min,4 000 r/min离心15min,上清减压过滤后,按1.3.4步骤测定黄酮得率。
1.3.3.4 浸泡时间
准确称取酢浆草2 g6份,加入40%乙醇40mL,分别室温浸泡时间30、60、90、120、150、180min后,微波小火处理2min,4 000 r/min离心15min,上清减压过滤后,按1.3.4步骤测定黄酮得率。
1.3.4 酢浆草黄酮得率的测定方法
精密吸取提取液1mL于25mL容量瓶中,另取标准曲线所用的空白组为对照品,用蒸馏水补至6mL,加入1.0 mL 0.7 mol/L亚硝酸钠摇匀,静置6 min后加入1.0mL 0.5mol/L硝酸铝,6min后再加入10mL 1 mol/L氢氧化钠,蒸馏水定容至刻度,混匀,静置15 min后于500 nm测吸光度,按公式(1)计算黄酮得率。

式中:C为容量瓶中测量液的总黄酮浓度,mg/ mL;V1为测量液的定容体积,mL;V2为测量时量取的体积,mL;V3为提取液的体积,mL;m为样品重量,g。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 料液比对酢浆草黄酮得率的影响
料液比对酢浆草黄酮得率的影响见图1。

图1 料液比对酢浆草黄酮得率的影响Fig.1 Effectof thesolid liquid ratio on theyield of flavonoids from Oxaliscorniculata L.
由图1可知,黄酮的得率随着加入溶剂体积的增加而增加,当料液比达到1∶15(g/mL)时,黄酮的得率最高。但超过1∶15(g/mL)后,黄酮得率反而有一定降低,分析可能是溶剂增加之后增加了一些其他类型杂质的溶出,对黄酮类化合物的溶出产生竞争抑制,因此选取料液比为1∶15(g/mL)。
2.1.2 乙醇浓度对酢浆草黄酮得率的影响
乙醇浓度对酢浆草黄酮得率的影响见图2。

图2 乙醇浓度对酢浆草黄酮得率的影响Fig.2 Effectof theethonal concentration on the yield of flavonoids from Oxalis corniculata L.
由图2可知,随着乙醇浓度的提高,黄酮的得率增大,乙醇浓度达到30%时,黄酮得率最佳,当乙醇浓度高于30%之后反而呈下降趋势,可能是因为乙醇浓度提高之后某些极性更小的物质溶解增加,因此初步选定乙醇浓度为30%。
2.1.3 微波时间对酢浆草黄酮得率的影响
微波时间对酢浆草黄酮得率的影响见图3。

图3 微波时间对酢浆草黄酮得率的影响Fig.3 Effectofm icrowave-assisted extracting timeon the yield of flavonoids from Oxaliscorniculata L.
由图3可知,黄酮得率随着微波时间的延长而增加,当微波处理时间超过1.75min后,黄酮得率反而减小,可能微波时间过长时,产热过多,对黄酮类化合物有一定破坏。因此,初步拟定微波处理时间为1.75min。
2.1.4 浸泡时间对酢浆草黄酮得率的影响
浸泡时间对酢浆草黄酮得率的影响见图4。

图4 浸泡时间对酢浆草黄酮得率的影响Fig.4 Effectof soaking timeon the yield of flavonoids from Oxaliscorniculata L.
由图4可知,浸泡时间达到120min时黄酮的得率最佳,但整体而言,浸泡时间对黄酮的得率影响不明显,因此不选择此因素进行正交设计。
2.2 正交试验结果与分析
根据单因素试验结果,选定乙醇浓度、微波时间和料液比3个影响较大的因素进行正交设计,因素及相应的水平选择情况见表1,正交设计及试验结果见表2。
由表1、表2可知,极差分析表明,最佳提取条件A2B3C1为乙醇浓度30%,微波处理时间是2min,料液比1∶10(g/mL),各因素对黄酮的影响依次从大到小为:乙醇浓度>料液比>微波时间,说明在具体生产工艺确定中,乙醇浓度要严格控制。

表1 因素与水平表Table1 Factorsand levels

表2 正交设计及试验结果Table2 Resultsof orthogonaldesign
2.3 验证试验
在料液比1∶10(g/mL),乙醇浓度30%,微波小火2min的条件下进行3次验证试验,见表3。
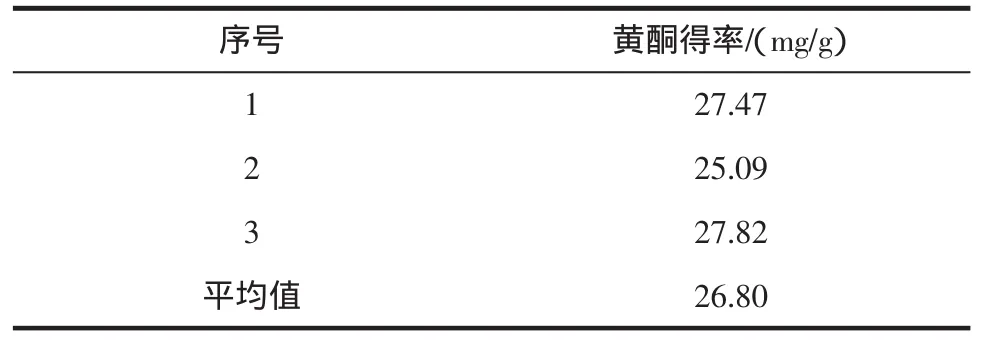
表3 验证试验结果Table3 Resultsof verification test
所得得率的平均值为26.80mg/g,RSD=5.54%,说明该工艺条件下试验重复性良好。
3 小结
经过单因素试验和正交试验确定微波辅助提取酢浆草黄酮的最佳条件为乙醇浓度30%、料液比1∶10(g/mL)、微波处理时间2min,在此条件下,黄酮得率为26.80mg/g。酢浆草中极性物质在微波场中易吸收能量转化为热能,使内部温度迅速升高,促进细胞内成分的释放,可以大大缩短提取时间,提高提取效率[16]。此法设备要求不高,提取流程简单,耗费时间较短,适用于酢浆草黄酮的提取分离,可为后期进一步深入研究其有效活性成分、开发新的用途提供了研究基础。
[1]陈明林,刘登义,李珊珊.酢浆草属5种植物的微形态特征观察[J].植物资源与环境学报,2007,16(3):7-18
[2]余汉华,王勇,肖英华,等.酢浆草的生药鉴定[J].中国民族民间医药,2005(3):178-179
[3] ADutta,CHandique,M Lahkar.Evaluation ofanti-inflammatory activity of Oxalis corniculata in experimentally induced inflammatory bowel disease in rats[J].International Journal of Basic&Clinical Pharmacology,2015,4(4):744-748
[4] Sreejith G,JayasreeM,Latha PG,etal.Hepatoprotective activity of Oxalis corniculata L.ethanolic extractagainst paracetamol induced hepatotoxicity in Wistar rats and its in vitro antioxidant effects[J]. Indian Journalof ExperimentalBiology,2014,52(2):147-152
[5]刘晓艳,董莉,刘亭,等.酢浆草提取物对成骨细胞增殖及分化的影响[J].中国实验方剂学杂志,2015,21(1):117-120
[6]丁良,李静,杨慧.酢浆草提取物体外抗氧化活性研究[J].辽宁中医杂志,2011(10):2055-2057
[7] 李静.酢浆草提取物体外抗肿瘤和抗氧化研究[D].保定:河北大学,2011
[8]李若男.酢浆草清除DPPH有机自由基活性研究[J].安徽农业大学学报,2010,37(4):744-747
[9]刘世旺,徐艳霞,石宏武.酢浆草乙醇提取物对细菌生长曲线的影响[J].北方园艺,2007(3):113-115
[10]崔珺.苗药酢浆草抗炎镇痛有效组分研究[D].贵阳:贵阳医学院, 2015
[11]王含玉.酢浆草对a-萘异硫氰酸酯所致大鼠肝损伤的干预作用[D].保定:河北大学,2015
[12]贾纪萍,熊玥,严宏凤,等.酢浆草提取工艺的研究及总有机酸的测定[J].广东化工,2015,42(20):135-136
[13]李胜华.黄花酢浆草的化学成分研究[J].中国药学杂志,2013(21): 1820-1822
[14]刘焕云,王海燕,梁燕.龙眼壳黄酮的微波提取及体外抗氧化活性研究[J].天然产物研究与开发,2015(3):438-441
[15]赵跃刚,王隶书,范艳君,等.酢浆草药材中总黄酮的含量测定[J].时珍国医国药,2011,22(1):81-82
[16]焦士龙.微波提取中药有效成分实验研究[D].天津:天津大学, 2006
Optim ization of M icrowave-assisted Extracting Process of Flavonoids from Oxalis corniculata L.
YANGWen-ting,AIXi,WEIQin
(Environmentaland Biological Engineering College,Wuhan Technology and BussinessUniversity,Wuhan 430065,Hubei,China)
To optimize themicrowave-assisted process of extracting flavonoids from Oxalis corniculata L.Extracting time,solid-liquid ratio,ethanol concentration and soaking timewere determinated by the single-factor experimentand orthogonaldesign,using the yield of total flavonoidsas index.Results showed that the optimum conditionswere extracting time 2min,ethanol concentration 30%,solid-liquid ratio 1∶10(g/mL).Under these conditions,the yieldwas26.80mg/g.
microwave-assisted extraction;Oxaliscorniculata L.;flavonoids;orthogonaldesign
10.3969/j.issn.1005-6521.2016.24.012
2016-03-29
湖北省教育厅科学技术研究项目(B2016337);武汉工商学院校级学术团队基金资助项目(XSTD2015003)
杨文婷(1983—),女(汉),讲师,硕士研究生,主要从事天然产物的开发利用研究。
