YDL080c基因缺失的低异戊醇酿酒酵母菌构建
2016-12-22周世水
杨 青,李 洲,周世水*
(1.华南理工大学生物科学与工程学院,广东广州 510006;2.汕尾市青梅产业研究院,广东陆丰 516500)
YDL080c基因缺失的低异戊醇酿酒酵母菌构建
杨 青1,李 洲2,周世水1*
(1.华南理工大学生物科学与工程学院,广东广州 510006;2.汕尾市青梅产业研究院,广东陆丰 516500)
[目的]构建YDL080c基因缺失的低异戊醇生成的酿酒酵母菌。[方法]利用Cre-loxP重组系统与酵母电转化法敲除酿酒酵母中编码类丙酮酸脱羧酶的基因YDL080c,切断酿酒酵母代谢中的异戊醇生成,从而构建一株低异戊醇生成的酿酒酵母菌株。[结果]成功构建出YDL080c基因缺失的工程酵母菌Y1,Y1酿造酒中相对异戊醇含量为0.81 g/L,比初始菌降低28.3%。[结论]利用基因敲除YDL080c的工程酵母菌能够有效减少酿造酒中异戊醇的生成量。
基因敲除;异戊醇;酿酒酵母
蒸馏酒中除含乙醇、酯类和有机酸外,还含有异戊醇、异丁醇、正丙醇等高级醇。一般蒸馏酒中高级醇的含量偏高,在1.5 g/L[1]左右,酒中适当高级醇含量有利于酒的口感,但高级醇含量过高会使饮用者产生头晕目眩的感觉,严重影响酒的品质。
蒸馏酒高级醇中异戊醇的含量约占50%,异戊醇在酵母酿造酒中主要通过Ehrlich代谢机制和Harris代谢机制[2-4]2种途径产生。丙酮酸脱羧酶系是整个代谢过程中至关重要的酶系,敲除编码丙酮酸脱羧酶系的基因会有效地降低酵母代谢过程中产生的异戊醇含量,从而降低酒中高级醇含量。笔者利用Gre-loxP重组系统[5]与酵母电转化法敲除酿酒酵母中编码类丙酮酸脱羧酶的基因YDL080c,构建低生成异戊醇的酿酒酵母用于酿造低高级醇酒。
1 材料与方法
1.1 试验材料
1.1.1 菌种与质粒。酿酒酵母S2(华南理工大学发酵工程实验室保存),质粒pUG6(含抗G418 的Kanr筛选标记)购于杭州宝赛生物科技有限公司。
1.1.2 主要试剂。TaqHS酶购于TaKaRa公司,G418购于纽普诺博生物制品有限公司,小量酵母基因提取试剂盒、质粒制备试剂盒购于艾比根生物技术有限公司,凝胶DNA微量回收试剂盒购于基(欣研)生物科技有限公司。
1.1.3 主要仪器。411BR8273 电转仪、电泳仪、Gel Doc2000凝胶成像分析系统、安捷伦7890A气相色谱仪、DB-WAX毛细管柱( 30.00 m × 0.25 m× 2.50 μm)。
1.1.4 PCR引物。根据NCBI获得基因YDL080c与GenBank获得pUG6的基因序列(AF298793.1)设计引物,由英潍捷基贸易有限公司合成。基因YDL080c的验证引物A1、A2,敲除引物B1、B2,转化敲除组件后的验证引物C1、C2。A1:GAGTTAAATGCTGCCTACG,A2:GTTGGCGGCATACCCACTATG;B1:CGGCTCAACCAGCTGAACATACATACCATATTT-GGACTCTCCGGACAGCTGAAGCTTCGTAC,B2:CTGGTTGGA-ACCAATGGGATATTTCATTCCAGACCCATTCTTGTCGCATAG-GCCACTAGTGGATC;C1:CCAGAATACCCTCCTTGA,C2:TGTTTATGTTCGGATGTGAT。
1.2 试验方法
1.2.1 基因YDL080c的验证。以0.4 μL 提取菌株S2的DNA 为模板,A1、A2 为引物进行PCR。反应体系为10 μL,反应程序:94 ℃预变性5 min;94 ℃变性30 s,49.8 ℃退火30 s,72 ℃延伸30 s,循环30次;72 ℃延伸10 min。用琼脂糖凝胶电泳验证PCR产物。
1.2.2 菌株S2对抗生素G418 耐受试验。抗生素G418 浓度分别为0、20、40和60 μg /mL。将菌株S2分别涂布于不同抗生素浓度的YPD平板上,30 ℃培养。
1.2.3 基因YDL080c敲除组件的PCR扩增。以pUG6 为模板,B1、B2 为引物( 5′端有45 bp与YDL080c 同源[6]),按“1.2.1”的PCR条件进行扩增和琼脂糖凝胶电泳验证。
1.2.4 转化和筛选阳性酵母菌。将YDL080c基因敲除组件用电转化法[7]转化酵母(OD600 nm= 2),然后涂布在含抗生素G418 浓度60 μg /mL 的YPD 平板上,30 ℃培养3 d。
取几株平板上的阳性菌株与初始菌株S2进行摇床培养12 h,分别提取其基因组,以C1、C2为引物进行PCR扩增和琼脂糖凝胶电泳验证。
1.2.5 菌株的发酵。用13°P 麦芽汁,接种1 × 107CFU/mL,30 ℃发酵6 d,蒸馏出50%体积的酒,测定乙醇和异戊醇含量。
1.2.6 异戊醇的气相色谱法测定。色谱分离条件:N2流速2.0 mL/min,干燥空气流速350 mL/min,H2流速30 mL/min,N2尾吹30 mL/min;压力18.939 psi,分流比30∶1,检测器进样口温度均为250 ℃,进样量1 μl。
升温程序:50 ℃保温2 min,再以15 ℃ /min 升温至200 ℃,并保温3 min。
2 结果与分析
2.1 酿酒酵母S2中基因YDL080c的PCR验证结果 按照“1.2.1”方法进行PCR扩增,再进行琼脂糖凝胶电泳,结果见图1。由图1可知,泳道1与泳道2 PCR产物的DNA片段与设计的验证引物A1、A2扩增的DNA片段(161 bp)大小一致,因此可判断菌株S2中含有基因YDL080c。
2.2 酿酒酵母S2对抗生素G418 的耐受性 按照“1.2.2”方法进行酿酒酵母S2对抗生素G418 的耐受性试验,结果见图2。由图2可知,随着培养基中抗生素G418 浓度的升高,平板中的菌落逐渐减少,当G418 的浓度达到60 μg/mL,不含Kanr抗性基因的酵母菌株将无法生长。因此,G418浓度60 μg/mL为筛选转化菌株的浓度。

注:M.DL 2000 Marker,1和2.基因YDL080c的PCR产物。Note:M was DL 2000 Marker,1 and 2 was PCR products of genetic YDL080c.图1 基因YDL080c的PCR扩增结果Fig.1 The results of electrophoresis of gene YDL080c by PCR amplification

注:A、B、C、D中G418浓度分别为0、20、40、60 μg/mL。Note:G418 concentration was 0, 20, 40, 60 μg/mL respectively in A, B, C and D.图2 酿酒酵母S2对抗生素G418 的耐受性Fig.2 Resistance experiment of Saccharomyces cerevisiae S2 to the antibiotic G418
2.3YDL080c基因敲除组件的PCR扩增 根据“1.2.3”方法PCR扩增YDL080c基因敲除组件,结果见图3。由图3可知,泳道6的PCR产物片段与设计的敲除引物B1、B2扩增的DNA片段(1 703 bp)大小一致,因此,确定泳道6的PCR成功构建出YDL080c基因的敲除组件。

注:M.DL 2000 Marker,6.基因YDL080c的PCR电泳结果。Note:M was DL 2000 Marker,6 was PCR electrophoresis results of gene YDL080c.图3 YDL080c基因敲除组件构建的电泳结果Fig.3 Electrophoresis results of YDL080c gene knockout assembly
2.4 转化菌株的PCR筛选 根据“1.2.4”方法,用PCR方法剔除假阳性菌落,以筛选阳性工程菌,结果见图4。由图4可知,初始酵母菌株S2、工程菌株Y2、Y3、Y4、Y5、Y6的PCR产物在电泳中均无DNA条带,仅工程菌株Y1验证得到了与设计的验证引物C1、C2大小一致的DNA片段(330 bp),因此可判定菌株Y1已成功敲除YDL080c基因。
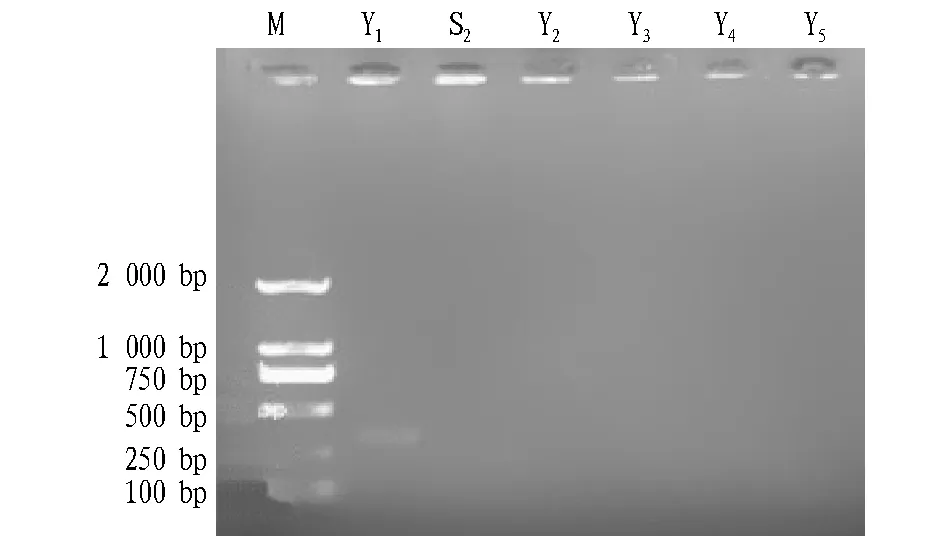
注:M.DL 2000 Marker,S2.初始菌株PCR验证产物,Y1、Y2、Y3、Y4、Y5.为阳性菌株的PCR验证产物。Note:M was DL 2000 Marker,S2 was PCR validation product of the initial strain,Y1、Y2、Y3、Y4、Y5 was PCR validation product of positive strains.图4 工程菌株PCR验证结果Fig.4 The PCR validation experiment of engineering strain
2.5 工程菌株的发酵试验 按照“1.2.5”方法对工程菌株Y1进行发酵试验。根据气相色谱测定结果绘制出异戊醇测定的标准曲线,并得到线性方程:y=1.865 3x+0.002 9,其中,x为异戊醇浓度,y为异戊醇测定峰面积RF,结果见图5。

图5 异戊醇测定的标准曲线Fig.5 The standard curve of isopentanol measurement
将工程菌株Y1发酵蒸馏酒的异戊醇气相测定RF值带入方程y= 1.865 3x+0.002 9,得到Y1的相对异戊醇含量为0.81 g/L,其气相测定图谱见图6。
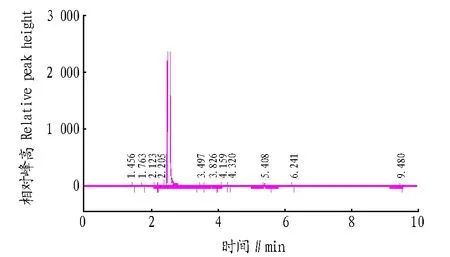
图6 菌株Y1酿造酒的气相色谱Fig.6 Gas chromatogram of brewing wine of strain Y1
初始菌株S2的相对异戊醇含量为1.13 g/L,Y1酿造酒中的相对异戊醇含量比S2降低了28.3%,降低异戊醇的效果显著。且酿造酒的酒精含量也略有升高,从原来的10.0%提高到10.5%。这表明用基因敲除YDL080c的工程酵母菌能够有效降低酿造酒中的异戊醇含量,且不影响菌株的酒精发酵性能。
2.6 菌株Y1的传代稳定性 对菌株Y1进行连续5代以上的传代,按照“1.2.5”方法进行发酵试验,并测定异戊醇含量,结果见表1。由表1可知,基因敲除的工程菌Y1经过5代的传代,其相对异戊醇含量基本保持在0.81 g/L,说明经过Cre-loxp重组系统改造的工程菌具有良好的遗传稳定性。
表1 菌株Y1传递5代后蒸馏酒中的物质含量
Table 1 Substance content of distilled liquor is fermented by strain Y1was passed in 5 generations

传代代数Passagegeneration相对异戊醇含量Relativeisopentanolcontent∥g/L酒精浓度(V/V)Alcoholconcentration%F10.7910.0F20.8010.3F30.8110.5F40.8010.3F50.8110.5
3 结论
该研究成功构建了一株基因YDL080c缺失的酿酒酵母工程菌Y1,能够显著降低酿造酒中的异戊醇含量,Y1酿造酒中的相对异戊醇含量降低至0.81 g/L,比初始菌S2降低了28.3%。对于乙醇的发酵性能,Y1不仅未降低,反而略有升高,其遗传性状经5代传递表现稳定。参考文献
[1] 周世水.控制啤酒中高级醇含量的研究[J].酿酒,2005,33(3):51-53.
[2] DICKINSON J R,HARRISON S J,DICKINSON J A,et al.An investigation of the metabolism of isoleucine to active amyl alcohol in saccharomyces cerevisiae[J].Journal of biological chemistry,2000,275(15):10937-10942.
[3] 李童,孙军勇,吴殿辉,等.YDL080C和LEU2基因敲除对工业黄酒酵母异戊醇生成量的影响[J].食品工业科技,2015,36(15):189-193.
[4] 张兴亚,林玲,蒋予箭.黄酒中高级醇含量控制的研究进展[J].中国酿造,2011(10):13-17.
[5] 熊志钦,周世水.基因敲除GCV2的酿酒酵母构建[J].安徽农业科学,2015(15):63-65.
[6] GUELDENER U,HEINISCH J,KOEHLER G J,et al.A second set ofloxPmarker cassettes for Cre-mediated multiple gene knockouts in budding yeast[J].Nucleic acids research,2002,30(6):88-94.
[7] 张轩薇,叶燕锐,刘晓肖,等.毕赤酵母新启动子GCW14在细胞表面展示CALB中的应用[J].生物技术通报,2013(4):129-135.
Construction ofSaccharomycescerevisiaewith Low Isopentanol Production by Deleting GeneYDL080c
YANG Qing1, LI Zhou2, ZHOU Shi-shui1*
(1.College of Biological Science and Engineering, South China University of Technology,Guangzhou,Guangdong 510006;2.Shanwei City Plum Industry Research Institutey,Lufeng, Guangdong 516500)
[Objective]TheSaccharomycescerevisiaewith producing low isopentanol was constructed by knocking out geneYDL080c.[Method]TheSaccharomycescerevisiaewith producing low isopentanol was constructed byusing Cre-loxP recombination system and yeast electrical transformation method to knock out the geneYDL080cencoding pyruvate decarboxylase,in order to cut off the produce of isopentanol in metabolism ofSaccharomycescerevisiae.[Result]The engineering strain Y1withoutYDL080cwas successfully constructed. The relative isopentanol content was 0.81 g/L in wine brewed by Y1, which was 28.3% lower than that of the original strain. [Conclusion]EngineeringSaccharomycescerevisiaewithout geneYDL080ccan effectively reduce the production of isopentanol in brewed wine.
Gene knock-out;Isopentanol;Saccharomycescerevisiae
杨青(1991- ),女,甘肃兰州人,硕士研究生,研究方向:基因敲除。*通讯作者,副教授,博士,硕士生导师,从事发酵工程与酿酒方面的研究。
2016-11-02
S 188+.4
A
0517-6611(2016)33-0140-03
