microRNA-260在秀丽隐杆线虫衰老进程中的作用研究
2016-12-22张照康BILLYKirundaJohn努尔古丽苏里坦杨利建
张照康, BILLY Kirunda John, 努尔古丽·苏里坦, 杨利建
(华中师范大学 物理科学与技术学院, 武汉 430079)
microRNA-260在秀丽隐杆线虫衰老进程中的作用研究
张照康, BILLY Kirunda John, 努尔古丽·苏里坦, 杨利建*
(华中师范大学 物理科学与技术学院, 武汉 430079)
本文以秀丽隐杆线虫(C.elegans)为模式生物,通过测定microRNA-260(miR-260)编码基因敲除后(Deletion)突变株与野生株(N2)线虫寿命、生殖能力、进食能力和热刺激条件下的生存能力,研究miR-260在衰老进程中发挥的作用.利用线虫体内衰老相关关键基因表达量的分析,探讨miR-260干预衰老的可能分子机制.实验结果显示:miR-260突变株系相对于野生型线虫寿命缩短,子代数目减少,进食能力的衰弱速度减慢,热刺激条件下的生存条件能力降低.结论:miR-260敲除后总体上加快秀丽隐杆线虫突变体衰老的进程.其可能的分子机理为,miR-260主要通过影响饮食限制通路和TOR信号通路中共同关键基因eat-2以及JNK信号通路中的jnk-1基因等的表达来调控线虫的衰老进程.
秀丽隐杆线虫; miR-260; 衰老;eat-2;jnk-1
衰老是生物体不可抗拒的自然规律,是有机体自我更新和修复能力减弱,结构和功能退化,并最终走向死亡的过程,其特征表现在压力刺激能力减退,平衡状态打破和罹患疾病风险增加[1].随着全球人口老龄化,多种老年退行性疾病的高发以及随之产生的巨大的医疗费用已成为越来越严重的社会问题.因此,探求健康的衰老模式,寻求简便易行,经济有效,安全性高,并适宜推广的干预衰老及治疗衰老相关疾病的措施和方法具有重大意义.
秀丽隐杆线虫(以下简称“线虫”)是衰老研究的经典模式生物[2-3].它具有实验操作简单、周期短、遗传背景清晰等优点,易于进行寿命实验和作用机制的探索,被广泛用于神经行为学、衰老、sRNA、药物筛选、环境科学和食品科学等相关方面的科学研究[4].其次,秀丽线虫是获得全基因组序列的生物,并且这些基因中40%以上的基因与人类基因同源,这为人们通过秀丽线虫研究人类衰老的基因机理奠定了基础.再次,有研究表明线虫信号通路中的关键基因的突变会极大的影响线虫衰老的进程[2-5]. 例如,首个在线虫中发现,多物种中保守的调控衰老的胰岛素/IGF-1信号通路,其关键起始基因daf-2缺失的突变株线虫寿命在20℃条件下延长达三倍之多[6-8].目前发现影响线虫衰老的主要信号通路还包括雷帕霉素目标信号通路(target of rapamycin, TOR)[9-13]、自噬通路、线粒体呼吸通路和缺氧诱导因子-1(hypoxia-inducible factor 1, HIF-1)通路等,生殖系统[14]和饮食限制[15-17]也会调控线虫寿命,这些通路之间既相互联系却又各自在衰老进程中发挥不同的作用.
MicroRNAs(miRNAs)是在真核生物中发现的一类内源性的具有调控功能的非编码小分子单链RNA,其大小长度约20~25个核苷酸[18,19].miRNA可以与靶mRNA通过碱基互补配对的方式结合,使得靶mRNA降解或者抑制靶mRNA的翻译,从而调控靶mRNA的表达[18-21]. miRNA在胚胎发育、脂肪代谢、细胞增殖、凋亡、分化等一系列生理过程中都起到重要调控作用.miR-260作为线虫体内miRNA的一种,它对线虫的衰老、生殖等生命过程的调控作用还未清楚.Burgt等[22]用生物信息学方法预测后生动物的miRNAs,他们指出miR-260没有发卡结构;Liu等[23]在讨论山羊皮肤miRNAs保守性时提到了线虫miR-260;但是,目前对线虫miR-260功能方面的研究还是十分有限.
本文通过对miR-260敲除后突变株线虫表观特征的研究,探索miR-260在线虫衰老、生殖等生命过程中的调控作用.在此基础上进一步探讨了miR-260调控衰老的分子机制,实验中选取影响线虫寿命的胰岛素/IGF-1信号通路、生殖信号通路和TOR信号通路中直接关键基因daf-16,胰岛素/IGF-1信号通路主要起始基因daf-2,JNK通路中的关键基因jnk-1,饮食限制及TOR信号通路共同关键基因eat-2等[2,6-17,24-29]共4个基因,在基因表达水平了解敲除miR-260对线虫衰老进程的影响.
1材料与方法
1.1实验材料
秀丽线虫虫株:野生株(N2)和miR-260突变株(miR-260),由中国科学与技术大学生命科学学院单革老师实验室惠赠.(miR-260突变株:秀丽隐杆线虫品系:MT14919;基因型:mir-260(n4601)Ⅱ;删除断点(Deletion breakpoints):TTACTAAAAAAAAAGTGCCTAG/GATTGTCTGAA-AATT…CGGCTGAAAAATAT/AAATTTATA ACTGGGCAACAGAAA.摘自Caenorhabditis Genetics Center(CGC)网页)
菌株:E.coliOP50(大肠杆菌OP50);线虫食物,由华中科技大学生命科学与技术学院吴政星老师实验室惠赠.
1.2主要试剂
M9溶液(1 000 mL):KH2PO4(3 g) ; Na2HPO4(6 g); NaCl(5 g); 高压灭菌,再加入1M/L MgSO4(1 mL).
S-Buffer溶液(1 000 mL): 0.05 M/L K2HPO4(129 mL);0.05 M/L KH2PO4(871 mL);NaCl(5.85 g)用固体配制,最后定容至1 L,高压灭菌.
Bleach裂解液:5 M/L NaOH(1 mL);10% NaClO(2 mL);ddH2O(7 mL).
5-Fluoro-2’deoxyuridine (FUdR)配制:浓度为1 M/L,分子量246.2,用ddH2O配制,不灭菌,用无菌膜过滤.
NGM培养基(1 000 mL):琼脂粉(agar,17 g);蛋白胨(peptone,2.5 g);NaCl(3.0 g);加水定容至1 L.高温高压灭菌后冷却至60℃左右加入:1 M/L CaCl2(1 mL); 1 M/L MgSO4(1 mL);磷酸钾缓冲液(pH=6,25 mL);5 mg/mL胆固醇(1 mL);制霉菌素(1 mL);超净台内快速倒入直径3 cm或6 cm培养皿中,冷却晾干,收起待用.
LB培养液(1 000 mL):胰蛋白胨(Tryptone,10 g);酵母提取物(Yeast extract,5 g);NaCl(10 g);定容至1 L,高温高压灭菌.
Trizol试剂购于 Invitrogen(英杰生命技术,美国)公司.反转录试剂盒购于 Thermo Fisher Scientific(赛默飞世尔科技,美国)公司.KH2PO4、Na2HPO4·12H2O、NaCl、K2HPO4·3H2O、NaOH、NaClO等试剂购于国药集团.FUdR、胆固醇、制霉菌素购于阿拉丁试剂公司.蛋白胨、胰蛋白胨、酵母提取物等试剂购于Thermo Fisher Oxoid(赛默飞世尔科技集团Oxoid公司,英国).
1.3主要仪器
恒温培养箱,购于上海精宏实验设备有限公司;超净工作台,购于苏州安泰空气技术有限公司(AIRTECH);PCR仪,购于杭州朗基科学仪器有限公司;Nanodrop 2000超微量分光光度计,购于Thermo Fisher Scientific(赛默飞世尔科技,美国)公司;RT-PCR仪,购于BIO-RAD(伯乐生物科技 美国)公司.
1.4实验方法
1.4.1线虫的同步化 同步化是线虫寿命、衰老相关实验的关键步骤之一,是为了得到基本同时孵化或同时开始生长的健康活跃可用于实验的线虫的常用实验手段.
同步化方法:将NGM培养基上多数线虫培养至产卵期,用0.8 mL Bleach裂解液冲洗NGM培养基,将虫子冲洗下来后,静置3 min,震荡,低速离心,尽可能的吸取上清液,再加入S-buffer溶液,震荡,低速离心,尽可能的吸取上清.重复2次加入后加入0.8 mL S-buffer溶液放进入25℃生化恒温箱中培养过夜.第二天离心,尽可能的吸取上清,将剩余部分混匀,均匀的打在NGM培养基上.待NGM培养基中的线虫进入产卵期,将正处于产卵期的线虫(母虫)挑到NGM培养基上进行产卵.2~3 h后将线虫(母虫)挑走杀死后,将NGM培养基放进25℃的生化培养箱中进行培养.第二天观察存活情况,发育至成虫(L4期)后可用来进行寿命相关实验.
1.4.2寿命测定实验 25℃实验温度下,将同步化后发育至成虫(L4期)的线虫,挑至加有FUdR的NGM培养基上进行培养,每24 h监测一次线虫的存活情况并将死亡线虫挑出直至全部死亡.线虫死亡判定:以用挑线虫的铂金丝触碰线虫头部两次,线虫无刺激反应为死亡判定标准.
1.4.3线虫后代数目测定实验 25℃实验温度下,将同步化后发育至L3阶段的一条线虫(产卵之前),挑至NGM培养基.每隔24 h观察一次,若已有孵化子代线虫则需将母虫转移至新的NGM培养基上,在子代线虫生长至成虫前挑出杀死并进行计数,直至没有子代幼虫产生.
1.4.4线虫的热刺激条件下生存能力的测定实验 25℃实验温度下,将同步化后发育至成虫(L4期)的线虫,挑至加有FUdR的NGM培养基上进行培养5~10 d,去除死亡虫子将培养基放入37℃生化培养箱中培养,每2~3 h监测一次线虫的生存情况,直至全部死亡.
1.4.5线虫进食能力的测定实验 25℃实验温度下,将同步化后发育至成虫(L4期)的线虫,挑至滴有食物的NGM培养基上进行培养,一条虫子一个板.5 d后开始每隔24 h监测一次虫子的咽部跳动次数(以记录的第一天为起始第一天),用秒表记录十秒内的咽部跳动次数,记录3次以上,去除异常值后取平均,直至跳动次数低于150次/分,即认为进入了慢速吞咽期.
1.5miR-260分子机制的研究
1.5.1线虫总RNA的提取及cDNA的合成 25℃实验温度下,将同步化后发育至成虫(L4期)的线虫培养4 d,用M9缓冲液将线虫洗下来,离心,尽去上清,加入Trizol试剂提取总RNA.按照Trizol提取RNA的步骤分别提取N2株系和miR-260株系的总RNA.将提取的总RNA进行凝胶电泳鉴定,并对总RNA浓度,纯度进行测定,未发生降解的总RNA方可进行下一步实验.按照Thermo Scientific反转录试剂盒的说明进行cDNA的合成.
1.5.2qPCR鉴定关键基因表达量 分别以N2株系和miR-260株系线虫合成的cDNA为模板,act-1为内参基因,进行qPCR测定两株系各个关键基因之间相对表达量的差异.寻找miR-260突变株在基因表达层次与野生型N2的差异,以便从基因表达水平了解miR-260是通过哪些信号通路来影响衰老进程的.
1.6数据分析与处理
使用软件Origin,Excel实验数据进行统计学分析处理,采用平均值假设检验分析,其中*代表P<0.05为显著性差异,**代表P<0.01为极显著性差异.
2结果与讨论
2.1线虫衰老特征实验结果
2.1.1敲除miR-260对线虫寿命的影响 寿命长度是衡量衰老的重要指标之一.实验结果(表1和图1)表明,miR-260突变株(miR-260)组线虫平均寿命显著低于对照组野生株(N2)组线虫(P<0.05).其中对照组野生株(N2) 组线虫平均寿命为14.51±0.94 d,最长寿命为19.67±0.47 d;miR-260突变株组线虫平均寿命为12.62±0.94 d,最长寿命为19.33±1.25 d,分别缩短了13.04%和1.69%.
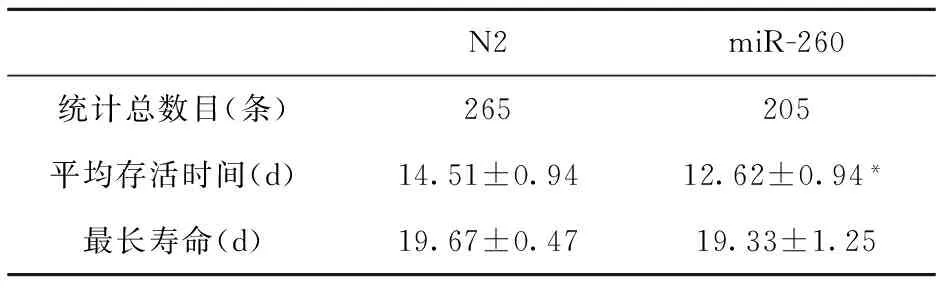
表1 野生型(N2)与miR-260突变株的平均寿命
注:*为P<0.05.
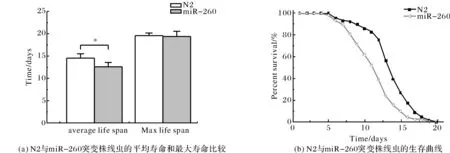
图1 N2与miR-260突变株线虫的寿命对比Fig.1 Lifespan of N2 and miR-260
2.1.2敲除miR-260对线虫生殖能力的影响 产卵量是生殖能力的直接体现,线虫在性成熟后第2 d和第3 d进入生殖高峰期,本实验测得miR-260突变株组线虫平均子代数目明显低于对照组野生株(N2)组线虫,如图2所示.其中对照组野生株(N2)组线虫平均子代数目为118.37±17.21,而miR-260突变株组平均子代数目为89.95±24.46, 减少了24.01%.miR-260突变株的生殖能力显著下降.
2.1.3敲除miR-260对线虫的热刺激条件下生存能力的影响 对环境的适应能力是反应衰老进程的指标之一.实验结果(图3)表明,miR-260突变株组线虫的热刺激条件下的适应能力的各项指标都低于对照组野生株(N2)组线虫.其中第5 d热刺激条件下对照组野生株(N2)组线虫平均存活时间为10.58±0.39 h,最长存活时间为18.00 h; miR-260突变株线虫平均存活时间为8.85±0.73 h,最长存活时间为16±2 h,分别缩短了18.90%和11.11%, miR-260突变株平均存活时间明显低于野生株(N2)组.第10 d热刺激条件下对照组野生株(N2)组线虫平均存活时间为8.31±0.75 h,最长存活时间为14.40±1.44 h;miR-260突变组线虫平均存活时间为7.99±0.53 h,最长存活时间为13.80±2.16 h,分别缩短了3.85%和4.17%.
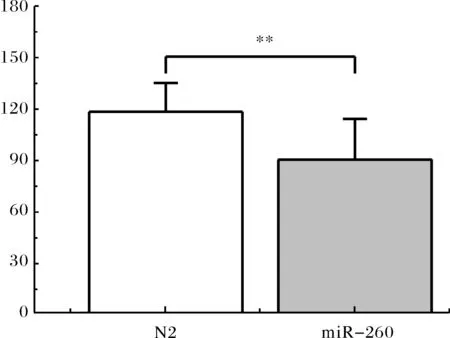
图2 N2与miR-260突变株线虫的子代数目Fig.2 Brood size of N2 and miR-260
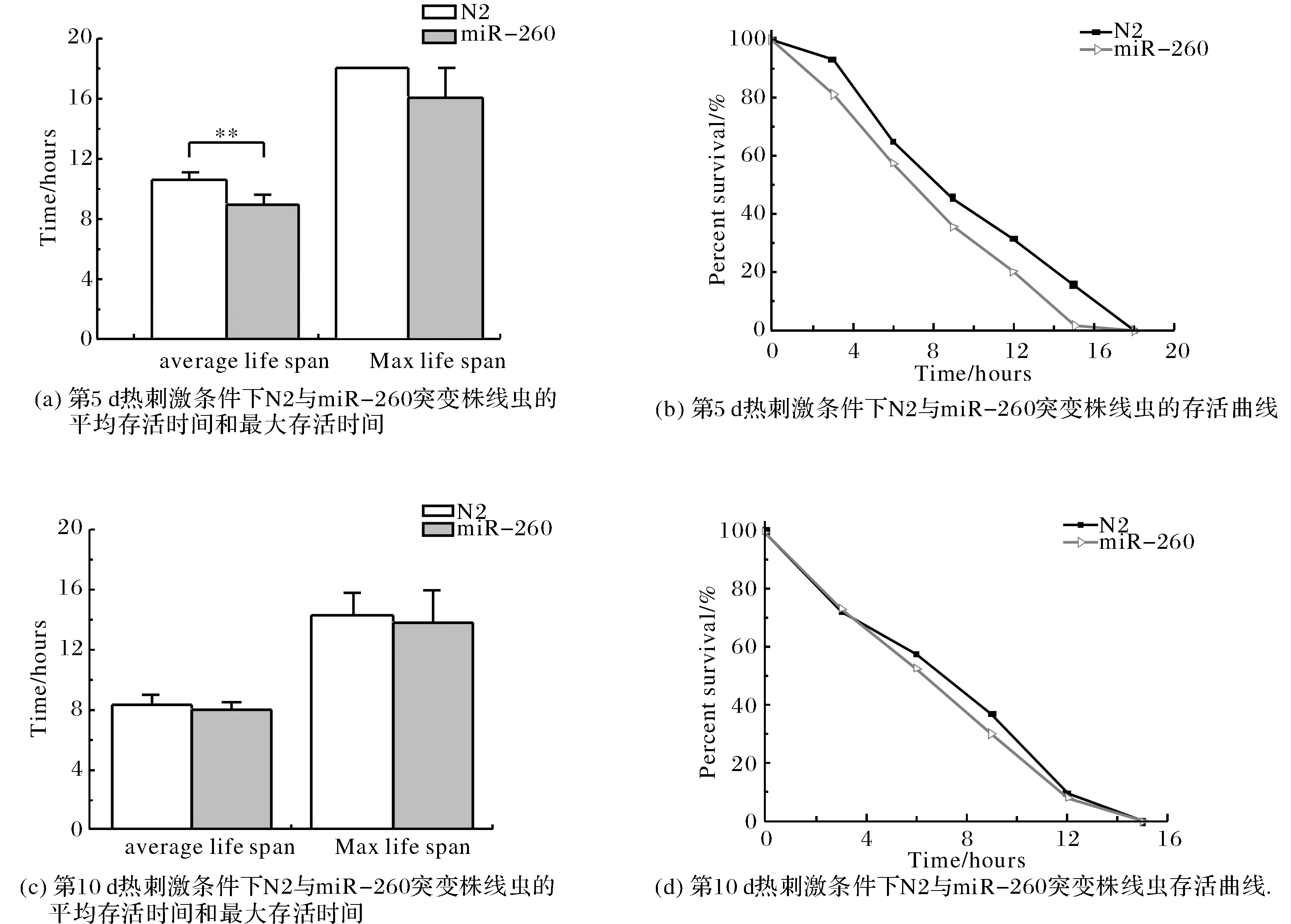
图3 N2与miR-260突变株线虫的热刺激条件下生存能力测试Fig.3 The survival of the N2 and miR-260 in the heat stress
2.1.4敲除miR-260对线虫进食能力的影响 随着线虫的不断衰老,其进食能力下降,吞咽速度减慢.因此,线虫吞咽速率也是其衰老标志之一,我们对比了两组线虫进入慢速吞咽期的时间.实验结果(图4)表明,miR-260突变株组线虫进入慢速吞咽期的时间略晚于野生株(N2)组线虫.其中对照组野生株(N2)组线虫进入慢速吞咽期的时间为6.00±0.20 d,而miR-260突变株组线虫进入慢速吞咽期的时间为6.70±0.81 d,延长了11.67%.miR-260突变株秀丽线虫的进食能力显著增强.
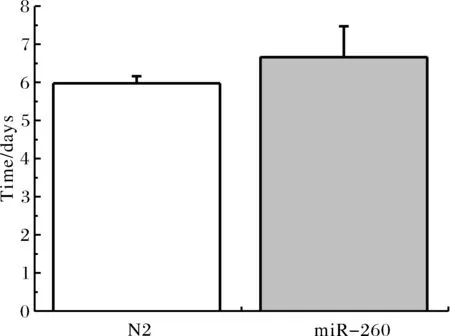
图4 N2与miR-260突变株的进入慢速吞咽期平均时间Fig.4 Average time for the occurrence of slow pharyngeal pumping rate of N2 and miR-260 C. elegans
2.2分子机制的探究结果
2.2.1引物序列 实验以act-1为内参基因,选择衰老相关关键基因daf-2、daf-16、jnk-1、eat-2为代表基因,在mRNA表达水平探究敲除miR-260对线虫衰老进程的影响,其引物序列如表2.

表2 qPCR引物序列
2.2.2敲除miR-260对线虫衰老进程中关键基因表达的影响 利用实时荧光定量PCR对衰老相关关键基因daf-2、daf-16、jnk-1、eat-2相对表达量进行监测,以野生株N2表达量为control,act-1为内参基因.实验结果表明(图5):miR-260突变株线虫组的daf-2、daf-16、jnk-1、eat-2的表达量分别是野生株N2线虫组的1.199±0.117,0.770±0.018,0.638±0.031和3.097±0.264倍.可见,敲除miR-260基因对衰老关键基因的表达产生不同程度的影响,daf-2和eat-2表达量增加,其中eat-2表达量上调至三倍之多,有极显著性差异;daf-16和jnk-1表达量减少,其中jnk-1表达量的降低具有显著性差异.

图5 miR-260突变株线虫的关键基因相对野生型N2表达水平Fig.5 The expression level of key genes in miR-260 deleted C.elegans compared with N2 C.elegans
3结论与讨论
本文探索了miR-260突变株线虫寿命、衰老的相关特征及其影响衰老的相关分子机制.实验结果表明:与野生株(N2)线虫相比,平均寿命明显缩短,生殖能力、热刺激条件下的适应能力都显著下降,但进食能力却有一定的提高.其可能的分子机理是mir-260的敲除通过影响基因jnk-1、eat-2进而调控线虫的衰老进程.jnk-1为JNK通路中的关键基因,而JNK为线虫体内唯一的编码丝氨酸/丝氨酸激酶的刺激活化蛋白激酶,其主要在运动能力、成虫寿命、热刺激及氧化刺激等方面发挥重要作用.jnk-1表达量的提高能延长线虫寿命,提高热刺激和氧化刺激抵抗能力[24-25].eat-2作为饮食限制及TOR信号通路共同关键起始基因,在线虫进食能力和寿命调控中发挥着不可或缺的作用,eat-2的表达水平降低,会降低其进食能力并延长线虫寿命[26].mir-260的敲除造成eat-2表达量增加(**极显著性差异),jnk-1表达量减少(*显著性差异),线虫寿命缩短,繁殖能力下降,刺激能力降低,进食能力增强,基因表达方面结果与表观结果较为符合.即可认为miR-260通过影响基因jnk-1、eat-2进而调控线虫的衰老进程.
另外,daf-2、daf-16表达量也具有一定变化,且与表观结果一致.其中daf-2为胰岛素/IGF-1信号通路主要起始基因,降低daf-2的表达水平能够延长线虫寿命3倍之多.daf-2基因的突变还使得线虫健康生活的时间增加,极大地延缓线虫衰老进程[7,27].daf-16为胰岛素/IGF-1信号通路、生殖信号通路和TOR信号通路中最终直接影响寿命的关键基因,daf-16表达的增加能延缓线虫的衰老进程,增加线虫寿命和生殖能力[17,28-29].
目前已发现影响线虫寿命的miRNAs并不是很多,lin-4, miR-34,miR-80,miR-228,miR-239功能的缺失会增加线虫寿命,而let-7,miR-71和miR-84/miR-241的突变会使线虫寿命缩短.这些miRNAs是通过与靶 mRNA碱基互补配对方式结合,使得靶mRNA降解或者抑制靶mRNA的翻译,从而调控靶mRNA的表达并影响寿命.例如,lin-4的靶基因是lin-14,lin-14通过影响胰岛素信号通路的daf-16和hsf-1的表达来调控线虫寿命. miR-260作为细胞内具有调控作用miRNAs中的一员,它的敲除极大的影响了线虫的寿命,改变了衰老进程中的关键基因的表达,但其具体的作用机制以及相关的靶基因尚待进一步探究.
致谢 该工作得到国家自然科学基金面上项目、华中师范大学中央高校基本科研业务费和创业创新项目基金支持,感谢这些基金的支持.该工作是在课题组贾亚老师和杨利建老师的指导下完成的,感谢两位老师的悉心指导及课题组成员所提供的帮助.
感谢中国科学与技术大学生命科学学院单革老师实验室赠予线虫虫株,感谢华中科技大学生命科学与技术学院吴政星老师实验室赠予E.coli OP50,感谢武汉轻工大学宫智勇老师实验室及华中师范大学生命科学学院公共实验平台提供的RT-PCR仪.
[1] FLAAT T. A new definition of aging?[J].Frontiers in Genetics, 2012, 3(3):148.
[2] KENYON C J. The genetics of ageing[J].Nature, 2010, 464(7288):504-512.
[3] TISSENBAUM H A. Special issue on genetics and aging: genetics, life span, health span, and the aging process in caenorhabditis elegans[J].Journals of Gerontology, 2012, 67(5):503-510.
[4] KLAPPER M, EHMKE M, PLGUNOW D, et al. Fluorescence based fixative and vital staining of lipid droplets in Caenorhabditis elegans reveal fat stores using microscopy and flow cytometry approaches[J].Journal of Lipid Research, 2011, 52(6):1281-1293.
[5] TURNHEIM K. When drug therapy gets old:Pharmacokinetics and pharmacodynamics in the elderly[J].Experimental Gerontology, 2003, 38(8):843-853.
[6] KENYON C. The plasticity of aging: insights from long-lived mutants[J].Cell, 2005, 120(4):449-460.
[7] HERNDON L A, SCHMEISSNER P J, DUDARONEK J M, et al. Stochastic and genetic factors influence tissue specific decline in ageing C. elegans[J].Nature,2002, 419(6909):808-814.
[8] TULLET J M A, HERTWECK M, AN J H, et al. Direct inhibition of the longevity-promoting factor SKN-1 by insulin-like signaling in C. elegans[J].Cell, 2008, 132(6):1025-1038.
[9] KAEBERLEIN M, WILSON POWERS R, STEFFEN K K, et al Regulation of yeast replicative life span by TOR and Sch9 in response to nutrients[J].Science, 2005, 310(5751):1193-1196.
[10] KAPAHI P, ZID B M, HARPER T, et al. Regulation of lifespan in Drosophila by modulation of genes in the TOR signaling pathway[J].Current Biology, 2004, 14(10):885-890.
[11] JIA K, CHEN D, RIDDLE D L. The TOR pathway interacts with the insulin signaling pathway to regulateC.eleganslarval development, metabolism and life span[J]. Development, 2004, 131(16):3897-3906.
[12] VELLAI T, TAKACS-VELLAI K, ZHANG Y. Genetics: influence of TOR kinase on lifespan inC.elegans[J].Nature, 2003, 426(6967):620.
[13] HARRISON D E, STRONG R, SHARPET Z D, et al. Rapamycin fed late in life extends lifespan in genetically Heterogeneous mice[J]. Nature, 2009, 460(7253):392-395.
[14] LAPIERRE L R, HANSEN M. Lessons fromC.elegans: signaling pathways for longevity Endocrinology and Metabolism[J].Trends in Endocrinology & Metabolism, 2012, 23(12):637-644.
[15] LIBERT S, ZWIENER J, CHU X, et al. Regulation of Drosophila life span by olfaction and food-derived odors[J].Science, 2007, 315(5815):1133-1137.
[16] APFELD J, O’CONNOR G, MCDONAGH T, et al. The AMP-activated protein kinase AAK-2 links energy levels and insulin like signals to lifespan inC.elegans[J]. Genes & Development, 2004, 18(24):3004-3009.
[17] LAKOWSKI B, HEKIMI S. The genetics of caloric restriction in Caenorhabditis elegans[J].Proceedings of the National Academy of Sciences, 1998, 95(22):13091-13096.
[18] BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J].Cell, 2004,116(2):281-297.
[19] AMBROS V,BARTEL B,BARTEK D P, et al. A uniform system for microRNA annotation[J].RNA, 2003, 9(3):277-279.
[20] HUMPHREYS D T, WESTMAN B J, MARTIN D I, et al. MicroRNAs control translation initiation by inhibiting eukaryotic initiation factor 4E/cap and poly[J]. Proceedings of the National Academy of Sciences, 2005, 102(47):16961-16966.
[21] JING Q, HUANG S, GUTH S, et al. Involvement of microRNA in AU-rich element-mediated mRNA instability[J].Cell, 2005, 120(5):623-634.
[22] BURGT A V D, FIERS M W, NAP J P, et al. In silico miRNA prediction in metazoan genomes: balancing between sensitivity and specificity[J].BMC Genomics, 2009, 10(1):1-24.
[23] LIU Z, XIAO H, LI H, et al. Identification of conserved and novel microRNAs in cashmere goat skin by deep sequencing[J/OL].PLoS ONE, 2012, 7(12),e50001[2012-12-07].http://journals.plos.org/plosone/article/file?id=10.1371/journal.pone.0050001&type=printable. doi:10.1371/journal.pone.0050001.
[24] SEUNG WOOK O, ARNAB M, NENAD S, et al. JNK regulates lifespan inCaenorhabditiselegansby modulating nuclear translocation of fork head transcription factor/DAF-16[J]. Proceedings of the National Academy of Sciences, 2005, 102(12):4494-4499.
[25] KAWASAKI M, HISAMOTO N, IINO Y, et al. A Caenorhabditis elegans JNK signal transduction pathway regulates coordinated movement via type-D GABAergic motor neurons[J].EMBO Journal, 1999, 18(13):3604-3615.
[26] ARANTES-OLIVEIR N, BERMAN J R, KRNYON C, et al. Healthy animals with extreme longevity[J].Science, 2003, 302(5645):611.
[27] GARIGN D, HSU A L, FRASER A G, et al. Genetic analysis of tissue aging in Caenorhabditis elegans: a role for heat shock factor and bacterial proliferation[J].Genetics, 2002, 161(3):1101-1112.
[28] GREER E L, DOWLATSHAHI D, BANKO M R, et al. An AMPK-FOXO pathway mediates longevity induced by a novel method of dietary restriction in C.elegans[J].Current Biology, 2007, 17(19):1646-1656.
[29] HONJOH S,YAMAMOTO T,UNO M, et al. Signalling through HEB-1 mediates intermittent fasting-induced longevity inC.elegans[J].Nature, 2009, 457(7230):726-730.
The role of miR-260 in the ageing process ofC.elegansand its molecular mechanism
ZHANG Zhaokang, BILLY Kirunda John, NURGUL Sultan, YANG Lijian
(College of Physical Science and Technology, Central China Normal University, Wuhan 430079)
By usingCaenorhabditiselegans(C.elegans) as a model animal, the effect of deletion of miR-260 coding gene inC.eleganswas studied on lifespan, fertility, ability to eat and the ability to survive under the heat stress. In order to have better understanding on the mechanisms of how miR-260 regulate lifespan, the expression level of key genes in main aging pathways were investigated. The results showed that: miR-260 deletion strains have a shortened lifespan, reduced brood size, increased time attaining the low feed rate and decreased ability to survive under the heat stress, which speeding up the aging process. Its possible molecular mechanism is that deletion of miR-260 influenced the expression ofeat-2 andjnk-1, and regulated the aging process through dietary restriction pathway, TOR signaling pathway and JNK signaling pathway.
Caenorhabditiselegans; miR-260; aging;eat-2;jnk-1
2016-09-02.
国家自然科学基金项目(11175068,11474117);中央高校基本科研业务费项目(CCNU2015A05045);华中师范大学大学生创新创业训练项目.
1000-1190(2016)06-0897-07
Q291
A
*通讯联系人. E-mail: lijian_yang@phy.ccnu.edu.cn.
