12个厂家盐酸舍曲林片的溶出曲线相似性研究
2016-12-22刘慧颖隋晓璠辽宁省药品检验检测院沈阳110036
刘慧颖,隋晓璠,陈 默(辽宁省药品检验检测院,沈阳 110036)
·药品监督·
12个厂家盐酸舍曲林片的溶出曲线相似性研究
刘慧颖*,隋晓璠,陈 默(辽宁省药品检验检测院,沈阳 110036)
目的:比较12个厂家盐酸舍曲林片的溶出曲线相似性,评价企业制剂工艺的成熟性和稳定性。方法:考察原研厂家盐酸舍曲林片分别以水、0.1 mol/L盐酸、醋酸-醋酸钠缓冲液(pH 4.5)和磷酸盐缓冲液(pH 6.8)为溶出介质的溶出曲线,最终确定以区分力最强的磷酸盐缓冲液(pH 6.8)900 ml来测定不同厂家盐酸舍曲林片的均一性和绘制溶出曲线;采用相似因子f2法评价溶出曲线相似性。结果:12家生产企业的样品各点溶出度的RSD均小于10%(n=6),均一性均较好;11个仿制企业中,f2值大于50的生产企业只有1家,占总数的9.1%。结论:12家生产企业制剂工艺的稳定性均较好,但多数仿制企业药品与原研药溶出性能比较存在较大差异。建议相关生产企业对工艺、处方和原、辅料来源等进行深入研究,以提高产品质量。
盐酸舍曲林片;溶出度;溶出曲线;均一性;f2因子
1 材料
1.1 仪器
LC-2010 CHT高效液相色谱仪,配备紫外检测器(日本岛津公司);AT-7 Smart溶出度测定仪(瑞士Sotax公司);XP205分析天平(瑞士梅特勒-托利多公司)。
1.2 药品与试剂
盐酸舍曲林对照品(中国食品药品检定研究院,批号:100702-200401);盐酸舍曲林片为2013年国家评价性抽验品种,共收集到12个厂家样品,每个厂家各选择1批进行试验。其中,A厂为辉瑞制药有限公司,批号:1372013,为参比制剂;B厂批号:130101;C厂批号:130401;D厂批号:20130401;E厂批号:02313010;F厂批号:20130103;G厂批号:130901;H厂批号:121201;I厂批号:130301;J厂批号:1210242;K厂批号:20130101;L厂批号:2K5440T。上述盐酸舍曲林片均为素片,规格均为50 mg/片。甲醇和乙腈为色谱纯;磷酸二氢钾、氢氧化钠、醋酸钠、冰醋酸、盐酸、醋酸和三乙胺均为分析纯;水为纯化水。
2 方法
2.1 色谱系统的选择
综合比较美国药典(USP)35版[8]、英国药典(BP)2012年版[9]、12个生产企业盐酸舍曲林片的执行标准,除1家生产企业执行标准为紫外法外,其余均为高效液相色谱法,但色谱条件不尽相同。为保证横向比较结果的可比性,笔者统一色谱条件为原研药溶出度的测定方法,具体为:以十八烷基硅烷键合硅胶为填充剂,乙腈-甲醇-缓冲液(0.045 mol/L醋酸溶液与0.025 mol/L三乙胺溶液等量混合)(40∶40∶20)为流动相,检测波长为267 nm。
2.2 装置和转速的确定
打好污染防治攻坚战时间紧、任务重、难度大,是一场大仗、硬仗、苦仗,离不开坚强有力的领导和纪律保障。今年以来,盐城市纪检监察机关认真贯彻习近平生态文明思想,按照中央纪委和省纪委部署,积极投身污染防治攻坚战,持续强化环保领域监督执纪问责,有力推动全市经济社会实现绿色转型、绿色跨越。
2.2.1 装置的确定 除了2家生产企业标准中溶出度检查所用仪器装置分别采用篮法和小杯法外,其余10家生产企业标准中均采用了桨法。考虑到盐酸舍曲林片属于崩解型片剂,故选择桨法测定。
2.2.2 转速的确定 除了2家生产企业标准中桨法分别设定转速为50 r/min和100 r/min外,其余10家生产企业标准中均设为75 r/min。因桨法试验宜在温和的试验条件下进行,最终采用10个企业标准中的转速75 r/min,与原研药标准一致,并与USP 35版[8]和BP 2012版[9]转速也一致。
2.3 溶出介质的确定
2.3.1 溶出介质种类的确定 以辉瑞制药有限公司的盐酸舍曲林片为考察样品,分别选取水、0.1 mol/L盐酸、醋酸-醋酸钠缓冲液(pH 4.5)和磷酸盐缓冲液(pH 6.8)[同2015年版《中国药典》(四部)8004缓冲液的配制]为溶出介质,测定各时间点的溶出度并绘制溶出曲线,结果见图1。

图1 盐酸舍曲林片原研药在4种溶出介质中的溶出曲线Fig 1 Dissolution curves of Sertraline hydrochloride tablets from original manufacturer in 4 dissolution mediums
图1显示,选择水和pH 4.5缓冲液为溶出介质时,盐酸舍曲林片在15 min内就达到溶出平衡,对制剂之间差异的区分力不大,且盐酸舍曲林在水中的最终溶出度未达到85%;选择0.1 mol/L盐酸和pH 4.5缓冲液为溶出介质时,在10 min内即达到溶出度的85%,此时再进行溶出曲线的比较已没有意义;而当溶出介质选择磷酸盐缓冲液(pH 6.8)时,盐酸舍曲林片能平缓溶出,45 min时溶出度达到86%,最能灵敏地反映制剂生产工艺的变化和偏差。最终确定以区分力最强的磷酸盐缓冲液(pH 6.8)为溶出介质。
2.3.2 溶出介质体积的确定 12家生产企业标准中,有1家生产企业的溶出介质体积为250 ml,3家生产企业为1 000 ml,其余8家生产企业均为900 ml。900 ml为常规体积,且符合定量的要求,故最终确定溶出介质体积为900 ml。
2.4 测定方法的建立
综合上述条件,确定溶出曲线测定方法为:取各生产企业样品,照溶出度测定法[2015年版《中国药典》(四部)0931溶出度与释放度测定法],以磷酸盐缓冲液(pH 6.8)900 ml为溶剂,转速为75 r/min,经5、10、15、20、30、45、60、75 min分别取溶液5 ml(并即时补液),滤过,取续滤液作为供试品溶液。另精密称取盐酸舍曲林对照品适量,先加少量甲醇使溶解,再用溶出介质定量稀释制成每1 ml中约含盐酸舍曲林60 μg的溶液,作为对照品溶液。按“2.1”项色谱条件进行测定,计算溶出度,结果与0.893 6相乘(将盐酸舍曲林换算为舍曲林)。
3 结果与评价
3.1 均一性比较
3.1.1 评价标准 以每个生产企业一个批号一次试验6片在各点溶出度的精密度为指标,比较批内均一性。第1个取样点溶出度的相对标准偏差(RSD)应在20%以内,其他各取样点溶出度的RSD应在10%以内[5]。
3.1.2 评价结果 12批片剂样品各时间点溶出度的RSD均小于10%(n=6),均符合“3.1.1”项评价标准,见图2。

图2 盐酸舍曲林片均一性评价结果Fig 2 Uniformity of Sertraline hydrochloride tablets
图2显示,各生产企业的产品批内均一性均较好,表明各企业制剂工艺均较稳定。
3.2 溶出曲线相似性的比较
3.2.1 评价标准[5]按下列公式计算f2(相似因子)值。其中,Rt为t时间参比制剂平均累积溶出度;Tt为t时间自研制剂平均累积溶出度;n为取样点个数(n=3~5,且Rt>85%的点不超过1个)。若f2≥50,则认为受试制剂与参比制剂溶出过程一致。

3.2.2 评价结果 各制剂与参比制剂溶出曲线的f2比较见表1,溶出曲线见图3。

表1 11个仿制企业生产的盐酸舍曲林片f2比较Tab 1 Comparison of f2factors of Sertraline hydrochloride tablets from 11 imitation manufacturers
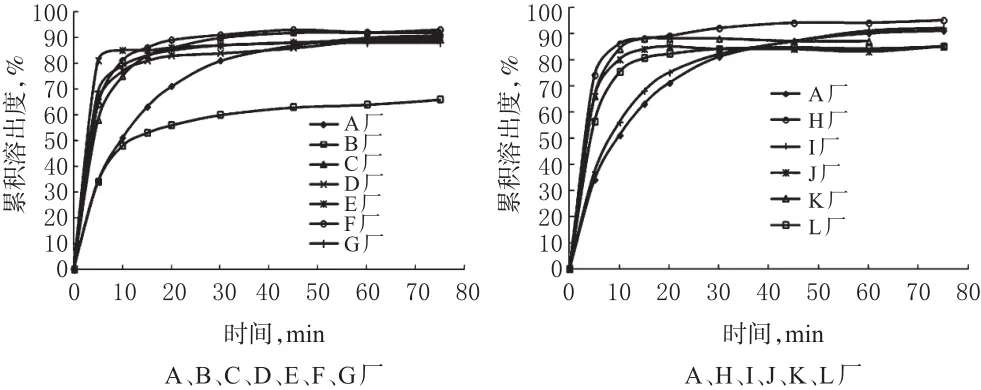
图3 12家企业生产的盐酸舍曲林片样品的溶出曲线Fig 3 Dissolution curves of Sertraline hydrochloride tablets from 12 manufacturers
由表1可知,f2值大于50的生产企业仅I一个,可认为与参比制剂溶出行为相似,仅占总数的9.1%。
4 讨论
目前评价溶出曲线相似性多采用f2法[10-13]。但该方法对参比制剂与受试制剂均有一定的限度,如:参比制剂与受试制剂含量应一致,含量差异不得超过5%;每个制剂均要对12个样品的溶出情况进行测定[4]。因工作时限和整体工作的安排,本实验对每批产品测定6个样品的溶出情况,采用f2法进行溶出行为比较。
均一性测定中,重复性试验RSD相对较大的取样时间点主要集中在前两点,这可能与药物崩解后的比表面积、溶出速率、工艺不同的影响有关。
按各厂家的执行标准,笔者对国家评价性抽验150余批盐酸舍曲林片溶出度进行单点限度检测,结果均符合规定。但在溶出曲线相似性比较中,只有一家企业的样品f2值大于50。经与参比制剂溶出曲线比较发现,绝大多数企业的产品在测定时间内均能达到完全溶出,存在的较大差异主要体现在前20 min,大部分样品20 min内的溶出度即达到85%(t85≤20 min),样品溶出速度较快,尤其是f2值较低的E、H和K厂家样品,t85≤10 min,而参比制剂的t85=45 min,可见样品溶出速率直接影响与参比制剂溶出过程的相似性。
目前,2015年版《中国药典》(二部)[14]已收载了该品种,统一了盐酸舍曲林片的溶出度检测方法,采用醋酸-醋酸钠缓冲液(pH 4.5)作为溶出介质,但从实验结果看,该介质对制剂之间差异的区分力不大。因此,相关机构有必要建立科学的溶出度评价标准,进一步提高检测方法,促进生产企业对工艺、处方和原、辅料来源等进行深入研究,提高产品质量,保证国内产品与原研产品质量的一致性和等效性。
[1] Sweetman SC.Martindale the complete drug reference [M].36th edition.London:Pharmaceutical Press,2009:421-422.
[2] 张建忠,柯樱,沈佳琳.抗抑郁药的研发进展及市场情况[J].上海医药,2014,35(21):66.
[3] 马海燕.新型抗抑郁药的临床应用研究进展[J].实用医药杂志,2013,30(10):940.
[4] 王昕,唐素芳,高立勤.溶出曲线相似性的两种评价方法[J].天津药学,2011,23(1):53.
[5] 谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308.
[6] 谢沐风.解读“口服固体制剂仿制药一致性评价技术手段:多条溶出曲线”[J].中国医药工业杂志,2013,44(4):411.
[7] 朱宏明,李继彬,邢正英,等.10厂家替米沙坦片的体外溶出度考察[J].中国药房,2015,26(4):541.
[8] 美国药典委员会.美国药典[S].35版.华盛顿:美国药典委员会,2012:5 536-5 538.
[9] 英国药典委员会.英国药典[S].2012年版.伦敦:英国药典委员会,2012:3 279-3 280.
[10] 赵霓.不同厂家卡托普利片在4种溶出介质中的溶出曲线比较研究[J].中国药师,2012,15(6):845.
[11] 刘佳,高刘芳,林维政.缬沙坦胶囊质量一致性研究[J].中国药师,2014,17(11):1 870.
[12] 程怡,裘建设,胡瑞标,等.f2因子法评价头孢克洛干混悬剂溶出曲线的相似性[J].中国新药杂志,2012,21(20):2 437.
[13] 赵昕,王平,马滔.f2因子法评价头孢呋辛酯片溶出曲线相似性[J].国际检验医学杂志,2014,35(16):2 214.
[14] 国家药典委员会.中华人民共和国药典:二部[S].2015年版.北京:中国医药科技出版社,2015:1 018-1 019.
(编辑:余庆华)
Study on the Similarity of Dissolution Curves of Sertraline Hydrochloride Tablets from 12 Manufacturers
LIU Huiying,SUI Xiaofan,CHEN Mo(Liaoning Institute for Drug Control,Shenyang 110036,China)
OBJECTIVE:To compare the similarity of dissolution curves of Sertraline hydrochloride tablets from 12 manufacturers,and to evaluate the maturity and stability of technology.METHODS:The dissolution curves of Sertraline hydrochloride tablets from original manufacturer were investigated by using water,0.1 mol/L hydrochloric acid,acetic acid-natrium aceticum buffer solution(pH 4.5)and phosphate buffer solution(pH 6.8)as medium respectively.The phosphate buffer solution(pH 6.8)900 ml was selected to determine the uniformity and dissolution curves of Sertraline hydrochloride tablets from different manufacturers because it was superior to other medium in identification capacity.The similarity of dissolution curves were evaluated by f2factor method. RESULTS:The uniformity results of samples from 12 manufacturers were acceptable,all RSDs of each point dissolution were less than 10%(n=6);among 11 imitation manufacturers investigated,only one f2value was more than 50,which was 9.1%of the total.CONCLUSIONS:The stability of Sertraline hydrochloride tablets from 12 manufacturers were quite well,whereas,the quality of drugs from imitation manufacturers was greatly different from that of original drugs.It is suggested to intensively study the technology,formula,raw material and excipients source so as to improve drug quality.
Sertraline hydrochloride tablets;Dissolution;Dissolution curve;Uniformity;f2factor
R917
A
1001-0408(2016)34-4862-03
2016-02-16
2016-06-16)
*主管药师,硕士。研究方向:化学药品质量控制和标准研究。电话:024-31266302。E-mail:wzmlhy@163.com
DOI 10.6039/j.issn.1001-0408.2016.34.34
