胰管括约肌切开联合胰管支架对胆道微结石性急性复发性胰腺炎的疗效评价*
2016-12-22陈佩婷刘文正张耀朋黄永辉
常 虹 陈佩婷 刘文正 张耀朋 姚 炜 李 柯 黄永辉
(北京大学第三医院消化科,北京 100083)
·临床论著·
胰管括约肌切开联合胰管支架对胆道微结石性急性复发性胰腺炎的疗效评价*
常 虹 陈佩婷 刘文正 张耀朋 姚 炜 李 柯 黄永辉**
(北京大学第三医院消化科,北京 100083)
目的 探讨胰管括约肌切开(endoscopic pancreatic sphincterotomy,EPS)联合胰管支架置入术治疗胆道微结石性急性复发性胰腺炎的可行性。 方法 回顾性分析2005年4月~2014年4月我院诊断急性复发性胰腺炎(2次及以上急性胰腺炎发作)且明确病因为胆道微结石52例资料,24例行EPS并胰管支架置入术(EPS组),28例行内镜下乳头括约肌切开(endoscopic sphincteropapillotomy,EST)并胆道清理术(其中20例鼻胆管引流术)(EST组),比较2组复发率、术后近期和远期并发症。 结果 52例中术后胰腺炎9例,其中EPS组6例(25.0%,6/24),EST组3例(10.7%,3/28),无统计学差异(χ2=0.980,P=0.322)。EPS组随访3~100个月,中位数33个月;EST组随访3~115个月,中位数52个月。5例急性胰腺炎复发,EPS组2例(8.3%,2/24),EST组3例(10.7%,3/28),无统计学差异(χ2=0.000,P=1.000)。EPS组和EST组胆道远期并发症发生率分别为8.3%(2/24)和32.1%(9/28),有统计学差异(χ2=4.392,P=0.046)。 结论 EPS联合胰管支架置入术治疗胆道微结石导致的急性复发性胰腺炎是可行的。胰管括约肌切开不会引起反流,且能保留胆管括约肌功能。
急性复发性胰腺炎; 胆道微结石; 胰管括约肌切开术
急性胰腺炎(acute pancreatitis,AP)的发病率呈上升趋势,其中10%~20%的急性胰腺炎反复发作,称为急性复发性胰腺炎(acute recurrent pancreatitis,ARP)。急性复发性胰腺炎是指至少有2次确诊为急性胰腺炎发作的患者,且影像学检查无慢性胰腺炎改变[1]。迄今已有多篇研究报道胆道微结石(biliary microlithiasis,BML)即直径<3 mm的结石为ARP的重要原因[1]。本研究回顾性分析2005年4月~2014年4月10年来于我院诊断的52例胆道微结石性ARP患者资料,比较内镜下胰管括约肌切开(endoscopic pancreatic sphincterotomy,EPS)并胰管支架置入术与传统的治疗方式内镜下乳头切开(endoscopic sphincteropapillotomy,EST)并胆管取石术对胆道微结石性ARP的疗效,近期及远期并发症的发生率等指标,为微结石性ARP提供更可行的治疗方式。
1 临床资料与方法
1.1 一般资料
病例选择标准:诊断为ARP(2次及以上发作),病史、血钙、血脂、免疫学指标、肝胆超声、CT和MR等除外酒精、代谢、自身免疫所致胰腺炎,慢性胰腺炎,胆管及胆囊阳性结石,内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)除外病因为壶腹肿瘤、胰腺分裂、胰胆管汇流异常以及Oddi括约肌功能障碍者。于ERCP插管过程中有胆泥溢出,行胆汁显微镜分析或胆管内超声(intraductal ultrasonography,IDUS)检查,明确胆道微结石性ARP。
急性胰腺炎分级按照2013年颁布的新亚特兰大分类[2]和中华医学会消化病学分会胰腺疾病学组的中国急性胰腺炎诊治指南[3]进行分级,分为轻度急性胰腺炎(mild acute pancreatitis,MAP)、中度急性胰腺炎(moderately severe acute pancreatitis,MSAP)和重度急性胰腺炎(severe acute pancreatitis,SAP)。MAP为符合AP诊断标准,满足以下情况之一;无脏器衰竭,无局部或全身并发症,Ranson评分<3分,急性生理功能和慢性健康状况评分系统(acute physiology and chronic health evaluation,APACHE)Ⅱ评分<8分,AP严重程度床边指数(bedside index for severity in AP,BISAP)<3分,修正CT严重指数(modified CT severity index,MCTSI)评分<4分。MSAP为符合AP诊断标准,急性期满足下列情况之一:Ranson评分≥3分,APACHEⅡ评分≥8分,BISAP评分≥3分,MCTSI≥4分,可有一过性(<48 h)的器官功能障碍,恢复期出现需要干预的假性囊肿、胰瘘或胰周脓肿等。SAP为符合AP诊断标准,伴有持续性(>48 h)器官功能障碍(单器官或多器官),改良Marshall评分≥2分。
手术方式由操作医师决定,由于传统治疗理念为EST并胆道取石,故前期入组病例多为EST组。操作医生集中为3位熟练ERCP医师。按内镜下不同治疗方式分为2组:EPS组行胰管括约肌切开(endoscopic pancreatic sphincterotomy,EPS)并胰管支架置入术,EST组行内镜下乳头括约肌切开(endoscopic sphincteropapillotomy,EST)并胆道清理术包含有无行鼻胆管引流术(endoscopic nasobiliary drainage,ENBD)。
共52例,其中MAP 46例(88.5%),MSAP 6例(11.5%)。EPS组24例,EST组28例(其中20例行ENBD),2组可比性分析见表1,除胆囊切除史(P=0.019)、脂肪酶(P=0.015)外,其余差异无统计学意义,具有可比性。

表1 2组一般资料及术前化验比较
*Fisher检验
术前化验有部分患者不全。TG,甘油三酯;ALT,丙氨酸氨基转移酶;AST,天冬氨酸氨基转移酶;ALP,碱性磷酸酶;T-Bil,总胆红素;D-Bil,直接胆红素;TP,总蛋白;ALB,白蛋白;WBC,白细胞;AMY,淀粉酶;LIPA,脂肪酶
1.2 器械
十二指肠镜TJF160(Olympus公司,日本);超声内镜SP702(FUJINON公司,日本);附件包括高频电发生器,双腔切开刀,气囊导管,斑马导丝,鼻胆引流管,胰管塑料内支架(美国Wilson-cook公司,长5~7 cm,直径5Fr、7Fr,德国Flex公司,长5 cm和7 cm,直径5Fr、7Fr);偏振光显微镜(DM2500)(LEICA公司,德国);台式微量冷冻离心机Microfuge 22R(Beckman Coulter公司,美国)。
1.3 操作技术
常规ERCP术前准备,行常规ERCP,观察十二指肠乳头,选择性胆胰管插管并造影,抽吸胆汁5 ml行显微镜分析,IDUS判定是否存在微结石(图1)[4]。
胆汁显微镜分析方法:胆汁12 000 r/min离心10 min,剔除上清液,将沉淀物制成3张玻片,置于普通光及偏振光观察并按Juniper和Burson标准[5]计数结晶,每张玻片只要发现胆固醇单水化合物晶体(cholesterol monohydrate crystals,CMC)或多于25个胆红素钙颗粒(calcium bilirubinate granules,CBG)即为阳性(图2)。
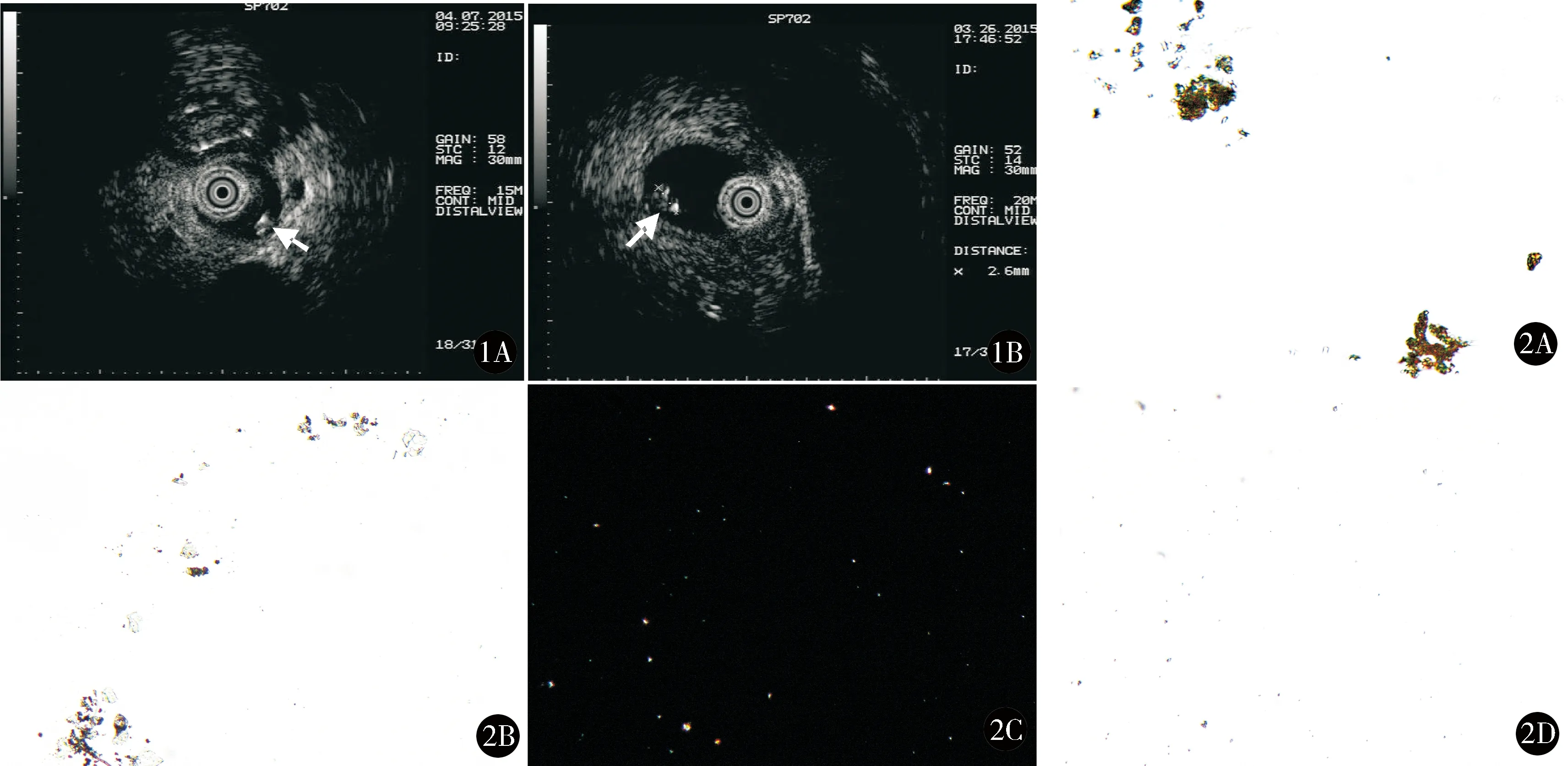
图1 IDUS微结石阳性(胆管腔内强回声,直径≤3 mm,后伴有或不伴有回声影,且与胆管壁分界清楚) 图2 显微镜下微结石阳性:A. CBG呈棕红色聚集(×40);B. CBG和CMC散在分布(×10);C.显微镜偏振光下CMC双折射(×10);D.显微镜普通光下(同C视野)(×10)
EPS组常规内镜下切开胰管括约肌,将导丝深插入胰管,沿导丝推入支架,1~2个月后内镜下取出。EST组常规内镜下切开胆管括约肌,球囊取石清理胆道和(或)ENBD。术后常规禁食、补液、抗炎、抑酸、抑酶治疗3天,抑制胰腺分泌应用生长抑素3 mg静脉滴注,24 h维持,抑酸药应用质子泵抑制剂。
1.4 随访方法和观察指标
采用电话及门诊随访方式,3~6个月一次。随访有无再次因急性胰腺炎发作到医院诊治,门诊超声及化验检查有无胆道并发症(如胆囊结石、胆管结石等),有无再次就诊行二次ERCP及相关操作,胰管支架放置时间及取出时间。
并发症诊断标准:①ERCP术后胰腺炎(根据Cotton的标准)[6]:ERCP术后出现上腹痛,血清淀粉酶或脂肪酶超过正常上限的3倍,符合胰腺炎诊断的影像学依据,以上3条符合2条即可诊断。②急性胰腺炎复发:符合2013年中华医学会胰腺病学组制定的急性胰腺炎诊断标准[3],既往急性胰腺炎发作次数2次及以上,排除慢性胰腺炎。③胆道并发症:常规影像学检查(B超、CT或MRI)证实胆囊及胆管结石存在;患者出现发热、腹痛伴或不伴有黄疸,化验肝功能异常、血白细胞升高,影像学提示胆总管增宽伴或不伴有胆石,提示胆管炎存在。
1.5 统计学方法
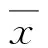
2 结果
2.1 手术情况和术后近期并发症
52例全部行内镜下治疗,操作成功完成。EST组8例未放置ENBD,20例ENBD鼻胆管均3天拔除。EPS组比EST组术后住院时间短,总住院费用少(P<0.05),见表2。
EPS组24例中术后胰腺炎6例(25.0%),均为MAP;EST组28例中术后胰腺炎3例(10.7%),其中1例MSAP,2例MAP。2组术后胰腺炎发生率差异无统计学意义(表2)。所有术后胰腺炎均保守治疗痊愈出院。2组均无出血、穿孔、感染等其他并发症。
2.2 随访结果
EPS组24例随访3~100个月,中位数33个月,EST组28例随访3~115个月,中位数52个月。
2.2.1 急性胰腺炎复发 2组复发率差异无统计学意义(表2)。
EPS组24例中急性胰腺炎复发2例(8.3%),分别于术后3、8个月复发入院,皆再次行ERCP并行扩大EPS,二次手术后分别随访13个月及12个月,未再发作急性胰腺炎。
EST组28例中急性胰腺炎复发3例(10.7%),分别为术后4、6、11个月复发住院,其中2例再次行ERCP,1例行EST,1例行EPS,二次手术后分别随访20个月和35个月,无急性胰腺炎复发,另1例拒绝再次ERCP,予禁食、补液、抑酸、抑酶等保守治疗好转出院,以后出现多次复发。
2.2.2 胆道并发症 EPS组胆道并发症发生率低于EST组(表2)。
EPS组24例中胆道并发症2例(8.3%),其中胆管炎1例(术后11个月发作一次,保守治疗缓解),胆管结石1例(术后24个月腹部超声发现,行ERCP内镜下胆管取石)。
EST组28例中胆道并发症9例(32.1%),其中腹部超声提示胆囊结石4例(术后24~60个月发现,继续随诊观察),腹痛发作同时腹部超声提示胆囊增大胆囊炎2例(术后18及48个月,均保守治疗),胆管炎发作2例(术后16及24个月,保守治疗缓解),胆管结石1例(术后55个月,行ERCP内镜下胆管取石)。
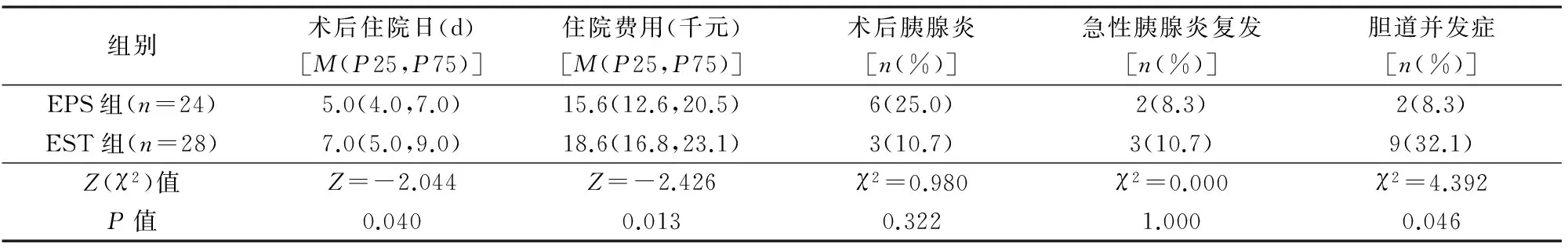
表2 2组结果比较
3 讨论
ARP可能与胆道结石、酒精、高甘油三酯血症、Oddi括约肌功能障碍(sphincter of Oddi dysfunction,SOD)、胰胆管汇流异常、胰腺分裂及胰腺肿瘤等有关。其中胆源性胰腺炎占60%左右[1],而微结石占有很大的比例。Houssin等[7]报道752例胆囊结石,结石<3 mm者22%并发AP,结石3~10 mm并发AP者为5%,10~20 mm为3%,>20 mm为1%,提示微结石更容易导致胰腺炎发作。
目前胆源性胰腺炎的内镜治疗模式以EST联合胆道取石为主,对于合并胆囊结石患者可行预防性胆囊切除。多篇研究表明针对微结石性胰腺炎行EST和胆囊切除术可取得显著疗效[8]。胆源性胰腺炎的发病机制多数是基于Opie的胆胰共同通道学说进行展开,为胆石嵌顿胆管导致乳头开口堵塞或狭窄,胆道不畅导致胆管压力升高,引起胆汁反流入胰管导致急性胰腺炎发生,然而微结石导致胰腺炎的发病机制并不同于一般胆源性胰腺炎。Acosta等[9]的研究显示,在85%~95%胆源性胰腺炎患者的大便中找到结石,而无急性胰腺炎的胆石症患者仅有10%大便中有结石存在,据此提出胆石从胆管滚动进入十二指肠(而非单纯结石嵌顿),刺激Oddi括约肌,导致其充血、水肿、痉挛、功能紊乱,甚至逆向收缩,形成暂时性或功能性的胰管收缩,引起胰腺炎发作,即所谓胆石通过学说,这更能解释胆道微结石导致胰腺炎的发病过程。所以治疗胆道微结石性ARP的重点在于畅通胰管,故理论上EPS联合胰管支架置入能阻断上述微结石诱发AP发作的病理生理过程,可以从解剖学的角度上实施胆胰管开口分离,避免微结石通过乳头对胰管开口的刺激,同时放置胰管支架保证胰液流出通畅,降低胰管内压力,防止胰腺炎复发。
本研究首先回顾入选患者的一般资料,比较EPS组和EST组一般情况和术前化验,EST组有较多(10/28,35.7%)已行胆囊切除术(EPS组2/24,8.3%,P=0.019),考虑与EST组患者有较大部分为较早入组的患者有关,且导致EST组随访时间相对长。而早期对于特发性胰腺炎患者若合并有胆囊结石,部分建议至外科行胆囊切除术,而本研究入组患者皆排除影像学检查胆囊结石阳性者,故排除胆囊切除术对2组预后影响。
本研究中28例EST组在随访期间有3例(10.7%)再次出现胰腺炎发作,而EPS组24例在随访期间复发2例(8.3%),2组无统计学差异,故认为EPS可达到与EST相同疗效。对3例复发患者再次行EPS治疗皆未再出现复发,也在一定程度上证明了EPS对微结石性ARP的显著疗效。但本研究为样本量较小的非随机性研究,不能完全排除存在选择性偏倚可能;其次,回顾性研究所搜集部分病例是在治疗模式的探索阶段就诊,存在治疗方式不完全统一,若制定固定治疗模式进行随机的前瞻性队列研究更能提升证据力度。且本研究中EPS用于治疗微结石性急性复发性胰腺炎为近几年新开展的治疗模式,对于患者的远期情况仍处于观察阶段,需延长随访时间,继续追踪EPS组的远期并发症情况,将更能完整评价两种治疗模式的疗效。
ERCP术后并发症发生率约1%~40%[10],主要为出血、穿孔、感染及术后胰腺炎,其中以ERCP术后胰腺炎(post ERCP pancreatitis,PEP)较为常见。已有多项研究[11,12]指出预防性置入胰管支架可以减少PEP的发作或减轻其严重程度。本研究EPS组均预防性置入胰管支架,EPS组和EST组PEP发生率分别为25.0%和10.7%,差异无统计学意义,但EPS组6例PEP均为MAP,而EST组3例PEP中1例为MSAP,表明胰管支架也许能有效减轻术后胰腺炎的严重程度。EPS术后住院时间短于EST,且总费用少。
EST术后远期并发症主要为结石复发、反流性胆管炎、乳头狭窄、胆囊炎、胆囊癌等,其中以结石复发、反流性胆管炎和胆囊炎为主,Doi等[13]报道,随访5~15年远期并发症的总体发生率介于12%~25%。大部分学者认为其与EST术后Oddi括约肌解剖构造被破坏有关。EST切开壶腹括约肌和胆总管末端括约肌,在一定程度上使括约肌功能减弱或丧失,抗反流屏障减退,十二指肠内容物容易逆流入胆管,造成细菌逆行感染和定植,同时细菌感染增加胆管结石复发的风险。而EPS仅切开胰管末端括约肌,充分保留胆管括约肌功能,从机制上降低上述胆道远期并发症发生的可能。本研究EPS组胆道远期并发症发生率低于EST组,分别为8.3%和32.1%,具有统计学意义。
总之,EST胆道取石术作为目前公认的微结石性ARP的治疗方式,其疗效显著是肯定的,但其操作对乳头括约肌所造成的损伤不可避免的,而胆管括约肌功能损害导致的胆道远期并发症对预后造成的影响不容忽视。EPS通过对微结石性ARP的发病机制进行干预有效地减少胰腺炎复发,且因其保留胆管括约肌功能,减少胆道远期并发症的发生。虽然EPS存在增加PEP的风险,但预防性置入胰管支架可以有效防止重症PEP的发生,故EPS联合胰管支架置入术可作为微结石性ARP的内镜治疗的新选择。
1 Testoni PA.Acute recurrent pancreatitis:etiopathogenesis,diagnosis and treatment.World J Gastroenterol,2014,20(45):16891-16901.
2 Banks PA,Bollen TL,Dervenis C,et al.Classification of acute pancreatitis-2012:revision of the Atlanta classification and definitions by international consensus.Gut,2013,62(1):102-111.
3 中华医学会消化病学分会胰腺疾病学组,中华胰腺病杂志编辑委员会与中华消化杂志编辑委员会.中国急性胰腺炎诊治指南(2013年,上海).胃肠病学,2013,18(7):428-433.
4 Yoon LY,Moon JH,Choi HJ,et al.Clinical usefulness of intraductal ultrasonography for the management of acute biliary pancreatitis.J Gastroenterol Hepatol,2015,30(5):952-956.
5 Menon S.Biliary microlithiasis.Gastrointest Endosc,2009,69(6):1197-1198.
6 Cotton PB,Lehman G,Vennes J,et al.Endoscopic sphincterotomy complicant and their management: an attempt at consensus.Gastrointest Endosc,1991,37(3):383-393.
7 Houssin D,Castaing D,Lemoine J,et al.Microlithiasis of the gallbladder.Surg Gynecol Obstet,1983,157(1):20-24.
8 Räty S,Pulkkinen J,Nordback I,et al.Can laparoscopic cholecystectomy prevent recurrent idiopathic acute pancreatitis?a prospective randomized multicenter trial.Ann Surg,2015,262(5):736-741.
9 Acosta JM,Ledesma CL.Gallstone migration as a cause of acute pancreatitis.N Engl J Med,1974,290(9):484-487.
10 Bor R,Madácsy L,Fábián A,et al.Endoscopic retrograde pancreatography:when should we do it?World J Gastrointest Endosc,2015,7(11):1023-1031.
11 Choudhary A,Bechtold ML,Arif M,et al.Pancreatic stents for prophylaxis against post-ERCP pancreatitis:a meta-analysis and systematic review.Gastrointest Endosc,2011,73(2):275-282.
12 常 虹,黄永辉,段丽萍,等.复发性特发性胰腺炎内镜治疗的临床分析.中华胰腺病杂志,2012,12(2):83-85.
13 Doi S,Yasuda I,Mukai T,et al.Comparison of long-term outcomes after endoscopic sphincterotomy versus endoscopic papillary balloon dilation:a propensity score-based cohort analysis.J Gastroenterol,2013,48(9):1090-1096.
(修回日期:2016-09-12)
(责任编辑:王惠群)
Clinical Outcomes of Endoscopic Pancreatic Sphincterotomy Combined with Pancreatic Duct Stenting for Acute Recurrent Pancreatitis Caused by Biliary Microlithiasis
ChangHong,ChenPeiting,LiuWenzheng,etal.
DepartmentofGastroenterology,PekingUniversityThirdHospital,Beijing100083,China
HuangYonghui,E-mail:huangyonghui@medmail.com.cn
Objective To investigate the feasibility of endoscopic pancreatic sphincterotomy (EPS) combined with pancreatic duct stenting for acute recurrent pancreatitis (ARP) caused by biliary microlithiasis. Methods The clinical data of 52 cases of ARP (2 or more attacks of acute pancreatitis) diagnosed in our hospital from April 2005 to April 2014 were retrospectively analyzed. There were 24 cases in EPS group with pancreatic stenting and 28 cases in EST (endoscopic sphincteropapillotomy) group (20 cases with EPBD). The rate of recurrence and incidence of the early and late complication were compared between the two groups. ResultsThere were 9 cases of post ERCP pancreatitis after the endoscopic therapy, including 6 cases (25.0%) in the EPS group and 3 cases (10.7%) in the EST group. There was no statistical difference between the two groups (χ2=0.980,P=0.322). During the follow-up in the EPS group (median, 33 months; range, 3-100 months) and in the EST group (median, 52 months; range, 3-115 months), recurrence of acute pancreatitis occurred in 5 patients, including 2 cases in the EPS group (8.3%) and 3 in the EST group (10.7%). There was no statistical difference between the two groups (χ2=0.000,P=1.000). The incidence of long-term complications was 8.3% (2/24) in the EPS group and 32.1% (9/28) in the EST group, showing significant difference (χ2=4.392,P=0.046). Conclusions EPS combined with pancreatic stenting in the treatment of acute recurrent pancreatitis caused by biliary calculi is feasible. EPS does not cause reflux and help recover the biliary sphincter function.
Acute recurrent pancreatitis; Biliary microlithiasis; Endoscopic pancreatic sphincterotomy
首都市民健康项目培育(Z141100002114017)
A
1009-6604(2016)12-1080-05
10.3969/j.issn.1009-6604.2016.12.005
2016-07-22)
**通讯作者,E-mail: huangyonghui@medmail.com.cn
