真菌葡聚糖检测对血液恶性肿瘤患者早期深部真菌感染的诊断效能
2016-12-21李睿任然熊大迁
李睿 任然 熊大迁
临床研究
真菌葡聚糖检测对血液恶性肿瘤患者早期深部真菌感染的诊断效能
李睿 任然 熊大迁
目的 探讨血浆(1,3)-β-D-葡聚糖检测在早期诊断血液恶性肿瘤患者侵袭性真菌病(IFD)中的价值。方法 选择成都中医药大学附属医院2014年10月年至2016年4月收治的非粒细胞缺乏血液恶性肿瘤患者进行筛选分组。确诊血液恶性肿瘤患者160例,其中80例确诊侵袭性真菌感染者为IFD组,非IFD患者80例。采用MB-80微生物动态快速检测系统测定IFD组和非IFD患者血浆(1,3)-β-D-葡聚糖含量,采用受试者工作特征曲线(ROC)评估G试验对IFD的诊断价值。结合真菌培养鉴定,统计不同类型真菌引起的深部感染(1,3)-β-D-葡聚糖水平的差异。结果 IFD组(1,3)-β-D-葡聚糖含量显著高于非IFD组(ng/L: 346.54±204.95比43.21±15.11,P < 0.05)。G试验单独诊断IFD的ROC曲线下面积(AUC)、阳性预测值、阴性预测值分别为0.91、86.71%、90.47%;针对血液恶性肿瘤IFD患者,最佳诊断阈值为≥70 ng/L时,诊断敏感度为90%,特异度为88.75%。G试验诊断IFD的时间较传统临床诊断明显缩短(d:4.87±2.55比7.13±4.42,P < 0.01)。80例IFD患者40例分离出真菌,其中念珠菌属36株(占90%),(1,3)-β-D-葡聚糖均值为333.55 ng/L;曲霉菌4株(占10%),(1,3)-β-D-葡聚糖均值> 1 000 ng/L。不同念珠菌之间(1,3)-β-D-葡聚糖水平比较差异无统计学意义(P > 0.05),念珠菌属与曲霉菌属之间(1,3)-β-D-葡聚糖水平比较差异有统计学意义(P < 0.05)。结论 (1,3)-β-D-葡聚糖检测是一种快速、准确、简便的诊断IFD方法,对于IFD的早期诊断有重要价值,对于区分念珠菌还是曲霉菌引发的深部真菌感染也有一定临床价值。
(1,3)-β-D-葡聚糖;血液肿瘤病;侵袭性真菌感染;真菌培养
血液病患者常因大剂量化疗、骨髓干细胞移植和免疫抑制剂的使用导致侵袭性真菌感染发生风险较高,侵袭性真菌病(invasive fungal disease,IFD)是恶性血液病、慢性阻塞性肺疾病[1]、肝移植[2]患者的常见并发症。IFD确诊主要依赖于无菌标本真菌培养阳性,或组织病理学检查发现组织内有真菌菌丝或孢子,组织病理阳性是诊断IFD的“金标准”,但组织标本往往取材困难,且具有创伤性,标本又需要特殊染色,延误了患者的诊断和治疗。北京协和医院对3 447例患者进行尸检,结果发现深部真菌感染85例,其中生前明确真菌感染诊断者仅5例,占5.9%,漏检率高达94.1%[3]。
IFD常见的临床类型为系统性念珠菌病和肺曲霉菌病,病原体分别是念珠菌属和曲霉菌属,(1,3)-β-D-葡聚糖是其相似的细胞壁成分。真菌进入血液或深部组织,经吞噬细胞的吞噬和消化等作用后,(1,3)-β-D-葡聚糖可从真菌细胞壁释放,从而使血中的含量升高,因此,检测人体体液中(1,3)-β-D-葡聚糖水平(G试验)可为临床诊断侵袭性真菌感染提供有效的实验室依据。本研究联合真菌培养鉴定,系统分析了G试验在非粒细胞缺乏血液恶性肿瘤患者IFD诊断中的价值,报告如下。
1 资料与方法
1.1 仪器和试剂 北京金山川公司MB-80微生物动态快速检测系统,GKT-1M Set动态真菌检测试剂盒,法国梅里埃生物制品公司沙保葡萄糖琼脂培养基,VITEK-2 Compact全自动微生物分析仪YST鉴定卡。
1.2 病例资料的选择 选择本院血液科2014年10月至2016年4月收治的160例血液恶性肿瘤患者,参照中国IFD工作组制定的《血液病/恶性肿瘤患者侵袭性真菌感染的诊断标准与治疗原则(第三次修订)》[4],诊断为IFD患者80例,非IFD患者80例。以患者发热(体温> 38.5 ℃)作为确诊IFD的研究起点。
1.3 研究方法
1.3.1 G试验 血浆(1,3)-β-D-葡聚糖检测采用MB-80微生物动态快速检测系统,操作按试剂盒说明书进行。以试剂盒推荐的诊断值> 60 ng/L判定为G试验阳性。
1.3.2 真菌培养鉴定及药敏试验 IFD患者入组时留取血液、痰液、尿液、粪便、脓液、积液等标本进行真菌培养和药敏试验。将所有培养物接种于沙保弱培养基中,25 ℃恒温培养箱培养24~48 h。白色念珠菌、热带假丝酵母菌、克柔念珠菌转种于科玛嘉显色培养基进行鉴定,其余酵母样真菌鉴定采用VITEK-2 Compact YST鉴定卡进行鉴定。质控菌株为白假丝酵母菌ATCC14053。
1.3.3 检测指标 观察IFD组和非IFD组G试验测定值的差异及G试验和传统诊断方法诊断IFD阳性的患者数;绘制受试者工作特征曲线(ROC),分析G试验诊断IFD的价值;比较G试验和传统临床方法诊断IFD的时间差异;分析血液恶性肿瘤IFD患者真菌培养情况及不同真菌种类(1,3)-β-D-葡聚糖含量。
1.4 统计学分析 采用GraphPad Prism 5统计软件分析数据,正态分布的计量资料以均数±标准差(±s)表示,组间比较采用配对t检验;计数资料采用率表示,组间比较采用χ2检验;P < 0.05为差异有统计学意义。绘制ROC曲线,分析G试验诊断IFD的价值。
2 结果
2.1 G试验和传统临床诊断方法结果比较在160例血液恶性肿瘤患者中,G试验阳性83例,阴性77例。IFD组G试验测定值明显高于非IFD组(ng/L:346.54±204.95比43.21±15.11,P < 0.05)。传统临床诊断为IFD患者中72例G试验阳性,8例阴性;非IFD患者中11例G试验阳性,69例阴性。见表1。

表1 G试验和传统临床诊断方法结果比较
2.2 G试验对血液恶性肿瘤患者IFD的诊断价值 单独G试验对血液恶性肿瘤患者IFD诊断的ROC曲线下面积(AUC)为0.91,阳性预测值为86.71%,阴性预测值为90.47%。取≥40 ng/L为诊断阈值时敏感度为91.25%〔95%可信区间(95%CI) = 82.80%~96.41%〕、特异度为55%(95%CI = 43.47%~66.15%);取≥60 ng/L为诊断阈值时敏感度为90%(95%CI = 81.24%~95.58%)、特异度为85%(95%CI = 75.26%~92%);取≥70 ng/L为诊断阈值时敏感度为90%(95%CI = 81.24%~95.58%)、特异度为88.75%(95%CI =79.72%~94.72%);取≥80 ng/L为诊断阈值时敏感度为86.25%(95%CI = 76.73%~92.93%)、特异度为90%(95%CI = 81.24%~95.58%)。G试验诊断血液恶性肿瘤患者IFD的ROC曲线见图1。
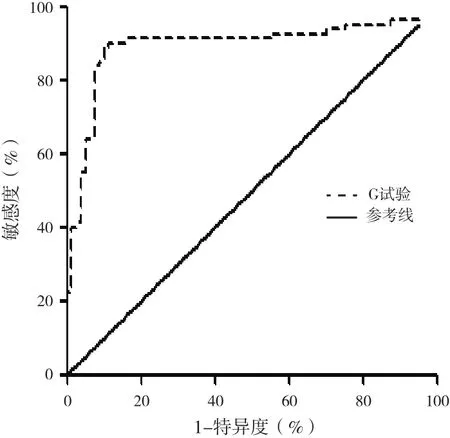
图1 G试验诊断血液恶性肿瘤IFD的ROC曲线
2.3 G试验和传统临床诊断的时间差异 G试验阳性作为诊断指标较传统临床诊断可有效缩短IFD的诊断时间(d:4.87±2.55比7.13±4.42,P < 0.01)。见图2。

图2 G试验和传统临床诊断IFD的时间差异
2.4 血液恶性肿瘤IFD患者真菌培养结果 80例IFD患者中40例真菌培养阳性,阳性标本来源于痰液33例,尿液5例,血液2例。40例阳性标本中,分离出念珠菌属36例,曲霉菌4例。念珠菌属(1,3)-β-D-葡聚糖含量均值为333.55 ng/L,曲霉菌属(1,3)-β-D-葡聚糖含量均值> 1 000 ng/L。不同念珠菌、不同曲霉菌之间(1,3)-β-D-葡聚糖含量比较差异无统计学意义(P > 0.05),念珠菌属与曲霉菌属之间比较差异有统计学意义(P < 0.05)。见表2。
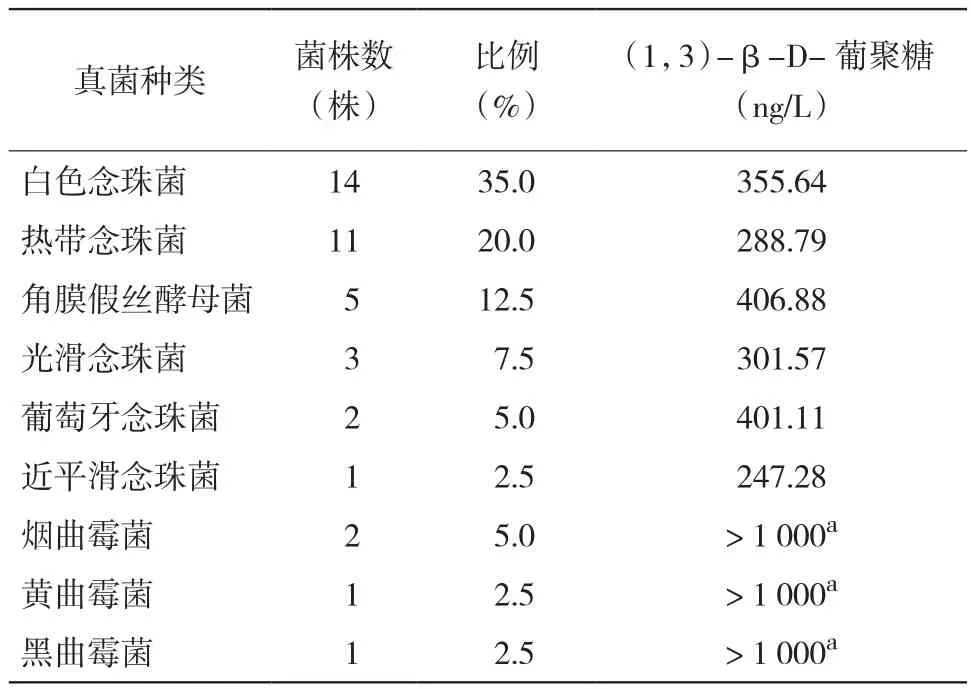
表2 血液恶性肿瘤IFD患者分离出的真菌种类、数量及不同种类真菌(1,3)-β-D-葡聚糖含量比较
3 讨论
IFD发病快、病情重、病死率高,是血液病患者死亡的主要原因之一,由于缺乏典型的临床表现、实验室病原体的培养阳性率低、所需时间长、影像学表现缺乏特异性,导致IFD早期诊断困难,抗真菌治疗不及时是目前IFD病死率较高的主要原因,作为“金标准”的组织病理学和深部组织培养由于具有创性,在血小板减少和凝血功能异常及其他类型的危重患者并不适用。
(1,3)-β-D-葡聚糖是酵母和丝状真菌细胞壁的多聚糖成分,真菌进入血液或深部组织,经吞噬细胞的吞噬和消化等作用后,(1,3)-β-D-葡聚糖可从真菌细胞壁释放,从而使血液中的含量升高[5-10]。既往研究也表明,检测血清(1,3)-β-D-葡聚糖含量确实能够反映患者深部真菌感染情况,且SLP真菌检测试剂盒测得(1,3)-β-D-葡聚糖含量较传统真菌培养法更加简便、快速,灵敏度高,可用于深部真菌感染的早期快速诊断[11],但G试验敏感度和特异度的不同与实验室设定的阈值有关,不同实验室、不同方法导致对于侵袭性真菌感染诊断的截断值、敏感度、特异度不同。韩世权等[12]一项前瞻性观察性研究通过评估不同G试验临界值对侵袭性真菌感染的诊断价值,并比较G试验、真菌培养与临床诊断3种方法诊断侵袭性真菌感染的差异,结果显示,G试验可作为早期诊断侵袭性真菌感染有效的检测手段,以20 ng/L为临界值时,其诊断侵袭性真菌感染的敏感度、特异度最高,分别为79.8%、87.9%,约登指数最大(为67.7%),且治疗过程中患者在G试验前后输注白蛋白并不影响G试验的检测结果。然而,针对G试验阈值有< 10 ng/L和> 20 ng/L,< 60 ng/L和> 100 ng/L,< 100.5 ng/L和> 151.5 ng/L,< 159 ng/L和> 259 ng/L,比较混乱,故其设定仍有一定争议[13-15]。
本研究用MB-80微生物快速动态检测系统,分别比较阈值为40、60、70、80 ng/L时诊断非粒细胞缺乏血液恶性肿瘤IFD的敏感度和特异度。通过对ROC曲线的分析发现,以70 ng/L为阈值时,AUC最大,敏感度为90%,特异度为88.75%;因为G试验的阴性预测值较高,故多次G试验阴性结果基本可以排除IFD的可能。但因为其干扰因素较多,存在假阳性的可能。分析可能的原因有:香菇多糖类抗肿瘤药物的使用;静脉输注血液制品,如白蛋白、免疫球蛋白、凝集因子等;链球菌引起的脓毒症:化疗引起的肠道黏膜受损,导致食物中葡聚糖成分进入血液等[4,7]。同时本研究表明,传统临床诊断IFD的时间较G试验明显延长,故G试验为IFD早期诊断赢得了宝贵的时间。真菌培养结果表明:血液恶性肿瘤IFD患者感染酵母样真菌仍以白色念珠菌为主,但其比例较之前文献报道的65%有所下降,其余非白色念珠菌所占比例有所上升,念珠菌感染种类也有所增加。原因可能为热带念珠菌有生成假菌丝及菌丝的能力,对细菌宿主的侵袭力更强大,可形成成熟的生物膜结构,更易发生在癌症患者中。
光滑念珠菌虽然致病性和毒性均不及白色念珠菌,但其对唑类抗真菌药物存在天然耐药或获得性耐药,可能导致检出率逐年升高,这与药物的选择机制有关。曲霉菌感染也较之前文献报道的5.9%上升。本研究结果还表明,不同种类真菌G试验测定值也有差异,如念珠菌感染者血清(1,3)-β-D-葡聚糖的含量均值为333.55 ng/L,曲霉菌感染者血清(1,3)-β-D-葡聚糖的含量> 1 000 ng/L。但也有个别念珠菌感染患者血清(1,3)-β-D-葡聚糖含量> 1 000 ng/L,可能与感染严重程度有关。故如患者血清(1,3)-β-D-葡聚糖为70~1 000 ng/L,念珠菌致感染的可能性较大;而血清(1,3)-β-D-葡聚糖含量> 1 000 ng/L时,曲霉菌引起感染的可能性较大[13-14]。
总之,G试验对诊断非粒细胞缺乏性血液恶性肿瘤患者IFD有着较高的敏感度、特异度,也可以缩短诊断时间,为临床早期诊断、治疗赢得了宝贵时间,对改善患者预后和降低病死率起到重要作用,对区分是念珠菌属还是曲霉菌属引起的感染也有一定鉴别作用,对多次检测阴性结果的患者也能基本排除IFD的诊断,避免过度使用抗真菌药物,为临床合理用药提供依据。
1 武子霞.慢性阻塞性肺疾病患者继发真菌感染临床分析.中国中西医结合急救杂志,2010,17:381.
2 陈建斌,魏思东,陈国勇,等.肝移植术后肺部真菌感染11例临床分析.实用器官移植电子杂志,2015,3:358-360.
3 杜斌,陈德昌,侯百东,等. 3 447例尸检病例的深部真菌感染分析.中华医学杂志, 1996,76:33-35
4 中国侵袭性真菌感染工作组.血液病/恶性肿瘤患者侵袭性真菌感染的诊断标准与治疗原则(第三次修订).中华内科杂志,2010,49:451-454.
5 杨惠琴,梅亚宁.血浆(1,3)-β-D-葡聚糖对深部真菌感染诊断的临床意义.中国真菌学杂志,2011,6:136-140.
6 金丽,孙曼,张昭勇,等.血清G试验在深部真菌感染中的诊断价值.安徽医学,2016,37:587-589.
7 Stevens DA. Advances in systemic antifungal therapy. Clin Dermatol,2012,30:657-661.
8 Clancy CJ, Nguyen MH. Finding the "missing 50%" of invasive candidiasis: how nonculture diagnostics will improve understanding of disease spectrum and transform patient care. Clin Infect Dis,2013,56:1284-1292.
9 杨莉莉,邓瑛,刘敏,等.血浆(1-3)-β-D葡聚糖对侵袭性真菌感染诊断的临床意义.检验医学与临床,2016,13:1364-1366.
10 钱雄杰,钮丽萍,杨鸿林.血浆1,3-β-D 葡聚糖检测在侵袭性真菌感染中的诊断价值.国际检验医学杂志,2015,36:53-54.
11 魏雁虹,杨广民,谢风.(1→3)-β-D-葡聚糖检测对深部真菌感染早期诊断的意义 .实用检验医师杂志,2011,3:220-222.
12 韩世权,苏晓蕾,赵睿,等.白蛋白对血浆(1,3)-β-D-葡聚糖检测诊断侵袭性真菌感染的影响.中华危重病急救医学,2015,27:672-676.
13 陈岩,王淑惠,黄宝青,等.血浆1,3-β-D-葡聚糖检测对恶性血液病患者侵袭性真菌感染的诊断价值.检验医学,2013,28:7-10.
14 宋敏,向成玉,杨葵,等.血浆1-3-β-D葡聚糖早期诊断深部真菌感染的临床价值.中华临床医师杂志(电子版),2015,9:3445-3447.
15 黄鹂莺姿,邓丽娟,付翔,等.血浆(1-3)-β-D-葡聚糖在新生儿侵袭性真菌感染中的诊断价值.华夏医学,2016,29:42-44.
(本文编辑:邸美仙)
Clinical efficacy of fungal glucan detection for early diagnosis of invasive fungal infections in patients with hematological malignance
LI Rui, REN Ran, XIONG Da-qian. Department of Clinical Laboratory, Affiliated Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610075, China
Objective To discuss the value of plasma (1, 3)-β-D-glucan detection in the early diagnosis in invasive fungal disease (IFD) patients with hematological malignance. Methods The hospitalized patients with hematological malignance without neutropenia admitted to Affiliated Hospital of Chengdu University of Traditional Chinese Medicine from October 2014 to April 2016 were enrolled. 160 hematological malignance patients were divided into different groups, 80 patients with invasive fungal, 80 patients with non-invasive fungal. Dynamic rapid microbial detection system MB-80 was used to detect plasma (1, 3)-β-D-glucan content, and the value of G test in the diagnosis of IFD was analyzed by receiver operating characteristic curve (ROC). Combined with fungal culture identified, the difference of (1, 3)-β-D-glucan from various types of fungi induced deep infection was analyzed. Results The content of (1, 3)-β-D-glucan of IFD infected group was significantly higher than that of non-IFD infected group (ng/L: 346.54±204.95 vs. 43.21±15.11, P < 0.05). In G test, the area under ROC curve (AUC) for IFD diagnosis was 0.91, positive predictive value was 86.71%, and negative predictive values was 90.47%. For patients with hematologic malignancies IFD, optimal diagnostic threshold was greater or equal to 70 ng/L, the diagnostic sensitivity was 90% and specificity was 88.75%, G test positive time for IFD diagnosis was significantly shorter than that of traditional diagnostic criteria (days: 4.87±2.55 vs. 7.13±4.42, P < 0.01). Fungi was isolated from 40 patients, in which 36 were Candida, accounted for 90%, and (1, 3)-β-D-glucan mean was 333.55 ng/L; and 4 were Aspergillus, accountedfor 10%, and mean (1, 3)-β-D-glucan was greater than 1 000 ng/L. No significant difference was shown in (1, 3)-β-D-glucan among different Candida (P > 0.05), but there was significant difference between Candida and Aspergillus groups (P < 0.05). Conclusions (1, 3)-β-D-glucan detection is a fast, accurate and simple method of diagnosing IFD for early diagnosis of IFD. And it has clinical value for distinguishing Candida or Aspergillus caused deep fungal infection.
(1, 3)-β-D-glucan; Hematological malignance; Invasive fungal disease; Fungal culture
610075 成都市,成都中医药大学附属医院检验科
熊大迁,Email:705006714@qq.com
10.3969/j.issn.1674-7151.2016.03.005
2016-07-14)
