铁棒锤不定根诱导及培养的初步研究
2016-12-21陈红刚杜弢何佳研张鑫杨晓霞
陈红刚,杜弢,何佳研,张鑫,杨晓霞
1.甘肃省高校中(藏)药化学质量研究省级重点实验室,甘肃 兰州 730000;2.甘肃中医药大学药用植物遗传育种研究所,甘肃 兰州 730000
铁棒锤不定根诱导及培养的初步研究
陈红刚1,2,杜弢1,2,何佳研1,张鑫1,杨晓霞1
1.甘肃省高校中(藏)药化学质量研究省级重点实验室,甘肃 兰州 730000;2.甘肃中医药大学药用植物遗传育种研究所,甘肃 兰州 730000
目的 建立铁棒锤不定根的诱导及增殖培养体系。方法 通过组织培养的方法,考察外植体类型及植物生长物质对铁棒锤不定根的诱导及增殖情况的影响。结果 不定根诱导能力依次为根>茎>叶,2.5 mg/L吲哚丁酸有利于铁棒锤不定根的诱导及增殖。结论 本研究初步建立了铁棒锤不定根的诱导及增殖培养体系,为铁棒锤深层次的资源开发及利用提供了一种新途径。
铁棒锤;不定根;诱导;增殖
铁棒锤为毛茛科植物铁棒锤Aconitum pendulum Busch的干燥根,别名铁牛七(陕西)、断肠草、两头尖、磨三转(甘肃)、乌药(青海)、一枝箭、三转半(四川)、一枝蒿(宁夏)等,其性热,味辛、苦,有大毒,归心、肾、脾经,具有活血祛瘀、祛风除湿、止痛消肿的功效[1],为陕、甘、宁、青等地应用较广的一种民间草药[2]。随着铁棒锤药用价值的挖掘及药理学研究的深入,其用途愈显广泛,铁棒锤不仅可以作为镇痛剂,还具有作为植物杀虫剂和杀鼠剂等多种用途[3],市场需求量日益增大,而无节制的采挖对铁棒锤野生资源破坏非常严重,一些地区野生资源已濒临枯竭。为了保护铁棒锤野生资源,满足社会用药需求,寻找新的药材来源已经迫在眉睫。
利用不定根培养生产次生产物具有生长周期短、条件可控、来源单一、遗传背景一致、经济方便、重复性强、效率高和可周年试验或生长等优点[4],并已在人参[5]、丹参[6]、三七[7]、苍术[8]、太子参[9]等多种药材中得以实现。本试验旨在通过建立铁棒锤不定根培养体系,为进一步大规模生产铁棒锤次生代谢产物的研究提供技术参考,同时也为铁棒锤深层次的资源开发及利用提供一种新途径。
1 仪器与试药
GTOP-500Y型智能光照培养箱,浙江托普仪器有限公司;I Ka Ks4000i型恒温摇床,德国IKA公司;XB224型分析天平,上海精科天美科学仪器有限公司。
赤霉素、MS培养基各组分、聚乙烯吡咯烷酮(PVP)、吲哚丁酸(IBA)、6-苄基腺嘌呤(6-BA)等均为分析纯。铁棒锤种子采自甘肃省临夏州积石山县黄草坪,经甘肃中医药大学杜弢教授鉴定为毛茛科植物铁棒锤Aconitum pendulum Busch。
2 方法
2.1 铁棒锤无菌苗的获得
取铁棒锤种子搓去种皮,用400 mg/L赤霉素浸泡12 h,然后用0.1%升汞(HgCl2)浸泡10 min灭菌,再用无菌水冲洗4 次,最后用75%酒精灭菌5 s,无菌水冲洗4次,吸干材料表面水分后,将种子(切去部分胚乳)接种在MS固体培养基上[10],共处理20瓶,每瓶10粒种子。培养基均添加蔗糖30 g/L、PVP 1.0 g/L+活性炭1.2 g/L、琼脂7.0 g/L,pH=5.8,培养温度(20±1)℃,光照12 h/d、强度2 500~3 000 lx。
2.2 铁棒锤不定根的诱导
切取“2.1”项下培养的铁棒锤无菌苗的根、茎段(1 cm左右)和真叶(0.25 cm2左右,横向切去尖端部分背紧贴培养基中)为外植体,分别平放到含有不同浓度IBA(0、0.5、1、1.5、2.0、2.5、3.0、3.5 mg/L)的MS固体培养基上,每个处理6个外植体(2根段、2茎段、2叶片),5次重复。培养基均添加蔗糖30 g/L、琼脂7.0 g/L、PVP 1.0 g/L+活性炭1.2 g/L,pH=5.8,培养温度(20±1)℃,暗培养。
2.3 铁棒锤不定根的增殖培养
将“2.2”诱导出的不定根切割成1 cm左右的段,接种在含有不同浓度IBA(1.5、2.5 mg/L)及6-BA(0、0.1、0.5 mg/L)的MS培养基中,培养基设固体、液体2个处理,每个处理设5个重复。固体培养基添加蔗糖30 g/L、琼脂7.0 g/L、PVP 1.0 g/L,pH=5.8,培养温度(20±1)℃,暗培养。液体培养基添加蔗糖30 g/L、PVP 1.0 g/L,pH=5.8,转速100 r/min,培养温度(20±1)℃,暗培养。
2.4 数据计算及分析
接种量(g)=接种后培养基总质量(g)-接种前培养基总质量(g)。收获量(g):将培养得到的不定根取出,洗去表面的培养基并用滤纸吸干水分,置于天平进行称量。增殖倍数=(收获量-接种量)÷接种量。采用SPSS17.0统计软件对数据进行分析。
3 结果
3.1 铁棒锤无菌苗生长情况
培养3~5 d铁棒锤种胚开始萌动,第6日开始发芽,第32日发芽率达到最高,平均株高6~8 cm,根长1~3 cm,每株含2~3片真叶,见图1。
3.2 外植体与外源性激素对铁棒锤不定根诱导的影响
根段培养至第6日表面开始出现少量愈伤化,第8日开始出现不定根(带有大量淡黄色及白色根毛),以后愈伤组织量逐渐增多,第15日达到最大,不定根数目也逐渐增多,在第17-21日达到最大,随后增长缓慢,在第27日不定根数目停止增长。茎段培养至第9日表面开始愈伤化,以后则少量愈伤化而直接产生不定根,在第17-26日大量增长,第27日不定根数目停止增长。叶片始终没有诱导产生愈伤组织及不定根,叶片颜色由深绿变为暗绿最后变为黑色死亡。根段、茎段、叶片诱导不定根情况见图2。

图1 铁棒锤无菌苗

图2 铁棒锤诱导不定根
第30日统计不同类型外植体在不同浓度外源性激素条件下的不定根诱导情况,结果见表1。可以看出,3种外植体在不同IBA浓度下不定根诱导能力明显不同,根段在所有IBA浓度下均可诱导产生不定根且诱导率较高,茎段在大多数IBA浓度下可诱导产生不定根但诱导率偏低,叶片则无论在何种IBA浓度下均不能诱导产生不定根,说明根段是铁棒锤不定根诱导的最好材料,茎次之,叶片最差,表现出明显的异质性。
随着IBA浓度的增加,外植体不定根诱导能力明显提高。其中根段在IBA浓度1.5 mg/L时诱导效果最好,达到100%,但在IBA浓度为2.5 mg/L时生根条数最多。茎段在IBA浓度为2.5 mg/L时诱导效果最好,达到60%,生根条数也最多。而随着IBA浓度的进一步增加,不论是根段还是茎段其不定根诱导能力及生根条数均有所下降。综合考虑,2.5 mg/L的IBA更有利于铁棒锤不定根的诱导。
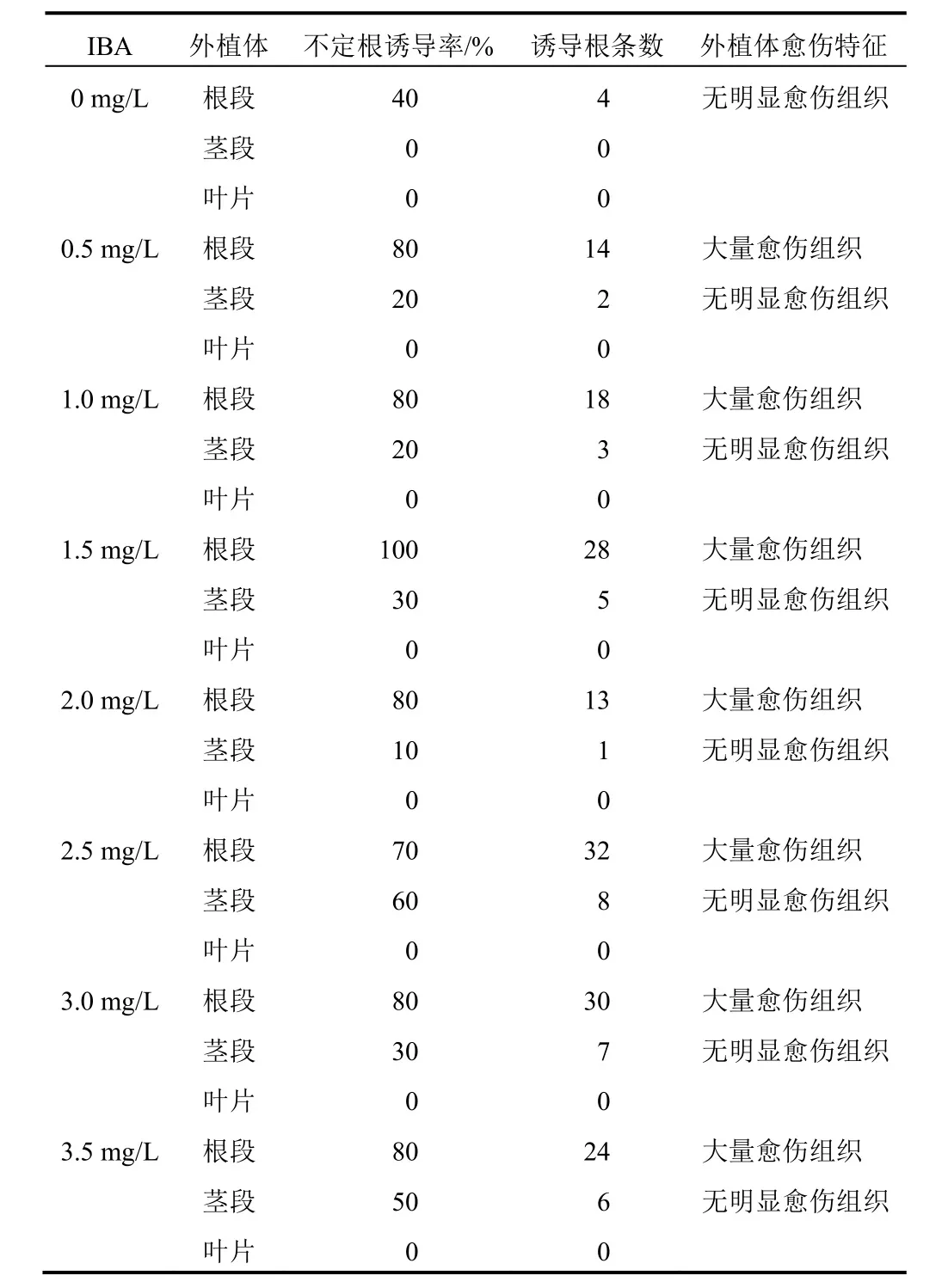
表1 不同IBA浓度与外植体对铁棒锤不定根诱导的影响
3.3 培养基类型与外源性激素对不定根增殖的影响
暗培养至第8日,根段表面开始出现白色突起,以后根段逐渐膨大,但生长缓慢,在第27日开始长出新不定根(带有大量淡黄色及白色根毛),见图3。
第40日统计不定根增殖情况,结果见表2。可以看出,各处理间不定根的增殖倍数差异较大。从培养基类型分析,固体培养基的平均增殖倍数高于液体培养基;从激素浓度来看,较高浓度的IBA更有利于不定根的增殖,不论是固体培养基还是液体培养基,均在IBA浓度为2.5 mg/L时增殖倍数达到最大,其中固体培养基最大增殖倍数达到5.97倍,而液体培养基最大增殖倍数达到3.93倍。

图3 增殖培养的铁棒锤不定根
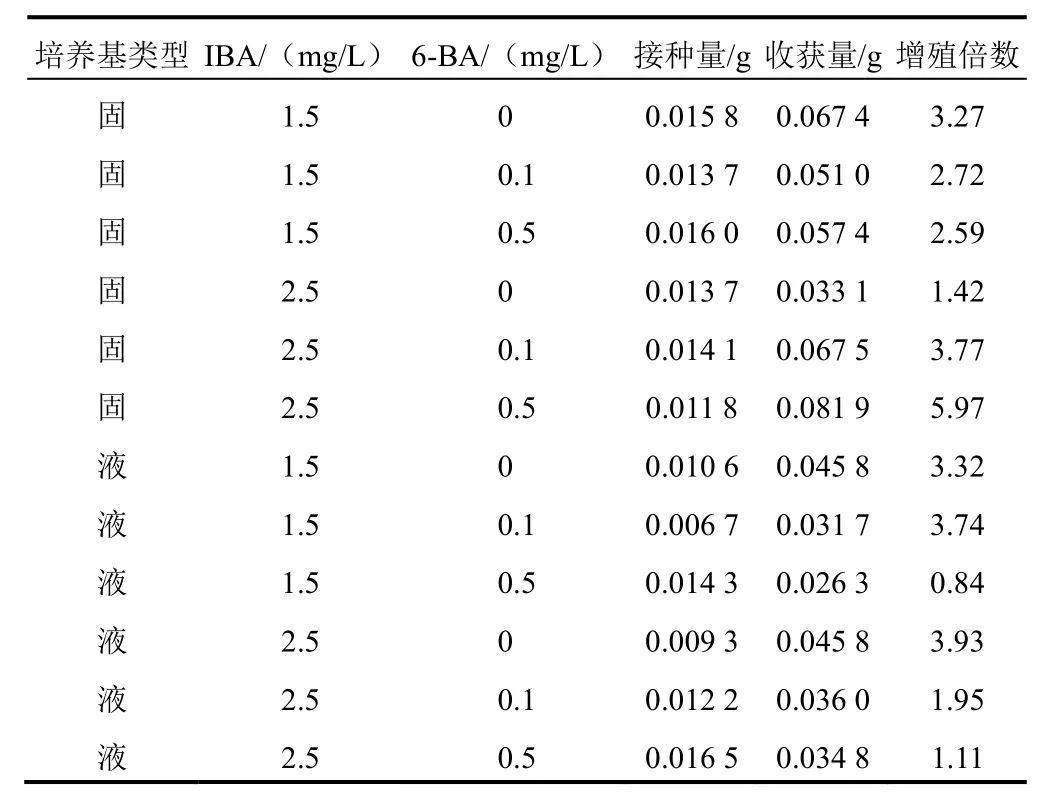
表2 培养基类型与外源性激素对铁棒锤不定根增殖的影响
4 讨论
铁棒锤无菌苗不定根诱导能力为根>茎>叶。在IBA浓度较低时,根段、茎段均可直接诱导产生不定根,但不定根的诱导率偏低且平均根条数较少。随着IBA浓度的升高,根段愈伤化程度逐渐增强,产生大量愈伤组织,再通过愈伤组织的分化间接诱导产生不定根,而茎段则基本不发生愈伤化,而是直接诱导产生不定根,推测不同类型的外植体诱导生根的机制可能存在差异。
本研究初步建立了铁棒锤不定根诱导及增殖培养体系,即以根段为诱导材料,MS+IBA 2.5 mg/L+PVP 1.0 g/L+活性炭1.2 g/L+蔗糖30 g/L+琼脂7.0 g/L为诱导培养基,MS+IBA 2.5 mg/L+6-BA 0.5 mg/L+PVP 1.0 g/L+蔗糖30 g/L+琼脂7.0 g/L为增殖培养基,pH=5.8,培养温度(20±1)℃,暗培养。但培养体系中不定根增殖倍数相对偏低,还需进一步优化试验方案,扩大增殖倍数,提高不定根产量。
与传统的大田栽培植物相比,利用组织培养方法获得有用的次生代谢产物具有不受时间、地点限制,可以提供均一产物等优点。而不定根由于没有外源基因,在药品的开发方面更具有优势,将不定根培养技术应用于铁棒锤有效成分生产,快速大量地获得铁棒锤不定根及次生代谢产物,可以有效解决铁棒锤野生资源不足及大田生产周期长、有效成分不稳定的问题,为进一步大规模生产其有效成分和研究铁棒锤有效成分的代谢途径提供物质材料,从而为保护铁棒锤野生资源及现有资源的开发利用提供一条可行的新途径。
[1] 杨智锋,刘建峰,张红,等.铁棒锤药材质量标准研究[J].中国中药杂志,2005,30(22):1771-1773.
[2] 陕西省革命委员会卫生局商业局.陕西中草药[M].北京:科学出版社, 1971:505.
[3] 胡君茹,姜华.藏药铁棒锤的化学成分及药理作用研究进展[J].甘肃中医,2006,19(11):18.
[4] 尹双双,高文远,王娟,等.药用植物不定根培养的影响因素[J].中国中药杂志,2012,37(24):3691-3694.
[5] 黄滔,高文远,王娟,等.离体培养条件对人参不定根生长及其活性成分合成的影响[J].中国中药杂志,2010,35(1):13-17.
[6] 陈巍,郭肖红,高文远,等.丹参不定根离体培养的研究[J].中国中药杂志,2006,31(17):1409-1412.
[7] 高先富,徐朝晖,刘佳健,等.三七不定根的离体诱导与培养[J].中国中药杂志,2006,31(18):1485-1488.
[8] 袁媛,吕冬梅,黄璐琦,等.苍术不定根诱导培养的研究[J].中国中药杂志,2007,32(1):65-66.
[9] 梁玉勇,尹双双,左北梅,等.太子参不定根组织培养的研究[J].中国中药杂志,2012,37(24):3803-3807.
[10] 陈红刚,杜弢,高素芳,等.胚培养途径探索铁棒锤种子的休眠原因[J].种子,2011,30(2):87-88.
Preliminary Study on Adventitious Root Induction and Culturing of Aconitum Pendulum
Busch
CHEN Hong-gang1,2, DU Tao1,2, HE Jia-yan1, ZHANG Xin1, YANG Xiao-xia1(1. Key Laboratory of
Chemistry and Quality for TCM and Tibetan Medicine in Universities of Gansu Province, Lanzhou 730000, China; 2. Institute of Medicinal Plant Genetics and Breeding of Gansu University of Chinese Medicine, Lanzhou 730000, China)
Objective To establish the adventitious root induction and culture system of Aconitum pendulum Busch. Methods The influence of different explants and plant growth substances on adventitious induction proliferation of Aconitum pendulum Busch were investigated through tissue culturing. Results Explants induction ability was: root>stem>leaf. 2.5 mg/L IBA was in favor of induction and multiplication adventitious root of Aconitum pendulum Busch. Conclusion The culture system of induction and proliferation adventitious roots of Aconitum pendulum Busch was preliminary established, which provides a new way for resource exploitation and utilization of Aconitum pendulum Busch.
Aconitum pendulum Busch; adventitious root; induction; proliferation
10.3969/j.issn.1005-5304.2016.04.021
R282.2
A
1005-5304(2016)04-0080-04
2015-05-25)
(
2015-06-09;编辑:陈静)
甘肃省青年科技基金计划(1308RJYA026);甘肃省高校中(藏)药化学与质量研究省级重点实验室开放基金项目(zzy-2012-03);兰州市科技计划项目(2013-3-115)
杜弢,E-mail:gslzdt@163.com
