新加糖肾康对高糖环境下人肾小管上皮细胞α-平滑肌肌动蛋白和E-钙黏蛋白的影响
2016-12-21朱苗蕊权卓杨丽霞程涛张定华高汉媛孙文
朱苗蕊,权卓,杨丽霞,程涛,张定华,高汉媛,孙文
1.兰州石化总医院,甘肃 兰州 730060;2.解放军第十医院,甘肃 武威,733000;3.甘肃省中医药研究院,甘肃 兰州 730050;4.甘肃省中医院,甘肃 兰州 730050;5.甘肃中医药大学,甘肃 兰州 730000;6.北京中医药大学,北京 100029
新加糖肾康对高糖环境下人肾小管上皮细胞α-平滑肌肌动蛋白和E-钙黏蛋白的影响
朱苗蕊1,权卓2,杨丽霞3,程涛3,张定华4,高汉媛5,孙文6
1.兰州石化总医院,甘肃 兰州 730060;2.解放军第十医院,甘肃 武威,733000;3.甘肃省中医药研究院,甘肃 兰州 730050;4.甘肃省中医院,甘肃 兰州 730050;5.甘肃中医药大学,甘肃 兰州 730000;6.北京中医药大学,北京 100029
目的 观察新加糖肾康对高糖环境培养下人肾小管上皮细胞(HK-2)α-平滑肌肌动蛋白(α-SMA)和E-钙黏蛋白(E-cadherin)的影响,探讨其防治糖尿病肾间质纤维化的作用机制。方法 含10%胎牛血清1640培养基体外培养HK-2细胞。实验分为空白对照组、高糖组、空白血清组和新加糖肾康低、中、高剂量组。药物干预后,MTT法检测细胞增殖,ELISA检测α-SMA和E-cadherin的含量。结果 与空白对照组比较,HK-2细胞经高糖培养后细胞数量和α-SMA含量显著增加、E-cadherin含量明显降低(P<0.05);与高糖组比较,新加糖肾康组α-SMA含量降低、E-cadherin含量增加、细胞增殖受到抑制。结论 新加糖肾康能够抑制肾小管上皮细胞表型转化及细胞增殖,具有防治糖尿病肾间质纤维化的作用。
新加糖肾康;高糖;人肾小管上皮细胞;表型转化;细胞增殖
糖尿病肾病(DN)是糖尿病常见的慢性微血管并发症之一,其发病率高、危害大,在糖尿病所有并发症中占主要地位。但其发病机制尚未完全阐明。既往研究认为,早期DN病变在肾小球部位,而近年来研究发现,肾小管上皮细胞表型转化引起的肾间质纤维化与其关系更为密切[1]。中药复方新加糖肾康是在甘肃省中医院刘国安和张定华研究的基础上,结合北京中医药大学刘铜华教授治疗DN的学术思想,经组方优化,最终确立的临床经验方,具有益气养阴、清热祛湿、活血化瘀的功效。本课题组前期研究发现,新加糖肾康能够减少高糖环境培养下人肾小管上皮细胞细胞外基质成分Ⅰ型胶原(ColⅠ)、Ⅲ型胶原(Col Ⅲ)和纤连蛋白(FN)的分泌与沉积,并能调控纤维化因子基质金属蛋白酶-9(MMP-9)及其抑制剂-1(TIMP-1)的分泌与释放[2-3]。本实验在此基础上,观察其对高糖环境下培养人肾小管上皮细胞标志蛋白α-平滑肌肌动蛋白(α-SMA)和E-钙黏蛋白(E-cadherin)的影响,进一步探讨其对DN肾间质纤维化的作用机制。
1 实验材料
1.1 动物与细胞株
SPF级雄性Wistar大鼠20只,甘肃中医药大学动物中心,许可证号SCXK(甘)2004-0006,饲养于甘肃省中医药研究院中药研究所动物室。人肾小管上皮细胞(HK-2),上海斯信生物科技有限公司,甘肃省中医药研究院中心实验室细胞培养室培养。
1.2 药物
新加糖肾康主要组成为黄芪、生地黄等,所有饮片购于甘肃省中医院药剂科,水提醇沉,冷藏备用。
1.3 主要试剂与仪器
人α-SMA ELISA试剂盒(批号E1208Hu)、E-cadherin ELISA试剂盒(批号E0209Hu),上海晶天生物科技有限公司;1640培养基(批号1237579)、胎牛血清(批号12657-029),Gibco公司;D-葡萄糖,汕头西陇化工厂有限公司,用时配成30 mmol/L浓度。CO2培养箱(日本SANYO),SW-CJ-2FD超净生物安全柜(苏净安泰),IX51倒置显微镜(日本Olympus),MS352酶标仪(芬兰Labsystems),-80 ℃ MDF-U53V超低温冰箱(日本SANYO)。
2 实验方法
2.1 新加糖肾康药物血清制备
雄性Wistar大鼠随机分为空白对照组和药物组,每组10只。药物组采用新加糖肾康灌胃,剂量为成人临床用量的6.5倍;空白对照组采用等体积生理盐水灌胃。每次灌胃1 mL/100 g体质量。早晚各1次,连续3 d。最后1次灌胃前禁食不禁水,灌胃30 min后,大鼠股动脉无菌采血,冷冻离心,吸取血清,装入EP管中,-20 ℃保存备用。
2.2 细胞培养及分组
HK-2 细胞于37 ℃、5%CO2培养箱中培养,培养基为含10%胎牛血清1640培养基。每日镜下观察细胞生长状态,及时更换新鲜培养基,待细胞生长融合达到80%以上,用含0.25%胰蛋白酶、0.05%EDTA消化液消化,镜下观察细胞消化程度,及时拍落消化细胞,用完全培养基终止消化,1000 r/min离心5 min,用新鲜培养基将细胞吹打均匀后进行传代培养。实验分为6组,空白对照组由1640培养液培养;高糖组在1640培养液中加入30 mmol/L D-葡萄糖,对细胞进行高糖环境下培养;空白血清组在高糖组的基础上,加入10%空白血清,对细胞进行干预性培养;新加糖肾康低剂量组在高糖组的基础上,加入5%新加糖肾康药物血清,对细胞进行干预性培养;新加糖肾康中剂量组在高糖组的基础上,加入10%新加糖肾康药物血清,对细胞进行干预性培养;新加糖肾康高剂量组在高糖组的基础上,加入20%新加糖肾康药物血清,对细胞进行干预性培养。
2.3 指标检测
2.3.1 细胞α-平滑肌肌动蛋白和E-钙黏蛋白表达检测 将传代培养的细胞吹打均匀,接种在24孔细胞培养板中,每孔剂量为1 mL细胞悬液,每组3孔,接种2板。2 h后镜下观察细胞贴壁状态,12 h后观察各组细胞外表形态,初步判断药物作用。培养24 h后吸弃上清液,每组加入1 mL含药培养液,继续培养。培养24、48 h时,仔细吸取每孔细胞上清液于1.5 mL EP管中,4 ℃、4000 r/min离心10 min,取上清液,低温保存待测。按ELISA试剂盒说明书检测。检测前将所有样本置于室温下慢慢融化,然后在反应条孔中加入标准品或待测标本,每孔剂量为100 μL。空白对照孔加入100 μL稀释液。在37 ℃培养箱中孵育,洗涤反应板,最后加酶标抗体进行酶联免疫反应。反应终止后,以空白对照孔调零,于酶标仪450 nm处测定各孔光密度(OD)值。
2.3.2 细胞增殖检测 将传代培养的细胞接种于96孔细胞培养板中,每孔100 μL,每组接种6孔,接种3板。显微镜下观察细胞贴壁状态,培养过夜,弃上清液,每组加入含药培养液100 μL,继续培养。分别在24、48、72 h时各取出一板细胞,弃上清液,加入1 mg/mL MTT 100 μL,继续孵育4 h。弃上清液,加入100 μL DMSO,振荡10~15 min,使培养板中的紫蓝色结晶体溶解。于酶标仪492 nm处测定各组细胞OD值。
3 统计学方法
采用SPSS13.0统计软件进行分析。实验数据以—x±s表示,多组间比较采用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 新加糖肾康对人肾小管上皮细胞α-平滑肌肌动蛋白和E-钙黏蛋白的影响
正常培养HK-2细胞在高糖培养环境下,细胞表型标志蛋白表达发生改变,原上皮细胞标志蛋白E-cadherin含量降低,成纤维细胞标志蛋白α-SMA含量显著增加(P<0.05)。经新加糖肾康干预后,α-SMA含量降低,而E-cadherin含量增加,药效随药物剂量和作用时间增加而增强,新加糖肾康各剂量组48 h时效果更显著,与高糖组比较差异有统计学意义(P<0.05)。结果见表1、表2。
表1 各组HK-2细胞不同时间点α-SMA含量比较(±s,ng/mL)
注:与空白对照组比较,*P<0.05;与高糖组比较,△P<0.05
组别 n 24 h 48 h空白对照组 3 0.510±0.074 0.602±0.096高糖组 3 1.840±0.073*2.279±0.112*空白血清组 3 0.621±0.058△0.549±0.184△新加糖肾康低剂量组 3 1.752±0.150*1.420±0.072*△新加糖肾康中剂量组 3 1.681±0.121*1.435±0.053*△新加糖肾康高剂量组 3 1.607±0.069*1.373±0.180*△
表2 各组HK-2细胞不同时间点E-cadherin含量比较(±s,ng/mL)
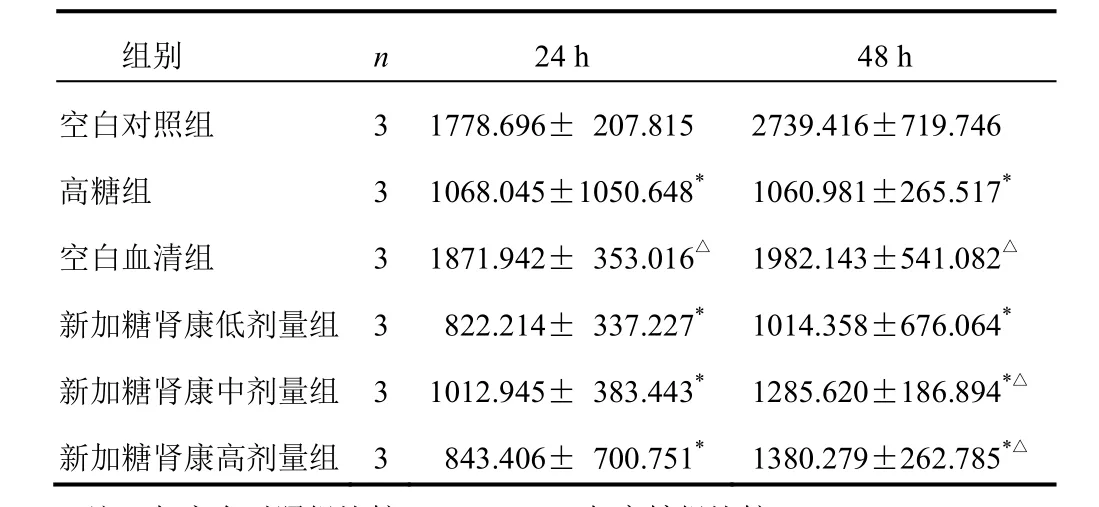
表2 各组HK-2细胞不同时间点E-cadherin含量比较(±s,ng/mL)
注:与空白对照组比较,*P<0.05;与高糖组比较,△P<0.05
组别 n 24 h 48 h空白对照组 3 1778.696± 207.815 2739.416±719.746高糖组 3 1068.045±1050.648*1060.981±265.517*空白血清组 3 1871.942± 353.016△1982.143±541.082△新加糖肾康低剂量组 3 822.214± 337.227*1014.358±676.064*新加糖肾康中剂量组 3 1012.945± 383.443*1285.620±186.894*△新加糖肾康高剂量组 3 843.406± 700.751*1380.279±262.785*△
4.2 新加糖肾康对人肾小管上皮细胞细胞增殖的影响
正常培养HK-2细胞在高糖环境下,细胞数量显著增加,并随高糖培养时间的增加,细胞增殖更加显著,与空白对照组比较差异有统计学意义(P<0.05);经新加糖肾康干预后,细胞数量减少,细胞增殖在一定程度上受到抑制,新加糖肾康中、高剂量组效果更为明显,与高糖组比较差异有统计学意义(P<0.05)。结果见表3。
表3 各组HK-2细胞不同时间点细胞增殖比较(±s,OD值)

表3 各组HK-2细胞不同时间点细胞增殖比较(±s,OD值)
注:与空白对照组比较,*P<0.05;与高糖组比较,△P<0.05
组别 n 24 h 48 h 72 h空白对照组 6 0.168±0.006 0.169±0.007 0.188±0.007高糖组 6 0.215±0.010*0.217±0.015*0.219±0.019*空白血清组 6 0.187±0.006△0.188±0.020△0.173±0.007△新加糖肾康低剂量组6 0.212±0.020*0.206±0.029*0.208±0.014*新加糖肾康中剂量组6 0.195±0.005*△0.194±0.007*△0.193±0.006△新加糖肾康高剂量组6 0.193±0.022*△0.189±0.005*△0.182±0.021△
5 讨论
DN属中医“消渴”“肾病”范畴,根据临床表现其类似于中医古籍中的“水肿”“胀满”“尿浊”等病证。金元时期著名医家刘河间《三消论》指出:“夫消渴者,多变为聋盲疮癣痤疿之类,或水液妄行而面上肿也。”再如《圣济总录》有云:“消渴病久,肾气受伤,肾主水,肾气虚衰,气化失常,开阖不利,水液凝聚体内而出现水肿。”上述皆指出消渴日久即可发生传变为水肿,这与现代DN的临床表现极为相似。有关DN的中医病机,古代医家的观点多集中在“肾虚血瘀”,并一致认为其基本病机表现为本虚标实,本虚一般指阴虚、阳虚、肺虚、肾虚等先天禀赋不足;标实主要指痰、浊、湿、瘀等后天病理因素。
近年来,有关肾小管上皮细胞转分化的研究在DN中越来越多,并取得了一定的研究成果。研究认为,肾小管上皮细胞转分化引起的肾间质纤维化、细胞外基质成分积聚等病理改变,是DN的基础特征。肾小管上皮细胞转分化,即表型转化,在DN的发展演变过程中起重要作用。表型转化主要是指当机体组织细胞所处的外界环境发生变化后,细胞本来特有的表性特征发生改变,细胞获取一种新的表型特征,由一种表型转变为另一种表型,也就是变成另一种细胞。
有研究表明,肌成纤维细胞是肾小管上皮细胞转分化的主要细胞类型[4],是细胞外基质成分合成的最主要细胞。肾小管上皮细胞转分化为肌成纤维细胞的病理特点有:首先上皮细胞的细胞间隙变宽,细胞间黏附状态渐渐消失,细胞拉长成梭状,细胞特征性标志蛋白发生改变,主要表现为上皮细胞的标志性蛋白E-cadherin的表达消失,肌成纤维细胞的标志蛋白α-SMA的表达出现;在细胞形态改变的同时伴随肾小管基底膜结构的大范围破坏,细胞失去基底膜的牵拉约束,活动力逐渐增强,离开固有位置向间质移行,到达间质后开始分泌大量的细胞外基质成分[5],引起局部组织的纤维化进程。因此,α-SMA和E-cadherin成为研究DN肾小管上皮细胞转分化的关键指标。
新加糖肾康方中黄芪、生地黄益气养阴,为君药;槐米、大黄清热祛湿,为臣药;益母草、山楂、水蛭活血化瘀,为佐药。其中水蛭为新增虫类药,加强了组方的活血化瘀作用。研究发现,正常HK-2细胞E-cadherin的含量较高,而α-SMA几乎没有,在高糖环境培养下,细胞数量显著增加,呈增殖状态,肌成纤维细胞的标志物α-SMA含量显著增加,而上皮细胞的标志蛋白E-cadherin含量显著下降,说明HK-2细胞在高糖环境下细胞表型发生了转变。但在新加糖肾康药物血清干预后,α-SMA含量开始减少,E-cadherin含量逐渐上升,细胞增殖受到抑制。结果表明,新加糖肾康具有抑制肾小管上皮细胞转分化的作用,这可能是其治疗DN的机制所在。
[1]李能娟,李红.肾小管上皮细胞表型转化与糖尿病肾病[J].国际内分泌代谢杂志,2006,26(4):277-279.
[2]朱苗蕊,杨丽霞,薛建军,等.新加糖肾康对高糖环境下HK-2细胞外基质成分沉积的作用研究[J].中医研究,2015,28(3):56-58.
[3]柴青春,杨丽霞,薛建军,等.糖肾康对高糖诱导人肾小管上皮细胞分泌基质金属蛋白酶-9及其抑制剂-1的影响[J].中国中医药信息杂志, 2014,21(10):58-60.
[4]杨丽霞,李彧,王谦,等.姜黄素对TGF-β1诱导人肾小管上皮细胞转分化及分泌细胞外基质成分的影响[J].中国中西医结合肾病杂志,2008, 9(12):1040-1043.
[5]FAN J M, NG Y Y, HILL P A, et al. Transfoming growth factor-beta regulates tubular epithelial-myofibroblast transdifferentiation in vitro[J]. Kid Int,1999,56:1455-1467.
Effects of New Tangshenkang on α-SMA and E-cadherin of Human Renal Tubular Epithelial
Cell HK-2 in High Concentrations of Glucose
ZHU Miao-rui1, QUAN Zhuo2, YANG Li-xia3, CHENG Tao3,
ZHANG Ding-hua4, GAO Han-yuan5, SUN Wen6(1. Lanzhou Petrochemical General Hospital, Lanzhou 730060, China; 2. Tenth Chinese People's Liberation Army Hospital, Wuwei 733000, China; 3. Gansu Province Academy of Chinese Medicine, Lanzhou 730050, China; 4. Gansu Province Hospital of TCM, Lanzhou 730050, China; 5. Gansu University of Chinese Medicine, Lanzhou 730000, China; 6. Beijing University of Chinese Medicine, Beijing 100029, China)
Objective To observe he effects of new Tangshenkang on α-SMA and E-cadherin of human renal tubular epithelial cell HK-2 in high concentrations of glucose; To explore the mechanism of new Tangshenkang on the prevention and treatment of diabetic renal fibrosis. Methods The HK-2 cells were cultured and divided into control group, high glucose group, animal serum control group, new Tangshenkang low-, medium-, and high-dosage group. After medicine intervention, cell proliferation was tested by MTT assay, and contents of α-SMA and E-cadherin were observed by ELISA assay. Results Compared with control group, α-SMA of HK-2 cultured with high glucose was much notable, but the content of E-cadherin significantly decreased, with statistical significance (P<0.05). The content of α-SMA of HK-2 cultured with new Tangshenkang decreased, and the content of E-cadherin increased; cell proliferation was markedly inhibited in culture medium supernatant of HK-2 cells cultured with high glucose plus new Tangshenkang compared with only high glucose, with statistical significance. Conclusion New Tangshenkang can inhibit cell proliferation and epithelial-myofibroblast transdifferentiation of HK-2 cell induced by high glucose, and prevent the development of diabetic renal fibrosis to a certain extent.
new Tangshenkang; high glucose; human renal tubular epithelial cell HK-2; epithelial-myofibroblast transdifferentiation; cell proliferation
10.3969/j.issn.1005-5304.2016.03.015
R285.5
A
1005-5304(2016)03-0054-04
国家自然科学基金(81202971);甘肃省中医药科技研究课题(GZK-2011-13)
杨丽霞,E-mail:yanglixia-415@163.com
(2015-04-21;编辑:华强)
