青岛灵山湾筏式养殖魁蚶食物来源的季节变动研究
2016-12-21蔡星媛张秀梅刘甜雨李文涛张沛东
蔡星媛,张秀梅,2*,刘甜雨,李文涛,张沛东
(1.中国海洋大学 水产学院,山东 青岛 266003;2.青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266072)
青岛灵山湾筏式养殖魁蚶食物来源的季节变动研究
蔡星媛1,张秀梅1,2*,刘甜雨1,李文涛1,张沛东1
(1.中国海洋大学 水产学院,山东 青岛 266003;2.青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266072)
魁蚶(Anadarabroughtonii)是我国北方重要的经济贝类,筏式养殖是其主要的生产方式。2014年5月至2015年1月,测定了不同季节灵山湾筏式养殖魁蚶及其3种潜在食物源(表层颗粒有机物SPOM、底层颗粒有机物BPOM和附着微藻AM)的碳氮稳定同位素(δ13C和δ15N),结合胃含物分析研究了海区食物源结构的季节变化对魁蚶食物组成的影响。结果显示,魁蚶及其食物源的稳定同位素比值均存在明显的季节差异,魁蚶的δ13C值(-19.6‰~-19.2‰)介于SPOM(-23.3‰~-21.8‰)、BPOM(-22.1‰~-21.2‰)和AM(-17.0‰~-16.0‰)之间,δ15N值范围集中在8.7‰~9.9‰。冬季魁蚶的δ13C值最低,δ15N值则最富集。水体颗粒有机物(主要由浮游植物组成)是魁蚶的主要食物来源(60.0%~77.8%),以夏季的饵料贡献率最高;海区再悬浮作用使BPOM的贡献率始终维持在较高水平(30.8%~47.1%);而养殖网笼上的附着微藻也可为魁蚶提供约22.1%~40.0%的食物。研究揭示了筏式养殖魁蚶可以混合滤食颗粒有机物和附着微藻,附着微藻是其重要的食物补充。
魁蚶;食物来源;季节变化;筏式养殖;稳定同位素分析;胃含物分析
1 引言
筏式养殖是我国沿海重要的贝类增养殖方式之一。筏养贝类主要滤食颗粒有机物(包括浮游植物、微型原生动物、碎屑等)[1—2]和海底沉积物中再悬浮的底栖微藻[3—4]。同时,浮筏及养殖网笼上的附着生物也可能是浮游动物和滤食性贝类的潜在食物来源[2,5]。然而,目前关于常见养殖贝类食物来源及其组成的相关研究尚不多见[2,6],仍缺乏更多的直接证据来表明附着微藻是养殖贝类的重要食物来源。
传统的胃含物分析法和新兴的稳定同位素技术都可用于评估消费者的食物来源。研究表明,消费者与其潜在食物源之间存在紧密的同位素相似性,通过对碳氮稳定同位素比值(δ13C、δ15N)的测定可以有效反应消费者在较长一段时间内消化吸收的食物来源信息[7—10]。通常,碳稳定同位素比值(δ13C)相对保守,富集度低,可用于反映消费者对所生活海区中不同食物来源的同化吸收情况[10—11];而消费者及其潜在食源间的氮稳定同位素比值(δ15N)则具有明显的富集现象,多用于营养级的确定[7,12]。胃含物分析法则简单、直观地反映了消费者在短时间内的摄食情况,但所需样本量大,易消化的饵料种类也因不易辨认而被忽略和低估[13—14]。因此,将稳定同位素技术与传统的胃含物分析法相结合,可以更全面、准确获得生物栖息地及其营养关系等方面的信息[14],并提供消费者长短期内的有效摄食信息[2]。
魁蚶(Anadarabroughtonii)作为一种经济价值较高的海产滤食性贝类,近年来已成为我国北方重要的增养殖品种,养殖面积和产量均呈现明显增加趋势[15],筏式养殖也是其主要的生产方式之一[16]。本研究选择青岛灵山湾筏式养殖魁蚶为研究对象,运用稳定同位素技术和胃含物分析法比较了魁蚶及其潜在食物源碳、氮稳定同位素比值的季节变化,并评估了海区内浮游植物和附着微藻对筏养魁蚶的饵料贡献率,旨在为全面了解魁蚶的食物关系,明确筏式养殖海区的食物网结构,构建贝类健康增养殖模式提供参考依据。
2 材料和方法
2.1 采样海区概况及样品处理
实验地点选在山东省青岛市胶南灵山湾筏式养殖区(35°54.590′N,120°07.630′E附近水域;水深4.8~6.7 m)(图1)。根据2014年5月至2015年1月对筏养区内环境指标的逐月监测,水温4.74~25.21℃,夏季7、8月达到最高,冬季1月为最低;盐度29.27~30.32;pH 7.90~8.25;叶绿素a含量1.35~6.31 mg/m3,平均值2.97 mg/m3,在8月和翌年1月达到峰值,分别为3.45 mg/m3和6.31 mg/m3;颗粒物质量(SESQ)[17]为0.30~1.44 μg/mg,始终处于中等水平以上。
于2014年5月(春)、8月(夏)、11月(秋)和2015年1月(冬),分别在筏式养殖区内开展4个季节魁蚶及潜在食物源的取样。每次分别采集同批次投放的筏养魁蚶15~20只,清除表面附着物,用游标卡尺(精确到0.01 cm)和电子天平(精确到0.01 g)量取魁蚶壳长、壳宽、壳高和体质量等生物学数据(表1)。解剖魁蚶取其闭壳肌,超纯水冲洗除盐,60℃下烘干待测。5~6只魁蚶的肌肉混为一个样品,共3个平行样。
魁蚶的潜在食物来源包括表层颗粒有机物(surface particular organic matter:SPOM)、底层颗粒有机物(bottom particular organic matter:BPOM)和附着微藻(attached microalgae:AM)。分别采集筏养区表层(距水面0.5 m处)和底层(距沉积物0.5 m处)的海水,200 μm筛绢过滤后,用Whatman GF/F玻璃纤维滤膜(450℃预先灼烧5 h)抽滤,膜样品即为SPOM和BPOM。同时,随机从采样点的魁蚶网笼附近收集大型藻类、养殖笼网衣及锚绳,带回实验室后用清水泡洗,再用刀片轻轻将大型藻类、网衣及锚绳上的附着微藻刮取;将采集的溶液200 μm筛绢过滤后,抽滤至GF/F滤膜上,膜样品即为AM。所有食物源样品各设3个平行样。
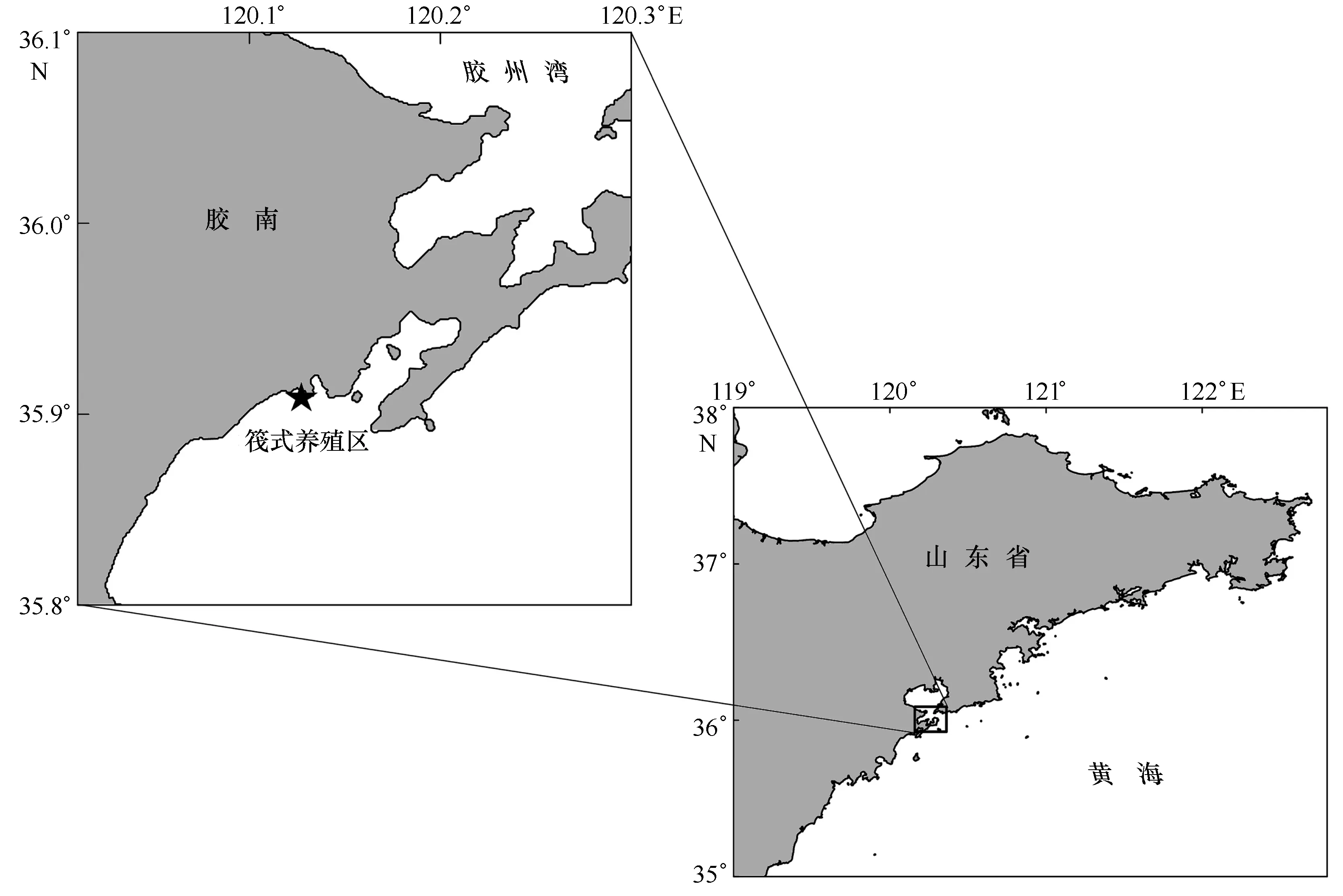
图1 实验研究海区及采样点Fig.1 Location of sampling station

样品春季(5月)夏季(8月)秋季(11月)冬季(1月)壳长/cm3.12±0.053.22±0.023.41±0.053.49±0.03壳高/cm2.38±0.062.40±0.032.62±0.052.75±0.03壳宽/cm1.43±0.041.81±0.021.99±0.042.08±0.02体质量/g6.82±0.556.96±0.2510.26±0.5512.26±0.45
2.2 稳定同位素分析
将所有样品(包括魁蚶和食物源样品)放置于60℃烘箱内烘干至恒重,魁蚶闭壳肌经石英研钵充分研磨后用脱脂溶液(甲醇∶氯仿∶水=2∶1∶0.8)浸泡除脂[18]。所有样品研磨后用1 mol/L盐酸酸化[19],每隔10 min混匀一次,直至没有气泡产生,然后用超纯水反复冲洗[6],再次烘干,研磨,存放于玻璃瓶中,干燥保存,待测。
所有样品的稳定同位素比值(δ13C、δ15N)采用稳定同位素质谱仪(MAT 253,Thermo Finnigan,美国)测定。该同位素质谱仪的外部设备是Flash EA1112元素分析仪。δ13C、δ15N表示样品与标准物质间的差异千分比,即:

(1)
式中,Rsample表示样品实际测得的同位素比值(R=13C/12C or15N/14N),Rstandard表示国际通用标准物(V-PDB标准物或标准大气氮气)的重轻同位素丰度之比。为保证仪器稳定性及实验结果的准确性,每测试5个样品后,插入1个标准样品测定,且个别样品进行复测。δ13C和δ15N值的测试精度分别小于0.1‰和0.2‰。
使用IsoSource程序[20]分析不同食物源对魁蚶的饵料贡献度及其季节变化,碳稳定同位素比值的分馏度按0.8‰计算[2,21]。模型计算时,采用的Increment值和Tolerance值分别为5%和0.05。
2.3 胃含物分析
每个季度取9只规格相似的魁蚶,用解剖刀将胃剪开,轻轻刮取胃内含物,并用洗瓶反复冲洗,直至胃内流出清澈液体。将冲洗所得的液体用5%的甲醛溶液固定保存,沉淀24 h后在光学显微镜下进行物种鉴定和计数。浮游植物鉴定到属。
2.4 数据分析处理
所有数据以平均值±标准误差(X± SE)表示,使用Excel 2013和SPSS 20.0进行数据统计分析,显著性水平P<0.05。选用单因素方差分析(One-way ANOVA,Duncan检验)比较了3种食物源(SPOM、BPOM和AM)碳、氮稳定同位素比值(δ13C、δ15N值)的季节差异,并比较了不同季节间魁蚶稳定同位素比值的差异。
3 实验结果
3.1 魁蚶和3种食物源的稳定同位素特征及其季节变化
筏式养殖魁蚶及其潜在食物源碳、氮稳定同位素比值(δ13C和δ15N)的测定结果如表2所示。魁蚶的碳同位素比值存在明显的季节差异(P<0.05),冬季的δ13C值仅为-19.6‰,显著低于秋季的-19.2‰,而与春、夏季无明显差异。魁蚶的氮同位素比值在8.7‰~9.9‰间波动,季节差异明显(P<0.05)。春、夏季的δ15N值显著小于秋、冬两季,以冬季的δ15N值富集最多,为9.9‰。
3种潜在食物源的δ13C、δ15N值也存在着显著的季节差异(P<0.05,表2,图2),SPOM、BPOM和AM的δ13C值变化范围依次为-23.3‰~-21.8‰、-22.1‰~-21.2‰和-17.0‰~-16.0‰,三者的δ13C富集依次增大,因此利用δ13C值可以基本将3种食物源区分开。其中,SPOM和BPOM的δ13C值均在夏季达到最大,分别为-21.8‰和-21.2‰,AM的最大值则出现在冬季,为-16.0‰。3种食物源δ15N值的变动范围则依次是5.9‰~7.1‰、6.5‰~8.0‰和4.0‰~7.4‰。食物源的δ15N值间存在交叉,但均小于魁蚶。单因素方差分析结果亦表明,相同季节3种食物源的δ13C和δ15N值差异显著(P<0.05)(表2,图2)。
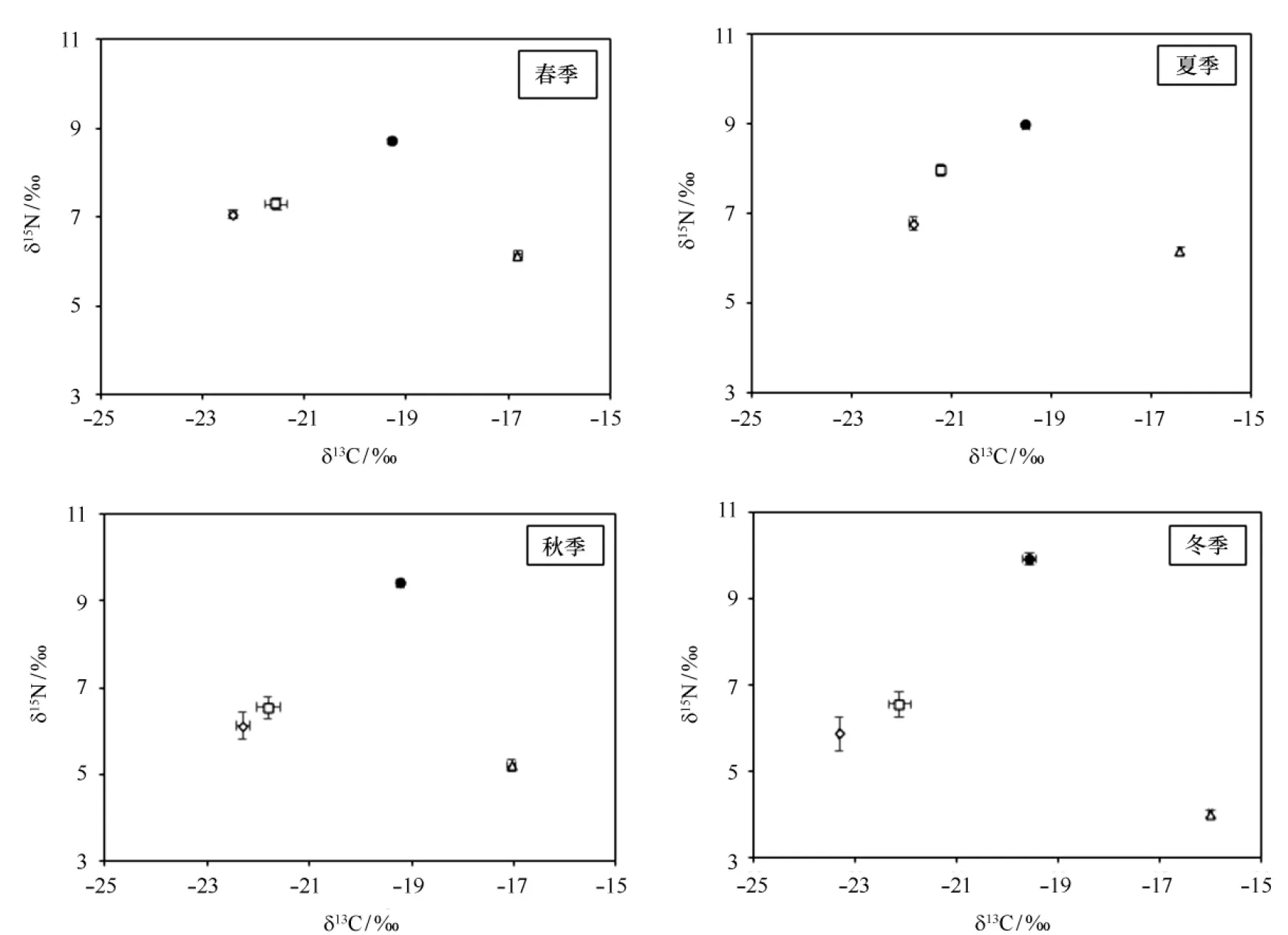
图2 魁蚶和3种食物源的稳定同位素特征值及其季节变化Fig.2 Seasonal changes in stable isotope values of A. broughtonii and their food sources●:魁蚶;◇:表层颗粒有机物;□:底层颗粒有机物;△:附着微藻。误差线表征δ13C、δ15N的标准误差●:A. broughtonii; ◇:SPOM (surface particular organic matter); □:BPOM (bottom particular organic matter); △:AM (attached microalgae). Error bars indicate standard deviations
3.2 3种食物源对魁蚶的营养贡献及其季节变化
3种潜在食物源对魁蚶的饵料贡献率如图3所示。在4个季节里,水体颗粒有机物(主要是浮游植物)的饵料贡献率均高于附着微藻,依次为63.3%(春)、77.8%(夏)、60.0%(秋)和65.0%(冬),其中以夏季的贡献率最高。AM的饵料贡献率则分别为36.7%(春)、22.1%(夏)、40.0%(秋)和35.0%(冬),以秋季最大。SPOM和BPOM对魁蚶的饵料贡献率也存在季节差异,SPOM的贡献率仅在春季高于BPOM(32.5%>30.8%),其余均小于或等于BPOM。夏季BPOM对魁蚶的贡献率高达47.1%,显著高于其他季节。
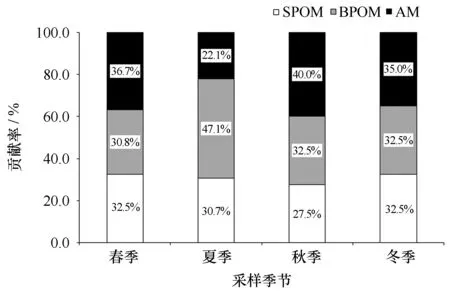
图3 基于稳定同位素分析的不同季节3种食物源对魁蚶的饵料贡献率(%)Fig.3 Seasonal changes in contribution (%) of three food sources of A. broughtonii by using stable isotopes analysisSPOM. 表层颗粒有机物;BPOM. 底层颗粒有机物;AM. 附着微藻SPOM. surface particular organic matter; BPOM. bottom particular organic matter; AM. attached microalgae
3.3 不同季节魁蚶胃含物组成
魁蚶胃含物中共鉴定出浮游植物2门18属(表3)。春季:浮游植物共12属,其中硅藻11属,甲藻1属。胃含物中浮游植物所占比例为54.6%,附着微藻约36.2%,其他类占9.2%。夏季:浮游植物共13属,其中硅藻11属,甲藻2属。胃含物中浮游植物所占比例为66.8%,附着微藻约20.0%,其他类占13.2%。秋季:浮游植物共11属,其中硅藻10属,甲藻1属。胃含物中浮游植物所占比例为54.3%,附着微藻约35.1%,其他类占10.6%。冬季:浮游植物共12属,其中硅藻11属,甲藻1属。胃含物中浮游植物所占比例为61.0%,附着微藻约32.2%,其他类占6.8%。
魁蚶胃含物中4个季节均能检测到的主要硅藻类饵料包括圆筛藻属、舟形藻属、曲舟藻和菱形藻属的种类,其他未鉴定种主要包括纤毛虫残体、少量无脊椎动物卵和有机碎屑等。魁蚶胃含物中附着微藻的比例与稳定同位素分析中的AM饵料贡献率相似(图3,图4)。
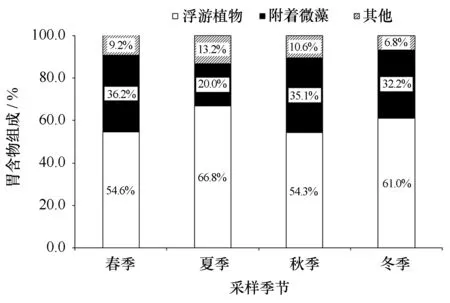
图4 魁蚶胃含物组成及其季节变化Fig.4 Seasonal changes in the composition of stomach contents of A. broughtonii
单位:%
4 讨论
4.1 魁蚶及其食物源同位素特征值的季节差异
养殖海区食物组成及其可利用性的季节差异会对双壳贝类的生长、存活产生影响[30—32]。消费者稳定同位素比值的季节差异可以有效表征食物可利用性的变化[30]。研究结果显示,冬季筏养魁蚶的δ13C值显著低于其他季节,这在尖角江珧蛤(Pinnanobilis)[33]、长牡蛎(Crassostreagigas)和大西洋舟螺(Crepidulafornicata)[34]同位素特征的季节性研究中也有报道,推测是因为冬季海区的浮游植物种类、生物量较少,导致筏养魁蚶的潜在饵料相对缺乏,食物限制效应突出。Riera对法国Mont Saint Michel海湾3种常见滤食性贝类(Crassostreagigas,Crepidulafornicata和Mytilusedulis)食物网的研究[35]也证实了该推测。魁蚶δ15N值的显著季节差异亦进一步佐证了海区食物组成及其可利用性的季节变动对消费者稳定同位素比值的影响。
4.2 魁蚶及其食物源间的营养关系
一般认为,养殖贝类混合滤食水体中的颗粒有机物、底栖微藻和附着生物等,不同食物源对贝类的饵料贡献率与其分布海区饵料食物的生物量组成和季节性变化密切相关[22],并受贝类的滤食偏好性影响[36](表4)。相比于δ13C值较低的陆源颗粒有机物,滤食性贝类更偏好δ13C值较高的海洋浮游植物和底栖微藻等。对菲律宾缀锦蛤(Tapesphilippinarum)食物组成的周年监测发现,底栖微藻和海源颗粒有机物对其饵料贡献率存在季节差异,但始终维持在41.2%~65.1%和25.7%~49.2%之间,均远高于河口颗粒有机物的贡献率[3]。除冬季外,底层颗粒有机物对韩国Sunjae Island海区潮间带养殖的菲律宾蛤仔(Ruditapesphilippinatum)的饵料贡献率均维持在一个较高水平,尤以夏、秋季最高,分别达到了95.2%和94.4%[32],可见底层颗粒有机物是滤食性贝类重要的食物组成。而附生微藻对海南新村湾海草床中魁蚶的饵料贡献率达到了33.6%,高于其他饵料组分[37]。Zhao等[38]对中国北方庄河湾潮间带6种常见养殖贝类食物来源的研究也指出,颗粒有机物的相对贡献率达到了71.6%,颗粒有机物是养殖贝类重要的食物组成[39]。在本研究中,筏养魁蚶以养殖水体中的颗粒有机物(主要是浮游植物)为主要食物来源(54.3%~66.8%),同时也滤食附着微藻(22.1%~40.0%),附着微藻是筏养魁蚶重要的食物来源之一。胃含物分析也发现,魁蚶的饵料组成相对简单,主要以植物性饵料为主,兼食动物性饵料,硅藻是其主要滤食种类,包括圆筛藻属、舟形藻属、曲舟藻属、菱形藻属和骨条藻属的种类。其中,附着微藻占魁蚶胃含物的比例约为20.0%~36.2%,与稳定同位素分析中附着微藻的饵料贡献率相似。
在浅海养殖水域,由于风浪作用、低潮潮汐和间歇性大风大雨等气象条件变化,极易引起海区沉积物的再悬浮[40],进而影响可供滤食性贝类摄食的饵料质量和数量[4,41]。因此,本研究将颗粒有机物进一步划分为表层颗粒有机物和底层颗粒有机物。在灵山湾筏式养殖区内,因水深较浅(4.8~6.7 m),底栖微藻再悬浮后向上运输,成为底层颗粒有机物的有效组分,极易被魁蚶滤食。本研究发现,底层颗粒有机物对筏养魁蚶的饵料贡献率始终维持在较高水平(30.8%~47.1%),特别是春季过后,大风大浪和暴雨等极端天气时有发生,养殖区的再悬浮作用增强,使更多的底层颗粒有机物被魁蚶滤食,并在夏季达到最大值47.1%。
研究发现,浮筏及网笼等结构物上的附着微藻也是魁蚶的重要食物来源,通常认为,贝类的滤食作用加剧了周边水体的流动,使网笼及浮筏上的附着微藻被剥落、脱离,再悬浮后可以被魁蚶直接滤食。研究表明,贝类具有极强的滤水能力,如贻贝(Mytilusgalloprovincialis和Mytilusedulis)和蛤仔(Tapessp.)的滤水率均可达到5 L/(g·h)[42],小规格魁蚶(壳长11.8 mm)的滤水能力也达到1.89 L/(g·h)[15]。因此,筏养魁蚶可以充分过滤周围水体,使网笼等养殖结构物上的附着微藻通过再悬浮作用而被滤食。而养殖网笼上通常也会附生大量的滤食性污损生物,包括藤壶类、海绵生物、牡蛎等无脊椎动物幼体和一些大型海藻等[43]。这些附着性污损生物会使网笼内外水体交换不畅,并与养殖魁蚶形成食物竞争关系,对魁蚶的滤食作用产生影响[44—45]。当网笼表面被高密度的污损生物附着时,势必会降低魁蚶对水体的直接过滤效率,只能以网笼上再悬浮的附着微藻为食。已有研究指出,污损生物的种类和数量具有明显的季节变化,夏、秋季显著多于春、冬两季[46],所以在夏、秋季,养殖网笼内外水体交换差,魁蚶与污损生物的食物竞争关系增强,进而使魁蚶对附着微藻的滤食率增加,这也解释了本研究中,秋季附着微藻对魁蚶的饵料贡献率明显高于其他季节,达到40%。但在实际的养殖生产中,养殖户会定期清理网笼和浮筏上的污损生物,将有效削弱魁蚶和污损生物的食物竞争关系。Fukumori等[2]在日本筏式养殖珍珠牡蛎的研究中亦指出,附着微藻是牡蛎的重要食物来源之一,养殖牡蛎主要通过吸滤作用滤食网笼上的附着微藻。由此判断,浮筏及网笼上的附着微藻可以成为筏式养殖贝类重要的食物补充。
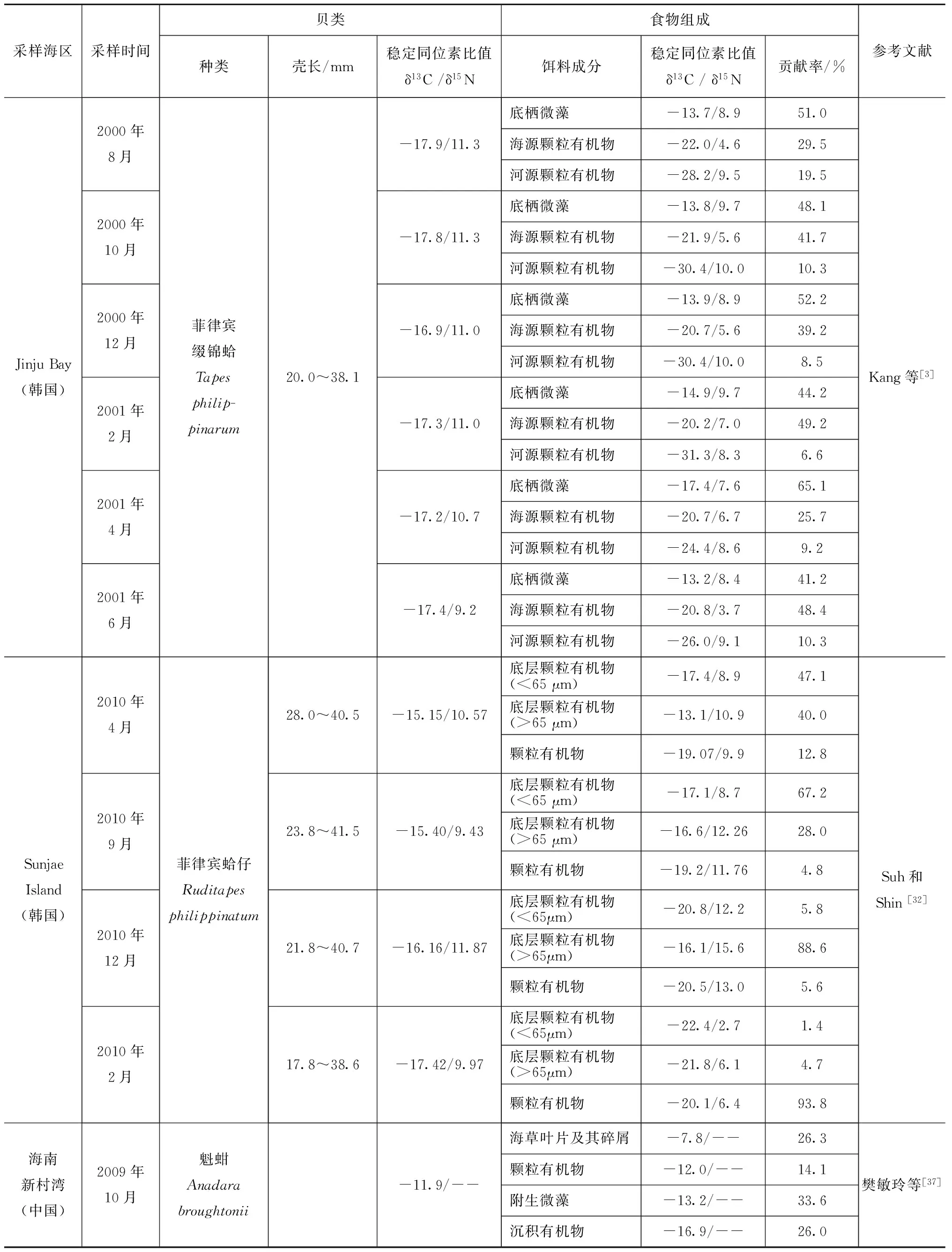
表4 常见贝类及其潜在食物源的稳定同位素组成和饵料贡献率
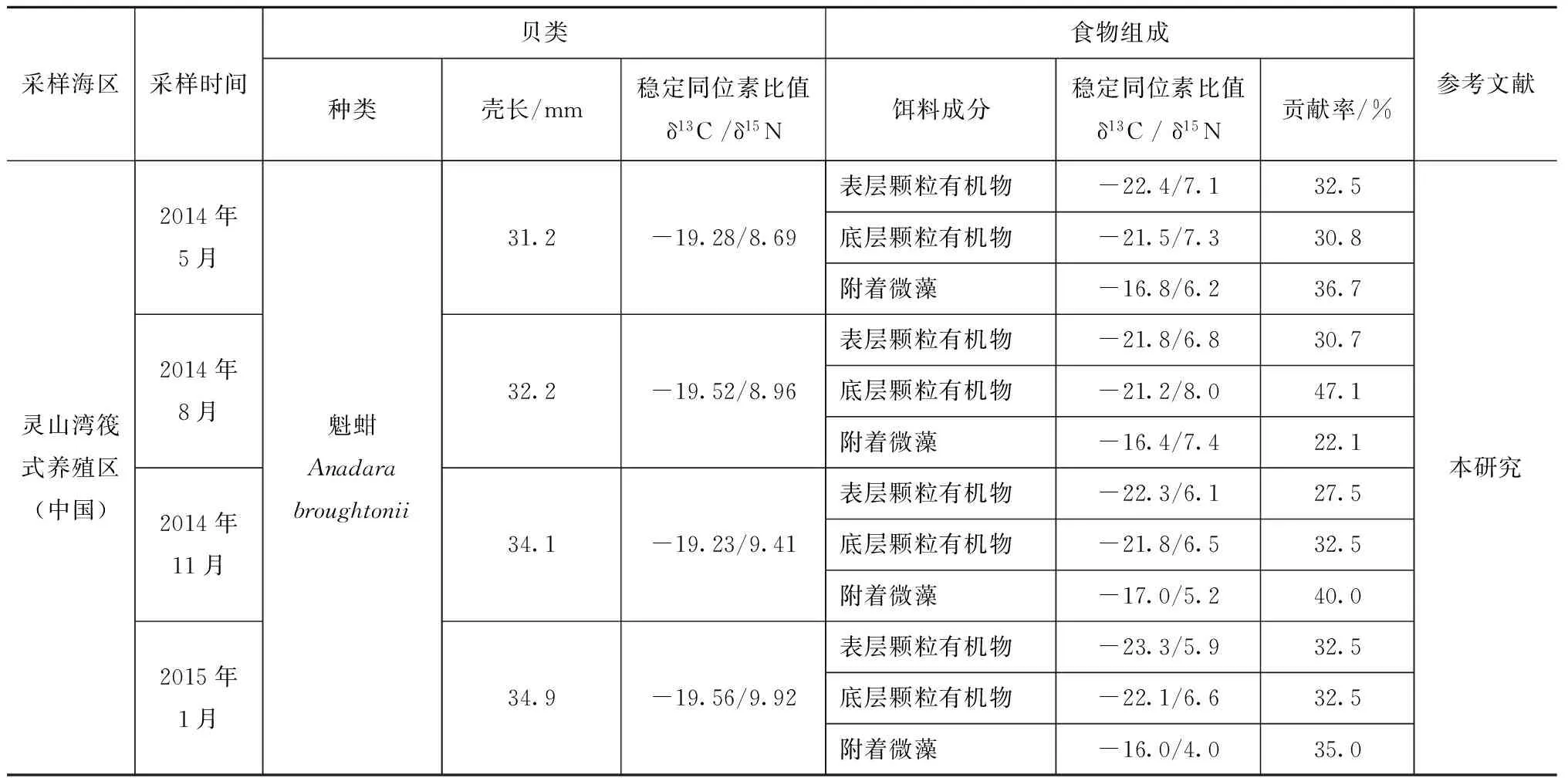
续表4
注:“-”表示未测定该数据。
[1] Crocker K M,Passow U. Differential aggregation of diatoms[J]. Marine Ecology Progress Series,1995,117(1):249-257.
[2] Fukumori K,Oi M,Doi H,et al. Food sources of the pearl oyster in coastal ecosystems of Japan:evidence from diet and stable isotope analysis[J]. Estuarine,Coastal and Shelf Science,2008,76(3):704-709.
[3] Kang C K,Kang Y S,Choy E J,et al. Condition,reproductive activity,and gross biochemical composition of the Manila clam,Tapesphilippinarumin natural and newly created sandy habitats of the southern coast of Korea[J]. Journal of Shellfish Research,2007,26(2):401-412.
[4] Yokoyama H,Ishihi Y. Feeding of the bivalveTheoralubricaon benthic microalgae:isotopic evidence[J]. Marine Ecology Progress Series,2003,255:303-309.
[5] Doi H,Chang K H,Obayashi Y,et al. Attached microalgae contribute to planktonic food webs in bays with fish and pearl oyster farms[J]. Marine Ecology Progress Series,2008,353:107-113.
[6] Hsieh H L,Kao Wenyuan,Chen Changpo,et al. Detrital flows through the feeding pathway of the oyster (Crassostreagigas) in a tropical shallow lagoon:δ13C signals[J]. Marine Biology,2000,136(4):677-684.
[7] Vander Zanden M,Rasmussen J B. Variation in δ15N and δ13C trophic fractionation:implications for aquatic food web studies[J]. Limnology and Oceanography,2001,46(8):2061-2066.
[8] Doi H,Matsumasa M,Toya T,et al. Spatial shifts in food sources for macrozoobenthos in an estuarine ecosystem:carbon and nitrogen stable isotope analyses[J]. Estuarine,Coastal and Shelf Science,2005,64(2):316-322.
[9] 林光辉. 稳定同位素生态学[M]. 北京:高等教育出版社,2013:161-162.
Lin Guanghui. Stable Isotope Ecology[M]. Beijing:Higher Education Press,2013:161-162.
[10] 鹿志创,田甲申,王召会,等. 应用碳氮稳定同位素技术研究江豚(Neophocaenaasiaeorientalisssp.sunameri)食性[J]. 生态学报,2016,36(1):69-76.
Lu Zhichuang,Tian Jiashen,Wang Zhaohui,et al. Using stable isotope technique to study feeding habits of the finless porpoise (Neophocaenaasiaeorientalisssp.sunameri)[J]. Acta Ecologica Sinica,2016,36(1):69-76.
[11] DeNiro M J,Epstein S. Mechanism of carbon isotope fractionation associated with lipid synthesis[J]. Science,1977,197(4300):261-263.
[12] Deniro M J,Epstein S. Influence of diet on the distribution of nitrogen isotopes in animals[J]. Geochimica et Cosmochimica Acta,1981,45(3):341-351.
[13] 颜云榕. 北部湾主要鱼类摄食生态及食物关系的研究[D]. 青岛:中国科学院海洋研究所,2010.
Yan Yunrong. Feeding ecology and food relations of the main fishes in the Beibu Gulf,South China Sea[D]. Qingdao:Institute of Oceanology,Chinese Academic of Sciences,2010.
[14] 韩东燕. 胶州湾主要虾虎鱼类摄食生态的研究[D]. 青岛:中国海洋大学,2013.
Han Dongyan. Study on feeding ecology of dominate gobiid fishes in Jiaozhou Bay[D]. Qingdao:Ocean University of China,2013.
[15] Kang K H,Park H J,Kim Y H,et al. Filtration and oxygen consumption rates on various growth stages ofScapharcabroughtoniispat[J]. Aquaculture Research,2008,39(2):195-199.
[16] 王兴林. 魁蚶筏式养殖技术[J]. 中国水产,1997,3:31-32.
Wang Xinglin. Raft culturing technique ofAnadarabroughtonii[J]. China Fisheries,1997,3:31-32.
[17] MacDonald B A,Ward J E. Variation in food quality and particle selectivity in the sea scallopPlacopectenmagellanicus(Mollusca:Bivalvia)[J]. Marine Ecology Progress Series,1994,108:251-264.
[18] Bligh E G,Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology,1959,37(8):911-917.
[19] Jacob U,Mintenbeck K,Brey T,et al. Stable isotope food web studies:a case for standardized sample treatment[J]. Marine Ecology Progress Series,2005,287:251-253.
[20] Phillips D L,Gregg J W. Source partitioning using stable isotopes:coping with too many sources[J]. Oecologia,2003,136(2):261-269.
[21] France R L,Peters R H. Ecosystem differences in the trophic enrichment of13C in aquatic food webs[J]. Canadian Journal of Fisheries and Aquatic Sciences,1997,54(6):1255-1258.
[22] Baeta A,Pinto R,Valiela I,et al. δ15N and δ13C in the Mondego estuary food web:seasonal variation in producers and consumers[J]. Marine Environmental Research,2009,67(3):109-116.
[23] Kanaya G,Kikuchi E. Spatial changes in a macrozoobenthic community along environmental gradients in a shallow brackish lagoon facing Sendai Bay,Japan[J]. Estuarine,Coastal and Shelf Science,2008,78(4):674-684.
[24] Moncreiff C A,Sullivan M J. Trophic importance of epiphytic algae in subtropical seagrass beds:evidence from multiple stable isotope analyses[J]. Marine Ecology Progress Series,2001,215:93-106.
[25] Vizzini S,Mazzola A. Seasonal variations in the stable carbon and nitrogen isotope ratios (13C/12C and15N/14N) of primary producers and consumers in a western Mediterranean coastal lagoon[J]. Marine Biology,2003,142(5):1009-1018.
[26] 郑新庆,黄凌风,林荣澄. 环境饵料丰度的季节变化对筼筜湖3种大型底栖动物食性的影响——来自稳定同位素的证据[J]. 海洋学报,2014,36(12):32-40.
Zheng Xinqing,Huang Lingfeng,Lin Rongcheng. Seasonal shifts in food sources influence feeding habits of three macrozoobenthos species in the Yundang Lagoon:the evidence from stable isotope[J]. Haiyang Xuebao,2014,36(12):32-40.
[27] Hemminga M A,Mateo M A. Stable carbon isotopes in seagrasses:variability in ratios and use in ecological studies[J]. Marine Ecology Progress Series,1996,140:285-298.
[28] Hofmann M,Wolf-Gladrow D A,Takahashi T,et al. Stable carbon isotope distribution of particulate organic matter in the ocean:a model study[J]. Marine Chemistry,2000,72(2):131-150.
[29] Ben-David M,Flynn R W,Schell D M. Annual and seasonal changes in diets of martens:evidence from stable isotope analysis[J]. Oecologia,1997,111(2):280-291.
[30] Madurell T,Fanelli E,Cartes J E. Isotopic composition of carbon and nitrogen of suprabenthic fauna in the NW Balearic Islands (western Mediterranean)[J]. Journal of Marine Systems,2008,71(3):336-345.
[31] Bayne B L,Svensson S. Seasonal variability in feeding behaviour,metabolic rates and carbon and nitrogen balances in the Sydney oyster,Saccostreaglomerata(Gould)[J]. Journal of Experimental Marine Biology and Ecology,2006,332(1):12-26.
[32] Suh Y J,Shin K H. Size-related and seasonal diet of the manila clam (Ruditapesphilippinarum),as determined using dual stable isotopes[J]. Estuarine,Coastal and Shelf Science,2013,135:94-105.
[33] Cabanellas-Reboredo M,Deudero S,Blanco A. Stable-isotope signatures (δ13C and δ15N) of different tissues ofPinnanobilisLinnaeus,1758 (Bivalvia):isotopic variations among tissues and between seasons[J]. Journal of Molluscan Studies,2009,75(4):343-349.
[34] Decottignies P,Beninger P G,Rincé Y,et al. Trophic interactions between two introduced suspension-feeders,CrepidulafornicataandCrassostreagigas,are influenced by seasonal effects and qualitative selection capacity[J]. Journal of Experimental Marine Biology and Ecology,2007,342(2):231-241.
[35] Riera P. Trophic subsidies ofCrassostreagigas,MytilusedulisandCrepidulafornicatain the Bay of Mont Saint Michel (France):a δ13C and δ15N investigation[J]. Estuarine,Coastal and Shelf Science,2007,72(1):33-41.
[36] Lopes-Lima M,Lima P,Hinzmann M,et al. Selective feeding byAnodontacygnea(Linnaeus,1771):the effects of seasonal changes and nutritional demands[J]. Limnologica-Ecology and Management of Inland Waters,2014,44:18-22.
[37] 樊敏玲,黄小平,张大文,等. 海南新村湾海草床主要鱼类及大型无脊椎动物的食源[J]. 生态学报,2011,31(1):31-38.
Fan Minling,Huang Xiaoping,Zhang Dawen,et al. Food sources of fish and macro-invertebrates in a tropical seagrass bed at Xincun Bay,Southern China[J]. Acta Ecologica Sinica,2011,31(1):31-38.
[38] Zhao Liqiang,Yang Feng,Yan Xiwu. Stable isotopes and fatty acids as dietary tracers of intertidal bivalves[J]. Fisheries Science,2013,79(5):749-756.
[39] Zhao Liqiang,Yan Xiwu,Yang Feng. Food sources of the Manila clamRuditapesphilippinarumin intertidal areas:evidence from stable isotope analysis[J]. Chinese Journal of Oceanology and Limnology,2013,31(4):782-788.
[40] Navarro J M,Widdows J. Feeding physiology ofCerastodermaedulein response to a wide range of seston concentrations[J]. Marine Ecology Progress Series,1997,152:175-186.
[41] Navarro J M,Labarta U,Fernndez-Reiriz M J,et al. Feeding behavior and differential absorption of biochemical components by the infaunal bivalveMuliniaedulisand the epibenthicMytiluschilensisin response to changes in food regimes[J]. Journal of Experimental Marine Biology and Ecology,2003,287(1):13-35.
[42] 周毅,杨红生,张福绥. 海水双壳贝类的生物沉积及其生态效应[J]. 海洋科学,2003,27(2):23-26.
Zhou Yi,Yang Hongsheng,Zhang Fusui. Biodeposition by seawater bivalve mollusk[J]. Marine Sciences,2003,27(2):23-26.
[43] 田伟,徐兆礼. 广西白龙半岛邻近海域污损生物群落结构分析[J]. 海洋学报,2015,37(6):120-127.
Tian Wei,Xu Zhaoli. The study on community structure of marine fouling in the waters off Bailong Peninsula,Guangxi[J]. Haiyang Xuebao,2015,37(6):120-127.
[44] Claereboudt M R,Bureau D,Cté J,et al. Fouling development and its effect on the growth of juvenile giant scallops (Placopectenmagellanicus) in suspended culture[J]. Aquaculture,1994,121(4):327-342.
[45] Lodeiros C J M,Himmelman J H. Identification of factors affecting growth and survival of the tropical scallopEuvola(Pecten)ziczacin the Golfo de Cariaco,Venezuela[J]. Aquaculture,2000,182(1):91-114.
[46] 张汉华,梁超愉,吴进锋,等. 大鹏湾深水网箱养殖区的污损生物研究[J]. 中国水产科学,2003,10(5):414-418.
Zhang Hanhua,Liang Chaoyu,Wu Jinfeng,et al. Fouling organism in marine cage culture area in Dapeng Bay,South China Sea[J]. Journal of Fishery Sciences of China,2003,10(5):414-418.
Seasonal variation in the food sources of the ark-shell Anadara broughtonii in raft culture in Lingshan Bay,Qingdao
Cai Xingyuan1,Zhang Xiumei1,2,Liu Tianyu1,Li Wentao1,Zhang Peidong1
(1.CollegeofFisheries,OceanUniversityofChina,Qingdao266003,China; 2.FunctionalLaboratoryforMarineFisheriesScienceandFoodProductionProcess,QingdaoNationalLaboratoryforMarineScienceandTechnology,Qingdao266072,China)
Ark-shellAnadarabroughtoniiis one of the most important commercial bivalve species in Northern China. Raft culture of ark-shell has been developing rapidly. Stable isotope (δ13C and δ15N) analysis was conducted onAnadarabroughtoniiin raft culture and three potential food sources:surface particular organic matter (SPOM),bottom particular organic matter (BPOM) and attached microalgae (AM) in the raft culture area,Lingshan Bay of Qingdao,in four seasons,from May 2014 to January 2015. Meanwhile,the composition of food sources for the cultured ark-shell was investigated in relation to season by using stable isotopes and stomach content analysis. The results showed that,the δ13C and δ15N values of ark-shell and their food sources varied significantly with season. The δ13C values of ark-shell (-19.6‰ to -19.2‰) were higher than those of SPOM (-23.3‰ to -21.8‰) and BPOM (-22.1‰ to -21.2‰),but lower than those of AM (-17.0‰ to -16.0‰). The δ15N values mainly ranged from 8.7‰ to 9.9‰. In addition,the ark-shell in winter had significantly depleted δ13C and enriched δ15N. The particulate organic matter (mainly phytoplankton) in water column was the principle food source for ark-shell,with a contribution of about 60.0%-77.8% (with the highest contribution in summer). Meanwhile,the contribution of BPOM resulting from resuspension in this area remained a high level (about 30.8%-47.1%),and the AM on culture cages took up about 22.1%-40.0% contribution in diets. These results indicate thatA.broughtoniifeeds on a mixture diet of particulate organic matter and attached microalgae,and the AM on cages can treat as important supplemental food sources in raft culture area.
Anadarabroughtonii; food sources; seasonal changes; raft culture; stable isotope analysis; stomach content analysis
2016-05-12;
2016-06-23。
海洋公益性行业科研专项(201405010, 201305043);青岛海洋科学与技术国家实验室鳌山科技创新计划项目(2015ASKJ01)。
蔡星媛(1989—),女,广西壮族自治区北海市人,主要从事资源增殖生态学研究。E-mail:caixingyuan111@126.com
*通信作者:张秀梅,教授,主要从事鱼类行为生态学、渔业资源保护学及增殖生态学研究。E-mail:gaozhang@ouc.edu.cn
10.3969/j.issn.0253-4193.2016.12.011
S917.4
A
0253-4193(2016)12-0106-12
蔡星媛,张秀梅,刘甜雨,等. 青岛灵山湾筏式养殖魁蚶食物来源的季节变动研究[J].海洋学报,2016,38(12):106—117,
Cai Xingyuan,Zhang Xiumei,Liu Tianyu,et al. Seasonal variation in the food sources of the ark-shellAnadarabroughtoniiin raft culture in Lingshan Bay,Qingdao[J]. Haiyang Xuebao,2016,38(12):106—117,doi:10.3969/j.issn.0253-4193.2016.12.011
