S1P致环磷酰胺染毒后雄性小鼠凋亡蛋白表达的影响
2016-12-21刘丹薇潘卫徐国宾杨国珍
刘丹薇 潘卫 徐国宾 杨国珍△
(1.贵州医科大学,医学检验学院生化学教研室,贵州 贵阳 550004;2.北京大学肿瘤医院检验科,北京 100142)
S1P致环磷酰胺染毒后雄性小鼠凋亡蛋白表达的影响
刘丹薇1潘卫1徐国宾2杨国珍1△
(1.贵州医科大学,医学检验学院生化学教研室,贵州 贵阳 550004;2.北京大学肿瘤医院检验科,北京 100142)
目的 探讨1-磷酸鞘氨醇(S1P)对雄性小鼠生殖细胞毒性损害的拮抗机制。方法 健康雄性昆明小鼠40只,随机分为5组,即正常对照组;S1P低剂量(0.5 μg/10 g小鼠体质量)、中剂量(1.0 μg/10 g小鼠体质量)、高剂量(2.0 μg/10 g小鼠体质量)组;环磷酰胺染毒组。腹腔注射给药5 d,于首次给药后30 d处死。分别采集睾丸样本,小鼠睾丸病理切片观察睾丸组织的病理学改变,免疫组化检测小鼠睾丸凋亡蛋白Bcl-2、Bax、Caspase-3的表达。 结果 与环磷酰胺染毒组相比:各S1P剂量组病理学结构均有不同程度的改善, Bcl-2蛋白表达增强,Bax、Caspase-3蛋白表达减弱。经图像分析软件分析后得出平均光密度值,各实验组与染毒组相比差异有统计学意义(P<0.05)。结论 S1P对雄性小鼠生殖细胞毒性损害具有一定的拮抗作用,可能通过活化Bcl-2和抑制Bax,抑制下游Caspase-3的表达来拮抗环磷酰胺所致的生殖毒性。
1-磷酸鞘氨醇; 雄性小鼠; 生殖毒性; 凋亡
据世界卫生组织(WHO)调查,当今社会大约有10%~15%的育龄夫妇不能够自然生育,且该比例仍在不断上升,其中1/2以上的不育症发生原因与男性密切相关。在过去近50年里,全球男性精液质量下降十分显著[1]。而在国内,形势同样不容乐观,据调查,过去25年间国内育龄男性精液质量分析报告显示,精子数量和精子活力均呈现出下降的趋势[2]。根据前期研究发现,1-磷酸鞘氨醇(Sphingosine-1-Phosphate,S1P)可以抑制环磷酰胺致雄性小鼠生殖毒性的损害。故本研究利用S1P对环磷酰胺导致的生殖毒性进行拮抗,希望能阐明在环磷酰胺作用后S1P作为拮抗剂对于雄性小鼠生殖细胞凋亡蛋白表达的影响,初步揭示S1P拮抗雄性生殖细胞毒性损害作用的机制。
1 材料和方法
1.1 材料
1.1.1 主要试剂与仪器 环磷酰胺(江苏恒瑞医药股份有限公司),S1P(美国Sigma公司),Caspase-3,Bax,Bcl-2一抗(美国Cell Signaling公司),一抗稀释液(北京索莱宝科技有限公司),免疫组化二抗(武汉博士德生物工程有限公司),DAB显色系统(北京中杉有限公司),苏木素(北京中杉金桥生物有限公司),电子精密天平(JJ500,常熟双杰测试仪器),光学显微镜(NIKON YS100,日本尼康公司),电热恒温水浴箱(北京市光明医疗仪器厂)。
1.1.2 动物 本次实验选择SPF级成熟昆明种雄性小鼠40只,体质量25~35 g,动物由贵州医科大学动物实验中心提供,动物许可证号:SYXK(黔)2012-0001。
1.2 实验方法
1.2.1 动物分组与染毒 将雄性小鼠随机分为5组,每组8只,分别为正常对照组;S1P低、中、高剂量拮抗组(0.5,1.0,2.0 μg/10 g小鼠体质量);环磷酰胺染毒组。正常对照组按0.1 mL/10 g体质量给予生理盐水;S1P低、中、高剂量拮抗组在给予环磷酰胺后间隔2 h再给予各剂量S1P;染毒组给予环磷酰胺40 mg/kg,连续腹腔注射给药5 d,染毒期间小鼠自由饮食饮水。
1.2.2 取材及标本制作 各组于给药结束后第30天,颈椎脱臼处死小鼠后立即打开腹腔,取出双侧睾丸;睾丸置于10% 甲醛固定,用于检测病理学变化及相关凋亡蛋白。
1.2.3 睾丸组织HE染色切片观察和生殖细胞凋亡蛋白检测 取各组每只小鼠睾丸组织切片做HE染色,观察睾丸组织学变化;取另一张组织切片检测相关凋亡蛋白,具体操作按免疫组化检测试剂盒说明书进行。光镜下,细胞浆或细胞膜呈棕黄色为阳性表达,每张切片选取随机5个高倍视野拍摄,图像输入IPP图像分析系统,得出平均光密度值。
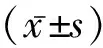
2 结 果
2.1 S1P对小鼠睾丸组织病理学的影响 如图1所示,正常对照组小鼠睾丸曲精小管完整,排列密集整齐,生精上皮厚,生殖细胞层次和数量多,可见精原细胞和不同发育阶段的精子,各级细胞排列精密,层次分明(图1A)。染毒组睾丸生精小管直径缩小,间距增宽,生精上皮变薄,管腔中生殖细胞数量减少,生精细胞排列紊乱、疏松,层数减少(图1B)。S1P各剂量拮抗组形态结构随拮抗剂量的增加,损伤程度逐渐减轻:低剂量组损伤明显,与染毒组相比差异不大(图1C);中剂量组损伤明显轻于染毒组(图1D);高剂量拮抗组损伤已经不明显,与正常对照组相比差异不大(图1E)。
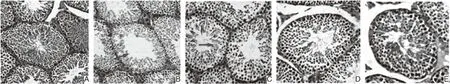
注:A.正常对照组;B.环磷酰胺染毒组;C.S1P低剂量组;D.S1P中剂量组;E.S1P高剂量组。图1 睾丸组织HE染色(×400)
2.2 S1P对小鼠生殖细胞凋亡蛋白Bcl-2、Bax、Caspase-3表达的影响 应用Image ProPlus图像分析系统测得Bcl-2、Bax、Caspase-3阳性表达的平均光密度值,Bcl-2:阳性表达产物呈棕黄色,主要位于细胞膜和细胞质。随拮抗剂量增加,阳性表达逐渐增强(光密度值增加)(图2 A1-E1),S1P中、高剂量组与染毒组相比差异有统计学意义(P<0.01),S1P高剂量组与正常对照组相比差异无统计学意义(P>0.05)。Bax:阳性表达产物呈棕黄色,主要位于细胞质。随拮抗剂量增加,阳性表达逐渐减弱(光密度值减小)(图2 A2-E2),S1P低、中、高剂量组与染毒组相比差异有统计学意义(P<0.01),S1P高剂量组与正常对照组相比差异无统计学意义(P>0.05)。Caspase-3:阳性表达产物呈棕黄色,主要位于细胞质。S1P拮抗组阳性表达随拮抗剂量增加改变不明显(图2 A3-E3),S1P低、中、高剂量组与染毒组相比阳性表达减弱(光密度值减小),差异有统计学意义(P<0.01);与正常对照组相比差异无统计学意义(P>0.05),见表1,图2。

表1 S1P对各组实验小鼠凋亡蛋白Bcl-2、Bax、Caspase-3阳性表达的影响
3 讨 论
细胞的死亡是多细胞生物整个生命过程中十分重要的环节,可及时清除机体内的衰老细胞和受损伤细胞,对各组织器官的发育及免疫系统的稳定发挥重要作用[3]。细胞凋亡是机体内细胞死亡的重要途径。在哺乳动物体内线粒体通路在细胞凋亡机制中起着至关重要的作用。当细胞受到内部凋亡刺激因子作用,如DNA损伤、细胞缺氧、癌基因活化、生长因子缺失等,可激活细胞内部线粒体凋亡途径,引起细胞凋亡。在众多的凋亡调控基因中,Bcl-2和Bax同属于Bcl-2家族蛋白,Bcl-2是目前已知的在凋亡调控过程中最重要的抗凋亡蛋白,同时含有BH1~BH4 四个同源结构域,其中BH4 是抗凋亡蛋白所特有的结构域,决定着抑制细胞凋亡功能的存在[4]。Bcl-2能定位在线粒体膜、内质网膜和核外膜上, 对保持膜的完整性至关重要。Bax蛋白则一般会以非活性单体形式分布于胞质中,当其在接收到凋亡信号刺激后,该蛋白被激活,从而发生一系列分子构象改变,插入线粒体外膜后形成Bax大孔道,从而导致线粒体膜的完整性被破坏,致使线粒体内部一些蛋白以及细胞色素C等得以通过线粒体膜进入细胞质[5],在dATP 存在下细胞色素C能通过半胱氨酸蛋白酶作用域与Apaf-1 结合形成凋亡体,并吸引Procaspase-9 在凋亡体上进行寡聚,进一步激活蛋白Caspase-3,启动Caspase 级联反应[6]。Caspase-3属于Caspase 蛋白家族中的凋亡效应亚类蛋白,位于级联反应下游,是多种凋亡途径的共同下游效应部分,被称为“死亡执行蛋白酶”[7]。通常情况下,细胞内的Caspase-3是以无活性的单链酶原形式存在,只有在相关因子作用下,该类蛋白酶在受到相关起始凋亡蛋白酶的切割后被激活,活化后相应的凋亡蛋白酶可以对维持细胞骨架以及生命活动所必须的蛋白逐一进行裂解[8],导致DNA损伤断裂,细胞骨架的破坏,最终引起细胞死亡。目前已经证明,Caspase-3的激活在很大程度上依赖于上游细胞色素C的释放。
通常情况下Bax和Bcl-2两种蛋白的表达量是稳定而平衡的,而当Bcl-2高表达时,细胞内Bax/Bax二聚体会大量解离,生成更为稳定的Bcl-2/Bax二聚体,该二聚体可以对抗其诱导凋亡的作用,使细胞存活期延长[9]。反之,当细胞内Bax过量表达时,Bax/Bax同源二聚体的数量则会明显增多,该类二聚体会使细胞对死亡信号的反应性增强,启动凋亡。因此,目前认为Bax能与抑制凋亡的Bcl-2蛋白对抗,阻止其抗凋亡作用的发挥,细胞内这两种对立蛋白间的比率关系是决定细胞存亡的关键[10]。本次研究结果显示,Bcl-2阳性表达随S1P剂量增加逐渐增强,Bax阳性表达随S1P剂量增加逐渐减弱,表明S1P可能通过诱导活化Bcl-2以及抑制Bax激活来抵抗环磷酰胺造成的凋亡作用,使细胞增殖能力增强,从而减少生殖细胞的死亡,对机体组织起到一定的修复作用。
细胞色素C是线粒体电子传递链上的一个重要组成部分,凋亡启动的关键步骤是细胞色素C从线粒体释放[11]。Caspase-3的激活在很大程度上就依赖于细胞色素C的释放。Bcl-2、Bax是线粒体膜的通透性改变的重要调控因素,它们位于线粒体上游,Bcl-2过度表达以及Bax的表达被抑制,这两种情况皆能抑制Bax的转位及二聚体化,使得 Bax大孔道关闭,控制细胞色素C的释放。另一方面,研究[12]发现Bcl-2的过度表达可能会导致细胞核谷胱甘肽积聚,从而令核内氧化还原平衡发生改变,阻止胞内Ca2+流动,抑制线粒体膜释放细胞色素C,最终抑制Caspase-3 的活化。Bcl-2也可作用在细胞色素C下游, 通过与细胞色素C结合, 将其从细胞浆池内转移出去而抑制Caspases-3的活化。Bcl-2还可直接作用于类CED-4 分子,抑制下游Caspase-3 蛋白酶的活化。Caspase-3蛋白在本次研究中发现S1P剂量组的阳性表达均与正常对照组无明显差异,但与环磷酰胺染毒组相比均有差异。这一结果与上述Bcl-2和Bax的蛋白表达并不矛盾,根据上述Bcl-2和Bax的蛋白表达结果可知,S1P诱导了Bcl-2蛋白的表达增加,抑制了Bax蛋白的表达,故可推测细胞色素C的释放或与Caspase-3蛋白的结合受到抑制,致使Caspase-3蛋白的活化被抑制,蛋白表达不产生明显变化。而为何各S1P实验组所加S1P剂量不同, Caspase-3的蛋白表达却与正常对照组相比均未有明显差异,推测可能原因是各S1P实验组S1P都使Bcl-2蛋白的表达上调,下游Caspase 级联反应被阻断,各组Caspase-3皆呈现低表达状态,受本次研究方法的灵敏度所限,已经检测不出各实验组组间的明显差异;各S1P实验组Caspase-3蛋白阳性表达与环磷酰胺染毒组相比均有差异,则与上述相关Bcl-2蛋白作用的推论吻合。
综上,S1P对雄性小鼠的生殖毒性损伤有一定的拮抗作用,S1P能改善因环磷酰胺所致的睾丸组织结构的病理改变,进一步增加精子数量,提高精子的质量;并且,S1P可能通过下调Bax蛋白和上调Bcl-2蛋白表达,抑制Caspases-3的活化,从而使生殖细胞增殖。而S1P作用的具体通路位点以及与其他系统的关联性,仍有待进一步研究。
(本文图2见封三)
[1] Shine R,Peek J,Birdsall M.Declining sperm quality in New Zealand over 20 years[J].N Z Med J,2008,121:50-56.
[2] 郑钧,蒋健政,黄宇峰. 精液的流变特性研究[J]. 微循环杂志,2001,11(4):36-37,46.
[3] Strasser A,Jost PJ,Nagata S. The many roles of FAS receptor signaling in the immune system [J].Immunity,2009,30(2):180-192.
[4] Sitailo LA,Jerome-Morais A,Denning MF. Mcl-1 functions as major epidermal survival protein required for proper keratinocyte differentiation[J]. J Invest Dermatol,2009,129(6):1351-1360.
[5] Mufioz-Pinedo C,Guio-Carrion A,Goldstein JC,et al.Different mitochondrial intermembranespace proteins are released during apoptosis in a manner that is coordinately initiated but can vary in duration[J].Proc Natl Acad Sci USA,2006,103(31):11573-11578.
[6] Hastak K,Gupta S,Ahmad N,et al.Role of p53 and NF-kappaB in epigallocatechin-3-gallate-induced apoptosis of LNCap cells[J]. Oncogene,2003,22(31): 4851-4859.
[7] Odonkor CA,Achilefu S. Modulation of effector caspase cleavage determines response of breast and lung tumor cell lines to chemotherapy[J]. Cancer Invest,2009, 27(4): 417-429.
[8] Mufioz-Pinedo C.Signaling pathways that regulate life and cell death:evolution of apoptosis in the context of self-defense [J]. Adv Exp Med Biol,2012,738:124-143.
[9] Tsukaharas S,Yamamoto S,Shew TT,et al. Inhalation of low-level formal-chehyde increases the bcl-2/bax expression ratio in the hippocampus of immunologically sensitized mice[J]. Neuroimmunomodulation,2008,13(2):63-68.
[10]Walensky LD. Bcl-2 in the crosshairs: tipping the balance of life and death[J]. Cell Death Differ,2006,13(8):1339-1350.
[11]Garrido C,Galluzi L,Brunet M,et al. Mechanism of cytochrome c release from mitochondria[J]. Cell Death Diff,2006,13(9) : 1423-1433.
[12]Phillipps HR,Hurst PR.XIAP: a potential determinant of ovarian follicular fate[J].Reproduction,2012,144(2):165-176.
Effects of S1P on the apoptins of male mice against the toxicity of cyclophosphamide
LiuDanwei1,PanWei1,XuGuobing2,YangGuozhen1.
1.DepartmentofMedicalLaboratory,GuizhouMedicalUniversity,Guiyang550004,China. 2.DepartmentofMedicalLaboratory,BeijingUniversityCancerHospital,Beijing100142,China.
Objective To study the protective effects of S1P on male mouse reproductive cells by toxicity damage. Methods Forty healthy male Kunming mice were randomly divided into 5 groups (the physiological saline negative control group,the low,middle and high dose group of S1P(0.5, 1.0, 2.0 μg/10 g),the cyclophosphamide positive control group). Mice in each group were given intraperitoneal injection for 5 days. The mice were killed at the thirtieth day after the first treatment. Testis of the mice was collected and observed pathologic changes of testis by pathological section. And was detected Bcl-2, Bax, Caspase-3 expression by immunehistochemical staining. Results Compared with the positive control group,there were statistical significantly differences in the pathologic changes. The expression of Bcl-2 was improved and the expression of Bax,Caspase-3 were opposite (P<0.05). Conclusion There were some protective effects of S1P on male mouse reproductive cells by toxicity damage. Maybe the mechanism is S1P can inhibit apoptosis protein Bax and excited Bcl-2 to reduce the damage by toxicity.
S1P ; Male mice; Reproductive toxicity; Apoptosis
R114
A
1000-744X(2016)09-0916-03
2016-05-07)
△通信作者,E-mail:yangguozhen-kong@hotmail.com
