Ac-SDKP通过Gαs/Gαi-cAMP信号通路抑制矽肺大鼠肺纤维化
2016-12-21耿玉聪李红垒高学敏李世峰薛新新杨奕徐丁洁徐洪杨方
耿玉聪,李红垒,高学敏,李世峰,薛新新,杨奕,徐丁洁,徐洪,杨方
(1.华北理工大学 医学实验研究中心,河北 唐山 063000;2.华北理工大学 中医学院,河北 唐山 063000)
·论 著·
Ac-SDKP通过Gαs/Gαi-cAMP信号通路抑制矽肺大鼠肺纤维化
耿玉聪1,李红垒1,高学敏1,李世峰1,薛新新1,杨奕1,徐丁洁2,徐洪1,杨方1
(1.华北理工大学 医学实验研究中心,河北 唐山 063000;2.华北理工大学 中医学院,河北 唐山 063000)
目的:研究N-乙酰基-丝氨酰-天门冬氨酰-赖氨酰-脯氨酸(Ac-SDKP)与激动型G蛋白(Gαs)/抑制型G蛋白(Gαi)-环磷酸腺苷(cAMP)信号通路的关系,探讨Ac-SDKP抑制矽肺大鼠纤维化的作用及其机制。方法:采用一次性支气管灌注SiO2构建大鼠矽肺模型,并予以Ac-SDKP抗纤维化治疗和预防治疗。体外采用血管紧张素(Ang)Ⅱ诱导大鼠肺成纤维细胞向肌成纤维细胞分化,并予以Ac-SDKP、缬沙坦(valasrtan)和二丁酰环磷酸腺苷(db-cAMP)预处理。免疫荧光法检测Gαs蛋白与波形蛋白(vimentin)在矽肺组织中的定位与表达,Western blot法检测矽肺组织和Ang Ⅱ诱导的肌成纤维细胞中Gαs、Gαi、α-平滑肌肌动蛋白(SMA)和Ⅰ型胶原表达,EIA试剂盒检测cAMP活性。结果:与对照组相比,矽肺大鼠肺组织中Gαs和cAMP表达下调,而Gαi表达上调并伴随α-SMA和Ⅰ型胶原表达升高(P<0.05),Ac-SDKP抗纤维化治疗和预防治疗均可抑制该变化;同时体外研究发现Ac-SDKP、valsartan和db-cAMP预处理后可抑制Ang Ⅱ介导的Gαs和cAMP表达下调(P<0.05),抑制肌成纤维细胞分化和细胞外基质沉积。结论:Ac-SDKP通过调节Gαs/Gαi-cAMP信号抑制肌成纤维细胞分化,发挥抗矽肺大鼠肺纤维化的作用。
矽肺;肌成纤维细胞;N-乙酰基-丝氨酰-天门冬氨酰-赖氨酰-脯氨酸;肺纤维化;环磷酸腺苷; 大鼠
矽肺病是我国最严重的职业病[1],其以矽结节形成和间质纤维化为主要病理特征。本课题组前期研究显示,N-乙酰基-丝氨酰-天门冬氨酰-赖氨酰-脯氨酸(N-acetyl-seryl-aspartyl-lysyl-proline,Ac-SDKP)具有拮抗矽肺大鼠肺纤维化的作用,蛋白组学实验也发现β2肾上腺素受体(ADRB2)-Gαs蛋白复合物(β2-adrenergic receptor-Gαsprotein complex,ADRB-Gαs)在矽肺模型组中表达下调,提示其可能与矽肺纤维化的发生、发展关系密切[2]。研究表明,ADRB2能够通过对激动型Gα蛋白(stimulatory G protein α,Gαs)的调节,促进腺苷酸环化酶(adenylyl cyclase,AC)表达上调,诱导cAMP的合成,进而发挥拮抗器官纤维化的作用[3-4]。抑制型Gα蛋白(inhibitory G protein α,Gαi)偶联信号的活化则抑制AC活性导致cAMP水平降低,产生与Gαs相反的生物学效应[5]。已有研究显示,cAMP能够通过对血管紧张素(angiotensin,Ang)Ⅱ/转化生长因子(transforming growth factor,TGF)-β1信号介导的促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号的调节,抑制成纤维细胞的增殖、肌成纤维细胞分化和胶原沉积,从而阻抑器官纤维化的进展[6-7]。以往研究多关注于Ac-SDKP对促纤维化的阻断作用,其能否通过对Gαs/Gαi-cAMP信号的调节,发挥抑制矽肺纤维化的作用,目前仍未所知。因此,本研究拟通过支气管灌注SiO2构建矽肺大鼠模型,结合体外Ang Ⅱ诱导的肌成纤维细胞分化模型,观察Ac-SDKP对Gαs/Gαi-cAMP信号通路的调节作用,进一步探讨其抗纤维化作用的可能机制。
1 材料与方法
1.1 采用支气管非暴露式一次性灌注SiO2构建矽肺大鼠模型[1]
SPF级成年雄性Wistar大鼠60只(北京华阜康生物科技股份有限公司,SCXK京2009-0004),体质量(180±10) g,于华北理工大学动物实验中心屏障实验室(SYXK冀2010-0038)饲养,自由食水,昼夜交替。对照组(4周及8周):支气管灌注生理盐水1 ml+腹腔埋入2 ml生理盐水微量缓释泵,饲养4、8周后处理;矽肺组(4周及8周):支气管灌注含50 mg·ml-1SiO2的生理盐水1 ml+腹腔埋入含2 ml生理盐水的微量缓释泵,饲养4、8周后处理。Ac-SDKP抗纤维化治疗组:支气管灌注含50 mg·ml-1SiO2的生理盐水1 ml+腹腔埋入含2 ml生理盐水的微量缓释泵,4周后更换为含Ac-SDKP(800 μg·kg-1·d-1)的微量缓释泵,继续饲养至第8周处理。Ac-SDKP预防治疗组:腹腔埋入含Ac-SDKP(800 μg·kg-1·d-1)的微量缓释泵,48 h后支气管灌注含50 mg·ml-1SiO2的生理盐水1 ml,第8周处理。
1.2 细胞培养
在体积分数5%CO2、37 ℃条件下培养原代培养肺成纤维细胞[8]。取第2代细胞用于实验。对照组:无血清DMEM培养基;Ang Ⅱ诱导组:给予Ang Ⅱ(10-7mol·L-1)诱导;Ac-SDKP干预组:Ang Ⅱ(10-7mol·L-1)诱导前1 h给予Ac-SDKP(10-8mol·L-1)预处理。缬沙坦(valsartan)干预组:空白培养基,Ang Ⅱ(10-7mol·L-1)诱导前1 h给予缬沙坦(10-6mol·L-1)预处理。二丁酰环磷酸腺苷(dibutyryl cyclic adenosine monophosphate,db-cAMP)干预组:空白培养基,Ang Ⅱ(10-7mol·L-1)诱导前1 h给予db-cAMP(10-4mol·L-1)预处理。
1.3 主要试剂
SiO2购置于美国Sigma公司;波形蛋白(vimentin)兔单克隆抗体(Abcam公司);α-平滑肌肌动蛋白(smooth muscle actin,α-SMA)兔单克隆抗体(Abcam公司);Gαs鼠单克隆抗体(Santa Cruz公司);Gαi兔多克隆抗体(Santa Cruz公司);cAMP EIA试剂盒(Cayman公司);Ⅰ型胶原(博士德公司);GAPDH兔多克隆抗体(Santa Cruz公司);HRP标记羊抗兔IgG(KPL公司);HRP标记羊抗鼠IgG(KPL公司);ECL显色试剂盒(GE Healthcare公司)。
1.4 免疫荧光法检测Gsα蛋白和vimentin在矽肺组织中的差异定位与共表达
大鼠肺组织石蜡切片常规脱蜡至水,血清封闭15 min,甩去血清后直接滴加Gsα/vimentin混合一抗(1∶200稀释),4 ℃过夜,次日加FITC/TRITC混合荧光二抗,37 ℃孵育1 h,甘油封片。Olympus图像扫描系统采集图像。
1.5 Western blot法检测Gαs、Gαi、vimentin和Ⅰ型胶原在肺组织和Ang Ⅱ诱导的成纤维细胞中的表达
常规提取组织和细胞蛋白,经考马斯亮蓝法测定蛋白浓度后上样(20 μg·泳道-1),常规电泳和电转。孵育一抗(1∶500)4 ℃过夜,加二抗(1∶5 000)37 ℃ 1 h后ECL发光显色,采用Image-Lab 5.1软件定量分析条带,以相应内参的比值作为目的蛋白的相对表达量。
1.6 EIA试剂盒检测大鼠肺组织和Ang Ⅱ诱导的成纤维细胞中cAMP活性
成纤维细胞经0.1 mol·L-1HCl预处理20 min,提取蛋白,1 000×g离心10 min,取上清用于检测;冰冻组织称量后加入5%的三氯乙酸(10 g·ml-1),组织充分匀浆后以1 500×g离心10 min,加入饱和乙醚提取三氯乙酸蛋白混合液,提上清于新离心管中,加热至70 ℃ 5 min,蒸发残余乙醚。Bradford法测定蛋白质浓度,以每孔50 μl加样,设3个复孔,后续操作按EIA-cAMP试剂盒说明书测定cAMP含量。
1.7 统计学处理
2 结 果
2.1 Ac-SDKP对矽肺大鼠Gαs、Gαi和cAMP表达的调节作用
免疫荧光结果所示,对照组4、8周大鼠的肺泡壁细胞中可见Gαs蛋白(红色荧光)呈点状阳性表达,绿色荧光标记的间质表型标志物vimentin亦有微弱表达(蓝色荧光DAPI标记细胞核);矽肺模型组4、8周可见vimentin绿色荧光强阳性表达于矽结节区域、间质纤维化区域和肺泡壁增宽区域,较为特异性地标记巨噬细胞和(肌)成纤维细胞,而Gαs蛋白则在矽结节和间质纤维化区域表达缺失,在纤维化周边正常肺泡壁细胞内可见标记Gαs的红色荧光。与矽肺模型组8周相比,Ac-SDKP抗纤维化治疗和预防治疗组矽结节明显减小,Gαs和vimentin阳性表达特点与对照组和矽肺模型组较为一致,但染色强度和范围明显较少。见图1。
Westernblot检测矽肺大鼠肺组织Gαs、Gαi、cAMP和纤维化相关指标α-SMA、Ⅰ型胶原表达,结果(表1、图2)显示,与对照组4、8周相比,Gαs和cAMP在矽肺模型组表达明显减少,其中Gαs下调至相应时间点对照组的25.68%和10.60%,cAMP下调至34.38%和11.25%;Ac-SDKP抗纤维化治疗和预防治疗后Gαs表达分别上调为矽肺模型组8周的8.88倍和9.44倍,cAMP分别上调为4.78倍和4.67倍。α-SMA、Ⅰ型胶原和Gαi表达在矽肺模型组分别较相应时间点对照组上调,其中α-SMA、Ⅰ型胶原和Gαi在矽肺4周组表达是对照4周组的3.48倍、1.96倍和3.45倍,矽肺模型组8周α-SMA、Ⅰ型胶原和Gαi表达是对照组8周的3.92倍、1.53倍和4.34倍。而Ac-SDKP抗纤维化治疗和预防治疗组α-SMA分别下调为矽肺模型组8周的27.45%和33.99%,Ⅰ型胶原分别下调为矽肺模型组8周的37.68%和56.52%,Gαi在Ac-SDKP抗纤维化治疗和预防治疗组表达分别是矽肺模型组8周的34.54%和32.12%。以上结果经方差分析,差异均具有统计学意义(P<0.05)。
EIA结果(图2)显示cAMP在矽肺模型组4、8周表达分别为对照组的37.85%和37.20%,而Ac-SDKP抗纤维化治疗和预防治疗后,cAMP表达为矽肺模型组8周的1.48倍和1.56倍,经方差分析,差异均具有统计学意义(P<0.05)。
2.2 Ac-SDKP在Ang Ⅱ诱导的肌成纤维细胞转分化过程中对Gαs/Gαi-cAMP信号的调节作用
Westernblot结果(图2,表2)显示,AngⅡ诱导组与对照组相比vimentin、Ⅰ型胶原和Gαi表达分别上调了2.22倍、2.16倍和17.88倍,给予Ac-SDKP、valsartan和db-cAMP预处理后与AngⅡ诱导组相比,Ⅰ型胶原的表达分别下调了68.52%、74.07%和62.96%,α-SMA的表达分别是AngⅡ诱导组的60.0%、58.33%和58.33%,Gαi表达在Ac-SDKP、valsartan和db-cAMP预处理表达被别下降为AngⅡ诱导组的76.92%、63.63%和42.66%,经方差分析,差异均具有统计学意义(P<0.05)。
C4.对照组4周;S4:矽肺模型组4周;C8:对照组8周;S8:矽肺模型组8周;Ac-post:Ac-SDKP抗纤维化治疗组;Ac-pre:Ac-SDKP预防治疗组
图1 vimentin和Gαs在矽肺大鼠肺组织中的定位和表达(免疫荧光染色 ×400)
C4.control 4 weeks; S4:silicosis 4 weeks; C8:control 8 weeks; S8:silicosis 8 weeks; Ac-post:Ac-SDKP post-treatment; Ac-pre:Ac-SDKP pre-treatment
Fig 1 The co-expression of vimentin and Gαsin lung tissue of silicotic rats(immunofluorescence ×400)
表1 Ac-SDKP对矽肺大鼠肺内Gαi、Gαs、α-SMA和Ⅰ型胶原蛋白表达的调节
Tab 1 The effect of Ac-SDKP on regulating Gαi,Gαs,α-SMA and collagen type Ⅰ in silicotic rats

组 别n相对表达量GαiGαsα-SMAⅠ型胶原对照组4周40.48±0.271.48±0.240.42±0.110.48±0.08矽肺模型组4周41.70±0.29a0.38±0.13a1.46±0.22a0.94±0.08a对照组8周40.38±0.201.51±0.200.39±0.090.45±0.10矽肺模型组8周41.65±0.26b0.16±0.07b1.53±0.42b0.69±0.39bAc-SDKP抗纤维化治疗组40.57±0.29c1.42±0.16c0.42±0.09c0.26±0.09cAc-SDKP预防治疗组40.53±0.34c1.51±0.21c0.52±0.12c0.39±0.15cF值19.22149.70727.6866.557
与对照组4周比较,aP<0.05;与对照组8周比较,bP<0.05;与矽肺模型组8周比较,cP<0.05

与对照组4周比较,aP<0.05;与对照组8周比较,bP<0.05;与矽肺模型组8周比较,cP<0.05。与对照组比较,dP<0.05;与Ang Ⅱ诱导组比较,eP<0.05
图2 Gαs、Gαi、cAMP、α-SMA和Ⅰ型胶原在肺组织和Ang Ⅱ诱导的成纤维细胞中的表达
Compared with control 4 weeks group,aP<0.05; compared with control 8 weeks group,bP<0.05; compared with silicosis 8 weeks group,cP<0.05.Compared with control group,dP<0.05; compared with Ang Ⅱ treatment group,eP<0.05
Fig 2 The expression of Gαs,Gαi,cAMP,α-SMA and collagen type Ⅰ in lung and in fibroblasts induced by Ang Ⅱ
EIA结果(图2)显示,Ang Ⅱ诱导组cAMP表达下调至对照组的50.26%,而Ac-SDKP、valsartan和db-cAMP预处理组与Ang Ⅱ诱导组相比cAMP表达上调了1.69倍、1.48倍和1.55倍,经方差分析,差异均具有统计学意义(P<0.05)。
3 讨 论
Ac-SDKP能够调节cAMP活化的交换蛋白(exchange protein directly activated by cAMP,Epac)信号,发挥抑制矽肺大鼠肌成纤维细胞分化和胶原沉积的作用[9]。然而,Ac-SDKP是否能够活化cAMP信号并发挥相应的抗纤维化作用,目前仍未所知。根据前期预实验结果[10],本研究采用vimentin标记矽结节和间质纤维化区域,观察Gαs蛋白的表达特点和范围,结果发现Gαs蛋白可阳性表达于结节周边及正常的肺泡壁细胞中,而在vimentin强阳性表达的矽结节内Gαs几乎无表达,提示其在矽结节及间质纤维化区域中的缺失表达可能与矽肺纤维化的形成有关。Western Blot结果也显示在矽肺大鼠模型中Gαs蛋白、cAMP含量表达下调,伴随Gαi、α-SMA和Ⅰ型胶原表达上调,提示矽肺发生、发展过程中可能伴随了内源性cAMP水平的降低。已有研究显示,ADRB2-Gαi蛋白信号是心衰的主要发病机制之一,可引起心肌细胞肥大、凋亡、心肌重塑和纤维化病变,在多比柔星诱导的大鼠心衰模型中发现Gαi3蛋白表达的上调,而ADRB2-Gαs蛋白信号则通过增加心肌收缩力发挥抗心肌纤维化的作用[11-13]。在本研究中,给予Ac-SDKP抗纤维化治疗和预防治疗后能够逆转上述变化,提示Ac-SDKP能够通过上调Gαs蛋白、抑制Gαi蛋白的表达促进了cAMP水平的上调,从而抑制了胶原沉积和纤维化的进展。
体外研究也显示,Gαs偶联受体激动剂/Gαi偶联受体拮抗剂、cAMP的类似物均具有抗器官纤维化的效应,其中间环节是通过促进cAMP表达水平的上调,从而抑制成纤维细胞的增殖、阻抑细胞外基质的沉积和肌成纤维细胞的分化[7]。本课题组前期研究也显示,Ac-SDKP能够抑制矽肺大鼠Ang Ⅱ受体的表达,从而拮抗了Ang Ⅱ信号的活化[14]。Ang Ⅱ能够通过上调Gαi蛋白的表达加速cAMP的降解,促进了成纤维细胞Ⅰ型胶原、α-SMA、纤溶酶原激活物抑制剂和纤连蛋白表达的上调[15]。本研究结果也显示,Ang Ⅱ能够显著诱导肺成纤维细胞向肌成纤维细胞分化,同时伴随了Gαi蛋白表达的上调和Gαs蛋白、cAMP含量的下调。而予以Ac-SDKP、AT1受体阻滞剂valsartan或cAMP类似物db-cAMP预处理,均能通过对cAMP信号的活化,促进内源性cAMP水平的上调,从而抑制了胶原合成和肌成纤维细胞分化。总之,Ac-SDKP能够通过对Gαs/Gαi-cAMP信号通路的调节发挥抗矽肺大鼠肺纤维化的保护作用。
表2 Ac-SDKP对Ang Ⅱ诱导的肌成纤维细胞Gαi、Gαs、α-SMA和Ⅰ型胶原表达的调节
Tab 2 The effect of Ac-SDKP on regulating Gαi,Gαs,α-SMA and collagen type Ⅰ in fibroblasts induced by Ang Ⅱ
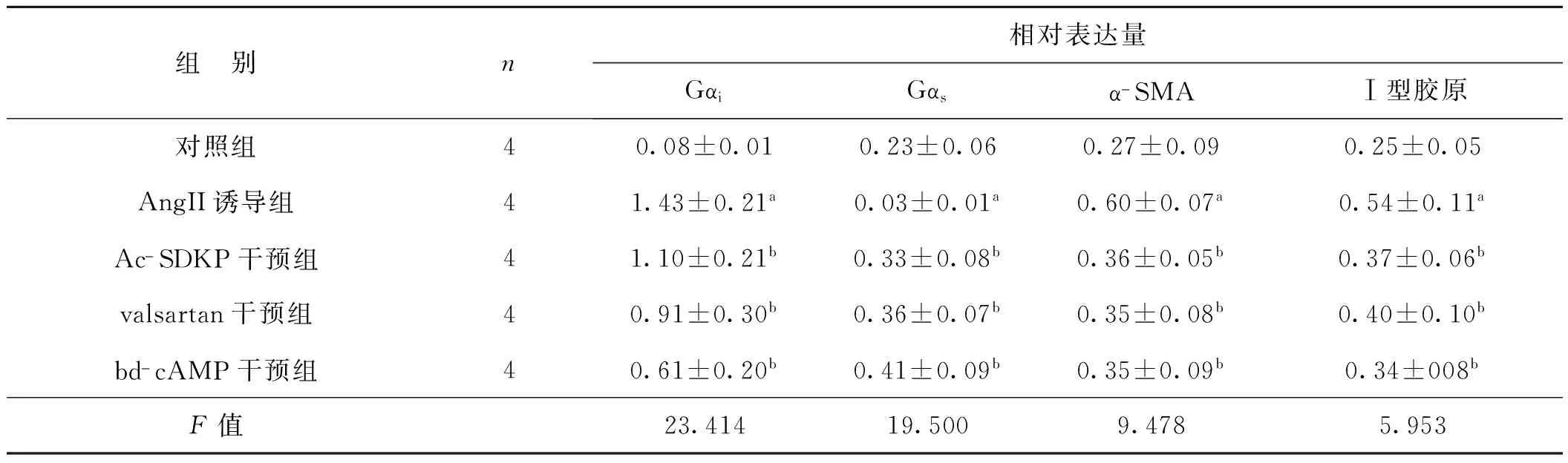
组 别n相对表达量GαiGαsα-SMAⅠ型胶原对照组40.08±0.010.23±0.060.27±0.090.25±0.05AngII诱导组41.43±0.21a0.03±0.01a0.60±0.07a0.54±0.11aAc-SDKP干预组41.10±0.21b0.33±0.08b0.36±0.05b0.37±0.06bvalsartan干预组40.91±0.30b0.36±0.07b0.35±0.08b0.40±0.10bbd-cAMP干预组40.61±0.20b0.41±0.09b0.35±0.09b0.34±008bF值23.41419.5009.4785.953
与对照组比较,aP<0.05;与Ang Ⅱ诱导组比较,bP<0.05
[1] 王娟.珐菲亚参胶囊辅助大容量全肺灌洗术治疗煤工尘肺的临床效果观察[J].现代医学,2016,44(2):239-241.
[2] 徐洪,薛新新,杜世璞,等.Ac-SDKP抗矽肺纤维化作用的比较蛋白组学研究[J].中华劳动卫生职业病杂志,2014,32(8):561-567.
[3] INSEL P A,MURRAY F,YOKOYAMA U,et al.cAMP and Epac in the regulation of tissue fibrosis[J].Br J Pharmacol,2012,166(2):447-456.
[4] LU D,AROONSAKOOL N,YOKOYAMA U,et al.Increase in cellular cyclic AMP concentrations reverses the profibrogenic phenotype of cardiac myofibroblasts:a novel therapeutic approach for cardiac fibrosis[J].Mol Pharmacol,2013,84(6):787-793.
[5] SUN J,FU L,TANG X,et al.Testosterone modulation of cardiac β-adrenergic signals in a rat model of heart failure[J].Gen Comp Endocrinol,2011,172(3):518-525.
[6] MILLER C L,CAI Y,OIKAWA M,et al.Cyclic nucleotide phosphodiesterase:a key regulator of cardiac fibroblast activation and extracellular matrix remodeling in the heart[J].Basic Res Cardiol,2011,106(6):1023-1039.
[7] SCHINNER E,WETZL V,SCHLOSSMANN J.Cyclic nucleotide signaling in kidney fibrosis[J].Int J Mol Sci,2015,16(2):2320-2351.
[8] 孙月,徐洪,徐丁洁,等.新生鼠肺成纤维细胞原代培养方法的比较与体外肌成纤维细胞转化模型的建立[J].医学研究生学报,2014,27(2):129-132.
[9] 杜世璞,薛新新,李世峰,等.Ac-SDKP 经由Epac信号抑制矽肺肌成纤维细胞分化的作用及机制[J].环境与职业医学杂志,2015,32(2):296-301.
[10] 徐洪,孙月,徐丁洁,等.α-平滑肌肌动蛋白、波形蛋白在大鼠矽肺模型中表达的病理形态学特点及其意义[J].解剖学杂志,2014,37(3):300-303.
[11] CHEN Y,YANG S,YAO W,et al.Prostacyclin analogue beraprost inhibits cardiac fibroblast proliferation depending on prostacyclin receptor activation through a TGF β-Smad signal pathway[J].PLoS One,2014,9(5):e98483.
[12] WOO A Y,SONG Y,XIAO R P,et al.Biased β2-adrenoceptor signaling in heart failure:pathophysiology and drug discovery[J].Br J Pharmacol,2014,153(4):751-759.
[13] YAN L,VATNER S F,VATNER D E.Disruption of type 5 adenylyl yclase prevents β-adrenergic receptor cardiomyopathy:a novel approach to β-adrenergic receptor blockade[J].Phusiol Heart Circ Physiol,2014,307(10):H1521-H1528.
[14] XU H,YANG F,SUN Y,et al.New Antifibrotic target of Ac-SDKP:inhibition of myofibroblast differentiation in rat lung with Silicosis[J].PLoS One,2012,7(7):e40301.
[15] MILLER C L,CAI Y,OIKAWA M,et al.Cyclic nucleotide phosphodiesterase 1A:a key regulator of cardiac fibroblast activation and extracellular matrix remodeling in the heart[J].Basic Res Cardiol,2011,106(6):1023-1039.
Effect and mechanism of Ac-SDKP on inhibition of silicosisviaGαs/Gαi-cAMP pathway
GENG Yu-cong1,LI Hong-lei1,GAO Xue-min1,LI Shi-feng1,XUE Xin-xin1,YANG Yi1,XU Ding-jie2,XU Hong1,YANG Fang1
(1.MedicalResearchCenter,NorthChinaUniversityofScienceandTechnology,Tangshan063000,China; 2.InstituteofTraditionalChineseMedicine,NorthChinaUniversityofScienceandTechnology,Tangshan063000,China)
Objective:To explore the anti-fibrotic effect of Ac-SDKPviaGαs/Gαi-cAMP pathway in silicotic rats.Methods:Silicotic rats were constructed using bronchial instillation of SiO2,with Ac-SDKP post-treatment and pre-treatment.Myofibroblasts induced by Ang Ⅱ were pre-treated with Ac-SDKP,valsartan and db-cAMP.The distribution and co-expression of Gsαand vimentin were observed using immunofluorescence.The expression of Gαs,Gαi,α-SMA and collagen type I in lung tissue and fibroblasts were detected by Western blot.The level of cAMP was measured with EIA cAMP kit.Results:Compared with control group,the level of Gαsand cAMP were down-regulated in silicosis model,accompanied by up-regulated level of Gαi,α-SMA and collegan type I(P<0.05).Post-and pre-treatment with Ac-SDKP could suppress the changes induced by silica.In addition,Ac-SDKP,valsartan and db-cAMP efficiently ameliorated the down-regulation of Gαsand cAMP,myofibroblasts differentiation and collagen deposition in fibroblasts induced by Ang Ⅱ(P<0.05).Conclusion:Ac-SDKP inhibits silicosis and myofibroblasts differentiation by regulating Gαs/Gαi-cAMP signal pathway.
silicosis; myofibroblasts; N-acetyl-seryl-aspartyl-lysyl-proline; pulmonary fiborosis; cAMP; rats
2016-03-20
2016-05-24
国家自然科学基金资助项目(81472953);河北省自然科学基金资助项目(H201409115);河北省研究生创新项目(2015S04)
耿玉聪(1989-),女,河北保定人,在读硕士研究生。E-mail:947979751@qq.com
杨方 E-mail:fangyang1955@163.com
耿玉聪,李红垒,高学敏,等.Ac-SDKP通过Gαs/Gαi-cAMP信号通路抑制矽肺大鼠肺纤维化[J].东南大学学报:医学版,2016,35(5):658-663.
R135.2; R-332
A
1671-6264(2016)05-0658-06
10.3969/j.issn.1671-6264.2016.05.003
