金属考点面面观
2016-12-20唐殿华
唐殿华

综观历年黑龙江省各地、市对金属知识的考查,主要包括金属的性质及应用、金属活动性顺序及应用、金属的冶炼、金属的锈蚀及防护等。试题既有对金属某一知识的单独考查,也有将金属知识相融合的综合考查。现以近几年黑龙江省各地、市中考题为例来加以说明。
考点一:金属的物理性质及应用
解答此类题首先要明确常见金属所具有的导电、导热及延展性等共同的物理性质,然后通过金属在生产生活中的具体应用去判断其所利用的是金属的哪些物理性质。
例1:(2015年 黑龙江省龙东地区)铝在工业和生活中应用广泛。
(1)铝是地壳中含量最高的 (填“金属”或“非金属”)元素,其年产量已跃居第二位;
(2)铝可制成电线,主要是利用其有良好的延展性和 性;
(3)铝制品具有很好的抗腐蚀性能,其原因是
。
解析:本题主要考查金属的物理性质及应用。(1)铝是地壳中含量最高的金属元素;(2)铝可制成电线,除要求具有良好的延展性外,主要是利用其良好的导电性;(3)铝制品具有很好的抗腐蚀性能,主要是常温下铝与氧气反应生成致密的氧化铝薄膜,可以阻止铝的进一步氧化。
答案:(1)金属;(2)导电;(3)常温下铝与氧气反应生成致密的氧化铝薄膜。
考点二:合金及应用
解答此类题首先要明确合金与纯金属的区别,并把握合金的特征,然后根据合金的特征去判断题给信息及应用。
例2:(2014年 黑龙江省齐齐哈尔市)生活中常用的硬币都是合金制成的,其中一元硬币为钢芯镀镍合金,五角硬币为铜锌合金和钢芯镀铜合金。请说出用来铸造硬币的合金需要具有哪些性质。(答出三点)
解析:本题主要考查合金的特性及应用。硬币作为商业贸易流通的一种货币,必须具备硬度和耐磨性好、抗腐蚀性好、熔点高、色泽美观等优点。
答案:硬度和耐磨性好;抗腐蚀性好;熔点高;色泽美观。(任意三点即可)
考点三:金属的化学性质及应用
解答此类题首先要掌握金属常见的三条化学性质,尤其是能熟练正确书写几种常见金属分别与氧气、稀酸及盐溶液发生反应的化学方程式,其次要掌握金属与稀酸或盐溶液发生反应的条件,然后在此基础上进行应用。
例3:(2014年 黑龙江省牡丹江市)如图,将等质量的锌和铁分别入左、右试管中,加入等质量、等质量分数的稀盐酸,充分反应后,冷却到室温,金属均有剩余,(U型管内为水,初始液面相平,反应过程中装置气密性良好)下列说法正确的是( )。
A. 右试管中溶液为浅绿色
B. 两试管中所得溶液的质量相等
C. U型管中液面左升右降
D. U型管中液面仍相平
解析:本题主要考查金属与稀酸反应的化学性质及应用。由于锌、铁都能与盐酸反应生成氢气,根据金属均有剩余,说明盐酸全部反应,生成的氢气质量相等,且生成的亚铁盐溶液显浅绿色,因此A正确;而生成等质量的氢气,所用的铁和锌的质量不等,因此两试管中所得溶液的质量不相等,因此B错误;由于生成的氢气质量相等,体积也相等,U形管两端的气体体积变化相等,因此U型管中液面不变,故C错误,D正确。
答案 :A、D。
考点四:常见金属活动性的顺序及应用
解答此类题需掌握常见金属的活动性顺序,然后能根据金属的活动性解释生产生活中的一些现象,并在此基础上能做到熟练应用。
例4:(2014年 黑龙江省牡丹江市)下列关于金属的叙述与金属活动性顺序无关的是( )。
A. 不用铁制容器配制波尔多液(含有硫酸铜)
B. 真金不怕火炼
C. 用稀硫酸识别黄铜(铜锌合金)假冒的黄金指环
D. 铝制品比铁制品更耐腐蚀
解析:本题主要考查金属活动性的应用。不用铁制容器配制波尔多液,是由于铁比铜活泼,铁与硫酸铜反应,与金属活动性顺序有关;由于金的化学性质很稳定,即使在高温条件下,也不与氧气反应,所以,真金不怕火炼,与金属活动性顺序有关;由于黄铜中含有锌,锌能与硫酸反应放出氢气,所以用稀硫酸识别黄铜(铜锌合金)假冒的黄金指环,与金属活动性顺序有关;由于铝与氧气反应生成致密的氧化铝,能阻止反应的进一步进行,所以,铝制品比铁制品更耐腐蚀,与金属活动性顺序无关。
答案: D。
考点五:金属活动性顺序的实验探究
解答此类题首先要能根据所探究的金属活动性顺序选择适当的试剂,然后设计出合理的实验方案设计进行实验探究。
例5 :(2013年 黑龙江省绥化市)实验室开放日,同学们在老师的指导下,进行实践活动,验证铜、铁、锌三种金属的活动性顺序。实验室提供:
药品:硫酸铜溶液、铜片、锌片、铁钉和氯化锌溶液
仪器:烧杯、试管
用品:砂纸、火柴
(1)在验证三种金属活动顺序时,应该取用哪些药品?
(2)请写出你是怎样验证这三种金属的活动顺序的(过程、现象、结论)。
解析:本题主要考查通过实验探究验证金属活动性顺序。(1)要验证铜、铁、锌三种金属的活动性顺序,通常根据金属能否与酸、盐发生反应来分析,结合题中给出的药品,应选择硫酸铜溶液、铁钉和氯化锌溶液;(2)要验证铜、铁、锌三种金属的活动性顺序,可将铁钉放入硫酸铜溶液中,铁钉表面覆盖一层红色物质,说明了铁的活动性大于铜,再把铁钉放入氯化锌溶液中,无明显现象,说明锌的活动性大于铁,由此可以证明三种金属的活动性顺序是:锌>铁>铜。
答案:(1)硫酸铜溶液、铁钉和氯化锌溶液;(2)将铁钉放入硫酸铜溶液中,铁钉表面覆盖一层红色物质,说明了铁的活动性大于铜,再把铁钉放入氯化锌溶液中,无明显现象,说明锌的活动性大于铁,由此可以证明三种金属的活动性顺序是:锌>铁>铜。
考点六:金属矿物及冶炼
解答此类题首先要掌握实验室模拟炼铁的实验装置及操作步骤,重点掌握高炉炼铁的化学方程式,然后迁移到工业炼铁中所用装置、原料及尾气处理等知识的综合应用中去。
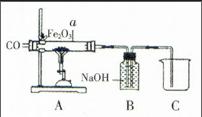
例6 :(2015年 黑龙江省绥化市)某化学兴趣小组同学利用图中所示装置模拟炼铁:
(1)为了避免玻璃管a在加热时可能发生爆炸,加热前应 ;
(2)a管中氧化铁发生反应的化学方程式为 ;
(3)B装置可用来吸收二氧化碳气体,写出该反应的化学方程式 ;B装置 (填“能”或“不能”)用来收集CO;
(4)若a管中氧化铁全部还原成铁,冷却后称量铁的质量比反应前氧化铁的质量减少了2.4g,则加入a管中氧化铁的质量是 g。
解析:本题主要考查对一氧化碳还原氧化铁反应操作的理解及各装置的作用。(1)一氧化碳具有可燃性,与空气混合,加热可能会发生爆炸,所以在加热前要先通一氧化碳排尽玻璃管内空气防止一氧化碳不纯发生爆炸;(2)在高温条件下,一氧化碳与氧化铁反应生成铁和二氧化碳,因此可写出反应的化学方程式;(3)装置B内盛有氢氧化钠溶液可以除去尾气中的二氧化碳,二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,据此可写出反应的化学方程式,同时一氧化碳气体不溶于水也不能与氢氧化钠反应,因此可排出装置内的溶液而被收集,防止造成空气污染;(4)a管中减少的是氧元素的质量。氧化铁中Fe与O元素的质量比=(56×2):(16×3)=7∶3,因此,氧化铁中氧元素质量为2.4g时,铁元素的质量=2.4g×7÷3=5.6g,则氧化铁的质量为:2.4g+5.6g=8g。
答案:(1)先通一会儿CO;(2)3CO+Fe2O3 2Fe+
3CO2(3)CO2+2NaOH Na2CO3+H2O 能;(4)8。
考点七:金属锈蚀的原因及金属资源的保护
解答此类题首先要掌握钢铁锈蚀的原因,其次要掌握实验探究钢铁锈蚀的方法,并能结合钢铁锈蚀的原因列举出生产生活中防止钢铁锈蚀的具体方法,在此基础上结合题给信息进行分析判断。
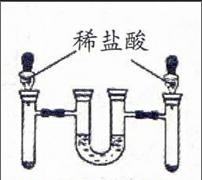
例7:(2014年 黑龙江省龙东地区)世界每年因腐蚀而报废的金属设备和材料相当于年产量的20%~ 40% ,为探究铁锈蚀条件,某同学设计的实验如图所示,一周后观察到 (填序号)试管内的铁钉生锈。请分析铁生锈的条件及防锈措施 。
Ⅰ Ⅱ Ⅲ
分析:本题主要考查金属锈蚀的原因及防护措施。铁只有与氧气和水同时接触才会生锈。Ⅰ中铁钉与水和氧气同时接触;Ⅱ中只与水接触;Ⅲ中只与氧气接触。因此一周后Ⅰ中铁钉会锈蚀。防锈的方法有多种,如刷漆等。
答案:Ⅰ;铁与氧气和水同时接触;刷漆等。(合理即可)
例8:(2013年 黑龙江省龙东地区)(1)金属资源面临枯竭,保护金属资源的有效途径之一就是回收再利用,请说出回收废旧金属的好处。(答一点即可)
(2)除回收再利用外,你还知道保护金属资源的有效途径有哪些?(答两点即可)
解析:本题主要考查金属资源的利用和保护。(1)金属资源面临枯竭,保护金属资源的有效途径之一就是回收再利用,其中回收废旧金属的好处有节约金属资源、减少环境污染、节约能源;(2)除回收再利用外,保护金属资源的有效途径有防止金属锈蚀,有计划、合理开采金属矿物,寻找金属替代品。
答案:(1)节约金属资源;(2)防止金属锈蚀;有计划、合理开采金属矿物。
考点八:金属与溶液的简单综合计算
解答此类题首先要掌握金属与稀酸或盐溶液反应的化学方程式,要知道在溶液中进行的反应其实质是溶质之间的反应,并且能根据化学方程式计算出溶质的质量,然后利用溶液有关知识进行相关计算。
例9:(2015年 黑龙江省牡丹江市)实验室有铁粉和铜粉的固体混合物,现取10g置于烧杯中,向烧杯中加入一定溶质质量分数的稀硫酸,烧杯内固体质量与加入稀硫酸的质量关系如图所示,请完成下列问题:
(1)固体样品中铜的质量为 g;
(2)求恰好完全反应时所得溶液中溶质的质量分数;
(3)B点溶液中的溶质是 。
解析:本题主要考查金属与稀酸反应的计算。(1)铁可以和稀硫酸反应,但是铜不能反应,所以可以判断剩余的固体为铜,其质量为4.4g;
(2)铁的质量为10g-4.4g=5.6g。
设生成硫酸亚铁的质量为x,生成氢气的质量为y
Fe+H2SO4=FeSO4+H2↑
56 152 2
5.6g x y
==
解得:x=15.2g, y=0.2g
所以恰好完全反应时所得溶液中溶质的质量分数为:×100%=10% 。
(3)从图中可以知道B点时的溶液为稀硫酸过量,所以可以判断其中的溶质为硫酸亚铁和硫酸。
答案:(1)4.4;(2)恰好完全反应时所得溶液中溶质的质量分数为10%;(3)硫酸亚铁和硫酸。
考点九:金属知识的综合应用
解答此类题要根据题给信息联系金属知识分步作答。
例10:(2013年 黑龙江省齐齐哈尔市)金属材料在生产生活中十分广泛,
(1)根据下图金属应用实例推断,金属具有的物理性质有 ;(答两点)
(2)生铁和钢都是铁的合金,二者性能不同的原因是 ;
(3)写出工业上以赤铁矿为原料炼铁过程中,一氧化碳与氧化铁发生反应的化学方程式 ;
每年因腐蚀而消费掉的金属材料数量惊人,铁生锈的条件是 ;防止金属腐蚀是保护金属资源的一条有效途径,保护金属资源的途径还有
(答一条即可);
(4)将一定量的锌粉放入稀硫酸、硫酸亚铁、硫酸铜的混合溶液中,充分反应后过滤,向滤渣中加盐酸有气泡产生。则滤渣中一定含有的固体是 ;滤液中一定不含的物质是 。
解析:本题主要考查金属的各种知识的综合应用。(1)电缆是利用了金属的导电性,热水壶是利用了金属的导热性,金属丝体现了金属的延展性。(2)生铁和钢的含碳量不同,生铁的含碳量是2%至4.3%,钢的含碳量是0.03%至2%之间,显然生铁和钢的含碳量不同。 (3)一氧化碳与氧化铁发生氧化还原反应,生成铁和二氧化碳,反应条件是高温;铁在潮湿的环境里容易生锈;寻找金属的替代品、改变金属的内部结构等都是保护金属资源的有效途径。(4)根据向滤渣中加盐酸有气泡产生可以断定将一定量的锌粉放入稀硫酸、硫酸亚铁、硫酸铜的混合溶液中,充分反应后一定有铁生成,又因为在金属活动性顺序里,只有排在前面的金属才能把排在后面的金属从它的盐溶液中置换出来,而且弱的金属先被置换出来,锌与硫酸亚铁、硫酸铜的混合溶液反应,先置换出铜,所以滤渣中一定含有的固体是铁、铜;滤液中一定不含的物质是硫酸、硫酸铜。
答案:(1)导电性、导热性或延展性;(2)含碳量不同;(3)3CO+Fe2O3 3CO2+2Fe;与水和氧气同时接触 ;寻找金属的替代品;(4)铁、铜 ;硫酸、硫酸铜。
