高效液相色谱-线性离子阱-静电场轨道阱高分辨质谱测定杨树胶的指标性成分水杨苷
2016-12-20赵晓亚付晓芳尚吟竹郑茜玥
赵晓亚,付晓芳,李 晶,王 鹏,叶 诚,尚吟竹,郑茜玥
(湖北出入境检验检疫局技术中心,湖北 武汉 430050)
高效液相色谱-线性离子阱-静电场轨道阱高分辨质谱测定杨树胶的指标性成分水杨苷
赵晓亚*,付晓芳,李 晶,王 鹏,叶 诚,尚吟竹,郑茜玥
(湖北出入境检验检疫局技术中心,湖北 武汉 430050)
建立了液相色谱-线性离子阱-静电场轨道阱高分辨质谱(LC-LTQ-Orbitrap)快速测定蜂胶中杨树胶指标性成分水杨苷含量的方法,并根据精确的母离子和子离子质荷比进行定性和确证,以判断蜂胶中是否掺杂杨树胶。样品经无水乙醇提取,Waters xselect HSS T3色谱柱(3.0 mm×100 mm,3.5 μm)分离,以乙腈-0.1%乙酸溶液为流动相,正离子扫描模式进行高分辨质谱检测,外标法定量。结果表明,该方法的线性范围为0.5~25.0 μg/mL,相关系数(r)大于0.99。在25.0,150.0,300.0 mg/kg 3个加标水平下的平均回收率为81.6%~91.0%,相对标准偏差为9.0%~11.6%。
高效液相色谱;线性离子阱-静电场轨道阱;高分辨质谱;蜂胶;杨树胶;水杨苷
GB/T 24283-2009[1]定义蜂胶为“工蜂采集植物树脂等分泌物与其上颚腺、蜡腺等分泌物混合形成的胶粘性物质”。蜂胶具有广泛的药理活性和功效,有抗菌、降血糖、抗炎镇痛、增强免疫、抗氧化、抗衰老等作用[2-4],因此蜂胶产品越来越受到消费者青睐,原料需求显著增加,出现了以杨树胶混入蜂胶中的造假问题。由于蜂胶来源于植物树脂,尤其是杨属性蜂胶主要来源于杨属植物,因此为鉴别蜂胶和杨树胶带来了难度。
目前对蜂胶真假鉴别的方法主要有液相色谱法[5-12]、气相色谱法[13]、气相色谱-质谱联用法[14-16]等。GH/T1081-2012中明确指出水杨苷广泛存在于杨属和柳属植物的芽、叶子和树皮中,西方蜜蜂在采集杨属植物树脂以及蜂巢内传递这些树脂加工成蜂胶的过程中加入了其腺体分泌的β-葡萄糖苷酶等,将树脂中所含有的水杨苷水解。但在杨树胶加工过程中水杨苷能稳定存在。因而水杨苷是区分蜂胶与杨树胶的有效指标。本文借鉴此标准,采用定性更准确的高分辨质谱,对鉴别蜂胶与杨树胶的特征化合物水杨苷进行测定,建立了对蜂胶中水杨苷定性、定量分析的液相色谱-线性离子阱-静电场轨道阱高分辨质谱(LC-LTQ-Orbitrap)法。
1 实验部分
1.1 仪器、试剂与材料
Thermo Scientific 线性离子阱-静电场轨道阱高分辨质谱仪LTQ-Orbitrap XL(赛默飞世尔科技公司),液相系统为Finnigan Surveyor液相色谱带自动进样器;Milli-Q超纯水器(美国Millipore公司);KQ-600B型超声波清洗器(昆山市超声仪器有限公司);MS2型旋涡振荡器(德国IKA公司);AB204-S型电子天平(美国Mettler Toledo公司)。
水杨苷(Salicin,CAS 138-52-3,分子式C13H18O7) 购自Fluka公司,纯度≥98.5%。甲醇、乙腈和无水乙醇(色谱纯,德国Merck公司);乙酸(分析纯);实验用水为Millipore系统制备的超纯水。蜂胶、杨树胶购于湖北蜂农。
1.2 标准溶液的配制
准确称取水杨苷标准品10.0 mg 于10 mL容量瓶中,用甲醇溶解并定容,配制成质量浓度为1.0 g/L的标准储备液。分别移取适量的上述储备液于一系列10 mL容量瓶中,用甲醇溶液定容,配制成一系列不同质量浓度的混合标准工作液。
1.3 样品前处理
样品在冰箱-10 ℃左右过夜,从冰箱中取出后立即搅碎混匀,在室温下,准确称取蜂胶或杨树胶样品0.500 g于25 mL容量瓶内,加入20 mL无水乙醇,超声使样品完全溶解后,用无水乙醇定容。取1.0 mL提取液过0.22 μm滤膜,供测定。
1.4 仪器条件
色谱柱:Waters xselect HSS T3(3.0 mm×100 mm,3.5 μm);流动相:0.1%乙酸溶液(A)-乙腈(B);梯度洗脱程序为:0~3 min,95% A,3~8 min,95%~40% A,8~15 min,40%~1% A,15~20 min,1% A,20~21 min,1%~95% A,21~30 min,95% A;流速 0.2 mL/min;进样量5 μL,柱温20 ℃。
质谱条件:质量分析器为FT Orbitrap,ESI(+)正离子模式扫描,质量范围(m/z)为100~500,分辨率为60 000,喷雾电压为4.5 kV,管状透镜电压为80 V,鞘气压力为35 arb,辅助气压力为5 arb。
2 结果与讨论
2.1 提取条件的选择
根据资料,蜂胶的提取通常采用甲醇、一定比例的乙醇溶液或无水乙醇,本实验比较了甲醇和乙醇作为提取溶剂的提取效率。实验发现,以甲醇作为提取溶剂时,溶解样品比乙醇作为提取溶剂时难,而且无水乙醇对样品中水杨苷的提取效率更高(对同一杨树胶分别采用乙醇和甲醇提取,测得进样液中水杨苷的峰面积分别为882 091和204 184),故采用无水乙醇为提取溶剂。
2.2 流动相的选择
对比了流动相体系分别为10 mmol/L乙酸铵(含0.1%甲酸)-乙腈、10 mmol/L乙酸铵(含0.1%甲酸)-甲醇、0.1%乙酸-乙腈和0.1%乙酸-甲醇时对被测化合物分离及峰形的影响。结果表明,水杨苷在乙酸铵流动相体系的响应低于乙酸流动相体系;用0.1%乙酸-乙腈流动相时,水杨苷会出现双峰,而以0.1%乙酸-甲醇为流动相时出峰情况得到改善,峰变为单一峰,但峰形很差,展宽严重。分别优化了0.1%乙酸-乙腈和0.1%乙酸-甲醇两种流动相体系的洗脱梯度,发现0.1%乙酸-乙腈溶液的洗脱效果随着梯度的调整,出现双峰的情况得到改善,在“1.4”所示的优化流动相条件下,得到了单一的色谱峰(图1)。
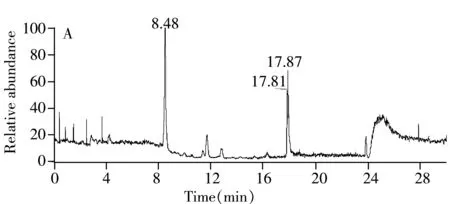
Fig.1 Chromatograms of salicin standard solution in optimal mobile phase
A.full scan spectrum;B.extracted ion chromatogram
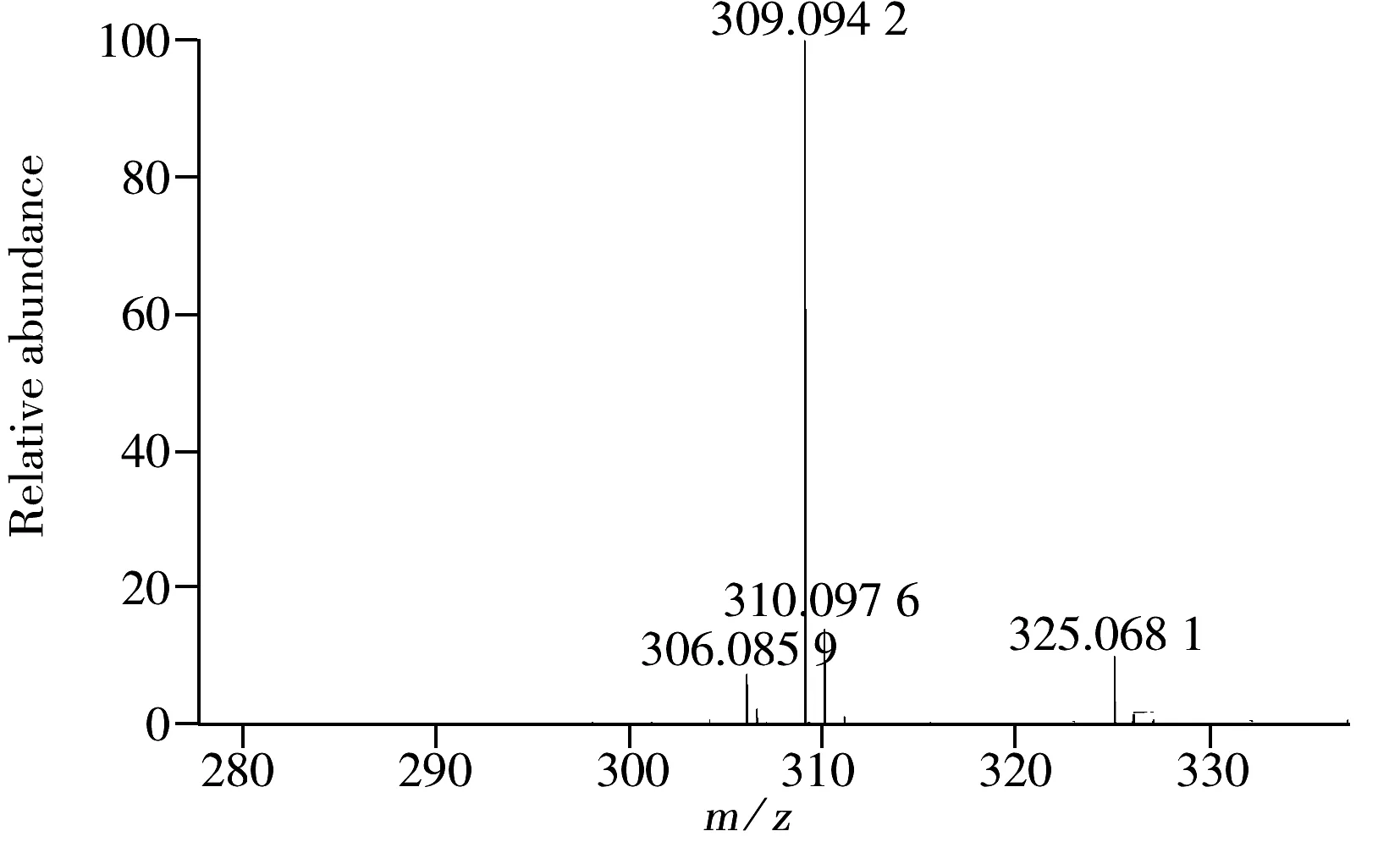
图2 水杨苷的质谱图Fig.2 Full scan mass spectrum of salicin
2.3 质谱条件的优化以及二级裂解
水杨苷的精确分子量为286.105 255,[M+H]+的精确质量为287.113 080,[M+Na]+的精确质量为309.095 022,[M+K]+的精确质量为325.068 962。在全扫描模式下,对水杨苷标准溶液在m/z280~335范围内进行扫描,结果显示水杨苷的[M+H]+响应非常低,而[M+Na]+响应很好,进一步优化鞘气电压和辅助气电压,可使被测物[M+Na]+的响应提高。质谱图见图2。图3给出了[M+Na]+离子在碰撞诱导解离(CID)
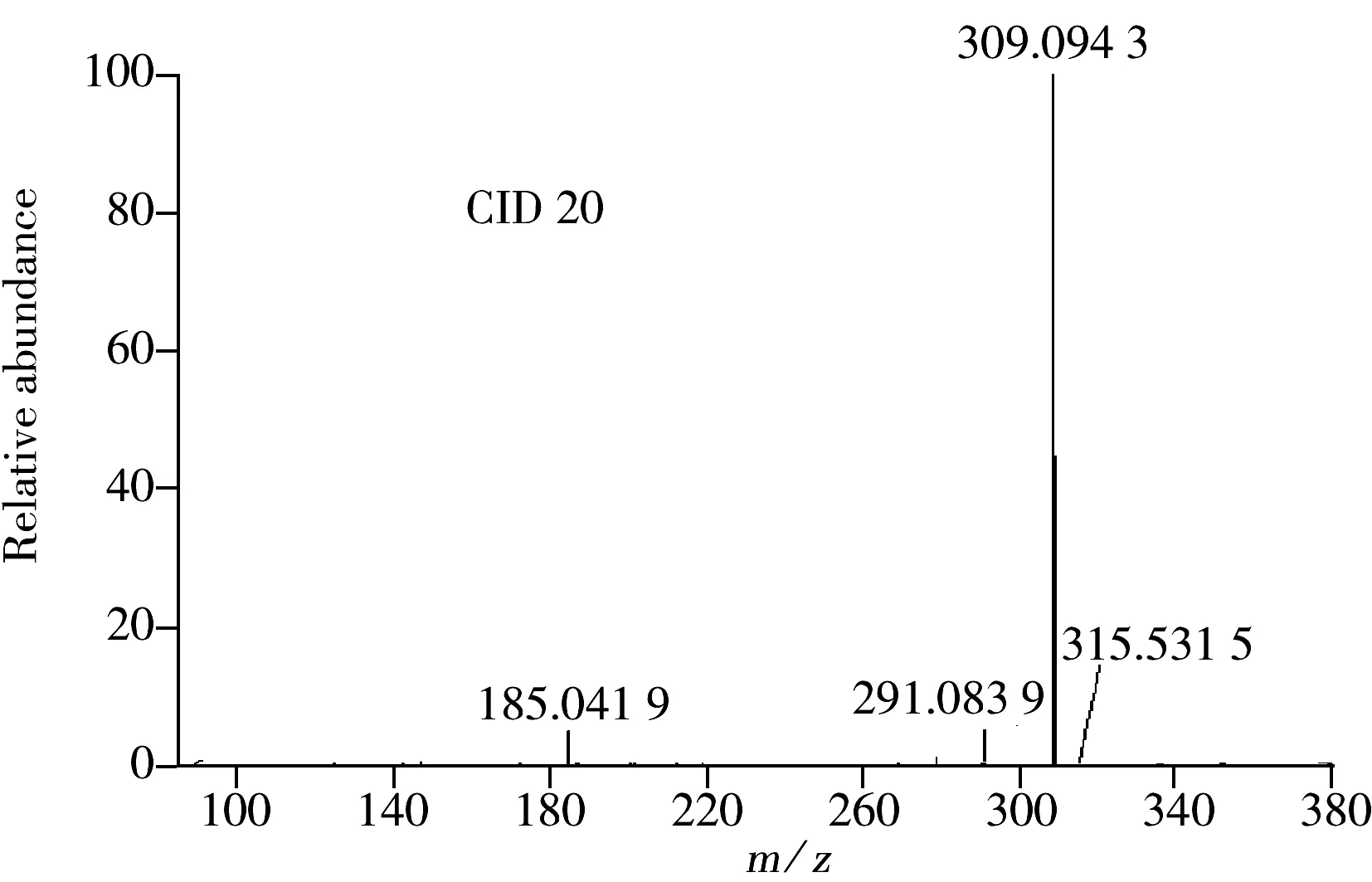



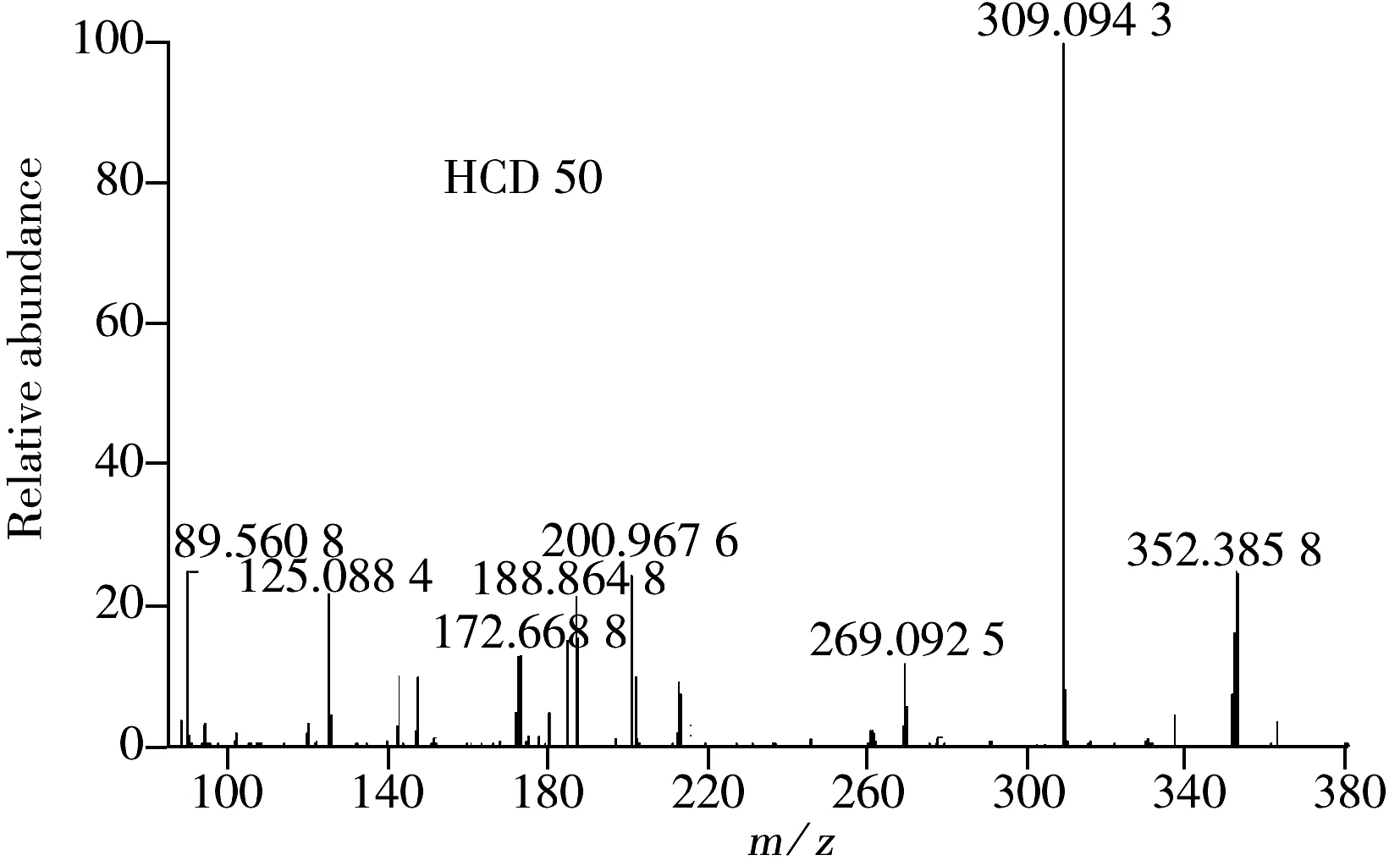
图3 水杨苷的二级裂解谱图
Fig.3 CID mass spectra of salicin in different energy
和高能碰撞诱导解离(HCD)裂解模式及不同能量下的二级质谱图。在HCD模式下,碰撞能量20 eV和40 eV时水杨苷特征碎片离子少,提高碰撞能量达50 eV时,无特征碎片离子;CID模式下,水杨苷的二级特征离子稳定,碎片离子的特征峰在40 eV和60 eV碰撞能量下无明显区别,碎片离子(m/z)主要为279.083 7,185.041 8和147.041 4。本方法采用自动触发二级质谱采集,并用ToxID筛选软件建立化合物的分子式数据库信息表,化合物筛选的离子提取窗口宽度为5 ppm。指定离子加合物类型为[M+Na]+,通过二级碎片离子(m/z) 279.083 7,185.041 8和147.041 4的设定,增加了检测的准确性。
2.4 线性范围、检出限、回收率及精确度
分别配制浓度为0.5,1.0,2.5,5.0,10.0,25.0 μg/mL的系列水杨苷标准溶液,按照所建立的分析方法进行测定,以目标组分的峰面积(y)对相应的进样浓度(x,μg/mL)绘制标准曲线,计算得到水杨苷在0.5~25.0 μg/mL范围内的线性方程为y=4.438 65×106x+9.072 03×106,相关系数(r2)为0.995。采用空白样品中添加水杨苷的方法,以3倍信噪比(S/N)计算得方法检出限为25.0 mg/kg。
称取蜂胶试样0.500 g,分别加入25.0,150.0,300.0 mg/kg 3种浓度水杨苷标准溶液,每个浓度平行测定6份,结果表明,3种添加浓度的平均回收率分别为81.6%,91.0%和89.9%,相对标准偏差(RSD)分别为11.6%,9.8%和9.0%。由于蜂胶会用杨树胶掺假,而水杨苷是杨树胶的特征成分,若蜂胶中掺有杨树胶,会有水杨苷的检出。称取蜂胶试样0.500 g,添加2.5%,5%,10%杨树胶,每个浓度平行10份,均检出水杨苷。样品蜂胶、杨树胶、蜂胶添加水杨苷标准溶液以及蜂胶添加杨树胶的谱图见图4。


图4 蜂胶(A)、杨树胶(B)、蜂胶添加25.0 mg/kg水杨苷(C)以及蜂胶添加5%杨树胶(D)的提取离子色谱图
Fig.4 Extracted ion chromatograms of propolis(A),poplar tree gum(B),25.0 mg/kg salicin spiked in propolis(C) and 5% poplar tree gum spiked in propolis(D)
2.5 实际样品的检测
蜂胶样品按本方法进行前处理,采用优化后的LC-LTQ-Orbitrap条件进行定性和定量分析。结果在部分蜂胶样品中检出水杨苷,有些样品超过GH/T1081-2012(若蜂胶样品中水杨苷含量大于0.15 mg/g或蜂胶乙醇提取物样品中水杨苷含量大于0.25 mg/g,该样品判定为检出杨树胶的样品)规定的0.15 mg/g的限量,说明在日常的蜂胶生产中存在掺杂杨树胶的现象。
3 结 论
本文将线性离子阱-静电场轨道阱高分辨质谱(LTQ-Orbitrap)技术引入蜂胶掺假鉴别检测,采用高分辨质谱,在进行母离子准确定性定量的同时,增加高分辨的二级质谱,提高了定性准确性,更有利于排除干扰,可在不具备标准物质的情况下进行确证。该方法具有准确、快速的特点,可用于日常蜂胶中杨树胶的鉴别检测。
[1] GB/T 24283-2009.Propolis.National Standards of the People's Republic of China(蜂胶.中华人民共和国国家标准).
[2] Wang X Q,Shen S F,Zhang Y F,Ma Z C.J.BohaiUniv.(王秀清,申树芳,张英锋,马子川.渤海大学学报),2010,31(3):219-224.
[3] Wang K,Zhang J L,Ping S,Ma Q X,Chen X ,Xuan H Z,Shi J H,Zhang C P,Hu F L.J.Ethnopharmacol.,2014,155:300-311.
[4] Zhang J L,Cao X P,Ping S,Wang K,Shi J H,Zhang C P,Zheng H Q,Hu F L.Evid.BasedComplementAlternatMed.,2015,(2015):1-15.
[5] Wang X P,Lin L,Bai J Q.ShanxiJ.Agric.Sci.(王小平,林励,白吉庆.陕西农业科学),2009,(3):133-134,142.
[6] Zhou P,Zhang Z T,Hu F L,Yu X Z.J.Bee(周萍,章征天,胡福良,余秀珍.蜜蜂杂志),2005,8:5-6.
[7] Zhang C P,Huang S,Wei W T,Ping S,Shen X G,Li Y J,Hu F L.J.FoodSci.,2014,79(7):1315-1322.
[8] Zhang C P,Hu F L.J.Chin.Inst.FoodSci.Technol.(张翠平,胡福良.中国食品学报),2011,11(1):222-225.[9] Zhang C P, Zheng H Q,Liu G,Hu F L.FoodChem.,2011,127:345-350.
[10] Sheng W S,Du Q T,Li S L,Yu J H,Wang L.ApicultureofChina(盛文胜,杜青桃,李树岚,喻建辉,汪玲.中国蜂业),2008,59(3):7-8.
[11] GH/T1081-2012.Determination of Poplar Tree Gum in Propolis-Reversed-phase High Performance Liquid Chromatography Method.Industry Standard of Supply and Marketing Cooperatives of the People's Republic of China(蜂胶中杨树胶的检测方法 反相液相色谱法.中华人民共和国供销合作社行业标准).
[12] Zhang C P,Huang S,Wei W T,Ping S,Shen X G,Li Y J,Hu F L.J.FoodSci.,2014,79(7):1315-1322.
[13] Ma H L,Luo L,Lu D L,Shao X J,Ma H Y.ApiculturalScienceandTechnology(马海乐,骆琳,陆道礼,邵兴军,马海燕.养蜂科技),2005,1:36-38.
[14] Cheng H,Qin Z H,Hu X S,Wu J H.JournalofFoodSafetyandQuality(程焕,秦子涵,胡小松,吴继红.食品安全质量检测学报),2012,3(1):1-9.
[15] Yu L P,Sheng W S.J.Bee(余兰平,盛文胜.蜜蜂杂志),2006,6:3-5.
[16] Zhang Z M,Chen S P,Li T L,Huang X J,Zhang L.FoodRes.Dev.(张卓旻,陈圣平,李天麟,黄新健,张兰.食品研究与开发),2009,30(8):132-134.
Determination of Salicin,a Characteristic Component of Poplar Tree Gumby HPLC-LTQ-Orbitrap High Resolution Mass Spectrometry
ZHAO Xiao-ya*,FU Xiao-fang,LI Jing,WANG Peng,YE Cheng,SHANG Yin-zhu,ZHENG Xi-yue
(Hubei Entry-Exit Inspection and Quarantine Bureau,Wuhan 430050,China)
A method of high performance liquid chromatography(HPLC) combined with LTQ-Orbitrap XL mass spectrometry was developed for the analysis of salicin,a characteristic component of poplar tree gum in propolis.With the exact parent ion and fragment ion, whether the propolis contains poplar tree gum could be confirmed.The samples were extracted with ethyl alcohol.The LC separation was performed on a Waters xselect HSS T3(3.0 mm×100 mm,3.5 μm) column with acetonitrile-0.1% acetic acid solution as mobile phase.The analyte was detected under positive mode.The calibration curve showed a good linearity within the concentration range of 0.5-25.0 μg/mL.The average recoveries of salicin ranged from 81.6% to 91.0% at the spiked levels of 25.0,150.0,300.0 mg/kg with relative standard deviations(RSDs) less than 11.6%.The developed method was simple,sensitive and repeatable,and could be used as a screen and confirmatory approach for the analysis of salicin in propolis.
high performance liquid chromatography(HPLC);linear ion trap-orbitrap mass spectrometer(LTQ-orbitrap MS);high-resolution mass spectrometry(HRMS);propolis;poplar tree gum;salicin
2015-09-06;
2015-10-08
国家质量监督检验检疫总局科研项目计划(2013IK156)
10.3969/j.issn.1004-4957.2016.03.015
O657.72
A
1004-4957(2016)03-0342-05
*通讯作者:赵晓亚,博士,高级工程师,研究方向:食品安全检测,Tel:027-58906069,E-mail:zhaoxy@hbciq.gov.cn
