固态发酵豆渣生产反刍动物饲料工艺条件研究
2016-12-20张永根薛世崇李洋丁雪张文佳王晓帆张立阳李高
张永根,薛世崇,李洋,丁雪,张文佳,王晓帆,张立阳,李高
(东北农业大学动物科学技术学院,哈尔滨 150030)
固态发酵豆渣生产反刍动物饲料工艺条件研究
张永根,薛世崇,李洋,丁雪,张文佳,王晓帆,张立阳,李高
(东北农业大学动物科学技术学院,哈尔滨 150030)
以豆渣为原料,利用混合菌种固态发酵将其转变成一种耐贮藏、适口性强反刍动物饲料。通过L9(34)正交试验研究培养基组成、接种物配比、接种量及培养温度对发酵品质影响。结果表明,35℃最适温度下培养基组成为豆渣ϑ麦麸=7 ϑ 3,接种物配比为乳酸菌ϑ枯草芽孢杆菌=1 ϑ 1,接种量5%时为最佳工艺条件。
豆渣;固态发酵;混合菌种;反刍动物饲料;工艺条件
张永根,薛世崇,李洋,等.固态发酵豆渣生产反刍动物饲料工艺条件研究[J].东北农业大学学报,2016,47(5):76-82.
Zhang Yonggen,Xue Shichong,Li Yang,et al.Study on fermentation process of ruminant feed in soybean dregs by solidstate fermentation[J].Journal of Northeast Agricultural University,2016,47(5):76-82.(in Chinese with English abstract)
我国是世界大豆加工主要国家之一,豆渣是加工豆油、酱油、豆腐等豆制品副产物(约占全豆干重15%~20%)[1]。豆渣口感粗糙、热能低,含水量大、易腐败变质、运输困难,通常作饲料直接饲喂或废弃。微生物发酵将豆渣转化为反刍动物发酵饲料,对改善我国生态环境、解决饲料资源短缺等具有现实意义。
潘天玲等向豆渣中添加绿色木霉、黑曲霉、啤酒酵母等菌种转化豆渣纤维,发酵产物中蛋白质含量达28.47%[2]。莫重文采用在豆渣中生长良好,对纤维素和半纤维素降解率强的酱油酿造米曲霉、黑曲霉和啤酒酵母为菌种,发现发酵豆渣产品中蛋白质含量可达29.76%,比原来提高43.07%[3]。辜赖涛等利用乳酸菌、酵母菌和枯草杆菌等,对以豆渣为主的原料发酵,粗蛋白含量可达28.06%,比发酵前提高42%[4]。
然而,目前关于发酵豆渣作为动物饲料的贮存条件研究尚未见报道。因此本试验以豆渣为原料,添加麦麸降低发酵培养基底物含水率,利用枯草芽孢杆菌好氧发酵快速消耗氧气,乳酸菌厌氧发酵将其转变成耐贮藏、适口性强反刍动物饲料,改善发酵豆渣生产、运输和饲喂条件。
1 材料与方法
1.1 材料
豆渣、麦麸:购自哈尔滨市华森畜牧科技有限公司,常规营养成分见表1。
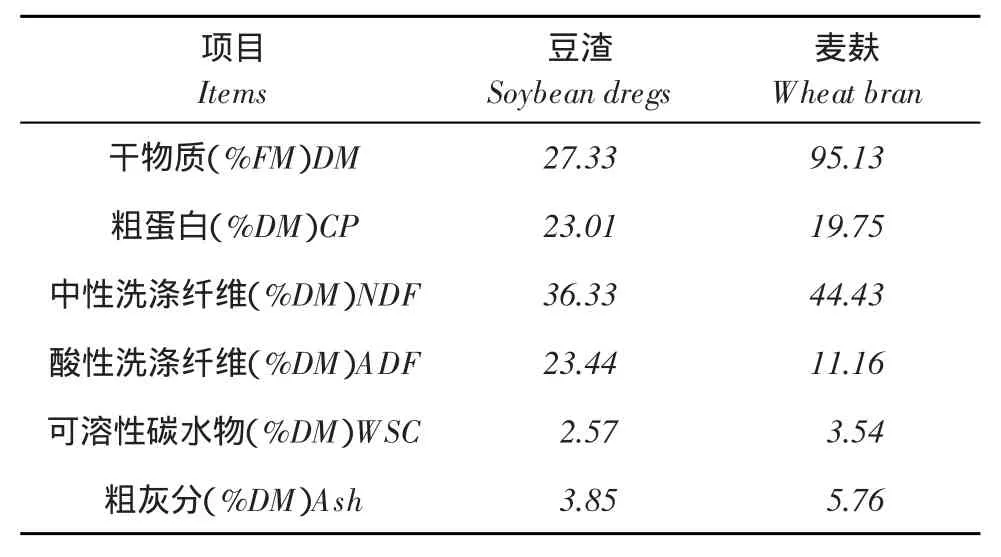
表1 豆渣和麦麸中常规营养成分Table 1Conventional nutrients of the soybean dregs and wheat bran
复合乳酸菌制剂:来自东北农业大学动物科学技术学院反刍教研室,主要成分包括干酪乳杆菌(L.casei),植物乳杆菌(L.plantarum)及布氏乳杆菌(L.buchneri),活菌数量大于1×108cfu·g-1。
枯草芽孢杆菌(Bacillus subtilis CMCC 63501):来自东北农业大学动物科学技术学院动物营养所,活菌数量大于1×106cfu·g-1。
1.2 固态发酵方法
取一定量豆渣,按照不同比例加入麦麸,并加入1%氯化钠、0.2%硫酸铵和3%尿素混合均匀。接种不同比例复合乳酸菌制剂和枯草芽孢杆菌,混合均匀后分别装进聚乙烯袋(规格为300 mm×200 mm)抽真空后封口,每袋500 g,每组6个重复。选择不同发酵温度,培养45 d,发酵结束后开袋取样,检测分析固态发酵豆渣发酵品质。
1.3 正交试验设计
选择培养基组成、接种物配比、接种量及培养温度4个因素,各取3个水平,以发酵产物的费氏评分作为考查指标,进行L9(34)正交试验,试验因素和水平见表2。
1.4 测定指标和方法
1.4.1 发酵指标测定
固态发酵45 d后开袋取样,混匀各处理组发酵产物,采用四分法分别取10 g样品,每组3个重复。加入蒸馏水90 mL置于4℃冰箱保存,样品浸泡24 h后过滤,测定上清液pH。取另1份上清液,分别测定氨态氮、乳酸及挥发性脂肪酸含量,氨态氮含量采用苯酚—次氯酸钠方法测定[5],乳酸含量采用Waters—600高效液相色谱仪测定[6],挥发性脂肪酸含量采用日本岛津GC—2010气相色谱仪测定[7]。

表2 正交试验因素水平Table 2Factors and the levels of orthogonal test
发酵豆渣品质依据Kilica提出费氏评分法综合打分,评分80~100为优等、60~80为良好、40~60为尚可、20~40为差、0~20为极差,共5个级别[8]。
1.4.2 发酵前后饲料中微生物数量测定
分别在固态发酵后第5、7、15、30和45天开袋取样,混匀各处理组发酵产物,采用四分法分别取10 g样品,每组3个重复。加入无菌生理盐水90 mL,经30 min浸泡后,吸取各样品浸泡液并逐级稀释,涂布法测定乳酸菌、枯草芽孢杆菌、酵母菌以及霉菌数量。MRS培养基测定乳酸菌数量,37℃下厌氧培养48 h后计数,LB培养基测定枯草芽孢杆菌数量,37℃下培养24 h后计数,马铃薯—葡萄糖—琼脂培养基测定酵母菌和霉菌数量,28℃下培养48 h后计数[9]。计数单位为每克发酵饲料中所含菌落形成单位[lg(cfu·g-1)]。
1.4.3 有氧稳定性试验
固态发酵结束后,取0.5 kg左右发酵产物置于不封口自封袋,暴露在空气中,通过检测发酵豆渣饲料温度,考查其二次发酵情况。室温条件下,每隔2 h测试自封袋内发酵豆渣温度,连续记录15 d,当中心温度在室温基础上升高2℃时认为呈不稳定状态,并测定其pH。
2 结果与分析
2.1 不同处理对固态发酵豆渣感官评定影响
9个试验组在45 d发酵结束后均未出现腐败气味,其中7、8、9三组具有较浓芳香酸味,同时呈褐色,相比其他6组颜色偏深。由表3可知,1、2、3三组水分含量高于其他6个试验组。
2.2 不同处理对固态发酵豆渣中微生物数量影响
由表4可知,在固态发酵过程中,乳酸菌含量在第5天时最多,此后逐渐降低,并趋于稳定。由表5可知,枯草芽孢杆菌数量随发酵时间延长小幅降低。由表6可知,在经过45 d发酵后,各组中均存在不同数量酵母菌,但数量小于3×103cfu·g-1;除第5、7、9组外,其余六组均存在不同数量霉菌,第2组霉菌数量最大为1.2×104cfu·g-1。
2.3 不同处理对固态发酵豆渣的发酵指标影响
由表7可知,各组pH均低于4.40,其中第6组pH最低为4.05。第4组氨态氮/总氮最低,且低于5%。各组乙酸含量相当,但7、8两组乳酸含量较高,乳酸/总酸也较高。根据各处理组费氏评分可知,除第3组为良好外,其余8个处理组等级均为优等。

表3 不同处理组中水分含量Table 3Moisture contents of different treatments(%)

表4 不同处理对固态发酵豆渣中乳酸菌数量影响Table 4Effects of different treatments on the number of lactic acid bacteria in soybean dregs by solid-state fermentation(lg cfu·g-1)
2.4 正交试验结果与分析
在表2确定主要影响因素和水平基础上进行正交试验,试验结果见表8。由表8可知,最好的试验组合为A3B1C1D2,即最佳工艺条件为培养基组成豆渣ϑ麦麸=7 ϑ 3,接种物配比复合乳酸菌制剂ϑ枯草芽孢杆菌=1 ϑ1,接种量为5%,培养温度35℃。
放眼望去景德镇现在陶瓷行业杂乱无章,零零散散,没有规划,大量能工巧匠在家歇业,只能打麻将、吃吃喝喝,这是要技艺失传的节奏。只有景德镇陶瓷大学学生和外来景漂在兢兢业业的为瓷器耕耘,从具有一定特色的陶溪川所吸纳的人才群体就看的出来,都是院校派师生。
另外,由R值分析可知,RA>RC>RB>RD,即4个因素对费氏评分的影响程度从大到小依次是培养基组成、接种量、接种物配比、发酵温度。因此在固态发酵过程中要优先考虑培养基组成。
2.5 有氧稳定性试验结果
一般在有氧稳定性试验中,pH达到5即已二次发酵,达到5.5则无法饲喂[10]。由表9可知,9个处理组的pH在第9天均小于5,而第3组pH在第11天时大于5,第13天时大于8,相比其他处理,有氧稳定性最差,与该组较低的费氏评分相一致。

表5 不同处理对固态发酵豆渣中枯草芽孢杆菌数量影响Table 5Effects of different treatments on the number of Bacillus subtilis in soybean dregs by solid-state fermentation (lg cfu·g-1)

表6 固态发酵结束不同试验组中酵母菌和霉菌数量Table 6Number of yeast and mold in different treatments after solid-state fermentation (lg cfu·g-1)

表7 不同处理对固态发酵豆渣的发酵指标影响(鲜重基础)Table 7Effects of different treatments on fermentation indices in soybean dregs by solid-state fermentation(Fresh weight basis)

表8 正交试验设计及结果Table 8Design and results of the orthogonal test
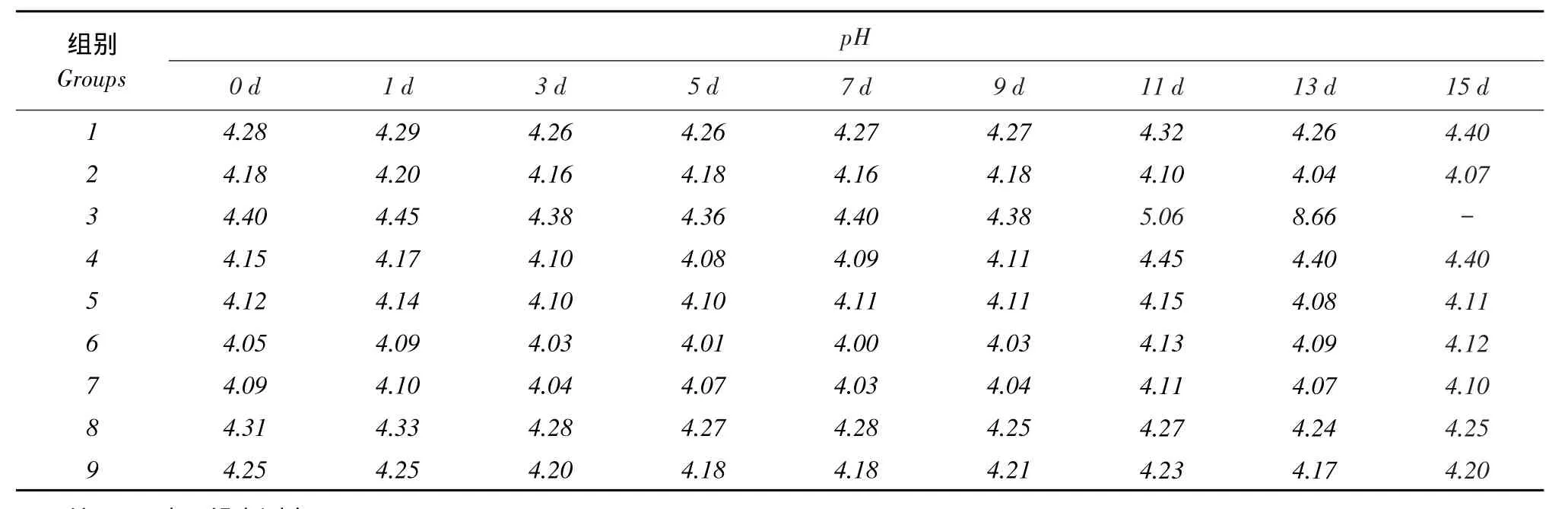
表9 不同处理组开袋后pH随天数变化Table 9Changes of different treatments on pH after solid-state fermentation
3 讨论
3.1 不同处理对固态发酵豆渣发酵品质影响
3.1.1 不同处理对固态发酵豆渣感官评定影响
辜澜涛等关于混合菌种对豆渣发酵品质改善效果的研究认为,豆渣经厌氧发酵后,颜色和气味发生明显变化,得到呈褐色,有曲香味良好品质豆渣发酵品[4]。本试验中,各组颜色和气味在发酵前后均发生明显变化,出现不同程度酸香气味,无臭味或刺鼻异味,发酵成功。其中7、8、9三个处理组由于麦麸添加比例最大,发酵豆渣褐色最深,酸香味最为浓郁。
3.1.2 不同处理对固态发酵豆渣中微生物数量影响
同时,根据国家标准(GB/T 13092)饲料中霉菌总数允许量为4.50×104cfu·g-1,本试验所有处理组中霉菌总数最高为1.2×104cfu·g-1,低于国家标准(GB/T 13092)最高允许量,说明发酵豆渣饲料安全。
3.1.3 不同处理对固态发酵豆渣的发酵指标影响
发酵饲料pH、氨态氮/总氮以及有机酸(乳酸、乙酸、丙酸、丁酸)含量,是评定饲料品质重要指标。由表7可知,经过45 d发酵,各组pH介于4.0~4.4,属于理想pH范围[13]。氨态氮/总氮直接反映发酵原料在发酵过程中蛋白质被分解程度,本试验中各处理组比值均小于8%,说明只有少量蛋白质被分解,发酵效果较好。
有机酸可优化发酵饲料品质,有机酸总量及其构成则反映饲料发酵过程好坏,其中乳酸、乙酸和丁酸最重要。在贮存发酵过程中,乙酸是有效抗菌成分,能抑制酵母和霉菌活动[14],提高有氧稳定性。乳酸所占比例越大,丁酸所占比例越小,发酵饲料品质越好。本试验中未检测到丁酸含量[15],各组有机酸获得较高的费氏评分。管武太等研究表明[16],在高粱青贮中添加乳酸菌制剂能显著提高乳酸含量,降低乙酸、丁酸和丙酸含量,改善发酵品质,与本试验结果一致。
3.2 正交试验结果
培养基底物、接种物配比、接种量、发酵温度等因素对发酵效果有重要影响[17]。本试验豆渣含水量较大,质地湿黏,添加部分麦麸作为固态发酵培养底物,一方面可以调节水分,另一方面可以为微生物生长提供所需碳源和氮源。从表8可知,对发酵效果影响最大因素是培养基底物组成,随麦麸添加量增加,发酵产物费氏评分升高。考虑生产成本,在最佳发酵工艺基础上,豆渣和麦麸的比例可调整为8 ϑ 2,甚至是9 ϑ 1,在生产理想发酵产物同时,缩减生产成本。
试验所选用乳酸菌和枯草芽孢杆菌均为益生菌,可促进动物对饲料消化、吸收、利用,提高饲料转化率,在防病促生长中起重要作用[18]。本试验中,通过固态发酵,一方面乳酸菌和枯草芽孢杆菌利用发酵底物提供的氮源和碳源繁殖和生长,使豆渣pH迅速降低,改善饲料发酵品质;另一方面微生物发酵过程中积累大量营养丰富菌体蛋白及微生物代谢产物,间接提高发酵产物营养价值。由正交试验结果可知,随乳酸菌添加比例升高,发酵产物品质降低。本试验中选用乳酸菌和枯草芽孢杆菌接种比例为1 ϑ1,接种量为5%,此接种比例是混菌最佳共生状态。
菌体生长随温度变化而改变,温度高生长快,温度低生长慢,但温度过高会对微生物生长产生一定阻力[19]。由R值分析可知,本试验中发酵温度对发酵品质影响最小,最适宜发酵温度为35℃。
3.3 不同处理对固态发酵豆渣有氧稳定性影响
当贮存饲料暴露于空气中后,贮存环境从厌氧转变为有氧状态,大量休眠微生物增殖活动加强,表现为温度升高[20]。一般认为饲料中心温度超过室温2℃,即为不稳定状态,有氧稳定性是衡量贮存料在开袋接触空气后质量指标[21]。而本试验在测定发酵产物有氧稳定性时,试验环境温度变化较大,对各试验组温度变化影响较大,无法根据温度变化评价各试验组有氧稳定性,因此选择pH值作为衡量有氧稳定性指标。导致pH升高的原因,主要为以下三方面:①饲料腐败后氨基酸发生分解代谢,产生游离氨对pH升高起一定作用;②梭菌发酵引起pH升高;③丁酸菌也会将碳水化合物和有机酸氧化酵解产生丁酸,丁酸酸性明显弱于乳酸,导致pH升高。
张宁等将乳酸菌制剂添加鲜稻秸中[22],检测其对青贮品质及有氧稳定性影响。通过测定青贮饲料二次发酵过程中温度以及发酵后pH、干物质和有机酸含量,可知乳酸菌制剂延长水稻秸青贮稳定期。Nishino等研究,布氏乳杆菌属于异型发酵,在厌氧情况下可将部分乳酸转化成乙酸,乙酸抑制酵母菌和霉菌生长,推迟二次发酵时间[23],与本试验结果一致。
4 结论
以豆渣和麦麸为原料,添加复合乳酸菌和枯草芽孢杆菌固态发酵,使其转变为低pH、耐贮存的反刍动物饲料方案切实可行。综合感官评定和发酵品质指标确定,固态发酵最佳工艺条件:培养基组成中豆腐渣ϑ麦麸=7 ϑ 3,接种物配比是乳酸菌ϑ枯草芽孢杆菌=1 ϑ 1,接种量为5%,发酵温度为35℃。
[1]Liu X B,Jin J,Wang G H,et al.Soybean yield physiology and development of high-yielding practices in Northeast China[J].Field Crops Research,2008,105:157-171.
[2]潘天玲,张东峰,赵昌盛,等.混菌固态发酵豆渣生产菌体蛋白的研究[J].化学与生物工程,2004(6):35-41.
[3]莫重文.混合菌发酵豆渣生产蛋白质饲料的研究[J].中国饲料,2007,14:36-38.
[4]辜澜涛,张光琦,宋德贵.混合菌发酵豆渣检测其粗蛋白变化情况[J].广西师范大学学报,2011,29(3):80-83.
[5]Salawu M B,Acamovic T,Stewart C S,et al.The use of tannins as silage additives:effects on silage composition and mobile bag disappearance of dry matter and protein[J].Animal Feed Science and Technology,1999,82(3/4):243-259.
[6]卢定强,徐蓓,李晖,等.反相高效液相色谱法同时测定乳酸及乳酸甲酯[J].精细化工,2007,24(2):206-208.
[7]刘丹丹.不同浓度绿汁发酵液和脱氢乙酸钠对青贮水稻秸品质和有氧稳定性的影响[D].哈尔滨:东北农业大学,2008.
[8]Kilica.Silage feed[M].Turkey:Bilgehan Press,1986.
[9]Whiter A G,Kung L.The effect of a dry or liquid application of Lactobacillus plantarum MTD1 on the fermentation of alfalfasilage [J].Journal of Dairy Science,2001,84(10):2195-2202.
[10]刘祯,李胜利,余雄,等.青贮添加剂对全株玉米青贮有氧稳定性的影响[J].中国奶牛,2012,20:26-29.
[11]王文梅,许丽,马卓,等.乳酸菌制剂的作用机制及其在禽类生产中的应用[J].东北农业大学学报,2013,44(3):146-150.
[12]徐鹏,董晓芳,佟建明.微生物饲料添加剂的主要功能及其研究进展[J].动物营养学报,2012,24(8):1397-1403.
[13]杨洁彬,郭兴华,凌代文,等.乳酸菌——生物学基础及应用[M].北京:中国轻工业出版社,1996.
[14]Moon N J.Inhibition of the growth of acid tolerant yeasts by acetate,lactate and propionate and their synergistic mixtures[J]. Journal of Applied Microbiology,1983,55(3):453-460.
[15]Mcdonald P.The biochemistry of silage[M].USA:Chalcombe Publications,1991.
[16]管武太,Ashbell G,Heng Y,等.微生物添加剂对青贮高粱发酵品质和稳定性的影响[J].中国农业科学,2002,35(11):1401-1405.
[17]张薇薇,张永根,刘震,等.响应面法优化马铃薯固态发酵生产奶牛饲料工艺条件研究[J].东北农业大学学报,2013,44(12): 113-118.
[18]张爱武,薛军.枯草芽孢杆菌在动物生产中的应用效果[J].中国畜牧兽医,2011,38(4):234-238.
[19]郭维烈,郭庆华.新型发酵蛋白饲料[M].北京:科学技术文献出版社,2000.
[20]Davies D R,Fychan R,Jones R.Aerobic deterioration of silage: causes and controls[C]//Nutritional biotechnology in the feed and food industries.Proceeolings of Alltech's 23rd Annual Symposium.The New Energy Crisis:Food,Feed or Fuel,2007:227-238. [21]Kleinschmit D,Schmidt R,Kung J R L.The effects of various antifungal additives on the fermentation and aerobic stability of corn silage[J].Journal of Dairy Science,2005,88(6):2130-2139.
[22]张宁,张永根,李欣新,等.添加2种乳酸菌制剂对水稻秸青贮品质及有氧稳定性的影响[J].中国畜牧杂志,2013,49(5):72-75.
[23]Nishino N,Yoshida M,Shiota H.Accumulation of 1,2-propanediol and enhancement of aerlbic stability in whole crop maize silage inoculated with Lactobacillus buchneri[J].Journal of Applied Microbiology,2003,94:800-807.
Study on fermentation process of ruminant feed in soybean dregs by solid-state fermentation
ZHANG Yonggen,XUE Shichong,LI Yang,DING Xue,ZHANG Wenjia,WANG Xiaofan,ZHANG Liyang,LI Gao
(School of of Animal Sciences and Technology, Northeast Agricultural University,Harbin 150030,China)
This experiment was aimed to use the soybean dregs as raw materials and transform them into a ruminant feed with good palatability and resistant storage by solid-state fermentation of mixed bacteria.The effects of the composition of fermentation stuff,the ratio of inoculating bacteria,the quantity of inoculation and the temperature of fermentation on the quality of fermented soybean dregs were researched by L9(34)orthogonal test.It had been showed that the optimum conditions of the fermentation process were as follows.Soybean dregs ϑwheat bran=7 ϑ3,lactic acid bacteria ϑBacillus subtilis=1 ϑ 1,quantity of inoculation was 5%and optimal temperature was 35℃.
soybean dregs;solid-state fermentation;mixed bacteria;ruminant feed;technological conditions
S816
A
1005-9369(2016)05-0076-07
2015-07-07
国家奶牛产业技术体系项目(CARS-37)
张永根(1962-),男,教授,博士,博士生导师,研究方向为反刍动物生产。E-mail:zhangyonggen@sina.com
时间2016-5-27 14:15:52[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160527.1415.022.html
