传染性喉气管炎病毒gD蛋白多克隆抗体制备与运用
2016-12-20张晓彩赵妍张雪梅刘胜旺
张晓彩,赵妍,张雪梅,刘胜旺
(中国农业科学院哈尔滨兽医研究所,兽医生物技术国家重点实验室,禽呼吸道病创新团队,哈尔滨 150001)
传染性喉气管炎病毒gD蛋白多克隆抗体制备与运用
张晓彩,赵妍,张雪梅,刘胜旺*
(中国农业科学院哈尔滨兽医研究所,兽医生物技术国家重点实验室,禽呼吸道病创新团队,哈尔滨 150001)
鸡传染性喉气管炎(Infectious laryngotracheitis,ILT)是由传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)引起的一种急性接触性上部呼吸道病。ILTV表面糖蛋白gD能刺激机体产生良好体液和细胞免疫应答,编码该蛋白的gD基因是ILTV主要抗原性基因之一。以ILTV-LJS09株基因组为模板,PCR扩增gD基因主要抗原区域(54~344 aa)及gD基因,分别亚克隆至pGEX-6P-1和pCAGGS载体,构建原核表达载体pGEX-6P-1-gD163/1032和真核表达载体pCAGGS-gD。利用纯化ILTV、原核表达纯化获得重组蛋白r-gD和真核质粒pCAGGS-gD,对新西兰大白兔进行免疫与加强免疫,制备兔抗ILTV gD多克隆抗体。通过间接免疫荧光试验确定ILTV gD多克隆抗体和ILTV感染的鸡肝癌细胞表达蛋白发生反应,表明制备的ILTV gD多克隆抗体能识别ILTV天然抗原表位,最佳稀释度为1 ϑ 1 000;用ILTV感染的LMH细胞培养物进行Western Blot分析,在40 ku左右出现一条特异性条带,与预期ILTV gD蛋白大小相符。激光共聚焦定位感染鸡肝癌细胞中ILTV gD蛋白,发现ILTV gD蛋白主要表达于感染细胞胞浆及融合细胞交界处。
ILTV gD蛋白;原核表达与纯化;真核表达;多克隆抗体;细胞定位
张晓彩,赵妍,张雪梅,等.传染性喉气管炎病毒gD蛋白多克隆抗体制备与运用[J].东北农业大学学报,2016,47(5):69-75.
Zhang Xiaocai,Zhao Yan,Zhang Xuemei,et al.Preparation of polyclonal antibodies against gD protein of ILTV and application[J].Journal of Northeast Agricultural University,2016,47(5):69-75.(in Chinese with English abstract)
鸡传染性喉气管炎(Infectious laryngotracheitis,ILT)是由鸡传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)引起的一种急性呼吸道传染病[1]。以呼吸困难、喘气、咳出血样分泌物、受侵害气管黏膜细胞肿胀和水肿、出血并导致糜烂为特征,在急性暴发时发病率为100%,死亡率高达70%,导致鸡死亡和产蛋量下降,是危害养禽业重要疫病之一[2]。
ILTV属于α-疱疹病毒亚科,基因组大小为155 kb,由一个长独特区(UL,110 kb)和一个短独特区(US,14 kb),及US区两侧的反向重复序列(IRS和TRS,各15 kb)组成[3]。ILTV仅一种血清型,但可表现不同毒力,与其他疱疹病毒不同,ILTV宿主范围窄,只感染鸡,偶尔感染野鸡,火鸡不能被自然感染,其他种类宿主未知。
gD糖蛋白由ILTV保守区US6基因编码,是ILTV病毒粒子表面和病毒感染细胞主要分子之一,在病毒复制和诱导宿主体内发生免疫应答反应时必需,且在疱疹病毒糖蛋白中gD蛋白较gB和gC能引起更持久免疫反应[4]。Johnson等报道ILTV SA-2株gD基因序列[5],但gD基因功能不明,有关糖蛋白gD研究很少,感染细胞分布部位和功能尚待研究。范薇对鸭瘟病毒gD蛋白进行亚细胞定位研究,发现gD蛋白主要定位在细胞核以外部分[6],孙永珍等研究ILTV gC蛋白定位,发现gC蛋白存在于细胞浆和细胞膜上[7]。但目前尚未对ILTV gD蛋白定位展开研究。
由于目前尚无针对ILTV gD蛋白商品化抗体,因此本研究以纯化ILTV、原核表达纯化获得重组蛋白r-gD和真核质粒pCAGGS-gD为免疫原,免疫新西兰大白兔,制备ILTV gD多克隆抗体。利用激光共聚焦方法初步鉴定ILTV gD蛋白在感染鸡肝癌细胞(Hepatocellular carcinoma epithelial cell line,LMH)中定位。本研究制备ILTV gD多克隆抗体在病原生物学特性及抗原性研究、检测与鉴别诊断等方面具有重要价值,为ILTV gD蛋白生物学特性及ILTV感染机制研究提供试验材料。
1 材料与方法
1.1 试验动物
健康清洁级新西兰雄性大白兔2只,体重2 kg·只-1,购自哈尔滨医科大学附属第二医院实验动物中心。
1.2 病毒及阳性血清
ILTV-LJS09毒株由中国农业科学院哈尔滨兽医研究所禽呼吸道病创新团队分离并保存;ILTV阳性血清由本研究所制备。
1.3 菌株、载体、细胞及主要试剂
大肠杆菌TG1、BL21感受态细胞、pGEX-6P-1、pCAGGS载体、幼仓鼠肾细胞(A BHK-derived cell line,BSR)和鸡肝癌细胞(LMH)由哈尔滨兽医研究所禽呼吸道病创新团队保存。Protein Ladder购自Thermo公司;T4DNA Ligase、限制性内切酶均购自TaKaRa公司;基因组提取试剂盒、质粒DNA小量提取试剂盒、凝胶回收试剂盒均购自Axygen公司;兔源GST抗体、红外标记山羊抗兔IgG、红外标记兔抗鸡IgY,FITC-羊抗兔IgG,TRITC-山羊抗兔IgG、FITC-兔抗鸡IgY等均购自北京中杉金桥生物技术有限公司。GST树脂购自MERCK公司,蛋白裂解液、5×SDS-PAGE Loading Buffer购自碧云天公司。
1.4 病毒增殖与基因组提取
ILTV-LJS09毒株感染单层LMH细胞,当细胞病变达到80%时收集细胞培养物,冻融3次后按照基因组DNA提取试剂盒说明书操作,提取DNA在-20℃保存备用。
1.5 引物设计与基因扩增
根据本研究所对ILTV-LJS09毒株全基因组序列(登录号:JX458822.1)测定结果,利用DNAStar protean软件分析gD蛋白抗原性、亲水性和表面可及性(见图1),选择抗原性强区段原核表达,gD基因全长扩增用于构建真核表达载体。采用PrimerPrimer 5.0软件设计引物(详见表1)序列中划线部分为引入酶切位点。引物由华大科技有限公司合成。
以提取ILTV-LJS09株基因组DNA为模板分别PCR扩增gD163/1032片段和gD基因全长。反应体系:10×Ex Taq Buffer(Mg2+Plus)2.5 μL,dNTP(各2.5 mmol·L-1)2.0 μL,引物(10 pmol·μL-1)各1 μL,模板(300 ng·μL-1)4 μL,Ex Taq(5 U·μL-1)0.3 μL,加ddH2O至25 μL。反应条件:95℃5 min;94℃10 s;59.3℃12 s;72℃1min,35个循环;72℃7 min;4℃∞。PCR产物用0.8%琼脂糖凝胶电泳鉴定,使用凝胶回收试剂盒纯化PCR产物。

图1 目的基因抗原性分析Fig.1Antigenic analysis of the gD gene

表1 gD扩增引物Table 1Primers for gD
1.6 原核表达载体pGEX-6P-1-gD163/1032和真核表达载体pCAGGS-gD构建与鉴定
将纯化后gD163/1032和gD全基因分别以XhoⅠ和Eco RⅠ酶切、连接到以相同酶切处理原核表达载体pGEX-6P-1和真核表达载体pCAGGS中。获得质粒分别命名为pGEX-6P-1-gD163/1032和pCAGGS-gD,由华大科技有限公司序列测定。
1.7 原核表达载体pGEX-6P-1-gD163/1032诱导表达、纯化及鉴定
将阳性重组质粒pGEX-6P-1-gD163/1032转化BL21感受态细胞,挑取单个菌落,次日以1 ϑ 100比例接入新鲜LB培养基,于37℃培养箱培养OD600至0.4时,加入终浓度为1 mmol·L-1的IPTG,诱导表达4 h。离心收集菌体,加适量PBS将菌体重悬,超声破碎后,离心分别收集上清和沉淀,将获得重组蛋白r-gD进行SDS-PAGE分析。将蛋白凝胶转印硝酸纤维素(NC)膜,过夜封闭后Western Blot分析。以5%脱脂乳封闭过夜,一抗分别为兔抗GST抗体(1 ϑ5 000)和ILTV阳性血清(1 ϑ100),37℃2 h,二抗分别为红外标记山羊抗兔IgG和红外标记兔抗鸡IgY,37℃作用1 h,以红外荧光扫描成像系统观察并记录结果。
GST树脂按说明书要求处理平衡后,将超声后离心过滤重组蛋白上清倒入树脂中,每5 min旋转一次柱子,1 h后用10倍柱体积PBS洗涤树脂,并以适量Elution Buffer洗脱目的蛋白,测定蛋白浓度,分装,-70℃保存备用。
1.8 真核表达载体pCAGGS-gD大量制备纯化与瞬时表达的IFA鉴定
SDS碱裂解法大量制备真核表达载体pCAGGS-gD,并测定纯度与浓度。将纯化pCAGGS-gD转染BSR细胞,48 h后无菌PBS洗4次,然后用冰冷无水乙醇4℃条件固定细胞,20 min后含Tween-20 PBS洗4次,ILTV阳性血清(1 ϑ 100)作为一抗,FITC-兔抗鸡IgY(1 ϑ 5 000)为二抗,倒置荧光显微镜观察并记录结果。
1.9 多克隆抗体制备
首先将纯化ILTV(哈尔滨兽医研究所禽呼吸道病创新团队制备)以背部分点注射方式免疫新西兰大白兔,免疫前采血,分离阴性血清备用。2周后,将纯化重组蛋白r-gD与弗氏完全佐剂等量混合,以相同方式免疫,1 mg·只-1。2周后,以大量制备并纯化的pCAGGS-gD 0.5 mg·只-1按相同的免疫方式进行第三次免疫。三次免疫后,再以纯化重组蛋白r-gD加强免疫,并于加强免疫后第7天心脏采血,分离血清,分装,-70℃保存备用。
1.10 IFA检测ILTV gD多克隆抗体与LMH细胞中ILTV反应
ILTV-LJS09感染单层LMH细胞,待80%病变后固定细胞,以10倍倍比稀释gD多克隆抗体作一抗,以FITC-羊抗兔IgG为二抗,同时设置未接毒细胞作阴性对照,在倒置荧光显微镜下观察结果,确定抗体最佳稀释度。
1.11 Western Blot测定ILTV gD多克隆抗体特异性
ILTV-LJS09感染单层LMH细胞,待80%病变后收集细胞,12 000 r·min-1离心10 min,加适量蛋白裂解液作用15 min,然后加5×SDS-PAGE Loading Buffer沸水中煮5 min,SDS-PAGE分析。将蛋白凝胶转印NC膜,过夜封闭后Western Blot分析。以ILTV gD多抗作为一抗,红外标记的山羊抗兔IgG(1 ϑ 15 000)为二抗,用红外荧光扫描成像系统记录结果,确定抗体最佳稀释度。
1.12 ILTV gD蛋白在LMH细胞定位
在乌龙矶水库除险加固工程设计中,对弃土弃渣场布局进行了合理规划,以减少对环境的影响。弃土弃渣结束后,进行覆土、整平等土地整治,覆土土料来源为弃土和弃渣场原有表土,弃土弃渣时要求下渣上土,以满足植被恢复的基本要求。弃土弃渣场土地整治完成后,采取栽种植物进行植被恢复,根据弃渣形态和成分,种植较易成活的树种和覆盖草皮。
ILTV-LJS09感染LMH细胞,待感染细胞出现明显病变后,PBS洗3次,以80%丙酮于-40℃固定细胞30 min,gD多克隆抗体(1 ϑ100)一抗,TRITC-山羊抗兔IgG(1 ϑ 200)为二抗,DAPI染细胞核,将未感染病毒细胞作对照,激光共聚焦扫描系统并记录结果。
2 结果与分析
2.1 ILTV gD蛋白抗原性分析结果
DNAStar软件中protean分析gD蛋白亲水性、抗原性和表面可及性(见图1),选择抗原性强区段原核表达。
2.2 目的基因gD163/1032和gD的PCR扩增结果
ILTV-LJS09毒株基因DNA为模板,分别PCR扩增gD163/1032(见图2A)和gD基因(见图2B),经琼脂糖凝胶电泳分析,结果可见gD基因PCR扩增为1 100 bp左右的片段,gD163/1032扩增为880 bp片段,条带均与预期结果相符。

图2 gD163/1032与gD基因PCR扩增Fig.2Amplification of gD163/1032 and gD gene by PCR
2.3 原核表达载体pGEX-6P-1-gD163/1032和真核表达载体pCAGGS-gD构建与鉴定结果
2.4 原核表达载体pGEX-6P-1-gD163/1032诱导表达、纯化及鉴定
SDS-PAGE分析表明,重组蛋白大小约为58 ku,与预期序列一致;重组蛋白存在于超声上清中,说明重组蛋白以可溶性蛋白形式存在(见图4);经GST标签树脂纯化得到重组蛋白r-gD。重组蛋白与GST标签抗体(见图5A)和ILTV阳性血清(见图5B)发生特异性反应,出现一条明显反应条带,表明表达产物具有良好反应原性。
2.5 真核表达载体pCAGGS-gD瞬时表达IFA鉴定结果
通过在倒置荧光显微镜下观察,可见转染真核表达载体pCAGGS-gD的BSR细胞与ILTV全病毒抗血清作用后出现绿色荧光,而转染pCAGGS载体的BSR细胞对照未见绿色荧光,结果表明:真核表达载体pCAGGS-gD能在BSR细胞中高效表达gD蛋白(见图6)。
2.6 IFA检测ILTV gD多克隆抗体与LMH细胞中ILTV反应
将制备的ILTV gD多抗10倍倍比稀释进行IFA检测,结果表明,ILTV gD多克隆抗体可和ILTV感染的LMH细胞表达的蛋白发生反应,并且ILTV gD多克隆抗体在1 ϑ 10、1 ϑ 100、1 ϑ 1 000、1 ϑ 10 000稀释时均可以和ILTV蛋白发生反应,确定用于IFA分析时一抗最佳稀释倍数是1 ϑ1 000(见图7),ILTV gD多克隆抗体效价大于1 ϑ 1 000。
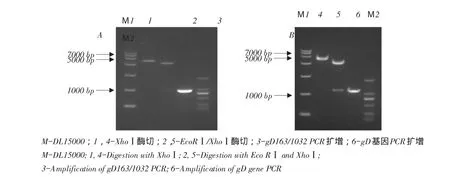
图3 重组质粒pGEX-6P-1-gD163/1032和pCAGGS-gD鉴定Fig.3Identification of plasmids pGEX-6P-1-gD163/1032 and pCAGGS-gD by digestion and PCR

图4 重组蛋白r-gD表达及纯化产物SDS-PAGE分析Fig.4SDS-PAGE analysis of the expressed and purified recombinant protein r-gD

图5 不同抗体鉴定重组蛋白r-gD的Western Blot分析Fig.5Western Blot analysis of recombinant protein r-gD by different antibodies

图6 IFA检测pCAGGS-gD瞬时表达Fig.6Identification of the transient expression of plasmid pCAGGS-gD by IFA

图7 IFA检测ILTV gD多克隆抗体最佳稀释度Fig.7gD antibody best dilution determined by immunofluorescence assay
2.7 Western Blot分析ILTV gD多克隆抗体特异性
将感染ILTV-LJS09的LMH细胞刮下,以制备的多抗为一抗进行Western Blot分析,结果显示在40 ku左右出现一条特异性条带(见图8),大小与预期ILTV gD蛋白相符。
2.8 ILTV gD蛋白在LMH细胞的定位分析
ILTV-LJS09感染LMH细胞,待出现病变后将细胞固定,免疫荧光染色,DAPI染核,在激光共聚焦成像系统观察gD蛋白在细胞中定位。结果发现,gD蛋白主要表达于感染细胞胞浆及融合细胞胞浆中(见图9)。

图8 Western Blot检测ILTV gD多克隆抗体特异性Fig.8Western Blot analysis of gD antibody specificity
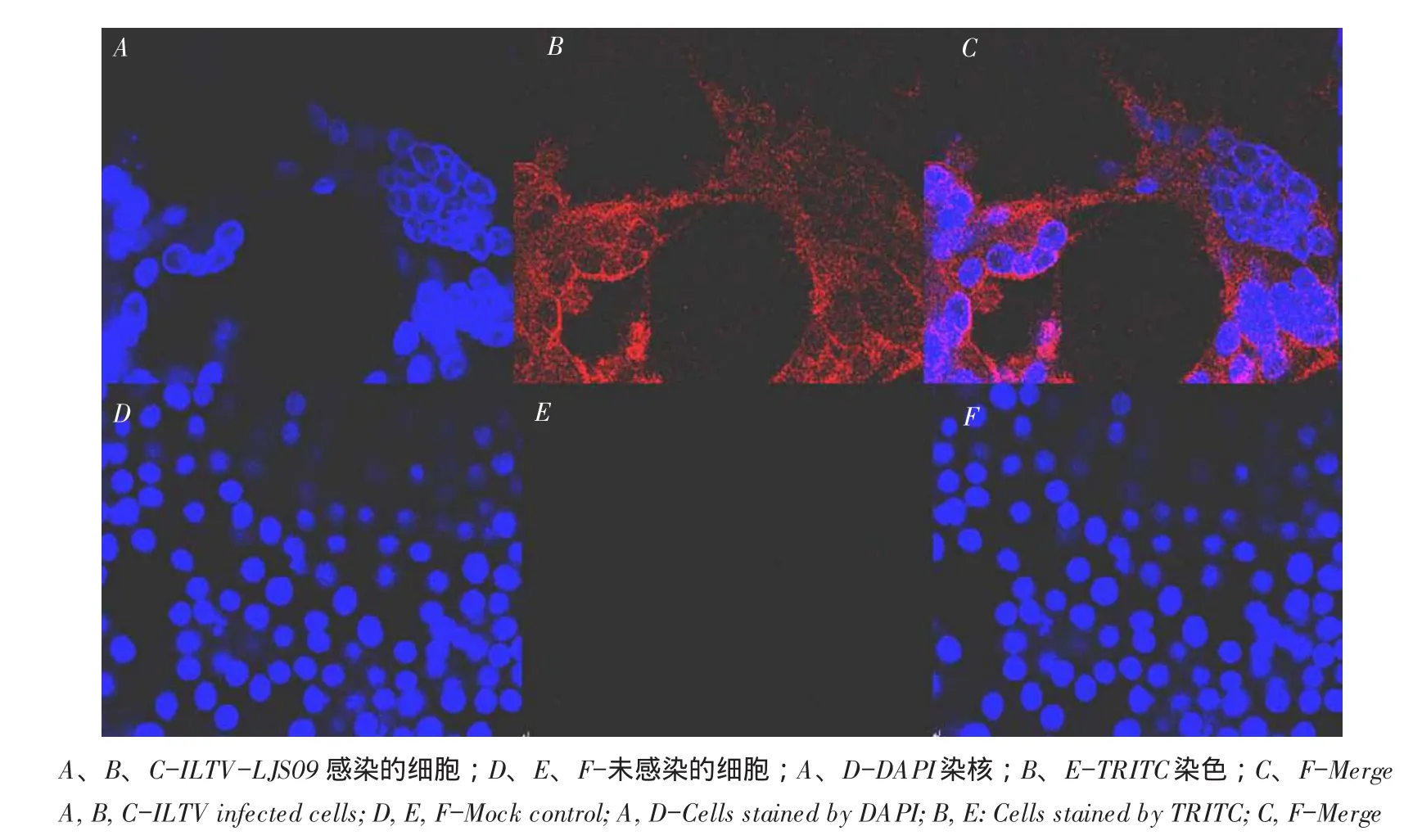
图9 激光共聚焦检测ILTV-LJS09 gD蛋白在LMH上分布Fig.9LSCM observation of ILTV-LJS09 gD protein in LMH cells
3 讨论
本试验应用DNAStar软件分析gD蛋白跨膜结构、亲水性、抗原性,选择抗原性较强区域作目的片段,比较分析15株ILTV gD氨基酸序列,选择氨基酸相对较保守区域(gD 54~344 aa)制备多克隆抗体,获得的ILTV gD多克隆抗体具有广谱性。IFA试验结果表明,本研究获得的ILTV gD多克隆抗体与ILTV感染LMH细胞表达的蛋白发生反应,表明制备的ILTV gD多克隆抗体能识别ILTV天然抗原表位,所获抗体在1 000倍稀释时检测效果最佳;用ILTV感染LMH细胞培养物进行Western Blot分析,结果表明,仅40 ku出现特异性条带,与预期ILTV gD蛋白大小相符,证明本研究制备多克隆抗体主要识别ILTV gD蛋白。大部分学者在制备多克隆抗体时采用直接免疫蛋白或免疫质粒,本研究首次尝试通过三种不同形式抗原交替免疫方式,即ILTV、纯化r-gD重组蛋白、真核表达载体,首次免疫使用纯化ILTV,使机体产生能识别ILTV天然抗原表位抗血清,再利用重组蛋白r-gD和真核表达质粒pCAGGS-gD加强免疫,针对ILTV gD蛋白抗体含量显著提高,试验结果证明该免疫程序可以获得高效价、高特异性多克隆抗体。本试验利用激光共聚焦检测gD蛋白在细胞中分布,发现gD蛋白在分散的单个细胞中含量少,在融合细胞的细胞浆和细胞膜上分布较多且集中。gD蛋白在LMH细胞中定位与疱疹病毒糖蛋白在感染细胞中分布一致[8-10]。
ILT作为危害养禽业发展的重要疾病之一,对该病毒生物学特性研究及新型诊断试剂研发尤为必要。本研究制备ILTV gD多克隆抗体为研究gD蛋白的生物学特性,ILTV感染机制,ILT临床诊断及诊断试剂盒研发奠定基础,也为ILTV gD基因工程重组疫苗和基因缺失疫苗鉴别诊断提供试验材料,应用前景广阔。
4 结论
本研究利用三种不同形式抗原,即纯化病毒,纯化r-gD蛋白,gD真核表达质粒,交替免疫新西兰大白兔,制备高效价、高特异性ILTV gD多克隆抗体。
[1]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.
[2]Bagust T J.Laryngotracheitis(Gallid-l)herpesvirus infection in the chicken:Latency establishment by wild and vaecines strainsof lLT virus[J].Avian Pathol,1986,15:581-95.
[3]Guy J S,Bagust T J.Laryngotracheitis[M]//Saif Y M,Barnes H J, Glisson J R,et al.Disease of poultry 11th ed.Iowa,Iowa:Iowa State University Press,2003:121-134.
[4]Johnson M A,Prideaux C T,Tyack S G,et al.Sequence characteristics of a gene in infectious laryngotracheitis virus homologous to glycoprotein D of herpes simplex virus[J].Arch Virol,1994,125:221-233.
[5]Johnson M A,Tyack S G,Prideaux C T,et al.Sequence characteristics of agene infectious laryngotracheitis virus homologous to glycoprotein D of herpes simplex virus DNA sequence[J]. DNA Seq,1995,5:191-4.
[6]范薇.鸭瘟病毒基因发现及重组蛋白应用研究[D].雅安:四川农业大学,2012.
[7]孙永珍,赵妍,崔红玉,等.鸡传染性喉气管炎病毒蛋白的多抗制备、细胞定位及功能研究[J].畜牧兽医学报,2014,45(8): 1309-1316.
[8]刘琰.鸭肠炎病毒gD蛋白亚细胞定位及其对病毒感染相关作用的研究[D].哈尔滨:东北农业大学,2012.
[9]刘庆伟,邱亚峰,王晓杜,等.抗伪狂犬病毒gC抗体制备及其gC蛋白表达[J].中国畜牧兽医,2011,38(3):108-112.
[10]刘峰源.鸭肠炎病毒糖蛋白gC基因的克隆、表达及部分功能的研究[D].哈尔滨:东北农业大学,2008.
Preparation of polyclonal antibodies against gD protein of ILTV and application
ZHANG Xiaocai,ZHAO Yan,ZHANG Xuemei,LIU Shengwang
(Key Laboratory of Veterinary Biotechnology/Group of Avian Respiratory Disease,Harbin Veterinary Research Institute,Chinese Academy of Agricultural Sciences,Harbin 150001,China)
Infectious Laryngotracheitis(ILT)is a highly contagious respiratory system disease caused by Infectious Laryngotracheitis Virus(ILTV).The ILTVgDgene was one of the main antigenic genes of ILTV,which can stimulate humoral immunity and cellular immune responsein vivo.The major antigenic region ofgDgene(54-344 aa)and the completedgDgene were amplified from ILTV-LJS09. The two fragments were subsequently inserted into pGEX-6P-1 and pCAGGS,respectively.The two expression vector were named pGEX-6P-1-gD163/1032 and pCAGGS-gD.The purfied ILTV,recombinant protein r-gD,and pCAGGS-gD plasmid were used as antigen to prepare polyclonal antibody.The immunofluorescence assay showed that ILTV gD polyclonal antibody could react with ILTV infected LMH cell cultures and demonstrated that ILTV gD polyclonal antibody could identify natural antigen epitope of ILTV.The best dilution was 1 ϑ 1 000 determined by immunofluorescence assay.Western Blotresult revealed a specific band approximately 40 ku,which was consistent with ILTV gD.The result showed that the polyclonal antibody has specificity.Detecting the location of gD protein in ILTV infected LMH showed that gD protein expressed in cytoplasm and the junction of fused cells.
ILTV gD protein;prokaryotic expression and purification;eukaryotic expression; polyclonal antibody;cellular location
S852.65+9.1
A
1005-9369(2016)05-0069-07
2016-04-27
农业部蛋鸡科技创新体系项目(CARS-41-K12)
张晓彩(1990-),女,硕士研究生,研究方向为鸡痘病毒。E-mail:zhangxiaocaijy@163.com
*通讯作者:刘胜旺,研究员,博士生导师,研究方向为传染性支气管炎病毒流行病学调查。E-mail:swliu@hvri.ac.cn
时间2016-5-27 14:15:33[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160527.1415.020.html
