夏季东海生源硫的分布、通量及其对非海盐硫酸盐的贡献
2016-12-20张洪海张升辉杨桂朋中国海洋大学化学化工学院山东青岛26600海洋国家实验室海洋生态与环境科学功能实验室山东青岛26607
孙 婧,张洪海,张升辉,高 楠,杨桂朋,2*(.中国海洋大学化学化工学院,山东 青岛 26600;2.海洋国家实验室海洋生态与环境科学功能实验室,山东 青岛 26607)
夏季东海生源硫的分布、通量及其对非海盐硫酸盐的贡献
孙 婧1,张洪海1,张升辉1,高 楠1,杨桂朋1,2*(1.中国海洋大学化学化工学院,山东 青岛 266100;2.海洋国家实验室海洋生态与环境科学功能实验室,山东 青岛 266071)
对2012年6月东海表层海水中二甲基硫(DMS)、二甲巯基丙酸内盐(DMSP)和二甲亚砜(DMSO)的浓度分布特征及其影响因素进行了研究,并估算了DMS的海-气通量及其对大气气溶胶中非海盐硫酸盐(nss-S O42-)的贡献率.结果表明,DMS、溶解态DMSP(DMSPd)、颗粒态 DMSP(DMSPp)、溶解态 DMSO(DMSOd)和颗粒态 DMSO(DMSOp)的浓度平均值±标准偏差为(5.71 ± 5.23),(5.94 ± 3.68),(23.84 ± 14.15),(9.14 ± 10.52)和(11.01 ± 5.81) nmol/L.DMS、DMSP和DMSOp浓度均在28oN ~29oN,122oE ~123.5oE海域呈现高值中心,沿中心向外扩散降低,并且与叶绿素a(Chl-a)的分布趋势基本一致.除DMSOd外,3种二甲基硫化物与Chl-a表现出显著的相关性,表明浮游植物生物量是影响东海生源有机硫化物生产分布的关键因素.此外,夏季东海DMS海-气通量介于(0.93~101.02) µmol/(m2·d),平均值±标准偏差为(18.13 ± 21.42) µmol/(m2·d).夏季东海生源硫释放对nss-SO42-的贡献率仅为2.2%,表明人为排放是东海大气气溶胶中nss-SO42-的主要来源.
二甲基硫;二甲巯基丙酸内盐;二甲亚砜;海-气通量;非海盐硫酸盐;东海
二甲基硫(DMS)是海洋中最重要、含量最丰富的挥发性生源硫化物[1],每年大约 28.1(17.6~34.4)Tg S从海洋进入大气[2],占海洋硫通量的90%以上,它是连接着海洋-大气-陆地之间硫循环的桥梁,被认为在全球硫循环和气候变化中发
挥着举足轻重的作用.DMS在大气中被氧化成为SO2、甲基磺酸盐(MSA),再通过同相或异相反应生成非海盐硫酸盐(nss-SO42-),形成气溶胶,增加大气中云凝结核(CCN)的数量,提高云层对太阳光的反射率,影响区域或全球气候变化[3].此外DMS的氧化产物大都具有酸性,是酸雨的重要贡献者,对酸雨的形成产生重要的影响[4].
β-二甲巯基丙酸内盐(DMSP)是 DMS的主要前体物质[5],是藻类细胞内普遍存在的一种次级代谢产物,广泛存在于透光层中[6],以颗粒态(DMSPp)和溶解态(DMSPd)两种形式存在.海水中一部分的 DMSP在细菌或某些藻类释放的DMSP裂解酶的作用下,分解为DMS和丙烯酸[7],它是海水中DMS产生的主要途径,因此DMSP的含量及转化途径直接影响DMS的生产与分布.海洋中的 DMS一旦产生,则主要通过微生物消耗、光化学氧化和海-气扩散等过程去除.二甲亚砜(DMSO),作为海水中主要的溶解态甲基硫化物之一,可通过DMS的光化学氧化[8-9]和细菌氧化[10]等过程产生,是DMS的汇.而一些真核生物和原核生物又能将DMSO还原为DMS[11],又可充当DMS的源.Andreae等[12]指出,在控制海水中DMS浓度影响生物圈与气候之间循环的过程中,DMS与DMSO之间的相互转化发挥着重要的作用.因此,DMSO虽然不能直接影响地球气候,但通过它与 DMS之间的相互转化,能对气候产生间接的影响.
目前,国内学者已经对中国近海 DMS和DMSP的时空分布、海-气通量进行了一系列研究[13-18],发现其分布大致呈现由近岸向远海降低的趋势,海-气通量存在季节差异.然而对于DMS、DMSP和DMSO三种有机硫化物之间的相关关系及其光化学和微生物转化过程尚缺乏系统的认识.在海洋现场调查中需要对 DMS、DMSP和DMSO进行综合研究,才能更加清楚地了解海洋中有机硫的生物地球化学循环过程.此外,东海生源硫释放对大气中nss-SO42-贡献的研究也非常有限[19-20],因此有必要对 DMS从海洋到大气再到气溶胶中 nss-SO42-这一系列转化过程进行全面的认识.本论文采集了夏季东海海水及大气气溶胶样品,分析了海水中DMS、DMSP和DMSO的浓度分布特征,重点讨论了3种硫化物之间及它们与生态环境因子的关系,并估算了DMS海-气通量及其对大气气溶胶中 nss-SO42-的贡献率,从海洋、海-气界面和大气三个方面对东海海域DMS的生物地球化学循环过程进行系统研究.
1 材料与方法
1.1 样品采集
于2012年6月14日~7月5日期间,随“科学三号”科学考察船对东海海域进行调查取样(图1),共包括6个断面的30个大面站.海水样品使用12L Niskin Rosette采水器进行采集,现场温度、盐度和水深由CTD在海水采集时同步测定.

图1 2012年6月中国东海调查站位Fig.1 Sampling stations in the East China Sea in June 2012
海水样品采集后,现场对DMS进行测定.对于DMSP样品,采集的水样经Whatman GF/F滤膜(直径47mm)重力过滤4mL于5mL离心管中,后添加 40µL 50%浓硫酸固定(用以除去海水样品中的 DMS)[21],即为溶解态 DMSP(DMSPd)样品.另外,取10mL海水样品直接装入10mL离心管中,加入 100µL 50% H2SO4固定,用于测定总DMSP(DMSPt)含量.对于DMSO样品,取40mL水样用内置Whatman GF/F滤膜(直径47mm)的
Nalgene过滤器重力过滤,滤液和滤膜分别装入盛有200µL 25% HCl的42mL棕色玻璃瓶中,加入40mL高纯水,拧盖密封,分别用来测定溶解态DMSO(DMSOd)和颗粒态DMSO(DMSOp).所有DMSP和DMSO样品均在4℃避光条件下保存.大气气溶胶样品利用大流量总悬浮颗粒物(TSP)采样器(KB-1000型,青岛金仕达电子科技有限公司)进行采集.将大气采样器置于船顶部甲板(距离海平面约 10m),将干燥的空白滤膜(20× 25cm,Whatman 41纤维素滤膜,Whatman公司,英国)装入采样器滤膜夹中,安装完毕后开机采集.为避免采集过程中受船体本身燃油排放的污染,只在船航行过程且风向合适情况下开启大气采样器.样品采集 24h后,将滤膜采集面向内对折,然后放入洁净干燥的聚乙烯塑料袋中,冷冻保存(-20℃).
1.2 样品分析
1.2.1 DMS的测定 DMS样品采用冷阱吹扫-捕集气相色谱法进行测定[22-23].用玻璃注射器取2mL海水样品注入到密封的样品瓶中,通入40mL/min的高纯N2进行吹扫,吹扫出的DMS流经Nafion干燥管(Perma Pure,美国)干燥后,并通过六通阀(Valco,美国)富集于浸在液氮中的1/16Teflon捕集管内,吹扫3min后将捕集管放入热水(>90℃)中加热解析,在载气携带下进入到配置火焰光度检测器(FPD)的GC-14GB气相色谱(Shimadzu,日本)中进行测定.该方法 DMS的检出限约为0.2nmol/L, 相对标准偏差<5%[22].
1.2.2 DMSP的测定 DMSP样品在强碱条件下(pH≥13)完全降解为DMS和丙烯酸,再通过分析DMS的浓度间接获得DMSP的浓度.取2mL样品注入样品瓶中,加入200µL 10mol/L KOH溶液,密封后避光冷藏(4℃)24h以上,待DMSP完全转化为DMS后,测定DMS的量,按照1:1的比例得到DMSP的浓度.
1.2.3 DMSO的测定 DMSO样品的测定采用NaBH4还原法[24].为排除海水样品中原存在的DMS以及可被NaBH4还原为DMS的DMSP产生的干扰,测定DMSO之前先加入2mL 10mol/L KOH溶液将DMSP碱解为DMS,然后用高纯N2吹扫 30min 除去样品中的 DMS.将处理过的DMSO样品pH调节为4,添加0.12g NaBH4静置还原15min,然后加入1mL 5% HCl,静置4min,最后通过测定DMS的含量间接获得DMSO的含量.
1.2.4 Chl-a的测定 对于海水中Chl-a含量的测定,量取300mL海水样品用Whatman GF/F滤膜(直径 47mm)过滤(压力低于 15kPa),滤膜包裹于锡纸中,冷冻保存(-20℃).分析时,将滤膜以10mL 90%(V/V)丙酮水溶液在低温避光的条件下萃取24h,在4000r/min转速下离心10min,取上清液使用F-4500分子荧光仪(日本日立)进行测定[25].
1.2.5 大气气溶胶的测定 样品使用ICS-3000离子色谱(美国戴安)分析,其中阴离子(SO42-和MSA)分别以30mmol/L和5mmol/L的KOH为淋洗液,使用 AS11-HC分离柱分离测定,检出限低于 0.02mg/L;阳离子(Na+等)以 20mmol/L的MSA为淋洗液,使用CS12A型色谱柱,检出限低于0.1mg/L.
2 结果与讨论
2.1 DMS、DMSP和DMSO的水平分布
夏季东海表层海水中 Chl-a的浓度变化范围是(0.05~4.29)µg/L,平均值±标准偏差为(0.87±1.28)µg/L.其浓度最高值出现在调查区西侧的DH19站位(28.04°N, 122.83°E),该站位表层海水营养盐浓度较高,溶解无机氮(DIN)浓度达到 7.69µmol/L,这可能与此处位于上升流周围水域(水温在 26~27℃)有关[26],生物获得来自上升流营养盐的补充,初级生产力得以提高.从图2可以看出,Chl-a的分布呈现由近岸外侧的高值中心向外扩散降低的趋势,这可能由于长江输运的部分泥沙沿浙闽沿岸流南下,造成闽浙沿岸海水透明度降低[27],限制了浮游植物的光合作用,使得近岸浓度低于外侧高值中心.表层海水中DMS的浓度在(0.41~18.31) nmol/L之间,平均值±标准偏差为(5.71 ± 5.23) nmol/L;DMSPd和DMSPp的浓度变化范围分别为(2.87~17.83)和(7.13~60.63) nmol/L,平均值±标准偏差为(5.94 ± 3.68)和(23.84 ± 14.15) nmol/L.此结果与近几年在东海夏季航
次的调查结果相近(表1),却高于Uzuka等[28]1994年夏季东海8月的调查结果,其DMS浓度的平均值±标准偏差为(1.77 ± 2.41) nmol/L.随着经济的发展和人类活动加剧,长江等河流携带入海的陆源物质显著增加,海洋中营养盐水平发生明显改变,进而对海区内浮游植物群落结构产生影响,据报道近 20年以来,东海海水氮磷比显著增加,硅氮比下降,硅藻比例从99%降到73%,而作为浮游植物中DMS高产种的甲藻比例却从小于1%增加到25%以上[29].因此,近些年来DMS浓度的抬升可能与浮游植物组成中甲藻种类比例的上升有很大的关系.
如图2所示,DMS、DMSPd和DMSPp浓度的分布趋势与Chl-a大致相似,均在28°N~29°N, 122°E~123.5°E海域呈现高值中心,沿中心向外扩散降低.DMS和DMSPp的浓度最高值出现在Chl-a最大的 DH19站位. DMS、DMSPd和DMSPp浓度的低值区与Chl-a浓度低值区相吻合,主要集中在东海陆架124°E以东海域,该区域表层海水的营养盐浓度处于低值(DIN<3µmol/L),导致该海域较低的初级生产力进而影响DMS、DMSPd和DMSPp的产生.

表1 不同年份夏季东海DMS和DMSP的浓度Table 1 Interannual variations of DMS and DMSP concentrations in the East China Sea in summer

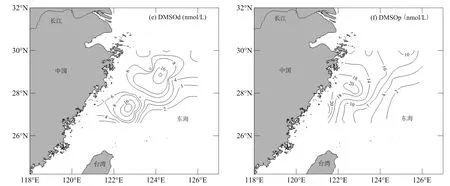
图2 夏季东海表层海水中Chl-a(μg/L)、DMS、DMSPd、DMSPp、DMSOd和DMSOp(nmol/L)的水平分布Fig.2 Horizontal distributions of Chl-a (μg/L), DMS, DMSPd, DMSPp, DMSOd and DMSOp (nmol/L) in the surface seawater of the East China Sea in summer
夏季表层海水中DMSOd和DMSOp的浓度范围分别为(3.10~47.34)和(3.44~23.71)nmol/ L,平均值±标准偏差为(9.14±10.52)和(11.01± 5.81) nmol/L.水平分布上,DMSOp浓度变化与浮游植物生物量有着密切的联系,其高值区与Chl-a高值区相吻合,表明浮游植物的生物合成是DMSOp的一个重要来源.与DMSOp分布不同,DMSOd的最大值出现在调查区南侧的DH24站位(27.30°N, 122.69°E),此处Chl-a浓度仅为0.09µg/L,这可能与DMSOd复杂的来源途径有关,包括陆源输入、生物生产或DMS的光化学氧化.
2.2 DMS、DMSP和DMSO之间的相互关系
调查结果表明,海水中3种溶解态有机硫化物的浓度由高到低依次为:DMSOd、DMSPd和DMS,这可能与 DMSO的陆源输入有关.此外, DMS在海水中复杂快速的去除途径也使得其浓度低于DMSOd.DMSOp具有与DMSPp类似的生理功能,通常将其与DMSPp进行比较,本航次DMSPp/DMSOp的比值范围介于0.38~3.79之间,平均值±标准偏差为 2.11±1.05,这与 Bouillon等[30]在巴芬湾中获得的DMSPp/DMSOp比值相类似,其5月的变化范围为0.033~3.03.此外,Simó和 Vila-Costa采集的南极海水样品的 DMSPp/ DMSOp比值范围介于 1~13[31],明显高于本航次调查结果,这可能与DMSP在细胞内具有抗冷冻功能有关[32],从而使温度较低的海域中释放更多的DMSP.
将本航次测得的DMS、DMSP和DMSO数据进行相关性分析(SPSS 16.0),表2为其所得结果.DMS与DMSPd和DMSPp之间均具有显著相关性,其相关性系数分别为0.852和0.862,表明DMSPp和DMSPd的降解对DMS的产生具有非常重要的贡献.同时DMSPd与DMSPp之间也具有显著相关性(r=0.836),这可能与海水中DMSPd主要由浮游植物释放的部分DMSPp溶解到海水中产生有关.此外,由于DMSOp及DMSPp有着共同的来源即通过生物体直接合成,并且有着相似的生理功能,因此,DMSOp与DMSPp也存在弱相关性(r=0.513).
2.3 DMS、DMSP和DMSO与Chl-a的关系
海水中的DMS、DMSP和DMSO主要源于浮游植物产生,将本航次测得的DMS、DMSP和DMSO数据与 Chl-a进行数据统计分析(SPSS 16.0),所得结果如表2所示.研究发现,除DMSOd外,其他4种二甲基硫化物与Chl-a之间均存在显著相关性,这与以往东海DMS、DMSP的调查结果类似[15-16,20].此外,王敏等[33]和杨洁[34]分别对秋季和春季东海海域进行调查发现,DMSOp与 Chl-a也存在一定的相关性.以上研究结果表明,浮游植物生物量在影响东海DMS、DMSP和DMSO的生产和分布方面发挥着重要作用.
为研究夏季东海单位浮游植物生物量生产DMS、DMSP和DMSO的能力,对表层海水中DMS、DMSP和DMSO与Chl-a的浓度比值进行计算,夏季东海 DMS/Chl-a比值为(16.55 ± 20.28) mmol/g,此结果与夏季马尾藻海区研究结果相近(20mmol/g)[35],但却明显低于 Uher等[36]在夏季欧洲陆架边缘海区的结果(45mmol/g).这种区域性差异主要归因于不同海区浮游植物优势藻种存在较大差别.Ditullio等[37]曾报道以硅藻和定边金藻为优势藻种的水体中,DMS/ Chl-a比值分别为(2~12)和(58~78) mmol/g.刘海娇等[38]和赵其彪[39]调查发现,2009年和 2011年东海夏季浮游植物均以硅藻为主,这与本论文观测到的低 DMS/Chl-a比值相对应. 夏季东海表层海水中DMSPp/Chl-a比值为(87.13 ± 74.94) mmol/g,高于 Yang等[15]冬季调查结果(35.79mmol/g). DMSOp/Chl-a比值为(47.55 ± 45.05)mmol/g,高于 2011年冬季调查结果(28.50mmol/g)[40],此结果的差异主要归因于海区内浮游植物群落的季节差异,刘海娇等[38]对东海不同季节浮游植物群落的调查结果表明,硅藻/甲藻比值在秋冬季高于春夏季,由于甲藻是DMSP和DMSO的高产种,随着冬季海水温度降低及水体扰动程度增加,甲藻在浮游植物组成中所占比例降低,导致夏季相对于冬季具有更高的DMSPp/Chl-a和DMSOp/ Chl-a比值.
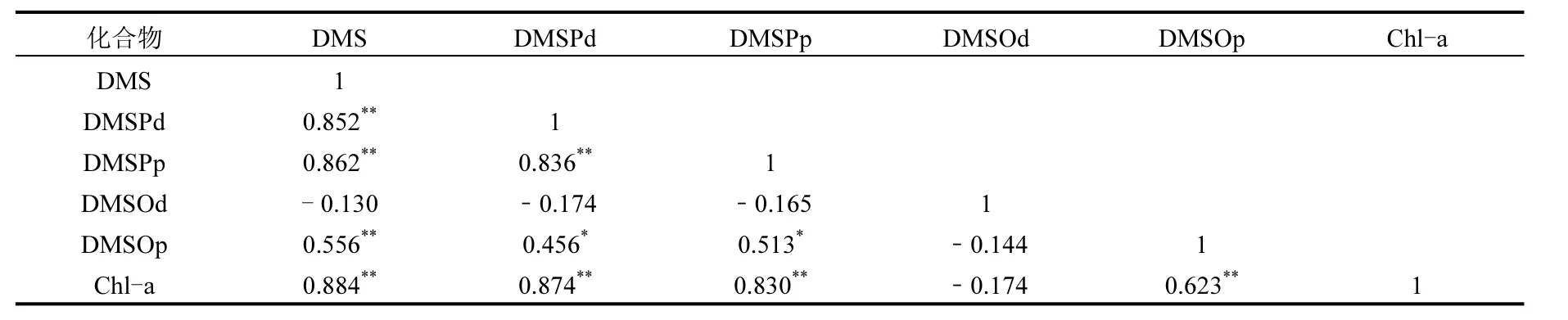
表2 东海表层海水中 DMS、DMSP、DMSO和Chl-a间的相关关系Table 2 Relationships between DMS, DMSP, DMSO and Chl-a in the surface water of the East China Sea
2.4 DMS的海-气通量
本研究采用Liss和Slater建立的滞膜模型[41]对DMS的海-气通量进行估算,其公式为

式中:F代表DMS海-气通量;k是海-气传输速率;cw和cg分别表示DMS在表层海水和大气中的浓度;H为亨利系数,由于DMS在海水中的浓度远高于其在大气中的浓度,所以上述公式可简化为

本论文采用目前国际上最常用的 N2000[42]来计算k值.
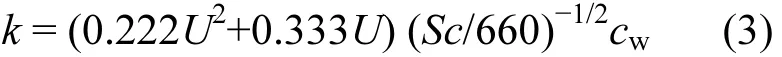
式中:U代表风速,Sc为DMS的Schmidt数,可以通过Saltzman确定的方程得到:
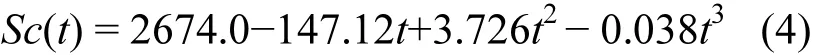
式中:t代表海水温度(℃),根据上述公式计算出k值,进而求出 DMS的海-气通量.计算结果表明,夏季东海 DMS的海-气通量变化范围为(0.93~101.02)µmol/(m2·d), 平均值±标准偏差为(18.13 ±21.42)µmol/(m2·d),各站位DMS的海-气通量差异较大,这是风速和 DMS浓度共同作用的结果.其中DMS海-气通量的最大值出现在DH26站位,此处风速较大(13m/s),同时 DMS浓度(10.53nmol/L)也较高.最小值出现在DH07站位,此处虽然风速高达13.8m/s,但DMS浓度却最低,二者共同作用导致了DMS海-气通量的最低值.
为了便于与往年数据进行比较,本文也使用以往通用的LM86方法[43]计算了DMS海-气通量,平均值±标准偏差为(10.94±14.21)µmol/ (m2·d),此结果高于Yang等[15]对夏季东海和黄海的调查结果[7.45µmol/(m2·d)].两次调查期间, DMS浓度平均值基本相当,导致通量变化的主要因素为风速,本次调查期间平均风速 7.46m/s明
显高于Yang等[15]调查期间的4.8m/s.另外,本次调查结果也明显高于Yang等[15]冬季的调查结果(3.19µmol/(m2·d)),这主要是由于本航次夏季DMS浓度(5.71nmol/L)明显高于冬季DMS浓度(1.97nmol/L),由此可见,海水中DMS浓度的增加能够直接影响DMS的海-气通量,从而对全球气候变化产生影响.
2.5 夏季生源硫对nss-SO42-的贡献
挥发进入大气的 DMS的主要氧化产物为MSA和 nss-SO42-,本航次调查同时对东海上空大气气溶胶中MSA和nss-SO42-浓度进行了分析,以研究夏季东海生源硫释放对 nss-SO42-的贡献.nss-SO42-的量为气溶胶中总 SO42-的量减去海盐硫酸盐(ss-SO42-)的量,其中ss-SO42-通过气溶胶中Na+的浓度换算[44].MSA作为DMS的稳定氧化产物之一,常被用来计算大气气溶胶中生源非海盐硫酸盐(nss-SO42-bio)对 nss-SO42-的贡献率[45],在开阔的大洋海域,nss-SO42bio-/ MSA的质量比值维持在 18~20之间[46],本研究采用c(nss-SO42-bio) = c(MSA) ×19来计算nss-浓度,并由此估算生源硫释放对 nss-SO42-的贡献.
夏季东海大气气溶胶中 MSA浓度范围为(1.17~3.23)ng/m3,平均值为(2.14±0.71)ng/m3,经计算得到 nss-SO42-的浓度范围为(0.87~3.54) µg/m3,平均值±标准偏差为(2.17±0.59)µg/m3,而nss-SO42-
bio的浓度在(0.022~0.061)µg/m3之间,平均值±标准偏差为(0.04±0.014)µg/m3.根据以上结果估算出夏季东海生源硫对 nss-SO42-的贡献率在 0.93~4.88%之间,平均值±标准偏差为(2.2 ± 1.3)%,与Arimoto等[47]报道的近海气溶胶中海洋生物释放的生源硫化物对总 nss-SO42-的贡献率小于10%的研究结果相一致.以上结果表明,夏季东海生源硫的释放对大气气溶胶中 nss-SO42-的贡献较低,人为排放是大气气溶胶中nss-SO42-的主要来源.
3 结论
3.1 夏季东海表层海水中几种二甲基硫化物的浓度大小顺序依次为:DMSPp>DMSOp> DMSOd>DMSPd>DMS,其中DMSOd是海水中含量最高的溶解态生源有机硫化物.此外, DMSPp和DMSPd的降解对DMS的产生都具有重要的贡献.
3.2 夏季东海DMS、DMSP和DMSOp的水平分布趋势与 Chl-a相似,总体呈现由近岸向远海降低的趋势.另外除DMSOd外,3种二甲基硫化物与 Chl-a均存在显著相关性,表明浮游植物生物量在影响东海生源有机硫化物的生产和分布方面发挥着重要作用.
3.3 夏季东海 DMS的海-气通量较大,明显高于冬季,这种差异主要是由夏季东海海水中较高的 DMS浓度导致.夏季东海生源硫释放对 nss-SO42-的贡献率仅为 2.2%,表明人为排放是大气气溶胶中nss-SO42-的主要来源.
[1] Lovelock J E, Maggs R J. Rasmussen R A. Atmospheric dimethylsulfide and the natural sulphur cycle [J]. Nature, 1972,237:452-453.
[2] Lana A, Bell T G, Simó R, et al. An updated climatology of surface dimethlysulfide concentrations and emission fluxes in the global ocean [J]. Global Biogeochemical Cycles, 2011,25(1):3-25.
[3] Charlson R J, Lovelock J E, Andreae M O, et al. Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate [J]. Nature, 1987,326(6114):655-661.
[4] Nguyen B C, Mihalopoulos N, Putaud J P, et al. Covariations in oceanic dimethylsulfide, its oxidation products and rain acidity at Amsterdam Island in the southern Indian Ocean [J]. Journal of Atmospheric Chemistry, 1992,15(1):39-53.
[5] Challenger F, Simpson M I. Studies on biological methylation. Part XII: A precursor of the dimethyl sulphide evolved by Polysiphonia fastigiata, Dimethy1-2-carboxyethyl-sulphonium hydroxide and its salts [J]. Journal of the Chemical Society, 1948, 3:1591-1597.
[6] Burgermeister S, Zimmermann R L, Georgii H W, et al. On the biogenic origin of dimethylsulfide: relation between chlorophyll, ATP, organismic DMSP, phytoplankton species, and DMS distribution in Atlantic surface water [J]. Journal of Geophysical Research, 1990,95(D12):20607–20615.
[7] Visscher P T, Taylor B F. Demethylation of dimethylsulfoniopropionate to 3-mercaptopropionate by an aerobic marine bacterium [J]. Applied and Environmental
Microbiology, 1994,60(12):4617-4619.
[8] Brimblecombe P, Shooter D. Photo-oxidation of dimethylsulphide in aqueous solution [J]. Marine Chemistry, 1986,19(4):343-353.
[9] 靳 娜,刘欣伟,宋雨辰,等.不同波段下黄海中二甲基硫光氧化动力学研究 [J]. 中国环境科学, 2016,36(1):167-174.
[10] Del Valle D A, Kieber D J, Kiene R P. Depth-dependent fate of biologically-consumed dimethylsulfide in the Sargasso Sea [J]. Marine Chemistry, 2007,103(1):197-208.
[11] Spiese C E, Kieber D J, Nomura C T, et al. Reduction of dimethylsulfoxide to dimethylsulfide by marine phytoplankton [J]. Limnology and Oceanography, 2009,54(2):560-570.
[12] Andreae M O, Crutzen P J. Atmospheric aerosols:Biogeochemical sources and role in atmospheric chemistry [J]. Science, 1997,276(5315):1052-1058.
[13] Yang G P, Zhang J W, Li L, et al. Dimethylsulfide in the surface water of the East China Sea [J]. Continental Shelf Research, 2000,20(1):69-82.
[14] Jiao N Z, Liu C Z, Hong H S, et al. Dynamics of dimethylsulfide and dimethylsulfoniopropionate produced by phytoplankton in the Chinese seas–distribution patterns and affecting factors [J]. Acta Botanica Sinica, 2003,45(7):774-786.
[15] Yang G P, Zhang H H, Zhou L M, et al. Temporal and spatial variations of dimethylsulfide (DMS) and dimethylsulfoniopropionate (DMSP) in the East China Sea and the Yellow Sea [J]. Continental Shelf Research, 2011,31(13):1325-1335.
[16] Yang G P, Zhuang G C, Zhang H H, et al. Distribution of dimethylsulfide and dimethylsulfoniopropionate in the Yellow Sea and the East China Sea during spring: Spatio-temporal variability and controlling factors [J]. Marine Chemistry, 2012, 138:21-31.
[17] 张洪海.中国东海、黄海DMS和DMSP的生物地球化学研究[D]. 青岛:中国海洋大学, 2009.
[18] 景伟文.海水微表层与次表层中DMS和DMSP的生物地球化学研究 [D]. 青岛:中国海洋大学, 2006.
[19] 何玉辉,杨桂朋,张洪海.冬季中国东海大气气溶胶中水溶性离子的组成与来源分析 [J]. 环境科学, 2011,32(8):2197-2203.
[20] Zhang S H, Yang G P, Zhang H H, et al. Spatial variation of biogenic sulfur in the south Yellow Sea and the East China Sea during summer and its contribution to atmospheric sulfate aerosol [J]. Science of the Total Environment, 2014,488:157-167.
[21] Bates T S, Cline J D, Gammon R H, et al. Regional and seasonal variations in the flux of oceanic dimethylsulfide to the atmosphere [J]. Journal of Geophysical Research: Oceans, 1987, 92(C3):2930-2938.
[22] 杨桂朋,康志强,景伟文,等.海水中痕量DMS和DMSP分析方法的研究 [J]. 海洋与湖沼, 2007,38(4):322-328.
[23] Zhang H H, Yang G P, Zhu T. Distribution and cycling of dimethylsulfide (DMS) and dimethylsulfoniopropionate (DMSP) in the sea-surface microlayer of the Yellow Sea, China, in spring [J]. Continental Shelf Research, 2008,28(17):2417-2427.
[24] Simó R, Malin G, Liss P S. Refinement of the borohydride reduction method for trace analysis of dissolved and particulate dimethyl sulfoxide in marine water samples [J]. Analytical Chemistry, 1998,70(22):4864-4867.
[25] 张洪海,杨桂朋.胶州湾及青岛近海微表层与次表层中二甲基硫(DMS)与二甲巯基丙酸(DMSP)的浓度分布 [J]. 海洋与湖沼, 2010,41(5):683-691.
[26] 陈 鑫,宋金明,袁华茂,等.东海 2012年夏季海-气界面碳交换及其区域碳汇强度变化趋势初探 [J]. 海洋学报, 2014,36(12):18-31.
[27] 薛宇欢,熊学军,刘衍庆.中国近海海水透明度分布特征与季节变化 [J]. 海洋科学进展, 2015,33(1):38-44.
[28] Uzuka N, Watanabe S, Tsunogai S. Dimethylsulfide in coastal zone of the East China Sea [J]. Journal of Oceanography, 1996, 52(3):313-321.
[29] Li H M, Tang H J, Shi X Y, et al. Increased nutrient loads from the Changjiang (Yangtze) River have led to increased Harmful Algal Blooms [J]. Harmful Algae, 2014,39:92-101.
[30] Bouillon R C, Lee P A, de Mora S J, et al. Vernal distribution of dimethylsulphide, dimethylsulphoniopropionate, and dimethylsulphoxide in the North Water in 1998 [J]. Deep Sea Research Part II: Topical Studies in Oceanography, 2002,49(22):5171-5189.
[31] Simó R, Vila-Costa M. Ubiquity of algal dimethylsulfoxide in the surface ocean: Geographic and temporal distribution patterns [J]. Marine chemistry, 2006,100(1):136-146.
[32] Nishiguchi M K, Somero G N. Temperature-and concentrationdependence of compatibility of the organic osmolyte βdimethylsulfoniopropionate [J]. Cryobiology, 1992,29(1):118-124.
[33] 王 敏,张洪海,杨桂朋.夏季黄渤海表层海水中二甲亚砜(DMSO)的浓度分布 [J]. 环境科学, 2013,34(1):45-50.
[34] 杨 洁.中国海域中二甲基亚砜的生物地球化学研究 [D]. 青岛:中国海洋大学, 2011.
[35] Dacey J W H, Howse F A, Michaels A F, et al. Temporal variability of dimethylsulfide and dimethylsulfoniopropionate in the Sargasso Sea [J]. Deep-Sea Research Part I: Oceanographic Research Papers, 1998,45(12):2085-2104.
[36] Uher G, Schebeske G, Barlow R G, et al. Distribution and air–sea gas exchange of dimethyl sulphide at the European western continental margin [J]. Marine chemistry, 2000,69(3):277-300.
[37] DiTullio G R, Smith W O. Relationship between dimethylsulfide
and phytoplankton pigment concentrations in the Ross Sea, Antarctica [J]. Deep Sea Research Part I: Oceanographic Research Papers, 1995,42(6):873-892.
[38] 刘海娇,傅文诚,孙 军.2009-2011年东海陆架海域网采浮游植物群落的季节变化 [J]. 海洋学报:中文版, 2015(10):106-122.
[39] 赵其彪.2011年东海浮游植物群落季节变化 [D]. 天津:天津科技大学, 2014.
[40] 王 鑫,张洪海,杨桂朋.东海和黄海冬季海水中二甲亚砜的分布及影响因素 [J]. 环境科学研究, 2014,27(10):1119-1125.
[41] Liss P S, Slater P G. Flux of gases across the air-sea interface [J]. Nature, 1974,247:181-184.
[42] Nightingale P D, Malin G, Law C S, et al. In situ evaluation of air-sea gas exchange parameterizations using novel conservative and volatile tracers [J]. Global Biogeochem. Cycles, 2000,14(1):373-387.
[43] Liss P S, Merlivat L. Air-sea gas exchange rates: Introduction and synthesis [M]. The role of air-sea exchange in geochemical cycling. Springer Netherlands, 1986:113-127.
[44] Gao Y, Arimoto R, Duce R A, et al. Atmospheric non-sea-salt sulfate, nitrate and methanesulfonate over the China Sea [J]. Journal of Geophysical Research: Atmospheres, 1996,101(D7):12601-12611.
[45] Prospero J M, Barrett K, Church T, et al. Atmospheric deposition of nutrients to the North Atlantic Basin [M]. Nitrogen Cycling in the North Atlantic Ocean and its Watersheds. Springer Netherlands, 1996:27-73.
[46] Dentener F J, Crutzen P J. A three-dimensional model of the global ammonia cycle [J]. Journal of Atmospheric Chemistry, 1994,19(4):331-369.
[47] Arimoto R, Duce R A, Savoie D L, et al. Relationships among aerosol constituents from Asia and the North Pacific during PEM-West A [J]. Journal of Geophysical Research: Atmospheres, 1996,101(D1):2011-2023.
Distribution and fluxes of biogenic sulfur in the East China Sea and its contribution to the non-sea-salt sulfate in atmospheric aerosol in summer.
SUN Jing1, ZHANG Hong-hai1, ZHANG Sheng-hui1, GAO Nan1, YANG Gui-peng1,2*(1.College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China; 2.Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China). China Environment Science, 2016,36(11):3456~3464
The spatial distributions of dimethylsulfide (DMS), dimethylsulfoniopropionate (DMSP), dimethylsulfoxide (DMSO) as well as their control factors were studied in the East China Sea during June 2012. The sea-to-air flux of DMS and its contribution to non-sea-salt sulfate (nss-SO42-) in atmospheric sulphate aerosol were also estimated. The average concentrations of DMS, dissolved DMSP (DMSPd), particulate DMSP (DMSPp), dissolved DMSO (DMSOd) and particulate DMSO (DMSOp) in the surface seawater were (5.71 ± 5.23), (5.94 ± 3.68), (23.84 ± 14.15), (9.14 ± 10.52) and (11.01 ± 5.81) nmol/L, respectively. Concentrations of DMS, DMSP and DMSOp formed high values center in the region of 28°N ~29°N and 122°E ~123.5°E and declined around this region diffusively, exhibiting similar distribution patterns to chlorophyll a (Chl-a). Concentrations of DMS, DMSPd, DMSPp and DMSOp were significantly correlated with the levels of Chl-a, suggesting that phytoplankton biomass might play an important role in controlling the production and distributions of biogenic sulfur compounds in the East China Sea. The sea-to-air fluxes of DMS in the study area varied from 0.93 to 101.02 µmol/(m2·d), with an average of (18.13 ± 21.42) µmol/(m2·d). The contribution of biogenic nss-SO42-to the total nss-SO42-in the atmospheric aerosol was only 2.2%, indicating that anthropogenic emission was the major source of atmospheric sulfur over the East China Sea in summer.
dimethylsulfide;dimethylsulfoniopropionate;dimethylsulfoxide;sea-to-air flux;non-sea-salt sulfate;East China Sea
X142
A
1000-1923(2016)11-3456-09
孙 婧(1991-),女,内蒙古土默特左旗人,中国海洋大学化学化工学院硕士研究生,主要从事生源硫的生物地球化学研究.
2016-04-15
国家自然科学基金项目(41576073,41306069, 41320104008);山东省博士基金(BS2013HZ011);中央高校基本科研项目自主基金(201513049);山东省“泰山学者”建设工程专项
* 责任作者, 教授, gpyang@ouc.edu.cn
