厌氧消化过程稳定性与微生物群落的相关性
2016-12-20赵小飞王小铭彭绪亚重庆大学三峡库区生态环境教育部重点实验室重庆400045
李 蕾,何 琴,马 垚,赵小飞,瞿 莉,王小铭,彭绪亚(重庆大学三峡库区生态环境教育部重点实验室,重庆 400045)
厌氧消化过程稳定性与微生物群落的相关性
李 蕾,何 琴,马 垚,赵小飞,瞿 莉,王小铭,彭绪亚*(重庆大学三峡库区生态环境教育部重点实验室,重庆 400045)
为探析厌氧消化过程稳定性与微生物群落的相关性,在餐厨垃圾厌氧消化反应器中引入负荷扰动以诱导不同的运行状态,理化分析和高通量测序相结合用于研究各个状态下的状态参数响应及微生物群落动态.结果表明,均衡的群落结构保证了反应器的稳定运行,稳定状态下反应器的甲烷产率和挥发性固体(VS)去除率分别高达(0.50±0.01) LC H4/gVS和(89.58±0.08)%.高负荷下产酸细菌(柔膜菌门、放线菌门)大量增殖,诱导互养脂肪酸降解菌(梭菌纲)的相对丰度剧增,然而与之互营的氢型产甲烷菌的丰度和活性却下降了.产甲烷菌与互养脂肪酸降解菌的失衡导致它们不能有效的互养合作,从而引起挥发性脂肪酸(VFA)积累和过程失稳.积累的VFA和氨使比乙酸产甲烷活性(SAMA)和比产甲烷活性(SMA)分别下降 60.12%和 72.51%,进一步加剧了过程失稳.扰动停止后,尽管反应器恢复了原有运行条件和性能,但微生物群落达到了新的平衡.
餐厨垃圾;厌氧消化;过程稳定性;微生物群落;454高通量测序
我国餐厨垃圾产量逐年增加,处置不当会引发一系列环境卫生和食品安全问题.厌氧消化(AD)技术能在处理废物的同时回收能源,被广泛用于餐厨垃圾处理[1-2].然而AD系统在运行过程中易发生抑制、酸化、起泡等“过程不稳定”现象,在高负荷下运行时尤其显著[3-5].鉴于AD系统是以微生物为主导的生化反应过程,研究微生物群落有助于优化系统性能,保证过程稳定性[6-9].近年来国内外很多研究探索了 AD系统中的微生
物群落,但大多只考虑了某一运行状态下系统中的群落组成或其随时间的演替[10-12].也有研究者将负荷扰动与微生物群落结合,但通常仅考虑了稳定运行阶段下微生物群落随负荷的演替[5,13].少量研究考虑了负荷扰动下稳定和失稳两种运行状态下的微生物群落动态.如 Polag等[14]研究了负荷高度波动的全规模反应器内总细菌、总古菌、甲烷八叠球菌科、甲烷鬃菌科等微生物的数量在不同运行阶段的变化.Goux等[4]在甜菜浆厌氧消化系统中发现超负荷酸化后甲烷鬃菌被甲烷囊菌取代,乙酸型产甲烷途径向氢型产甲烷转移;细菌在扰动后也达到了新的平衡.Razaviarani等[15]研究了污水污泥与餐厨废油联合厌氧消化反应器在稳定和超负荷两个运行阶段下的微生物群落动态,发现两种状态下主导甲烷菌不同,且超负荷后pH、碱度、甲烷含量下降,VFA急剧上升.可见现有文献主要研究不同运行状态下 AD系统的状态参数响应及微生物群落动态,甚至只关注了不同状态下主导细菌或古菌的演替,鲜有人探析微生物的演替为什么会导致系统失稳,微生物群落结构和 AD过程稳定性之间有怎样的相关性.
鉴于此,本研究在餐厨垃圾AD反应器内引入负荷扰动,诱导反应器产生稳定、失稳、恢复和重新稳定等不同运行状态.采用454高通量测序分析不同运行状态下微生物的群落动态,并与理化参数和微生物活性相结合,拟探析AD过程稳定性与微生物群落动态的相关性.
1 材料与方法
1.1 试验装置
试验装置为全自动的机械搅拌釜式反应器(BMR-A50U型,上海傲中),工作容积30L.顶部进料,侧边有上、中、下3个排料口,底部设有排渣口.恒温调节器控制水浴加热,保持温度恒定在(36±1)℃.反应器顶部有搅拌电机,转速 60rpm,每间隔2h搅拌1h.反应器配备了pH、ORP和温度探头,可实时在线监测相应参数.产生的气体经干燥后,由红外检测器实时在线检测气体成分、流量及产气总量.
1.2 实验材料和运行方案
餐厨垃圾取自学校食堂,去除粗颗粒杂质如骨头、塑料等后,用粉碎机粉碎至5mm以下.随后分装到4L的储存袋中,于-18℃冰冻保存.临用前一周置于 4℃冰箱中解冻.接种污泥取自常温下运行的农村户用沼气池.餐厨垃圾和接种污泥的理化性质见表1.

表1 底物和接种污泥的理化特征Table 1 Physical and chemical characterization of substrate and seed sludge
运行初期一次性向反应器内投加上述种泥30L,并预孵化两周.随后反应器进行半连续式启动,初始负荷为 3gVS/(L·d).运行过程中,反应器每天出料 200mL用于理化参数测定;每周集中排渣一次,以保证反应器有效容积.约一个月后,反应器pH值、甲烷产率和VS去除率达到稳定状态(连续10d波动不大于10%),表明系统已成功启动.
反应器成功启动后,分为4个阶段运行:第I阶段(0~45d),反应器依然在 3gVS/(L·d)的负荷下稳定运行,称为稳定运行期;第II阶段(46~90d),向反应器内引入负荷扰动,以 1gVS/(L·d)为梯度,每隔15d提高一个负荷档次,直至反应器运行失败,称为负荷扰动期;第 III阶段(91~120d),停止进料以消耗积累的中间代谢产物,称为恢复期;第 IV阶段(121~150d)再次进料,但为避免突然进料对长期饥饿的系统造成过大的冲击,首先分别在 1和2gVS/(L·d)的负荷下运行7d,观察到反应器性能没出现明显恶化后,提高负荷至 3gVS/(L·d)运
行至稳定,此阶段称为重新稳定期.
1.3 比产甲烷活性试验
取每个运行阶段末期(45, 90, 120和150d)的污泥进行产甲烷活性实验,分别以混合挥发性脂肪酸(50%乙酸, 25%丙酸和 25%丁酸)和乙酸为底物,来表征比产甲烷活性(SMA)和比乙酸产甲烷活性(SAMA)[16].实验在总容积 500mL,有效容积400mL的反应瓶内进行,每个处理设置3个平行.种泥和底物的终浓度分别为 5gVSS/L和2.5g/L(乙酸) 或 1g/L (混合酸).基础营养液占有效容积的20%.反应物添加完成后,向反应器内补充蒸馏水以达到有效容积,随即拧紧橡胶塞,并向反应瓶内充 5min氮气,以排空瓶内的氧气,保证厌氧环境.密封后的玻璃瓶放入恒温水浴锅内进行发酵,发酵温度保持在(36±1)ºC.产生的甲烷通过排 NaOH溶液(3mol/L)法进行收集.计算微生物活性时,以累积甲烷产量对时间作图,产气曲线上直线段部分的斜率与污泥浓度的比即为SMA或 SAMA,以 mgCODCH4/(gVSS·d)表示.此外,各阶段SMA和SAMA的显著性差异采用SPSS软件,基于邓肯多重范围检验进行单因素方差分析,显著性水平0.05.
1.4 物化参数分析
pH值、产气量和气体成分进行在线检测. TS和VS采用烘干法测定.总挥发性脂肪酸(VFA)和总碱度(TA)采用滴定法进行测定.总氨氮(TAN)采用标准方法测定.乙酸、丙酸等单个脂肪酸采用气相色谱测定(Agilent 7890A,美国). C/N采用元素分析仪测定(Elementar VarioELⅢ元素分析仪,德国).蛋白质采用凯氏定氮法测定,脂肪采用索氏提取法测定.VS去除率和游离氨(FAN)的计算见前期研究[17].
1.5 微生物分析
在每个运行阶段末期,从反应器中采集3个污泥样品,每个样0.3g;使用E.Z.N.A Soil DNA试剂盒,参照操作说明书进行基因组 DNA抽提.对所提取的DNA进行纯化,随后三份DNA混合后对其16S rRNA基因片段进行PCR扩增.细菌扩增引物为27F (5’-AGAGTTTGATCCTGGCTCAG-3’)和 533R(5’-TTACCGCGGCTGCTGGCAC-3’);古菌扩增引物为 344F(5’-ACGGGGYGCAGCAGGCGCGA-3’)和915R (5’-GTGCTCCCCCGCCAATTCCT-3’).扩增后的产物经纯化和定量,再送往上海美吉生物技术有限公司进行454高通量测序.所得原始核苷酸序列经分类、修剪和标准检验后划分到操作分类单元(OTU)水平.基于 OTU的多样性分析采用 Mothur软件(Mothur v.1.30.1)进行.分类学水平的分析采用SILVA 数据库软件(http://www.arb-silva.de).最终的核苷酸序列提交到 NCBI数据库,登录号为SRP065754.
2 结果和讨论
2.1 系统效率和过程稳定性对扰动的响应
从图1可知,I阶段TAN和FAN都呈增加趋势.据报道TAN和FAN浓度分别大于3000和100mg/L时会引起系统抑制[18],而该阶段的TAN和FAN浓度分别小于1767mg/L和82mg/L,因此这两个因子的抑制效果可以忽略.低负荷和无抑制使该阶段具有良好的系统性能,其甲烷产率和VS去除率分别在(0.50±0.01)L CH4/gVS和(89.58±0.08)%,与前人的研究相近[19].状态参数如VFA恒定在(2083±120)mg/L,小于其抑制阈值3000mg/L,pH也在最佳范围以内,VFA/TA在0.2~0.35之间,VFAs以乙酸为主,丙酸保持在很低的水平,指示系统运行稳定.
II阶段引入负荷扰动以诱导系统失稳.从图1中可知,负荷从 3gVS/(L·d)提高到 5gVS/(L·d)时,VFA出现轻微上升,并伴随着TA的轻微下降,这可能是FAN抑制引起的,因为FAN在67d超过了 100mg/L.然而状态参数并没有持续背离其原有水平,而是稳定在了新的浓度值,且系统效率并没有受到影响.进一步提高负荷至 6gVS/ (L·d),TAN和FAN继续增加,同时VFA也迅速从3100mg/L (82d)积累到9443mg/L(90d).此时,乙酸依然是最主导的VFA,但丙酸浓度上升了20倍,且丁酸和戊酸也出现了一定程度的积累(数据未显示).积累的 VFAs消耗系统碱度,导致 pH下降,VFA/TA也上升至 0.79±0.22,指示系统失稳.此外甲烷含量、甲烷产率和VS去除率也出现不
同程度的降低.可见II阶段末期所有指标都背离了其正常范围,共同指示出AD过程恶化.高负荷下,酸的产生和消耗不匹配可能是过程失稳的主要原因;而氨氮的积累也许进一步加剧了AD过程失稳.

图1 厌氧消化反应器运行性能Fig.1 Process performance of the anaerobic digester
超负荷后,降低运行负荷是进行过程恢复的最普遍的方式[7].结合本研究的严重酸化现象,在III阶段,系统没有投加任何负荷.从图中可知,随着“饥饿”时间的延长,积累的VFAs逐渐被消耗,甲烷含量慢慢回升.值得注意的是,甲烷含量不只是恢复到稳定期的水平,而是持续升高至明显高于稳定期.这可能是因为,随着 VFA被消耗,之前与VFA结合的HCO3-被释放,系统中TA增高,而TA的升高反过来又导致微生物代谢产生的CO2更多地溶解在液相中,而溢出到气相的CO2减少,进而导致气相中甲烷含量增加.恢复期更高的碱度和pH印证了该推论.
随着VFA降低到I阶段的水平,反应器重新进料并逐步恢复I阶段的运行条件.从图1可知, IV阶段运行稳定后,与I阶段具有类似的运行效率.高的 TAN[(2810±53)mg/L]和 FAN[(134±18) mg/L]并没有对该阶段造成抑制,这可能是因为氨氮逐渐积累的过程中,微生物被驯化了. Yenigün等[20]曾报道,驯化后微生物对 FAN 和TAN 的耐受浓度分别可达 337~800mg/L和2800~6000mg/L.但IV阶段的VFA和TA等较I阶段稍高,这可能与微生物群落的转移相关.
2.2 比产甲烷活性对扰动的响应

图2 不同运行状态下的SAMA和SMA变化Fig.2 Variations of SAMA and SMA during different operational stages
从图 2可知,各阶段的 SAMA在(0.109± 0.004)~(0.274±0.017)gCOD/(gVSS·d),与前人的研究结果相近[16,21].此外,每个阶段的 SAMA都高于SMA.这可能是因为测定SMA采用的底物中,丙酸和丁酸不能直接被产甲烷菌利用,而要先被互养的产氢产乙酸菌转化为乙酸和H2,再分别被乙酸型和氢型产甲烷菌降解.因此互养菌的活性直接影响了SMA的测定结果,更低的SMA也许预示着互养菌/氢型产甲烷菌活性不足[21].具体比较每一个运行阶段可知,I阶段具有最高的产甲烷活性,这与该阶段稳定的运行性能是对应的.II阶段SAMA和SMA分别下降了60.12%和72.51%,这可能是酸和氨积累导致的.而SMA更高程度的下降表明互养菌/氢型产甲烷活性在失稳过程中比乙酸型产甲烷活性受损更重.恢复阶
段两类活性都有所回升,其中SMA平均增加3.03倍,而SAMA上升了1.64倍,这也许意味着互养/氢型产甲烷途径在系统中的作用增强了.IV阶段的SAMA与III阶段没有显著差异,但SMA则显著上升,进一步表明互养/氢型产甲烷途径的重要作用.此外,对比IV阶段和I阶段可知,尽管两个阶段都处于稳定状态,但IV阶段仅有SMA恢复到了I阶段水平,SAMA则显著低于I阶段,这也许是该阶段VFA更高的原因之一.
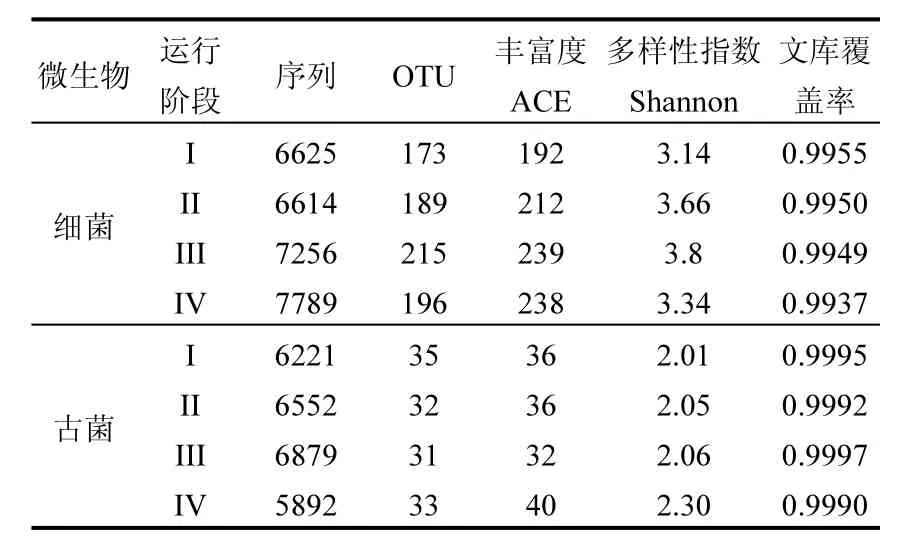
表2 不同运行阶段样品中微生物序列的统计分析Table 2 Statistics analysis of microbial sequences in samples retrieved from different operational stages
2.3 测序结果的统计分析
从表2可知,细菌和古菌样品的文库覆盖率都在 99%以上,表明系统中大部分的微生物已被检测到.此外,细菌丰富度和多样性都高于古菌,这与早期研究一致[22].进一步对比每个运行状态下的微生物生态学参数可知,细菌和古菌的各类参数均与过程稳定性没有明显相关性.可见,多样性指数并不能很好地指示反应器运行状态.Goux等[4]也有类似结论,他们指出微生物多样性与反应器过程稳定性之间没有明确相关性,群落结构才是决定微生物功能的重要因素.因此从群落结构演替的角度进一步分析失稳机理是必要的.
2.4 产甲烷菌群落动态
从图 3可知,乙酸营养型的甲烷鬃菌(Methanothrix)、 氢 营 养 型 的 甲 烷 囊 菌(Methanoculleus)和甲烷螺菌(Methanospirillum)是系统内主要的甲烷菌属.此外混合营养型的甲烷八叠球菌(Methanosarcina)也检测到了,但其丰度一直很低.具体而言,I阶段甲烷鬃菌是系统内最主导的甲烷菌,相对丰度为 46.97%;氢型产甲烷菌中甲烷螺菌主导,具有 35.35%的丰度,甲烷囊菌次之,占 9.89%.可见,该阶段具备“甲烷鬃菌主导,乙酸营养型和氢营养型产甲烷菌共存”的均衡古菌群落特征[6,23],这可能是该阶段性能稳定的原因之一.
II阶段酸和氨的积累大幅度地削弱了SAMA,但甲烷鬃菌的相对丰度却增加至58.47%.其他研究者同样报道过甲烷菌丰度与活性不成比例的现象[24-25].前期研究中,作者也详细阐述了这种异常的可能原因[1].相应的,该阶段总氢型产甲烷菌的丰度从 45.27%下降至 37.68%,这会降低 H2消耗效率.此外,主导的氢型产甲烷菌由甲烷螺菌向甲烷囊菌转移.据报道[25],甲烷囊菌比甲烷螺菌具有更高的H2亲和力,因此这种演替会进一步降低H2消耗速率.这与该阶段SMA的大幅下降是一致的.

图3 甲烷菌群落在属水平的动态演替Fig.3 Dynamics of methanogens at the genus level
III阶段甲烷鬃菌丰度基本不变,甲烷螺菌丰度下降,而甲烷囊菌丰度继续升高,且在 IV阶段成为系统中最主导的甲烷菌.甲烷囊菌取代甲烷螺菌成为主导氢型产甲烷菌可能与甲烷囊菌具有更高的氨氮耐受限值有关[26].此外甲烷囊菌在特定的途径上有更多的基因含量,有些会直接参与生物产甲烷过程,如它们可以采用乙醇和大量的二级醇作为电子供体来产甲烷[26],这些特征使得它们在不同的生长环境中存活更具优势.因此,
综合来看,超负荷过程中,酸和氨积累导致主导产甲烷菌呈现出了乙酸营养型的甲烷鬃菌向氢营养型的甲烷囊菌转移的趋势;而主导氢型产甲烷菌呈现出甲烷螺菌向甲烷囊菌转移的趋势.其他研究者在有扰动和无扰动的厌氧消化反应器中都曾观察到类似现象[8,11,13,27].
2.5 细菌群落动态
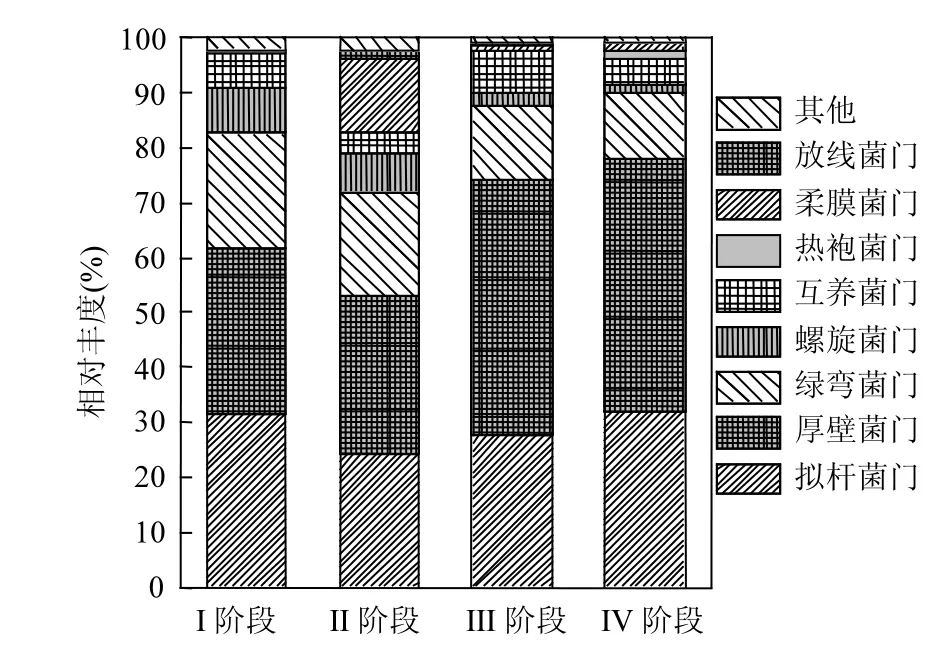
图4 细菌群落在门水平的动态演替Fig.4 Dynamics of bacterial communities at the phylum level
由图4和表3可知,拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、螺旋菌门(Spirochaetae)、互养菌门(Synergistete)、热袍菌门(Thermotogae)、柔膜菌门(Tenericutes)和放线菌门(Actinobacteria)是反应器内的主导细菌门(至少在一个样品中相对丰度大于1%).这与Guo等[5]及 Jang等[13]在餐厨垃圾厌氧消化系统中检测到的优势微生物是类似的.其中,拟杆菌门和厚壁菌门是众所周知的持久性微生物,能在AD过程中产生各种代谢酶,主要参与水解和酸化阶段.如拟杆菌门的Bacteroides属发酵膳食纤维产生乙酸[28];而Petrimonas属发酵糖类,主要代谢产物为乙酸和丙酸; vadinBC27 和Proteiniphilum属则是蛋白质或氨基酸降解菌[5].厚壁菌门的梭菌纲(Clostridia)除水解酸化外,还涉及产氢产乙酸和乙酸氧化.如其代表属Syntrophomonas可与氢型产甲烷菌互营将各种有机酸转化为 H2和乙酸[28];另一代表属Syntrophaceticus则为乙酸氧化菌,可将乙酸分解为 H2和 CO2[29].互养菌门也涉及酸化和乙酸氧化[6,13],Carballa等[6]和 Jang等[13]指出它们的存在代表了系统良好的耗乙酸性能.螺旋菌门的代表属 Spirochaeta具有葡萄糖利用活性[5];Treponema则包含同型产乙酸微生物,可转化H2和CO2为乙酸[30].热袍菌门以060F05-B-SD-P93为代表属,能产生胞外聚合物,形成聚集体以增大氢传递效率.厌氧反应器中柔膜菌门微生物似乎主要参与酸化阶段,可为乙酸型产甲烷菌提供乙酸[31].放线菌门据报道也参与酸化过程,能降解餐厨垃圾为 VFA,且放线菌门的有些微生物会产生丙酸[13].

表3 细菌在纲和属水平上的分布表(仅列出了至少在一个样品内相对丰度大于1.0%的属)Table 3 Taxonomic compositions of bacterial communities at the class and genus levels
对比各阶段细菌的演替动态可知,失稳过程中产酸的柔膜菌门和放线菌门丰度急剧增加.
Guo等[5]曾在超负荷的餐厨垃圾厌氧消化系统中观察到柔膜菌门增加的现象,而 Regueiro等[7]及Jang等[13]观察到超负荷时放线菌门的相对丰度增大.产酸菌的丰度增加也许是造成该阶段高VFA产量的主要原因.高的VFA产率诱导了系统内互养脂肪酸降解菌的增殖.从表3可知,该阶段梭菌纲丰度急剧增加.然而,梭菌纲也是著名的氢生产者,它们的增加代表它们向系统内释放了更多的 H2[22].与此矛盾的是,互营的氢型产甲烷菌丰度和活性在该阶段显著下降.这种压力下,同型产乙酸的 Treponema属作为耗氢微生物出现.据报道,同型产乙酸菌一般在低温下被观察到,在中或高温下,由于它们产能低于氢型产甲烷菌,通常不具有竞争优势[32].然而,Wang等[30]观察到在有H2流入的中温污泥AD反应器内,Treponema和氢型产甲烷菌共存. Siriwongrungson等[32]在丁酸高温AD反应器中发现,同型产乙酸能在产甲烷途径被抑制的情况下,充当替代耗氢途径.可见,在H2产量急剧增加而耗氢效率急剧下降的II阶段,Treponema作为耗氢的替代微生物出现是可以理解的,这甚至可能是AD自我优化的表现形式.然而,这种自我优化并没能阻止其失稳,这是因为尽管Treponema将多余的H2转化为了乙酸,乙酸型产甲烷菌的活性却也受到了影响,它们同样无法消耗过多的乙酸,最终导致了VFA积累.
恢复和重新稳定过程中,梭菌纲丰度进一步增加,反应器中积累的 VFA却逐渐被消耗.这一方面是因为放线菌门和柔膜菌门等产酸菌丰度下降,VFA产量下降了;另一方面是由于系统的SMA增加,使氢的产生和消耗之间达到了平衡.与此同时,细菌也向着产氢菌的方向转移.如发酵碳水化合物的Bacteroides和Petrimonas属的丰度在扰动后被Gelria和060F05-B-SD-P93属部分取代,而后两者均能降解碳水化合物产氢. Treponema属的丰度在后两个运行阶段逐渐下降,而与之具有相反功能的Syntrophaceticus属丰度增加,氧化乙酸为氢.微生物的这些演替也许都暗示着扰动后反应器内出现了产甲烷途径的转移,这与其活性的变化规律是一致的.另外,尽管 I和IV阶段的性能类似,对比两阶段的微生物群落可知,细菌和古菌群落都发生了明显的变化,扰动后群落达到了新的平衡.类似现象在Luo等[33]及Goux等[4]的研究中也曾被报道过.这也许预示着微生物存在高度的功能冗余.
3 结论
3.1 稳定运行阶段反应器中甲烷鬃菌主导,乙酸营养型和氢营养型产甲烷菌共存,水解、酸化和产氢产乙酸菌等微生物均衡生长,反应器运行稳定,甲烷产率和 VS去除率分别在(0.50±0.01) LCH4/gVS和(89.58±0.08)%,各项状态参数均在阈值以下,无中间代谢产物积累.
3.2 高负荷下产酸的柔膜菌门和放线菌门微生物急剧繁殖造成高VFA产率,是系统失稳的第一个原因.高VFA产率诱导互养脂肪酸降解菌大量生长,导致系统 H2产量增加;但互营的氢型产甲烷菌丰度和活性均下降,造成 H2消耗速率下降,产氢细菌和耗氢甲烷菌的代谢失衡是系统失稳的第二个原因.此外,VFA和氨积累使SAMA下降60.12%;且引起主导氢型甲烷菌从甲烷螺菌转为甲烷囊菌,导致SMA下降72.51%,甲烷菌的低代谢活性是系统失稳的又一个原因.
3.3 重新稳定阶段反应器虽然恢复了原有运行条件和性能,但微生物达到了新的平衡.细菌向产氢菌方向转移;产甲烷途径呈现出乙酸营养型向氢营养型产甲烷转移的趋势,氢型产甲烷菌丰度和活性均上升.这表明微生物应对扰动时呈现出高度的功能冗余.
[1] Li L, He Q, Ma Y, et al. Dynamics of microbial community in a mesophilic anaerobic digester treating food waste: Relationship between community structure and process stability [J]. Biores. Technol., 2015,189:113-120.
[2] 尹福斌,李子富,王冬泠,等.加碱预处理对致病微生物去除效果及动力学研究 [J]. 中国环境科学, 2015,35(1):196-203.
[3] 彭绪亚,洪俊华,贾传兴,等.磷酸酯酶活性对餐厨垃圾单相厌氧消化抑制的预警作用 [J]. 中国环境科学, 2012,32(3):541-546.
[4] Goux X, Calusinska M, Lemaigre S, et al. Microbial community dynamics in replicate anaerobic digesters exposed sequentially to increasing organic loading rate, acidosis, and process recovery [J]. Biotechnol. Biofuels, 2015,8(1):1-18.
[5] Guo X, Wang C, Sun F, et al. A comparison of microbial
characteristics between the thermophilic and mesophilic anaerobic digesters exposed to elevated food waste loadings [J]. Biores. Technol., 2014,152:420-428.
[6] Carballa M, Regueiro L, Lema J M. Microbial management of anaerobic digestion: exploiting the microbiome-functionality nexus [J]. Curr. Opin. Biotech., 2015,33:103-111.
[7] Regueiro L, Lema J M, Carballa M. Key microbial communities steering the functioning of anaerobic digesters during hydraulic and organic overloading shocks [J]. Biores. Technol., 2015, 197:208-216.
[8] 刘 阳,彭永臻,韩玉伟,等.游离氨对热水解联合中温厌氧消化处理剩余污泥的影响 [J]. 中国环境科学, 2015,35(9):2650-2657.
[9] 何 强,孙兴福,艾海男,等.两相一体式污泥浓缩消化反应器运行效能及其微生物特性 [J]. 中国环境科学, 2012,32(11):2039-2046.
[10] Karakashev D, Batstone D J, Angelidaki I. Influence of environmental conditions on methanogenic compositions in anaerobic biogas reactors [J]. Appl. Environ. Microb., 2005,71(1):331-338.
[11] Williams J, Williams H, Dinsdale R, et al. Monitoring methanogenic population dynamics in a full-scale anaerobic digester to facilitate operational management [J]. Biores. Technol., 2013,140:234-242.
[12] Cho S, Im W, Kim D, et al. Dry anaerobic digestion of food waste under mesophilic conditions: Performance and methanogenic community analysis [J]. Biores. Technol., 2013,131:210- 217.
[13] Jang H M, Kim J H, Ha J H, et al. Bacterial and methanogenic archaeal communities during the single-stage anaerobic digestion of highstrength food wastewater [J]. Biores. Technol., 2014,165:174-182.
[14] Polag D, May T, Müller L, et al. Online monitoring of stable carbon isotopes of methane in anaerobic digestion as a new tool for early warning of process instability [J]. Biores. Technol., 2015,197:161-170.
[15] Razaviarani V, Buchanan I D. Reactor performance and microbial community dynamics during anaerobic co-digestion of municipal wastewater sludge with restaurant grease waste at steady state and overloading stages [J]. Biores. Technol., 2014,172:232-240.
[16] Regueiro L, Veiga P, Figueroa M, et al. Relationship between microbial activity and microbial community structure in six full-scale anaerobic digesters [J]. Microbiol. Res., 2012,167(10):581-589.
[17] 唐 波,李 蕾,何 琴,等.总氨氮在餐厨垃圾厌氧消化系统中的积累及其抑制作用 [J]. 环境科学学报, 2016,(1):210-216.
[18] Heo N H, Park S C, Kang H. Effects of mixture ratio and hydraulic retention time on single-stage anaerobic co-digestion of food waste and waste activated sludge [J]. J. Environ. Sci. Heal. A., 2004,39(7):1739-1756.
[19] Nagao N, Tajima N, Kawai M, et al. Maximum organic loading rate for the single-stage wet anaerobic digestion of food waste [J]. Biores. Technol., 2012,118:210-218.
[20] Yenigün O, Demirel B. Ammonia inhibition in anaerobic digestion: A review [J]. Process Biochem., 2013,48(5/6):901-911.
[21] Palatsi J, Illa J, Prenafeta-Boldú F X, et al. Long-chain fatty acids inhibition and adaptation process in anaerobic thermophilic digestion: Batch tests, microbial community structure and mathematical modelling [J]. Biores. Technol., 2010,101(7):2243-2251.
[22] Kim S, Bae J, Choi O, et al. A pilot scale two-stage anaerobic digester treating food waste leachate (FWL): Performance and microbial structure analysis using pyrosequencing [J]. Process Biochem., 2014,49(2):301-308.
[23] Lerm S, Kleyböcker A, Miethling-Graff R, et al. Archaeal community composition affects the function of anaerobic co-digesters in response to organic overload [J]. Waste Manage., 2012,32(3):389-399.
[24] Schauer-Gimenez A E, Zitomer D H, Maki J S, et al. Bioaugmentation for improved recovery of anaerobic digesters after toxicant exposure [J]. Water Res., 2010,44(12):3555-3564.
[25] Shigematsu T, Era S, Mizuno Y, et al. Microbial community of a mesophilic propionate-degrading methanogenic consortium in chemostat cultivation analyzed based on 16S rRNA and acetate kinase genes [J]. Appl. Microbiol. Biot., 2006,72(2):401-415.
[26] Franke-Whittle I H, Walter A, Ebner C, et al. Investigation into the effect of high concentrations of volatile fatty acids in anaerobic digestion on methanogenic communities [J]. Waste Manage., 2014,34(11):2080-2089.
[27] Lerm S, Kleyböcker A, Miethling-Graff R, et al. Archaeal community composition affects the function of anaerobic co-digesters in response to organic overload [J]. Waste Manage., 2012,32(3):389-399.
[28] Li A, Chu Y N, Wang X, et al. A pyrosequencing-based metagenomic study of methane-producing microbial community in solid-state biogas reactor [J]. Biotechnol. Biofuels, 2013,6(1):3.
[29] Ziganshin A M, Liebetrau J, Pröter J, et al. Microbial community structure and dynamics during anaerobic digestion of various agricultural waste materials [J]. Appl. Microbiol. Biot., 2013, 97(11):5161-5174.
[30] Wang W, Xie L, Luo G, et al. Performance and microbial community analysis of the anaerobic reactor with coke oven gas biomethanation and in situ biogas upgrading [J]. Biores. Technol., 2013,146:234-239.
[31] Wirth R, Kovács E, Maróti G, et al. Characterization of a biogasproducing microbial community by short-read next generation DNA sequencing [J]. Biotechnol. Biofuels, 2012,5(1): 41.
[32] Siriwongrungson V, Zeng R J, Angelidaki I. Homoacetogenesis as the alternative pathway for H2sink during thermophilic anaerobic degradation of butyrate under suppressed methanogenesis [J]. Water Res., 2007,41(18):4204-4210.
[33] Luo G, De Francisci D, Kougias P G, et al. New steady-state microbial community compositions and process performances in biogas reactors induced by temperature disturbances [J]. Biotechnol. Biofuels, 2015,8(1):1-10.
Investigation on the relationship between process stability and microbial community in anaerobic digestion.
LI Lei, HE Qin, MA Yao, ZHAO Xiao-fei, QU Li, WANG Xiao-ming, PENG Xu-ya*(Key Laboratory of Three Gorges Reservoir Region’s Eco-Environment, Ministry of Education, Chongqing University, Chongqing 400045, China). China Environmental Science, 2016,36(11):3397~3404
To explore the relationship between process stability and microbial community in anaerobic digestion, organic loading rate (OLR) disturbances were introduced into an anaerobic digester treating food waste (FW) to induce different process stages. Physico-chemical analysis along with the 454-pyrosequencing microbial technique were performed to monitor the responses of state parameters as well as the dynamics of microbial community. Results showed that balanced community structure ensured the stable operation of the digester. Under steady-state conditions, the methane yield reached (0.50±0.01) LCH4/gVS and volatile solids (VS) removal rate reached (89.58±0.08) %. Under high OLR conditions, the relative abundance of acid-producing bacteria (phyla Tenericutes and Actinobacteria) increased dramatically, which induced the proliferation of syntrophic fatty acid degrading bacteria (class Clostridia), while the abundance and activity of syntrophic hydrogenotrophic methanogens decreased. The imbalance relationship between methanogens and syntrophic fatty acid degrading bacteria caused their inefficient syntrophy, eventually resulting in volatile fatty acid (VFA) accumulation and process deterioration. Moreover, the accumulated VFA and ammonia reduced the specific acetoclastic methanogenic activity (SAMA) and specific methanogenic activity (SMA) by 60.12% and 72.51%, respectively, which further deteriorated the digestion process. Although the digester afterwards recovered to its original operational conditions and process performance, the microbial community profile changed and achieved new steady-state conditions.
food waste;anaerobic digestion;process stability;microbial community;454-pyrosequencing
X705
A
1000-6923(2016)11-3397-08
李 蕾(1989-),女,江西宜春人,重庆大学博士研究生,研究方向为固体废物污染控制与资源化.发表论文10余篇.
2016-04-22
国家“十一五”科技支撑计划(2010BAC67B01)
* 责任作者, 教授, xypeng33@126.com
