氧化石墨烯的水环境行为及其生物毒性
2016-12-20吕小慧陈白杨朱小山哈尔滨工业大学深圳研究生院土木与环境工程学院广东深圳58055清华大学深圳研究生院广东深圳58055
吕小慧,陈白杨,朱小山(.哈尔滨工业大学深圳研究生院土木与环境工程学院,广东 深圳 58055;2.清华大学深圳研究生院,广东 深圳 58055)
氧化石墨烯的水环境行为及其生物毒性
吕小慧1,2,陈白杨1,朱小山2*(1.哈尔滨工业大学深圳研究生院土木与环境工程学院,广东 深圳 518055;2.清华大学深圳研究生院,广东 深圳 518055)
氧化石墨烯是一类石墨烯衍生物,性质独特,应用广泛,生产量急剧增加,其环境风险日益引起关注.氧化石墨烯具有高亲水性和表面活性,在水中易分散,易随水流发生迁移转化,可能对水环境和水生生物造成不利影响.因此,明确氧化石墨烯的水环境行为及其生态效应,对于正确理解和评估其环境风险,合理规划其使用和回收具有重要意义.目前,该领域的研究涵盖了氧化石墨烯在水环境中的分散/团聚、吸附、还原、降解、沉积等行为,及对微生物、浮游动物、藻类和鱼类等水生生物的毒性表现.本文综述了相关研究成果,分析了当前研究面临的挑战并展望其研究前景.
氧化石墨烯;水环境;环境行为;生物毒性
氧化石墨烯是指含氧基团官能化的石墨烯基碳纳米材料,具有高亲水性及高表面活性.在众多石墨烯基材料中,氧化石墨烯利用率最高,是宏量低成本制备石墨烯及其他石墨烯基材料的关键原料;应用广泛,在吸附、催化、能储、过滤、传感等众多领域具有广阔的应用前景[1].目前,氧化石墨烯的生产量持续快速增长,在生产、贮存、运输、使用、处置及回收这整个周期中,氧化石墨烯会不可避免地泄露到环境中,其环境风险日益引起关注.氧化石墨烯的环境行为和毒性效应均已成为国内外化学、材料学和环境学领域的交叉研究热点之一[2,3].
1 氧化石墨烯具有独特结构、优异性质及广泛应用
氧化石墨烯可以被认为是石墨烯的官能化衍生物,在大量实验分析基础上,人们普遍认定其结构包含sp2杂化碳原子网络及sp3杂化碳原子的含氧官能团(环氧基、羟基、羧基等) (图1).含氧官能团的存在不仅影响到氧化石墨烯的物理特性(造成其导电率的下降),而且赋予了氧化石
墨烯独特的化学性质:含氧官能团的高亲水性为氧化石墨烯片层带来了高润湿性;在水中离子化后使得氧化石墨烯片层带负电,进而发生静电排斥作用.以上性质使得氧化石墨烯在纯水中可以单分散形成稳定的悬浮液[4].此外,sp2杂化碳原子网络结构赋予了氧化石墨烯在极性溶剂,包括乙二醇、DMF、NMP、THF等中的分散能力.这些结构综合使氧化石墨烯表现出典型的水油双亲性[5].丰富的官能团同时使得原本惰性的碳层变得异常活泼,为各种反应的发生提供了大量表面活性位点,有利于提升氧化石墨烯在吸附、催化等化学反应中的活性并为进一步合成各类复合材料提供便利[6].由于其独特结构及优异性质,氧化石墨烯在吸附、催化、能储、过滤、传感、脱盐等众多领域得到广泛应用,其产量逐年上升[1,7-8].此外,氧化石墨烯在DNA检测及药物负载等方面亦具备应用潜力[9-10].然而,正因为氧化石墨烯的独特结构与性质及其广泛应用,使得人们担心其环境暴露可能带来难以预料的生物、生态效应.

图1 氧化石墨烯的Dékán结构模型[11]Fig.1 Dékán model of graphene oxide[11]
2 氧化石墨烯的水环境行为及其影响因素
氧化石墨烯在纯水中可以单分散形成稳定的悬浮液[4].但是,在自然水环境中,受复杂的水环境条件,如pH值、光照、离子强度/种类、溶解性有机质(DOM)、悬浮颗粒、水生生物等影响,氧化石墨烯可以发生分散/团聚、吸附、还原、降解等环境行为,其具体行为如表1所示.
2.1 分散/团聚
水溶液 pH值改变时,氧化石墨烯片层上含氧基团的电离程度改变,片层间的静电斥力随之变化,进而影响其片层分散性[12].氧化石墨烯的等电点在3以下,当溶液pH值在等电点(=3)附近时,片层不带电荷,静电斥力接近于零,易团聚;pH值小于等电点(<3)时,基团质子化,片层显正电性;pH值大于等电点时(>3),基团离子化,片层显负电性;且 pH值对等电点的偏离会导致片层表面的电荷增强,增强其分散性.自然水体的常见pH在4~10之间,在此范围内,pH对氧化石墨烯的分散液稳定性影响很小[13-15].
此外,水溶液中存在离子时,氧化石墨烯的团聚倾向增强,团聚程度与溶液的离子强度成正比.这可能是电解液压缩氧化石墨烯片层间的双电层,屏蔽其所带电荷,导致层间斥力降低所致[13,15-18].也有研究表明,水溶液中的二价或多价离子会与氧化石墨烯片层发生交联作用,使得片层发生快速的团聚[13,15-18].自然水环境中二价阳离子(如Mg2+和Ca2+等)的常见浓度(1mmol/L)与氧化石墨烯在盐溶液中的临界团聚浓度(CCC) (MgCl21.3mmol/L、CaCl20.9mmol/L)接近,表明氧化石墨烯在自然水环境中的团聚行为与二价离子的含量高度相关[13,15-18].
自然水环境中的 DOM,包括腐殖酸、氨基酸、蛋白质等,与氧化石墨烯通过ππ作用力、氢键和 Lewis酸碱作用力等机制发生吸附行为[13],被吸附的小分子 DOM通过空间位阻效应促进氧化石墨烯片层的分散[13,15,17-20];大分子 DOM如腐殖酸等也可以通过桥联、缠绕等作用促进氧化石墨烯团聚[21-22].其他水化学条件如 pH及离子强度等都可以影响有机质与碳层的相互作用[23],导致其对氧化石墨烯分散/团聚状态的影响复杂化.
水环境中带有表面电荷的悬浮颗粒(针铁矿、Al2O3等)可以通过多种机制结合在氧化石墨烯表面,增加其团聚倾向,且结合机制和团聚效率与分散液的pH值高度相关.Zhao等[16]研究发现,在4.0~8.5的pH范围内,正电性的针铁矿可以通过静电吸引作用吸附在氧化石墨烯片层边缘,使得片层折叠,发生非均相团聚.负电性的高岭土、蒙脱土颗粒则无此作用.Ren等[24]发现 Al2O3颗粒存在时氧化石墨烯分散性降低,且降低程度受pH值影响.pH较低(1.6~4.5)时,倾向团聚;pH升高
(4.5~8.7)时,分散性回升;pH高于 8.7(8.7~11)时, Al2O3正电性下降,然而形成的 Al(OH)4−通过Lewis酸碱作用力与氧化石墨烯相结合,反而促进了团聚率的上升.

表1 不同水化学条件对氧化石墨烯水环境行为的影响Table 1 Effects of various water chemistries on the behaviors of graphene oxide in aquatic environments
可见,水环境中氧化石墨烯的分散/团聚倾向主要与两方面因素相关:① 氧化石墨烯的原生性质,包括片层尺寸、氧化程度、表面电荷等;②水环境化学条件,包括pH值、离子强度及种类、DOM、悬浮颗粒等.以上因素共同影响氧化石墨烯的分散/团聚状态,极大增加了氧化石墨烯在自然水环境中行为的复杂性[2,25-26].
2.2 吸附
如前所述,氧化石墨烯可以吸附 DOM.此外,氧化石墨烯对重金属离子、有机物等水体污染物也具备高吸附能力,这不仅可以改变污染物的迁移、归趋等环境行为,而且能够影响其生态效应,具有重要研究意义.
研究表明,重金属离子主要通过静电吸引作用、离子交换作用及络合作用,结合在氧化石墨烯表面的含氧基团活性位点上[27];有机污染物则主要通过π-π共轭作用、氢键和范德华力等作用被氧化石墨烯吸附[2].一定条件下,氧化石墨烯对重金属例如Cu(II)、Zn(II)、Cd(II)、Pb(II)和U(VI)以及大部分有机污染物具有高吸附容量和高吸附平衡速率,甚至高于碳纳米管等其他纳米材料[28-29].
氧化石墨烯对水体污染物的吸附与众多环境条件,包括pH值、温度、离子强度、DOM等高度相关.pH值对吸附行为的影响一方面源于对氧化石墨烯表面电性的改变;pH值升高时,氧化石墨烯表面负电性增加,与正电性的金属离子或离子型有机物间的静电吸引作用变强[30];另一方面源于对金属离子或离子化有机物液相存在形态的影响,溶液pH值高于一定数值时Cd(II)、Hg(II)等会发生沉淀,主导性吸附机制由离子交换及络合作用转变为表面沉淀作用,吸附量下降
[30,31].温度在一定范围内升高时,重金属离子在氧化石墨烯表面的吸附量增加[30],这一方面应归因于吸附行为的吸热性;另一方面,温度升高降低了溶液的粘性,增加了金属离子的扩散速率,使得金属离子与氧化石墨烯的接触概率更高.离子强度对静电引力作用主导的吸附行为有显著影响,离子强度增加时,金属离子及四环素等正电性有机物的吸附量下降[32].DOM 如腐殖酸等会与污染物竞争氧化石墨烯表面的吸附位点,从而抑制氧化石墨烯对很多水体污染物的吸附[33].
目前氧化石墨烯对污染物的吸附研究多在纯水/配制溶液中进行,在自然水体中的研究较少.有研究表明,海水中氧化石墨烯对于 As(V)和As(Ⅲ)的最大吸附量分别为 142mg/g和139mg/g[34];自来水中氧化石墨烯对 Cd2+的吸附量保持在 59.69mg/g,是在纯水中吸附量的65.39%[32];与碳纳米管相比,自然有机质对石墨烯吸附菲和联苯的影响更小.这些结果说明自然水体中氧化石墨烯对污染物仍然具有高效的吸附作用,但其影响因素和发生机制更为复杂,仍需要进一步研究支持.
2.3 还原
水环境中的还原剂(含硫化合物[20,35]、维生素C[36]、氨基酸[37]、糖类[38]、蛋白质[39]等),细菌(希瓦氏菌[40-42],大肠杆菌[43],酵母菌[44]等),植物(野生胡萝卜根系[45]等),动物(蚌类[46]等),污染物(水合肼[47]等)及光照条件均可以对氧化石墨烯起到一定还原作用.含硫化合物如N aHSO3,Na2S等均可以还原氧化石墨烯表面的含氧官能团,其中NaHSO3还原性最强[35].Na2S浓度低至0.5mM时即可起到还原作用,且分散液 pH值和腐殖酸的存在对还原程度有很大影响[20].自然光照下,氧化石墨烯会发生一定程度的还原,且环氧基和羟基首先被还原[48].富氧水环境中,11h光照后,氧化石墨烯的O/C由58%下降至48%[18].Salas等[40]发现希瓦氏菌在呼吸作用中产生的电子可以通过膜色素蛋白传递给胞外的氧化石墨烯,从而对其起到还原作用,此外大肠杆菌也可以通过糖酵解过程还原氧化石墨烯[43].
2.4 降解
光照和某些生物体的摄入会使得氧化石墨烯发生降解.Hou等[48]研究发现,氧化石墨烯在水溶液中接受阳光照射后被还原并发生降解,生成结构无序化的小分子还原氧化石墨烯并同时产生二氧化碳,此反应过程与溶液氧含量相关,氧含量高时长程产生二氧化碳的量更多,然而长期的阳光照射并不能完全降解氧化石墨烯(图 2). Chowdhury等[18]研究得到,氧化石墨烯在富氧/厌氧水中光照后,其片层平均尺寸由200nm分别下降至 120nm/130nm.Hu等发现,在光照和水合反应的联合作用下,氧化石墨烯片层变薄并带状化[51].此外,Kotchey等指出山葵过氧化物酶可以分解氧化石墨烯片层表面的部分碳原子,形成缺陷和孔洞[55].被小鼠摄入 8d后,羧基化的氧化石墨烯片层边缘开始缺陷化,3个月后转化成无定型碳[56].
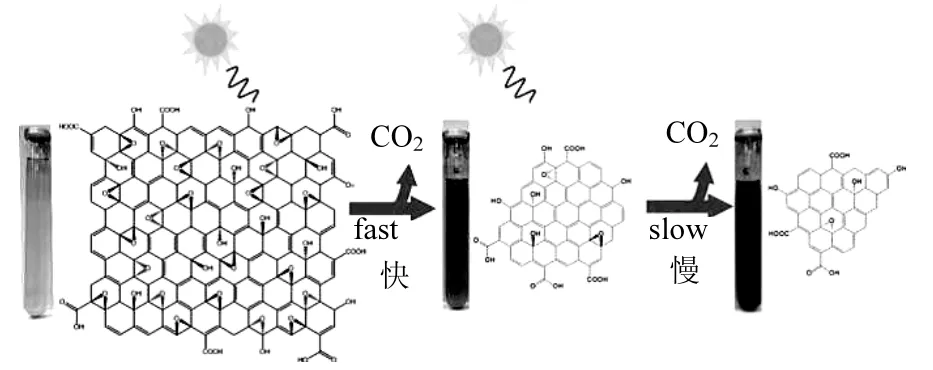
图2 氧化石墨烯在阳光下发生逐步降解[48]Fig.2 The stepwise degradation of graphene oxide by sunlight[48]
3 氧化石墨烯的水生生物毒性
氧化石墨烯的独特结构使其在水中具有高度分散性,容易随水流发生迁移、转化;且其化学性质活泼,极有可能对水生生物和水环境生态造成不利影响.但是,目前有关石墨烯基材料的水生生物毒性研究较为贫乏,仅有氧化石墨烯对细菌、鱼类、浮游动物及藻类影响的少数报道,且不同的研究,结果差异较大.有研究表明氧化石墨烯无明显生物毒性效应,但也有报道显示氧化石墨烯可以对多种水生生物造成显著毒性.
3.1 氧化石墨烯对细菌的毒性效应
某些研究表明,氧化石墨烯对细菌无显著毒性效应,甚至可促进细菌生长和增殖.例如,尽管氧
化石墨烯与希瓦氏菌、大肠杆菌等存在相互作用,可导致氧化石墨烯的理化性质或是细菌的生长状态发生改变,但实验中并未观测到氧化石墨烯的抗菌/抑菌性[40,43].Ruiz等[59]发现25µg/mL氧化石墨烯的培养液中,大肠杆菌生长速度更快,更易形成生物膜;在覆盖25µg或75µg氧化石墨烯的滤膜上,细菌的生长速度分别是对照的2或3倍.
相反,Liu等[60]发现大肠杆菌在含有 40µg/ mL氧化石墨烯的培养液中培养2h后,灭活率达到 69.3%,且其毒性表现为时间、浓度依赖性.这可能和氧化石墨烯对细胞膜造成直接物理损伤,破坏细胞完整性有关.Liu等[60]通过微观形貌表征,发现与氧化石墨烯作用之后,大肠杆菌的细胞形态失去规整性,发生不可恢复性的损伤. Karmali等[61]在实验中发现类似现象.Akhavan等[62]通过检测 RNA的释放量,同样证明氧化石墨烯对细胞完整性的破坏是其对大肠杆菌和金黄色葡萄球菌高细胞毒性的主要机制.氧化石墨烯的片状结构、低片层厚度使其具有较为锋利的边缘;此外,氧化石墨烯的负电性基团与细胞膜的正电性脂质可以发生相互作用[61],以上原因都可能对细胞膜造成伤害,破坏细胞的完整性.细胞膜完整性破坏的另一个后果可能是纳米材料的细胞内在化(internalization).研究显示,氧化石墨烯的细胞膜损伤作用使其可以进入动、植物细胞内部[63-65].但氧化石墨烯对细胞膜造成的直接物理损伤是否是其进入细胞的主要机制目前仍待进一步确认.由于氧化石墨烯结构为片状,其进入细胞的机制或异于其他纳米颗粒,已有研究显示,细胞倾向于通过内吞等无能耗的方式摄入石墨烯基纳米材料[66].此外,氧化石墨烯的片层尺寸对其进入细胞的能力及进入机制也有密切关系[64-65].
活性氧及氧化压力的产生可能是氧化石墨烯细胞毒性的另一原因.Gurunathan等[67]发现氧化石墨烯存在时,绿脓杆菌内的活性氧含量较之对照组高出了 3.8倍,其生长受到了显著抑制.Ahmed等[68]的研究结果显示50~300mg/L氧化石墨烯对污水中微生物菌落的代谢活性、存活率、对营养物质(氮、磷、有机物等)的摄取等均有明显抑制作用,而活性氧的产生与此具有密切联系.除活性氧的产生之外,氧化压力还可以通过其他机制,如对细胞结构的破坏或是对胞内组分的直接氧化引发.Liu等[60]发现大肠杆菌在含有40µg/mL氧化石墨烯的培养液中培养2h后,细胞内并无超氧离子产生,而氧化石墨烯对谷胱甘肽(GSH,细菌细胞内的一种抗氧化剂,可以防止细胞受到氧化压力损伤)却表现出强氧化性. Castrillon等[69]同样证实了氧化石墨烯对GSH的氧化作用.上述研究结果表明,氧化石墨烯可以通过非活性氧机制诱发氧化压力.
氧化石墨烯与DNA分子结合[70],引起RNA表达失调[71],可能是其细胞毒性的重要机制.Li等[71]采用固态测序技术发现,氧化石墨烯可以使得GLC-82细胞中多种miRNA表达上调或下调,从而可能影响线粒体功能并激活受体死亡信号通路.Gurunathan等[67]发现氧化石墨烯对绿脓杆菌的生长抑制过程中,除活性氧产生之外,还观察到细菌 DNA的断裂,这一现象同样出现在氧化石墨烯对人HUVEC细胞的毒性表现[72],以及其他石墨烯基材料的生物效应研究中[73].
3.2 氧化石墨烯对藻类的毒性效应
氧化石墨烯对藻类的毒性研究较少.有研究显示氧化石墨烯对小球藻(Chlorella vulgaris)不具备显著的毒性效应[74].氧化石墨烯对眼虫藻(Euglena gracilis)的作用则相反[75],藻类的生长、光合色素、抗氧化酶含量等均受到显著影响.当暴露时间为96h,浓度<1mg/L时,过氧化氢酶及超氧化物歧化酶活性显著增加;<2.5mg/L时,生长繁殖抑制明显、丙二醛含量显著增加;<5mg/L时,叶绿素 a含量下降明显.氧化石墨烯对藻类[76-78]的毒性作用可能与氧化石墨烯暴露下藻细胞内活性氧含量的增加有关.此外,纳米材料对水生植物的遮蔽效应不容忽视(图 3).Hu等[79]将装有眼虫藻的试管置于氧化石墨烯培养液中,并对这一体系采用单向光源照射,研究遮蔽与氧化石墨烯毒性的关系,结果发现氧化石墨烯会导致藻细胞的光利用率下降.此外,将氧化石墨烯加入眼虫藻的培养液后发现,其片层可以均匀覆盖在藻细胞表面.纳米材料团簇在藻细胞周围可能会阻碍其
从外部环境摄取营养,引起细胞内营养消耗[80].可见,氧化石墨烯对藻细胞的遮蔽效应及其对细胞代谢的影响值得进一步深入研究.
3.3 氧化石墨烯对鱼类的毒性效应
目前关于氧化石墨烯对鱼类的毒性研究主要采用斑马鱼(zebrafish)作为受试生物.Li等[81]发现高浓度(50mg/L)的氧化石墨烯对斑马鱼胚胎具备一定的细胞生长抑制效应(~20%)且导致其孵化速度略微下降,但并未存在细胞凋亡.Liu等[82]测试了1~100mg/L氧化石墨烯对斑马鱼胚胎的作用,结果显示24h暴露时间后,氧化石墨烯可以团聚并富集在胚胎绒毛膜表面,5mg/L以上的氧化石墨烯浓度下,受精时间为96h(96hpf) 的胚胎心率受到了显著抑制(P<0.05).但即使在100mg/L的高暴露浓度下也未发现胚胎畸形、孵化延迟、存活率下降或长度变化等毒性表现.此外.一些研究显示功能化的氧化石墨烯对斑马鱼胚胎无明显毒性或低毒性.L-半胱氨酸修饰的氧化石墨烯(1~10mg/L)作用于斑马鱼胚胎时不会明显导致胚胎畸形、死亡或发育延迟[83].聚乙烯亚胺功能化的小尺寸氧化石墨烯对斑马鱼胚胎具备低毒性效应,其胚胎致死率为10%左右[84].

图3 氧化石墨烯对藻细胞的遮蔽效应[75]Fig.3 Shielding effect of graphene oxide on algae cell[75]
相反,Mu等[83]发现氧化石墨烯对斑马鱼胚胎具有致畸、致死及孵化延迟等毒性效应.0.01~10mg/L的氧化石墨烯暴露浓度下,斑马鱼的胚胎畸形(心囊水肿,尾巴弯曲和眼睛畸形)比例为5%~9%,72hpf 时孵化比例为 10%~30%,显著低于空白对照组的 75%.96hpf 时暴露在氧化石墨烯分散液中的斑马鱼胚胎死亡率为 5%~8%.表征结果显示氧化石墨烯可以进入胚胎的眼细胞内部并抑制细胞核分裂,同时导致胞内活性氧含量上升,钠、钾-三磷酸腺苷酶活性下降及线粒体去极化现象.毒性测试时所使用氧化石墨烯的不同理化性质及测试环境的不同或是以上研究结果相异的主要原因之一.
3.4 氧化石墨烯对其它水生生物的毒性效应
Mesaric等[85]发现氧化石墨烯可抑制丰年虾(Artemia salina)的游泳活动 (EC50=0.16mg/mL) ,甚至导致死亡 (LC50=0.65mg/mL).0.01mg/mL氧化石墨烯暴露48h后,丰年虾体内胆碱酯酶活性上升,谷氨酰胺转移酶活性下降.氧化石墨烯与生物酶的相互作用或是其生物毒性的内在原因之一.事实上,氧化石墨烯片层上的羟基、羧基等基团具备高化学活性,容易结合生物酶等多种功能性蛋白质,影响酶的活性并可能引发长期毒性[86].研究显示氧化石墨烯可以抑制 α-糜蛋白酶的活性[87],且酶与氧化石墨烯的相互作用是不可逆过程[88].氧化石墨烯与生物酶的相互作用值得关注.
3.5 影响因素
当前研究表明氧化石墨烯对水生物的毒性效应千差万别,不同的受试生物以及不同的实验,得出不同的甚至相反的结果.除了不同的受试生物由于生理生态特性的不同所导致的毒性或敏感性差异外,氧化石墨烯本身的尺寸、层数、团聚状态、比表面积、表面化学等物理化学性质同样是氧化石墨烯毒性的重要影响因素.
3.5.1 尺寸/层数 尺寸可以影响石墨烯基材料的官能团密度、表面电荷、导电率和分散性等理化性质[89],并从很多方面影响氧化石墨烯与细胞间的相互作用,例如对细胞的包覆/附着、细胞摄入方式及富集部位等,从而对其毒性效应造成影响.
包覆效应是层状石墨烯基材料对细胞的毒性机制之一:单层石墨烯对多种分子无渗透性,可以妨碍细胞对营养物质的吸收及其增殖;氧化石墨烯渗透性较高,但其对无机离子和有机物分子具有高吸附能力,会对营养物质起到拦截作用.不同尺寸的氧化石墨烯对细胞的包覆程度不同,势
必对其毒性造成影响.Liu等[91]考察了不同尺寸(0.753~0.010µm)氧化石墨烯的细菌毒性,发现大尺寸氧化石墨烯可以完全覆盖细胞,毒性更高;而小尺寸氧化石墨烯仅能附着在细胞表面但不会起到覆盖作用,毒性较小.Perreault等[90]同样发现大比表面积的氧化石墨烯片层(0.65µm2) 更容易包覆细菌致其失活,但这一行为具有可逆性;而小尺寸片层(0.01µm2)缺陷密度更高,更易吸附氧并激发氧化压力,其抗菌性显著高于大尺寸片层(图4).
氧化石墨烯的尺寸还可以密切影响其细胞内化行为及内化机制.Yue等[64]对两种不同尺寸(350nm和2µm)氧化石墨烯片层与六种细胞的相互作用进行了研究,结果显示细胞对不同尺寸氧化石墨烯的摄入机制不同,小尺寸片层被巨噬细胞的丝状伪足缠绕进入,而大尺寸片层以近乎垂直的方式进入细胞.Mu等[65]以小鼠的C2C12细胞为研究对象,发现尺寸为500nm和1µm的氧化石墨烯片层分别通过内吞作用和噬菌作用进入细胞,但两种材料在低于 100µg/mL的暴露浓度下对细胞增殖均无抑制作用.
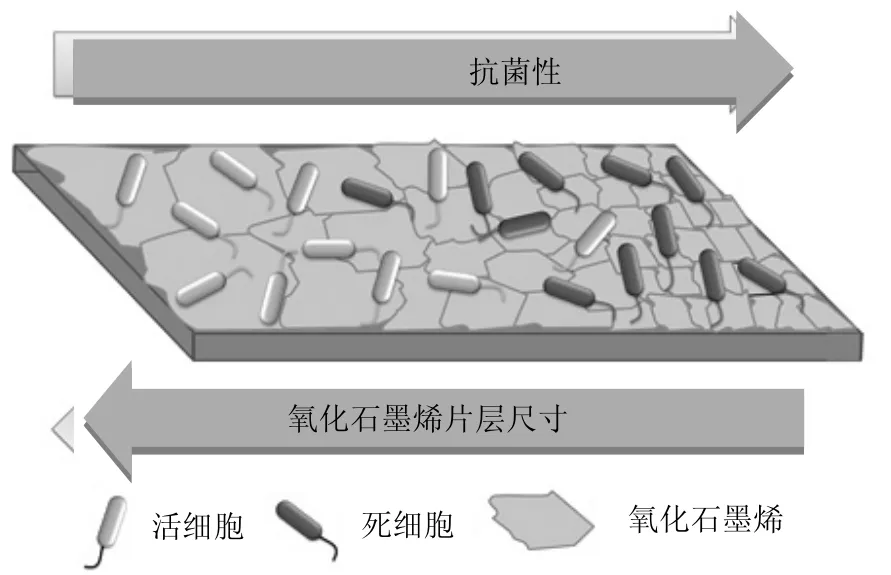
图4 氧化石墨烯的片层尺寸与其对大肠杆菌的毒性成反比[90]Fig.4 The inverse relation between size of graphene oxide and its toxicity to Escherichia coli[90]
氧化石墨烯的片层尺寸与其生物富集部位同样存在一定联系.尺寸为1~5µm和110~500nm的氧化石墨烯在小鼠体内的主要富集部位分别是肺部和肝部,但当体内剂量由 1mg/kg增加到10mg/kg时,小尺寸氧化石墨烯的富集部位会转移到肺部[92].而氧化石墨烯的尺寸与层数是否会对其水环境毒性造成影响,目前尚未有报道,相关的研究亟需展开.
3.5.2 团聚状态 氧化石墨烯的毒性水平与其团聚状态关系密切:生理盐水中,团聚的氧化石墨烯尤其是大片层氧化石墨烯的细菌毒性明显下降[91];腐殖酸存在时,团聚的氧化石墨烯对斑马鱼胚胎的绒毛膜伤害、卵黄细胞及深层细胞累积及线粒体损伤、氧化压力等毒性表现均受到抑制[93].这些研究结果表明氧化石墨烯在一定环境下的生物毒性与其团聚程度成反比.Liu等[60]指出氧化石墨烯及还原氧化石墨烯在溶液中的团聚程度不同,导致细菌与其作用方式不同,分别表现为被片层包覆/嵌入团聚体内部,这或是两种材料毒性差别的原因之一.以上研究结论与富勒烯、碳纳米管的相关毒性研究一致[94-97].富勒烯在水溶液中的团聚可以减少其与生物体作用过程中产生的活性氧量[97],降低毒性;多壁碳纳米管在污水中及富勒烯在自然水体中表现出更低的细菌毒性[96],也与它们在水中的团聚相关.这些研究结果表明,在纳米毒理学研究中,明确环境条件及一定条件下材料的团聚状态十分必要.
3.5.3 表面化学与杂质残留 氧化石墨烯的表面化学状态可以影响其表面电荷、亲/疏水性、导电性及吸附能力等理化性质,进而改变其与细胞的作用方式.此外,重金属/有机杂质的残留同样会对氧化石墨烯的生物毒性造成影响.
Das等[72]发现不同还原程度的氧化石墨烯表现出不同水平的细胞毒性,且毒性与表面残留的含氧官能团密度成正比.Gurunathan等[67]发现氧化石墨烯对绿脓杆菌的生长抑制率高于还原氧化石墨烯(还原剂:BME),且会导致更高的活性氧产量及DNA断裂现象.Yue等[64]指出氧化石墨烯中残留的锰可以引发高细胞死亡率,这与碳纳米管的一些毒性研究结果相一致.对此,在氧化石墨烯的制备过程中可采用长时间清洗、超声等办法排除杂质对其毒性效应的影响[59,98].
表面化学不同引起的表面电荷/导电性差异同样会影响材料的生物效应.Wang等[73]表征了两种不同功能化氧化石墨烯(PEG-GO、LA-
PEG-GO)的细胞毒性及基因毒性,表面正电性的LA-PEG-GO具有显著更低的基因毒性,且通过zeta电位测试发现,其表面电荷越少毒性越低.
利用氧化石墨烯的表面化学对其毒性的影响,可以通过表面功能化降低甚至消除氧化石墨烯的生物毒性.目前已经发现可以采用聚氧乙烯山梨醇月桂酸酯、核酸适体、聚乙二醇、葡萄糖、L-半胱氨酸等对氧化石墨烯进行修饰[83,99-102].实验证明修饰后的氧化石墨烯更难与细菌[99]或生物大分子[103]发生非特异性连接.Mu等[83]发现,L-半胱氨酸修饰的氧化石墨烯具有显著更低的电子自旋密度且不会导致环境缺氧,作用于斑马鱼胚胎时不会明显导致胚胎畸形、死亡或发育延迟.
4 结语
与其他碳纳米材料如石墨烯、富勒烯、碳纳米管等不同,氧化石墨烯的独特结构使其在水中具有高分散性、高吸附性以及高化学活性.氧化石墨烯的环境暴露,极有可能对水环境生态和水生生物造成不利影响.已有研究表明,氧化石墨烯在自然水环境中可发生团聚、吸附、还原、降解、沉积等复杂的环境行为[2-3];此外,一些研究表明氧化石墨烯可以在生物体内富集[60,62,104],并导致毒性效应[60],其主要的毒性表现包括生长抑制、代谢抑制、致畸或致死,毒性机制则包括物理损伤、氧化损伤、基因毒性、遮蔽效应等.然而截止目前,氧化石墨烯的水生生物毒性研究仍存在诸多问题:①全面性差.已报道的受试生物种类较少,且研究手段有限,体内/体外毒性实验均有待补充;②准确性低.定性/定量实验均较为缺乏.不同研究者的实验结论存在较大分歧;③可对比性差.不同报道所采用氧化石墨烯的制备方法、理化性质、分散手段、检测方法等方面均存在较大差异; ④联合毒性研究不足.氧化石墨烯对水污染物具备高吸附能力,然而仍无氧化石墨烯对污染物生物累积/食物链传递行为影响的研究报道.综上所述,仍需开展大量的研究工作,深入了解氧化石墨烯进入天然水环境后的环境行为,明确其生物毒性,尤其是其吸附环境中现存污染物后对自身以及吸附态污染物环境行为与毒性的影响,及其在生态系统食物链不同营养级生物中的富集与传递等,以便有效评估氧化石墨烯的水环境效应、规避其生态风险.
[1] Zhu Y, Murali S, Cai W, et al. Graphene and graphene oxide:synthesis, properties, and applications [J]. Advanced Materials, 2010,22(35):3906-3924.
[2] Zhao J, Wang Z, White J C, et al. Graphene in the Aquatic Environment: Adsorption, Dispersion, Toxicity and Transformation [J]. Environmental Science & Technology, 2014,48(17):9995-10009.
[3] 任文杰,腾 应.石墨烯的环境行为及其对环境中污染物迁移归趋的影响 [J]. 应用生态学报, 2014,9(25):2723-2732.
[4] Dreyer D R, Park S, Bielawski C W, et al. The chemistry of graphene oxide [J]. Chemical Society Reviews, 2010,39(1):228-240.
[5] Paredes J I, Villar-Rodil S, Martinez-Alonso A, et al. Graphene oxide dispersions in organic solvents [J]. Langmuir, 2008,24(19):10560-10564.
[6] Compton O C, Nguyen S T. Graphene oxide, highly reduced graphene oxide, and graphene: versatile building blocks for carbon-based materials [J]. Small, 2010,6(6):711-723.
[7] Hegab H M, Zou L D. Graphene oxide-assisted membranes:Fabrication and potential applications in desalination and water purification [J]. Journal of Membrane Science, 2015,484:95-106.
[8] Ren W, Mura S, Irudayaraj J M K. Modified graphene oxide sensors for ultra-sensitive detection of nitrate ions in water [J]. Talanta, 2015,143:234-239.
[9] Balapanuru J, Yang J-X, Xiao S, et al. A graphene oxide-organic dye ionic complex with DNA-sensing and optical-limiting properties [J]. Angewandte Chemie-International Edition, 2010,49(37):6549-6553.
[10] Zhang L M, Xia J G, Zhao Q H, et al. Functional graphene oxide as a nanocarrier for controlled loading and targeted delivery of mixed anticancer drugs [J]. Small, 2010,6(4):537-544.
[11] Szabo T, Berkesi O, Forgo P, et al. Evolution of surface functional groups in a series of progressively oxidized graphite oxides [J]. Chemistry of Materials, 2006,18(11):2740-2749.
[12] Cote L J, Kim J, Tung V C, et al. Graphene oxide as surfactant sheets [J]. Pure and Applied Chemistry, 2011,83(1):95-110.
[13] Chowdhury I, Duch M C, Mansukhani N D, et al. Colloidal properties and stability of graphene oxide nanomaterials in the aquatic environment [J]. Environmental Science & Technology, 2013,47(12):6288-6296.
[14] Lanphere J D, Luth C J, Walker S L. Effects of solution chemistry on the transport of graphene oxide in saturated porous media [J]. Environmental Science & Technology, 2013, 47(9):4255-4261.
[15] Hua Z, Tang Z, Bai X, et al. Aggregation and resuspension of graphene oxide in simulated natural surface aquatic environments [J]. Environmental Pollution (Barking, Essex: 1987), 2015,205:161-169.
[16] Zhao J, Liu F, Wang Z, et al. Heteroaggregation of graphene oxide with minerals in aqueous phase [J]. Environmental Science & Technology, 2015,49(5):2849-2857.
[17] Lanphere J D, Rogers B, Luth C, et al. Stability and transport of graphene oxide nanoparticles in groundwater and surface water [J]. Environmental Engineering Science, 2014,31(7):350-359.
[18] Chowdhury I, Hou W C, Goodwin D, et al. Sunlight affects aggregation and deposition of graphene oxide in the aquatic environment [J]. Water Research, 2015,78:37-46.
[19] Qi Z, Zhang L, Wang F, et al. Factors controling transport of graphene oxide nanoparticles in saturated sand columns [J]. Environmental Toxicology and Chemistry, 2014,33(5):998-1004.
[20] Fu H, Qu X, Chen W, et al. Transformation and destabilzation of graphene oxide in reducing aqueous solutions containning sulfide [J]. Environmental Toxicology and Chemistry, 2014,33(12):2647-2653.
[21] Yang Z, Yan H, Yang H, et al. Flocculation performance and mechanism of graphene oxide for removal of various contaminants from water [J]. Water Research, 2013,47:3037-3046.
[22] Tang L, Wang Y, Liu Y, et al. DNA-Directed self-assembly of graphene oxide with applications to ultrasensitive oligonucleotide assay [J]. Acs Nano, 2011,5(5):3817-3822.
[23] Gorham J M, Wnuk J D, Shin M, et al. Adsorption of natural organic matter onto carbonaceous surfaces: Atomic force microscopy study [J]. Environmental Science & Technology, 2007,41(4):1238-1244.
[24] Ren X, Li J, Tan X, et al. Impact of Al2O3on the aggregation and deposition of graphene oxide [J]. Environmental Science & Technology, 2014,48(10):5493-5500.
[25] Luo J, Cote L J, Tung V C, et al. Graphene oxide nanocolloids [J]. Journal of the American Chemical Society, 2010,132(50):17667-17669.
[26] Yoon K Y, An S J, Chen Y, et al. Graphene oxide nanoplatelet dispersions in concentrated NaCl and stabilization of oil/water emulsions [J]. Journal of Colloid and Interface Science, 2013, 403:1-6.
[27] Wu W Q, Yang Y, Zhou H H, et al. Highly efficient removal of Cu(II) from aqueous solution by using graphene oxide [J]. Water, Air, & Soil Pollution, 2013,224(1):1372-1372.
[28] Sitko R, Turek E, Zawisza B, et al. Adsorption of divalent metal ions from aqueous solutions using graphene oxide [J]. Dalton Transactions, 2013,42(16):5682-5689.
[29] Zhao G, Wen T, Yang X, et al. Preconcentration of U(VI) ions on few-layered graphene oxide nanosheets from aqueous solutions [J]. Dalton Transactions, 2012,41(20):6182-6188.
[30] Zhao G, Li J, Ren X, et al. Few-Layered Graphene oxide nanosheets as superior sorbents for heavy metal ion pollution management [J]. Environmental Science & Technology, 2011, 45(24):10454-10462.
[31] Cui L, Wang Y, Gao L, et al. Removal of Hg(II) from aqueous solution by resin loaded magnetic beta-cyclodextrin bead and graphene oxide sheet: Synthesis, adsorption mechanism and separation properties [J]. Journal of Colloid and Interface Science, 2015,456:42-49.
[32] Jiu-Hua D, Xiu-Rong Z, Guang-Ming Z, et al. Simultaneous removal of Cd(II) and ionic dyes from aqueous solution using magnetic graphene oxide nanocomposite as an adsorbent [J]. Chemical Engineering Journal, 2013,226:189-200.
[33] Li X, Tang X, Fang Y. Using graphene oxide as a superior adsorbent for the highly efficient immobilization of Cu(II) from aqueous solution [J]. Journal of Molecular Liquids, 2014,199:237-243.
[34] Mishra A K, Ramaprabhu S. Functionalized graphene sheets for arsenic removal and desalination of sea water [J]. Desalination, 2011,282:39-45.
[35] Chen W, Yan L, Bangal P R. Chemical reduction of graphene oxide to graphene by sulfur-containing compounds [J]. Journal of Physical Chemistry C, 2010,114(47):19885-19890.
[36] Gao J, Liu F, Liu Y, et al. Environment-friendly method to produce graphene that employs vitamin C and amino acid [J]. Chemistry of Materials, 2010,22(7):2213-2218.
[37] Bose S, Kuila T, Mishra A K, et al. Dual role of glycine as a chemical functionalizer and a reducing agent in the preparation of graphene: an environmentally friendly method [J]. Journal of Materials Chemistry, 2012,22(19):9696-9703.
[38] Zhu C, Guo S, Fang Y, et al. Reducing sugar: new functional molecules for the green synthesis of graphene nanosheets [J]. Acs Nano, 2010,4(4):2429-2437.
[39] Liu J, Fu S, Yuan B, et al. Toward a universal "adhesive nanosheet" for the assembly of multiple nanoparticles based on a protein-induced reduction/decoration of graphene oxide [J]. Journal of the American Chemical Society, 2010,132(21):7279-7281.
[40] Salas E C, Sun Z, Luttge A, et al. Reduction of graphene oxide via bacterial respiration [J]. Acs Nano, 2010,4(8):4852-4856.
[41] Wang G, Qian F, Saltikov C W, et al. Microbial reduction of
graphene oxide by Shewanella [J]. Nano Research, 2011,4(6):563-570.
[42] Jiao Y, Qian F, Li Y, et al. Deciphering the electron transport pathway for graphene oxide reduction by shewanella oneidensis MR-1 [J]. Journal of Bacteriology, 2011,193(14): 3662-3665.
[43] Akhavan O, Ghaderi E. Escherichia coli bacteria reduce graphene oxide to bactericidal graphene in a self-limiting manner [J]. Carbon, 2012,50(5):1853-1860.
[44] Khanra P, Kuila T, Kim NH, et al. Simultaneous biofunctionalization and reduction of graphene oxide by baker's yeast [J]. Chemical Engineering Journal, 2012,183:526-533.
[45] Kuila T, Bose S, Khanra P, et al. A green approach for the reduction of graphene oxide by wild carrot root [J]. Carbon, 2012,50:914-921.
[46] Li W, Tang X Z, Zhang H B, et al. Simultaneous surface functionalization and reduction of graphene oxide with octadecylamine for electrically conductive polystyrene composites [J]. Carbon, 2011,49(14):4724-4730.
[47] Lv W, Tao Y, Ni W, et al. One-pot self-assembly of threedimensional graphene macroassemblies with porous core and layered shell [J]. Journal of Materials Chemistry, 2011,21(33):12352-12357.
[48] Hou W C, Chowdhury I, Goodwin D G, Jr. , et al. Photochemical transformation of graphene oxide in sunlight [J]. Environmental Science & Technology, 2015,49(6):3435-3443.
[49] Li Z J, Chen F, Yuan L Y, et al. Uranium(VI) adsorption on graphene oxide nanosheets from aqueous solutions [J]. Chemical Engineering Journal, 2012,210:539-546.
[50] Gao Y, Li Y, Zhang L, et al. Adsorption and removal of tetracycline antibiotics from aqueous solution by graphene oxide [J]. Journal of Colloid and Interface Science, 2012,368:540-546.
[51] Hu X, Zhou M, Zhou Q. Ambient water and visible-light irradiation drive changes in graphene morphology, structure, surface chemistry, aggregation, and toxicity [J]. Environmental Science & Technology, 2015,49(6):3410-3418.
[52] Zhang Y H, Tang Y l, Li S Y, et al. Sorption and removal of tetrabromobisphenol A from solution by graphene oxide [J]. Chemical Engineering Journal, 2013,222:94-100.
[53] Apul O G, Wang Q, Zhou Y, et al. Adsorption of aromatic organic contaminants by graphene nanosheets: Comparison with carbon nanotubes and activated carbon [J]. Water Research, 2013,47(4):1648-1654.
[54] Pavagadhi S, Tang A L L, Sathishkumar M, et al. Removal of microcystin-LR and microcystin-RR by graphene oxide:Adsorption and kinetic experiments [J]. Water Research, 2013, 47(13):4621-4629.
[55] Kotchey G P, Allen B L, Vedala H, et al. The enzymatic oxidation of graphene oxide [J]. Acs Nano, 2011,5(3):2098-2108.
[56] Girish C M, Sasidharan A, Gowd G S, et al. Confocal raman imaging study showing macrophage mediated biodegradation of graphene in vivo [J]. Advanced Healthcare Materials, 2013,2(11):1489-1500.
[57] 吴春来,樊 静.石墨烯材料在重金属废水吸附净化中的应用[J]. 化工进展, 2013,32(11):2668-2694.
[58] Kyzas G Z, Deliyanni E A, Matis K A. Graphene oxide and its application as an adsorbent for wastewater treatment [J]. Journal of Chemical Technology and Biotechnology, 2014,89(2):196-205.
[59] Ruiz O N, Fernando KaS, Wang B, et al. Graphene oxide: A nonspecific enhancer of cellular growth [J]. Acs Nano, 2011, 5(10):8100-8107.
[60] Liu S, Zeng T H, Hofmann M, et al. Antibacterial activity of graphite, graphite oxide, graphene oxide, and reduced graphene oxide: membrane and oxidative stress [J]. Acs Nano, 2011,5(9):6971-6980.
[61] Karmali P P, Simberg D. Interactions of nanoparticles with plasma proteins: implication on clearance and toxicity of drug delivery systems [J]. Expert Opinion on Drug Delivery, 2011, 8(3):343-357.
[62] Akhavan O, Ghaderi E. Toxicity of graphene and graphene oxide nanowalls against bacteria [J]. Acs Nano, 2010,4(10):5731-5736.
[63] Tang Y, Tian J, Li S, et al. Combined effects of graphene oxide and Cd on the photosynthetic capacity and survival of Microcystis aeruginosa [J]. The Science of the total environment, 2015,532:154-161.
[64] Yue H, Wei W, Yue Z, et al. The role of the lateral dimension of graphene oxide in the regulation of cellular responses [J]. Biomaterials, 2012,33(16):4013-4021.
[65] Mu Q, Su G, Li L, et al. Size-Dependent cell uptake of protein-coated graphene oxide nanosheets [J]. ACS Applied Materials & Interfaces, 2012,4(4):2259-2266.
[66] Peng C, Hu W, Zhou Y, et al. Intracellular imaging with a graphene-based fluorescent probe [J]. Small, 2010,6(15):1686-1692.
[67] Gurunathan S, Han J W, Dayem A A, et al. Oxidative stress-mediated antibacterial activity of graphene oxide and reduced graphene oxide in Pseudomonas aeruginosa [J]. International Journal of Nanomedicine, 2012,7:5901-5914.
[68] Ahmed F, Rodrigues D F. Investigation of acute effects of graphene oxide on wastewater microbial community: A case study [J]. Journal of Hazardous Materials, 2013,256:33-39.
[69] Castrillon S R V, Perreault F, De Faria A F, et al. Interaction of graphene oxide with bacterial cell membranes: insights from force spectroscopy [J]. Environmental Science & Technology Letters,
2015,2(4):112-117.
[70] Lei H, Mi L, Zhou X, et al. Adsorption of double-stranded DNA to graphene oxide preventing enzymatic digestion [J]. Nanoscale, 2011,3(9):3888-3892.
[71] Li Y P, Wu Q L, Zhao Y L, et al. Response of microRNAs to in vitro treatment with graphene oxide [J]. Acs Nano, 2014,8(3):2100-2110.
[72] Das S, Singh S, Singh V, et al. Oxygenated functional group density on graphene oxide: Its effect on cell toxicity [J]. Particle & Particle Systems Characterization, 2013,30(2):148-157.
[73] Wang A, Pu K, Dong B, et al. Role of surface charge and oxidative stress in cytotoxicity and genotoxicity of graphene oxide towards human lung fibroblast cells [J]. Journal of Applied Toxicology, 2013,33(10):1156-1164.
[74] Wahid M H, Eroglu E, Chen X J, et al. Entrapment of chlorella vulgaris cells within graphene oxide layers [J]. Rsc Advances, 2013,3(22):8180-8183.
[75] Hu C W, Wang Q, Zhao H T, et al. Ecotoxicological effects of graphene oxide on the protozoan Euglena gracilis [J]. Chemosphere, 2015,128:184-190.
[76] Nogueira P F M, Nakabayashi D, Zucolotto V. The effects of graphene oxide on green algae Raphidocelis subcapitata [J]. Aquatic toxicology (Amsterdam, Netherlands), 2015,166:29-35.
[77] Hu X, Lu K, Mu L, et al. Interactions between graphene oxide and plant cells: Regulation of cell morphology, uptake, organelle damage, oxidative effects and metabolic disorders [J]. Carbon, 2014,80:665-676.
[78] Ouyang S H, Hu X G, Zhou Q X. Envelopment-Internalization synergistic effects and metabolic mechanisms of graphene oxide on single-cell chlorella vulgaris are dependent on the nanomaterial particle size [J]. ACS Applied Materials & Interfaces, 2015,7(32):18104-18112.
[79] Hu C, Wang Q, Zhao H, et al. Ecotoxicological effects of graphene oxide on the protozoan Euglena gracilis [J]. Chemosphere, 2015,128:184-190.
[80] Van Hoecke K, Quik J T K, Mankiewicz-Boczek J, et al. Fate and effects of CeO2nanoparticles in aquatic ecotoxicity tests [J]. Environmental Science & Technology, 2009,43(12):4537-4546.
[81] Chen L, Hu P, Zhang L, et al. Toxicity of graphene oxide and multi-walled carbon nanotubes against human cells and zebrafish [J]. Science China-Chemistry, 2012,55(10):2209-2216.
[82] Liu X T, Mu X Y, Wu X L, et al. Toxicity of multi-walled carbon nanotubes, graphene oxide, and reduced graphene oxide to zebrafish embryos [J]. Biomedical and Environmental Sciences, 2014,27(9):676-683.
[83] Mu L, Gao Y, Hu X G. L-Cysteine: A biocompatible, breathable and beneficial coating for graphene oxide [J]. Biomaterials, 2015, 52:301-311.
[84] Zhou X, Laroche F, Lamers G E M, et al. Ultra-small graphene oxide functionalized with polyethylenimine (PEI) for very efficient gene delivery in cell and zebrafish embryos [J]. Nano Research, 2012,5(10):703-709.
[85] Mesaric T, Gambardella C, Milivojevic T, et al. High surface adsorption properties of carbon-based nanomaterials are responsible for mortality, swimming inhibition, and biochemical responses in Artemia salina larvae [J]. Aquatic Toxicology, 2015, 163:121-129.
[86] Feng L, Liu Z. Graphene in biomedicine: opportunities and challenges [J]. Nanomedicine, 2011,6(2):317-324.
[87] Geim A K, Novoselov K S. The rise of graphene [J]. Nature Materials, 2007,6(3):183-191.
[88] Dan M, Wu P, Grulke E A, et al. Ceria-engineered nanomaterial distribution in, and clearance from, blood: size matters [J]. Nanomedicine, 2012,7(1):95-110.
[89] Erickson K, Erni R, Lee Z, et al. Determination of the local chemical structure of graphene oxide and reduced graphene oxide [J]. Advanced Materials, 2010,22(40):4467-4472.
[90] Perreault F, De Faria A F, Nejati S, et al. Antimicrobial properties of graphene oxide nanosheets: Why size matters [J]. Acs Nano, 2015,9(7):7226-7236.
[91] Liu S, Hu M, Zeng T H, et al. Lateral dimension-dependent antibacterial activity of graphene oxide sheets [J]. Langmuir, 2012,28(33):12364-12372.
[92] Liu J H, Yang S T, Wang H, et al. Effect of size and dose on the biodistribution of graphene oxide in mice [J]. Nanomedicine, 2012,7(12):1801-1812.
[93] Chen Y M, Ren C X, Ouyang S H, et al. Mitigation in multiple effects of graphene oxide toxicity in zebrafish embryogenesis driven by humic acid [J]. Environmental Science & Technology, 2015,49(16):10147-10154.
[94] Arias L R, Yang L. Inactivation of bacterial pathogens by carbon nanotubes in suspensions [J]. Langmuir, 2009,25(5):3003-3012.
[95] Lyon D Y, Adams L K, Falkner J C, et al. Antibacterial activity of fullerene water suspensions: Effects of preparation method and particle size [J]. Environmental Science & Technology, 2006, 40(14):4360-4366.
[96] Kang S, Mauter M S, Elimelech M. Microbial cytotoxicity of carbon-based nanomaterials: Implications for river water and wastewater effluent [J]. Environmental Science & Technology, 2009,43(7):2648-2653.
[97] Hotze E M, Labille J, Alvarez P, et al. Mechanisms of photochemistry and reactive oxygen production by fullerene suspensions in water [J]. Environmental Science & Technology, 2008,42(11):4175-4180.
[98] Ali-Boucetta H, Bitounis D, Raveendran-Nair R, et al. Purified graphene oxide dispersions lack in vitro cytotoxicity and in vivo pathogenicity [J]. Advanced Healthcare Materials, 2013,2(3):433-441.
[99] Park S, Mohanty N, Suk J W, et al. Biocompatible, robust freestanding paper composed of a TWEEN/Graphene composite [J]. Advanced Materials, 2010,22(15):1736-+.
[100] Liu Z, Robinson J T, Sun X M, et al. PEGylated nanographene oxide for delivery of water-insoluble cancer drugs [J]. Journal of the American Chemical Society, 2008,130(33):10876-+.
[101] Yang K, Zhang S, Zhang G, et al. Graphene in mice: Ultrahigh in vivo tumor uptake and efficient photothermal therapy [J]. Nano Letters, 2010,10(9):3318-3323.
[102] Zhang S, Yang K, Feng L Z, et al. In vitro and in vivo behaviors of dextran functionalized graphene [J]. Carbon, 2011, 49(12):4040-4049.
[103] Hu X G, Mu L, Wen J P, et al. Covalently synthesized graphene oxide-aptamer nanosheets for efficient visible-light photocatalysis of nucleic acids and proteins of viruses [J]. Carbon, 2012,50(8):2772-2781.
[104] Duch M C, Budinger G R S, Liang Y T, et al. Minimizing oxidation and stable nanoscale dispersion improves the biocompatibility of graphene in the lung [J]. Nano Letters, 2011, 11(12):5201-5207.
Fate and toxicity of graphene oxide in aquatic environment.
LÜ Xiao-hui1,2, CHEN Bai-yang1, ZHU Xiao-shan2*(1.Shenzhen Key Laboratory of Water Resource Utilization and Environmental Pollution Control, Harbin Institute of Technology Shenzhen Graduate School, Shenzhen 518055, China;2.Shenzhen Key Laboratory for Coastal Ocean Dynamic and Environment, Graduate School at Shenzhen, Tsinghua University, Shenzhen 518055, China). China Environmental Science, 2016,36(11):3348~3359
As a special graphene derivative, graphene oxide features unique properties and broad applicability in a wide range of industrial areas. However, due to its high hydrophilicity and surface reactivity, its fate and environmental risks to aquatic organisms in the environment have drawn considerable attention worldwide recently. Therefore, more knowledge regarding the aquatic behaviors and ecological effects of graphene oxide is of great importance to guide its future application and recovery. In this context, this review summarized a list of literature concerning the fate of graphene oxide in the environment, including dispersion/aggregation, adsorption, and reduction of graphene oxide, as well as its toxicity to a variety of aquatic organisms, such as zooplanktons and fishes.Accordingly, this paper discussed some challenges and prospects of its use on future studies.
graphene oxide; water environment; aquatic behaviors; biotoxicity
X703.5
A
1000-6923(2016)11-3348-12
吕小慧(1990-),女,山东聊城人,哈尔滨工业大学深圳研究生院博士研究生,主要从事纳米材料的环境效应研究.
2016-03-25
国家自然科学基金(41373089,41573094);深圳市科技计划基础研究项目(JCYJ20150331151536446,JCYJ20150529164918736)
* 责任作者, 副教授,:zhu.xiaoshan@sz.tsinghua.edu.cn
