电Fenton试剂助TiO2可见光催化降解水中的特丁津
2016-12-20唐建军陈益清杨声海深圳职业技术学院建筑与环境工程学院广东深圳58055中南大学冶金科学与工程学院湖南长沙40083
唐建军,陈益清,蒋 涛,杨声海(.深圳职业技术学院建筑与环境工程学院,广东 深圳 58055;.中南大学冶金科学与工程学院,湖南 长沙 40083)
电Fenton试剂助TiO2可见光催化降解水中的特丁津
唐建军1*,陈益清1,蒋 涛2,杨声海2(1.深圳职业技术学院建筑与环境工程学院,广东 深圳 518055;2.中南大学冶金科学与工程学院,湖南 长沙 410083)
以网状铱钽钛涂层电极为阳极、石墨板为阴极,设计了一种在线生成H2O2的电化学反应器,并研究了电 Fenton试剂(电生 H2O2及Fe3+)助 TiO2可见光催化降解特丁津的情况.结果表明:电化学法在线生成 H2O2能助 TiO2可见光催化降解特丁津,反应 180min降解率近100%;而以Fe3+协同TiO2则显著加快反应速率,反应30min降解率达100%;特丁津的降解始于脱氯,然后脱特丁基、乙基、氨基;通过对反应体系的光谱分析显示,特丁津的降解涉及羟基自由基(·OH)及超氧自由基(·O2-)的产生与参与.
可见光催化;电Fenton试剂;特丁津;羟基自由基;超氧自由基
特丁津(terbutylazine,分子式 C9H16ClN5)是一种三嗪类除草剂,主要通过植株根的吸收达到除草的效果,但在施加环境后会构成对生态环境的破坏,已被认定为内分泌干扰物质(ECDs).特丁津结构稳定,被微生物矿化过程十分缓慢,目前对这一环境污染物的去除主要以高级氧化法为主.TiO2光催化作为一种基于羟基自由基(·OH)过程的高级氧化技术,在应用于降解水环境中的特丁津等难生物降解的有机污染物方面具有优势.但由于 TiO2的光吸收范围限于波长小于387nm的紫外区,而太阳光谱中紫外部分能量通常不到 5%,实际应用时需要耗费大量的电能产生紫外光,致使这一高级氧化技术目前难以工程推广应用.
从利用太阳能角度出发,发展TiO2可见光催化反应势在必行,此项工作主要集中在对TiO2金属[1]或非金属[2]掺杂.掺杂处理虽可拓宽 TiO2的光吸收范围至可见光区,也将同时影响TiO2的稳定性,且掺杂后的 TiO2能带间隙变窄,在可见光作用下对有机污染物的降解有选择性[3].此外,也
有研究者基于有机染料分子吸收可见光形成激发态的特点,开发TiO2可见光催化降解有机染料的反应体系[4],但降解对象限于染料类有机物,且在染料分子的发色基团被破坏后反应相应停止,反应既矿化度低,也不能降解特丁津等无色有机污染物.
研究表明,H2O2可吸附于 TiO2表面形成复合物,并助 TiO2可见光催化降解水杨酸[5]、利谷隆[6-7]、阿特拉津[8]、扑草净[9]等无色有机污染物;反应机理区别于TiO2的掺杂改性或有机染料的光敏化效应,反应的实质是H2O2吸附于TiO2表面形成复合物,再在可见光作用下转为自由基等活性物种所致[5-10].制约这一可见光催化反应实际应用的最大不足H2O2的储存、在反应体系的传质、与TiO2复合物的形成及利用率等[11],而以电化学法向反应体系现场提供H2O2则有望解决以上不足.
以电化法在线生成 H2O2广泛应用于电Fenton水处理过程[12],与TiO2可见光催化耦合则少有研究,且在现有的少量报道中,TiO2光催化剂一般镀膜于阳极或阴极Ti表面[13-14],电极制备工艺复杂,且镀膜于电极Ti表面的TiO2非常困难与H2O2复合形成复合物,从而导致反应效率不高.为此,本工作以石墨板为阴极,铱钽涂层的 Ti极板为阳极,催化剂TiO2则以悬浊物形式加入反应体系,研究这一光电催化反应体系降解特丁津的效能,测试反应体系的活性物种,并研究 Fe3+与TiO2的协同效应.
1 材料与方法
1.1 试验材料与装置
图1为实验装置.以恒电流/电位仪(PS-1)提供直流电源;反应槽为玻璃 U型槽,单边规格φ55×120mm,容积 300mL,中间隔膜为阳离子交换膜,有效直径φ50mm,阴极选用石墨板(50×70×1mm),阳极选用铱钽涂层的钛极板(45×90×1.5mm);以硫酸钠(AR)为支持电解质,用稀H2SO4调节反应体系pH值为3.0,溶液pH值由Thermo ORION STAR A211型精密pH计测定;激发光源采用CMH-250型金卤灯光纤照射装置,功率 200W,发光波长范围 380~800nm,滤光片规格为400nm,光强80W/m2;催化剂采用混晶TiO2(德国 Degussa产品),记为 TIO;模型污染物特丁津(纯度99.4%)的起始浓度8mg/L,其分子结构式及液相色谱图如图2所示,记为TDJ;溶液体积为160mL,除非特别说明,催化剂TIO浓度为1.0g/L, Fe3+(以Fe2(SO4)3加入)浓度1.0mmol/L.
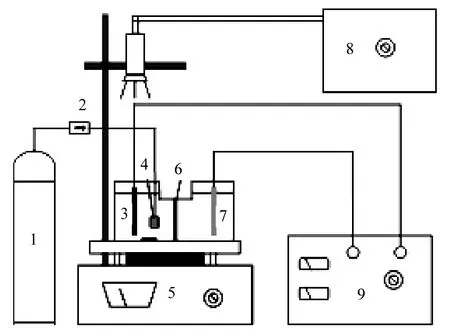
图1 光电化学催化反应器实验装置Fig.1 Schematic diagram of the experimental apparatus

图2 特丁津的分子结构式和液相色谱图Fig.2 Molecular structure and HPLC spectra of terbuthylazine
1.2 试验方法
试验过程中,先于电解槽阴极和阳极端各加入160mL含8mg/L的特丁津原液、定量Na2SO4和TIO催化剂,暗态下曝气并搅拌15min后,打开金卤灯开始实验.根据正交优化实验结果,确定电
极间距D=12cm、电流值I=40mA、支持电解质Na2SO4浓度0.075mol/L、氧气曝气量0.4L/min.控制上述条件通电 60min后,阴极端电生 H2O2浓度约1.60mmol/L.
反应过程可表示为:

1.3 分析与测试
特丁津浓度分析采用Waters 2695型高效液相色谱仪,其中进样量 10µL,流动相 V(乙腈):V(水)=60:40,流速 1.0mL/min,分离柱 Symmetry C18 5um,4.6×150mm,2998PDA检测器,检测波长λ=224nm;H2O2浓度分析采用草酸钛钾分光光度法,检测波长 λ=385nm;反应体系羟基自由基(·OH)的测试采用 Hitachi F-7000型荧光分光光度计,以浓度3.0×10-3mol/L的对苯二甲酸作探针分子,溶液pH值为11[15];超氧自由基(·O2-)的测试则利用氯化硝基四氮唑蓝(NBT)可被·O2-还原产生蓝色(或黑紫色)沉淀来表征[16],其中NBT的浓度为40mg/L,反应时间15min.Cl-和NO3-的浓度分析采用戴安DIONEX ISC-1500型离子色谱仪,分离柱Ion Pac AS 9-HC(4×250mm),电导检测器,淋洗液为9mmol/L的Na2CO3(优级纯)溶液,流速为1.0mL/min,进样量25µL;降解过程中间产物通过液相色谱质谱联用仪检测,色谱条件同液相色谱,质谱采用Thermo Finnigan公司LCQ Deca XP型LC-MS联用仪,质谱条件:ESI源,正离子扫描,离子源电压 3.5KV,毛细管电压 24V,毛细管温度250℃,扫描分子量80~240.
2 结果与讨论
2.1 不同反应条件的影响
图3为不同反应条件下反应体系H2O2的浓度变化趋势.由图3可知,单纯阴极电生H2O2其浓度随电解时间延长稳定增大,电解60min时其浓度达1.6mmol/L;往电解体系加入TIO或Fe3+后,H2O2浓度则有一定程度降低,60min时分别约为 1.2mmol/L、0.8mmol/L,而同时加入 TIO和Fe3+后,H2O2浓度则显著降低,20min时即降低至约 0.1mmol/L.其原因是反应体系中一方面阴极不断电解生成H2O2,表现为H2O2浓度不断增大,在加入Fe3+或TIO时则它们又可催化分解H2O2,即反应体系 H2O2同时在线生成及催化分解,故此时 H2O2浓度出现一定程度的降低,而同时加入Fe3+和TIO,则显示两者在催化分解H2O2时具明显的协同效应.

图3 不同反应条件H2O2浓度变化情况Fig.3 Change of H2O2concentration at different conditions
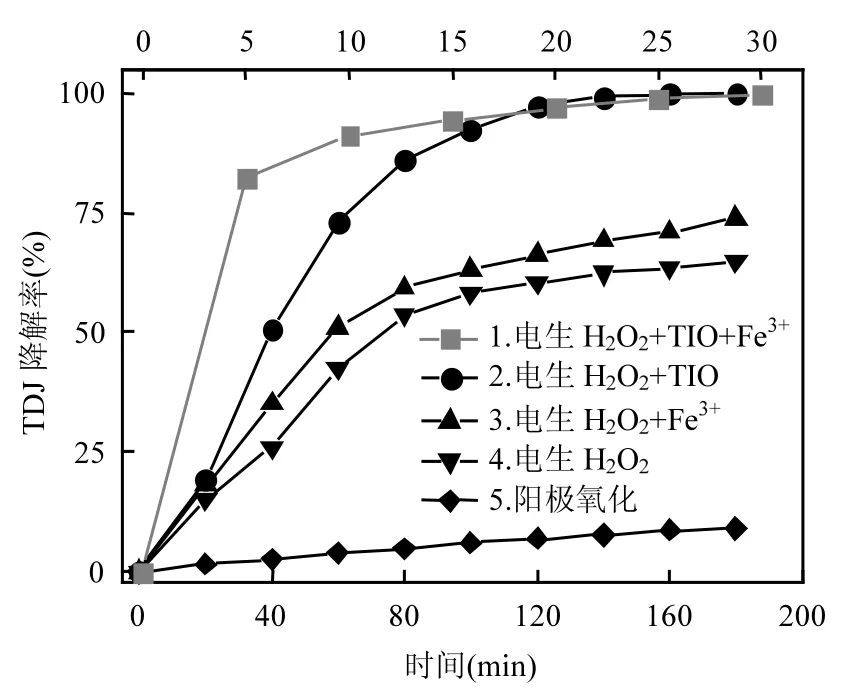
图4 不同反应条件降解特丁津的实验结果Fig.4 Results of terbuthylazine degradation at different conditions
图 4为不同反应条件下特丁津的降解情况.由图4可知,单纯电化学反应时,阳极氧化对特丁津没明显降解效果,反应180min降解率仅9%,阴极电生H2O2有一定的降解效果,降解率约为65%;
往阴极槽加入TIO或Fe3+后,则特丁津的降解率显著增大,反应180min降解率分别达99%及74%以上;而往阴极槽同时加入 TIO和 Fe3+,构成电Fenton与TiO2催化协同体系,则特丁津的降解效果更为明显,反应30min降解率即达100%.实验结果显示较文献报道[6-7,9]更快的降解速率及更彻底的降解效果,其原因是本研究反应体系中的H2O2同时在线持续生成及催化分解,解决了现有研究存在的反应后期降解效率低的不足[6-7],也由于 TiO2-Fe3+存在的协同催化效应[8],降解速率显著加快.
2.2 反应体系活性物种
图5为不同反应体系的3D荧光扫描谱图,其中溶液体系的pH值11,反应时间60min,探针分子对苯二甲酸的浓度3.0mmol/L.表明以TIO作光催化剂,以及反应体系通电生成H2O2情况下,在波长312nm光激发下,422nm发射处有一很强的荧光峰,而反应体系不通电即无 H2O2情况下,则422nm发射处并未出现明显的荧光峰.

图5 对苯二甲酸溶液体系的荧光3d扫描光谱Fig.5 The 3d scaned fluorescence spectroscopy of the supernatant liquid containing 3mM TA
·OH自由基是光催化反应体系中的主要活性物种,但对苯二甲酸可与其作用生成荧光物质二羟基对苯二甲酸(TA-OH)[15].因此,反应体系中荧光的产生是由于·OH自由基与对苯二甲酸生成TA-OH的结果,而荧光强度越强,说明体系中产生的·OH自由基越多,即可通过对荧光峰及其强度的测试来判断反应体系是否产生·OH及其浓度大小.
图 6为不同反应体系荧光峰强度随时间变化关系.由图6可知,单纯阴极电生H2O2体系,几乎检测不到自由基的生成;往阴极电解体系加入Fe3+或TIO后,则能检测到自由基的生成;而在同时加入TIO和Fe3+后,则反应体系·OH产生量急剧增大,但由于电解过程持续生成H2O2,而H2O2本身又是·OH自由基的湮灭剂,表现为图中荧光峰强度在10min后开始急剧下降.图6实验结果与图3及图4实验结果完全一致,即Fe3+或TIO能催化分解电生H2O2产生·OH自由基,并显示明显的协同效应.
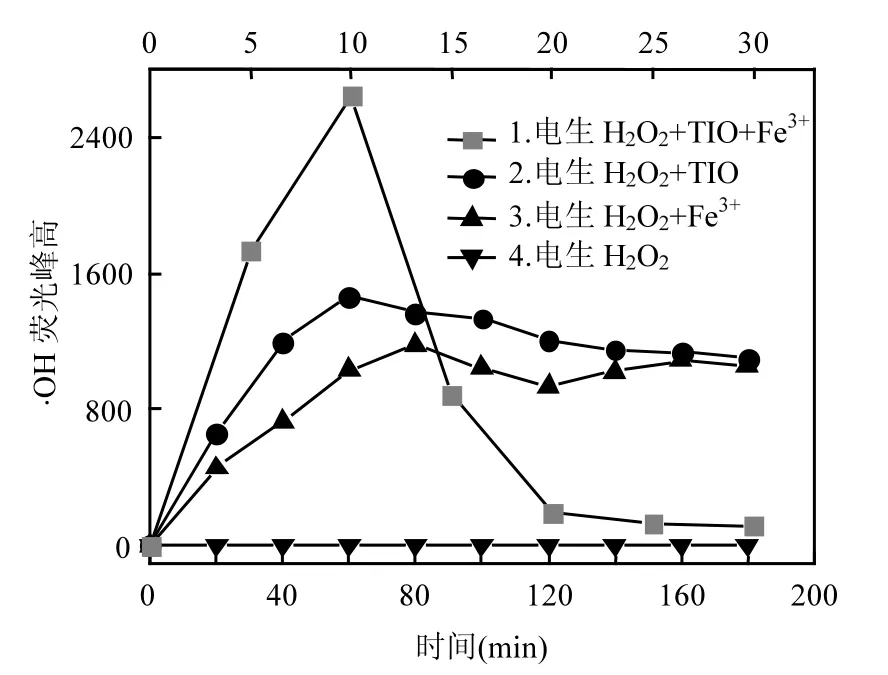
图6 不同反应条件下·OH产生量对比Fig.6 Comparison of ·OH formation amount at different conditions
图7为TIO-Fe3+协同催化电生H2O2反应体系·O2-活性物种的定性检测结果. ·O2-能将氯化硝基四氮唑蓝(NBT)还原生成蓝色或紫色沉淀,当反应体系·O2-较少,而NBT过量时,沉淀为蓝色,当·O2-过量时则为紫色[15].表明反应前在体系加入NBT时还原沉淀产物为白色,即此时反应体系
没有·O2-,反应一定时间后再加入NBT则还原沉淀产物为紫色,并随时间延长颜色更深,即此时反应体系有·O2-的生成.由此表明本研究反应体系特丁津的降解涉及·OH及·O2-等活性物种的产生与参与.

图7 不同反应时间硝基四氮唑蓝溶液体系的还原沉淀Fig.7 Reduzate of NBT at different reaction time
2.3 特丁津的降解途径

图8 不同反应时间液相色谱叠堆图Fig.8 Stack HPLC spectra at different reaction time
为更进一步了解特丁津的降解情况,对降解过程可能生成的中间产物作液相色谱分析,结果如图8所示.由图8可知,保留时间5.4min的色谱峰 5为特丁津特征峰,其色谱峰高和峰面积随反应时间不断变小,即随反应时间进行,特丁津不断被降解;色谱图还出现峰1、峰2、峰3和峰4,说明降解过程生成了多种中间产物,但各色谱峰变化没有呈现出与降解时间明显的规律性,说明这些中间产物在产生的同时也有部分被继续降解.

图9 反应体系Cl-和NO3-浓度随反应时间变化Fig.9 Changes of Cl-and NO3-concentration at different reaction time

表1 质谱检测的主要产物质荷比Table 1 The m/z of the main degradation products by HPLC-MS analysis

图10 反应前色谱图和质谱图Fig.10 HPLC and LC-ESI-MS spectra before reaction
图9为反应体系中Cl-和NO3-浓度随时间变化关系.由图9可知,反应进行5min后,Cl-浓度不
再变化,即特丁津的脱氯反应基本结束.在本研究条件下,初始浓度8mg/L的特丁津,反应30min后降解率近 100%,若支链的氯和氮脱除完全,则反应体系 Cl-浓度约 1.443mg/L,NO3-浓度约4.826mg/L.由此说明特丁津降解过程中脱氯完全,但支链氮只有部分转化为 NO3-,以离子色谱法检测到反应体系中的 NO3-浓度仅 0.45mg/L.为此,再对反应体系作LC-MS分析,其中表1为反应不同时刻的质谱结果,图10及图11分别为水样初始及反应10min后的质谱图谱.
特丁津相对分子质量为 229,正离子化后为[M+H]+质荷比为230,即图10中m/z 230.5处,主要的特征离子碎片是m/z 174.5 (丢失56amu).特丁津电离时可失去乙基-C2H5(M=29)、特丁基-C4H9(M=57)碎片或者二者同时失去而得到离子m/z 202、m/z 174和m/z 147.图11出现的离子m/z 212、m/z 185、m/z 156、m/z 129,则是降解过程中间产物离子化后的;离子 m/z 212对应物质为脱氯产物2-羟基特丁津;离子m/z 155对应物质为脱氯脱特丁基产物2-羟基脱特丁基特丁津;离子m/z 185对应物质为脱氯脱乙基脱氨基产物2,6-二羟基特丁津;离子m/z 129对应物质为脱氯脱乙基脱特丁基脱氨基产物 2,6-二羟基,4-氨基特丁津.
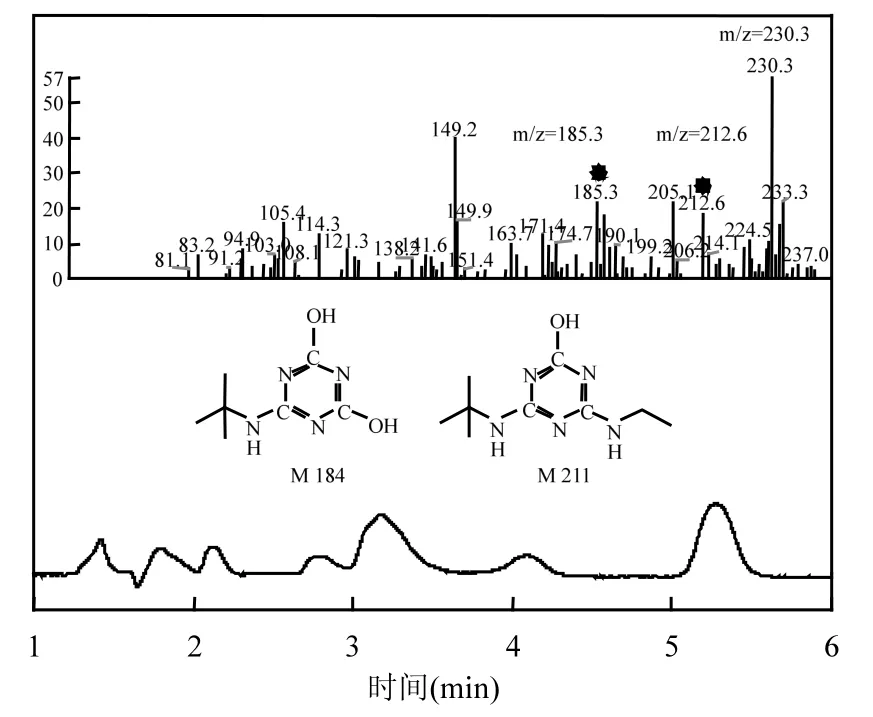
图11 反应10min后色谱图和质谱图Fig.11 HPLC and LC-MS spectra after 10min reaction
以上分析结果表明,特丁津的降解始于脱氯,生成2-羟基特丁津,然后进行脱特丁基、乙基、氨基,降解过程中没有开环反应,脱氮不完全,只有部分氨基被氧化为 NO3-,最后产物 2,6-二羟基,4-氨基特丁津.降解途径如下:

图12 特丁津降解途径示意Fig.12 Schematic diagram of terbuthylazine degradation pathway
3 结论
3.1 以网状铱钽钛电极为阳极、石墨板为阴极,电极间距D = 12cm、电流值I = 40mA、支持电解质Na2SO4浓度C = 0.075mol/L、氧气曝气量Q = 0.4L/min,在此条件下阴极侧持续稳定生成
H2O2,60min后浓度达1.60mmol/L.
3.2 电Fenton试剂(在线生成H2O2及Fe3+)能助TiO2可见光催化降解特丁津,反应30min降解率达 100%,显示较高及彻底的降解效果,特丁津的降解涉及羟基自由基(·OH)及超氧自由基()的产生与参与.
3.3 特丁津的降解过程中,生成了多种中间产物,始于脱氯,然后进行脱特丁基、乙基、氨基,但降解过程中没有开环反应,脱氮也不完全.
[1] 袁 霞,高碧芬,万建风,等.具有高活性(001)晶面的 Cr-Ti O2微球的制备及可见光催化性能 [J]. 高等学校化学学报, 2015, 36(2):355-360.
[2] Asahi R, Ohwika T, Morikawa T, et al. Visible-light photocatalysis in nitrogen-doped titanium oxides [J]. Science, 2001, 293(13):269-271.
[3] Marta M, William B, Colussi A J, et al. Oxidative power of nitrogen-doped TiO2photocatalysts under visible illumination [J]. J. Phys. Chem. B: 2004,108(45):17269-17273.
[4] 王 齐,赵进才,丛燕青,等.无定形TiO2可见光敏化降解染料污染物 [J]. 催化学报, 2011,32(6):1076-1082.
[5] Li X Z, Chen C C, Zhao J C, et al. Mechanism of photodecomposition of H2O2on TiO2surfaces under visible light irradiation [J]. Langmuir, 2001,17:4118-4122.
[6] Yao Y F, Chu W . Reaction mechanism of linuron degradation in TiO2suspension under visible light irradiation with the assistance of H2O2[J]. Environ. Sci. Technol., 2009,43:6183-6189.
[7] Yao Y F, Chu W. Linuron decomposition in aqueous semiconductor suspension under visible light irradiation with and without H2O2[J]. Chemical Engineering Journal, 2010,158:181-187.
[8] 唐建军,邹 原. TiO2-Fe3+可见光催化H2O2降解阿特拉津的协同效应 [J]. 环境科学学报, 2013,33(3):736-741.
[9] 李庆奎,周秉彦. H2O2助 TiO2可见光催化降解水中的扑草净[J]. 郑州大学学报, 2014,35(1):55-59.
[10] Ohno T, Mitsui T, Matsumura M . TiO2-photocatalyzed oxidation of adamantane in solutions containing oxygen or hydrogen peroxide [J]. J. Photochem. Photobio A: Chem., 2003,160:3-9.
[11] Liu W, Liu H C, Ai Z H. In-situ generated H2O2induced efficient visible light photo-electrochemical catalytic oxidation of PCPNa with TiO2[J]. J. Hazard. Mater., 2015,288:97-103.
[12] Rosales E, Pazos M, Sanroman M A. Advances in the electro-Fenton process for remediation of recalcitrant organic compounds [J]. Chem. Eng. Technol., 2012,35:609-617.
[13] Li X Z, Liu H S. Development of an E-H2O2TiO2photoelectrocatalytic oxidation system for water and wastewater treatment, Environ. Sci. Technol [J]. 2005,39:4614–4620.
[14] Jin Y N, Zhao G H, Wu M F, et al. In situ induced visible-light photoeletrocatalytic activity from molecular oxygen on carbon aerogel-supported TiO2[J]. J. Phys. Chem. C, 2011,115:9917–9925.
[15] Ishibashi K, Fujishima A, Watanabe T. Detection of Active Oxidative Species in TiO2Photocatalysis Using the Fluorescence Technique [J]. Electrochemistry Communications, 2000,2:207-210.
[16] 刘瑞恒,付时雨,詹怀宇.氯化硝基四氮唑蓝显色检测超氧阴离子自由基的研究 [J]. 分析测试学报, 2008,27(4):355-359.
Degradation of terbuthylazine by TiO2visible photocatalysis with electro-generated Fenton reagent assistance.
TANG Jian-jun1*, CHEN Yi-qing1, JIANG Tao2, YANG Sheng-hai2(1.School of Construction and Environmental Engineering, Shenzhen Polytechnic, Shenzhen 518055, China;2.School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China). China Environmental Science, 2016,36(11):3304~3310
A electro-chemical reactor with H2O2in-situ generation was designed, which using net structure Ir_Ta oxide coated Ti metal as anode, and platelike graphite as cathode, the degradation of terbuthylazine by TiO2visible-light photocatalysis with electro-generated Fenton reagent (electrogenerated H2O2and Fe3+) assiatance was also studied. Terbuthylazine could be degraded by TiO2visible-light photocatalysis with electrogenerated H2O2assiatance, and the degradation ratio could be 100% after 180 min reaction. Snergistic degradation of terbuthylazine was evidently fast when additionally adding Fe3+, its degradation ratio could be 100% after 30 min reaction. In the degradation process of terbuthylazine, dechlorination was first carried out, and tert-butyl, ethyl, amino groups were then oxidized. Spectrum analysis indicated that the reaction process was predominated by the hydroxyl free radical (·OH) and superoxide radical (·O2
visible light photocatalysis;electro-generated fenton reagent;terbuthylazine;hydroxyl free radical;superoxide radical
X703
A
1000-6923(2016)11-3304-07
唐建军(1973-),男,湖南东安人,教授,博士,主要从事水污染控制化学研究.发表论文40余篇.
2016-03-19
广东省自然科学基金(9151018201000029);深圳市科技计划项目(JCYJ20140508155916429)
* 责任作者, 教授, tangjj7384@sina.com
-) generation in the system.
