基于叶形态学的枇杷小种子植株遗传多样性研究
2016-12-19谢红江杨文渊王永清潘翠萍涂美艳张耀勋
陶 炼, 谢红江, 杨文渊, 王永清, 潘翠萍, 涂美艳,李 靖, 张耀勋
(1. 四川省农业科学院园艺研究所,四川 成都 610066;2. 四川农业大学园艺学院,四川 雅安 625014;3. 阿坝州茂县南新镇人民政府,四川 茂县 623200)
基于叶形态学的枇杷小种子植株遗传多样性研究
陶 炼1, 谢红江1, 杨文渊1, 王永清2, 潘翠萍2, 涂美艳1,李 靖1, 张耀勋3
(1. 四川省农业科学院园艺研究所,四川 成都 610066;2. 四川农业大学园艺学院,四川 雅安 625014;3. 阿坝州茂县南新镇人民政府,四川 茂县 623200)
从小种子育种途径出发,以79份大五星小种子再生植株为试材,通过测量各份单株植株的13个叶形态特征值,对其遗传多样性进行了研究。结果表明,退化种子植株在叶形态上具有较丰富的遗传多样性(D=0.785),其中叶长(D=0.991),叶宽(D=0.994),叶柄长(D=0.982),叶柄宽(D=0.995),叶片厚度(D=0.987)等多样性指数居于前列,表现出最高的遗传多样性水平,各个特征变异幅度很大,变异系数在9.84 %~40.09 %;UPGMA法将79份材料分为了6大类群,各个类群间叶表型各异且丰富;第Ⅰ类和第Ⅵ类表现最为特殊,明显区别于母本大五星。其中Ⅰ类表型为:叶片大型、叶柄粗长、叶色浓绿、质地厚实、坚硬。Ⅵ类表现为叶片细小、叶柄细长、叶色黄绿、质地偏薄软,为枇杷优良种质选育和核心种质构建的重要类群。鉴于退化种子植株在叶形态上呈现出丰富的遗传多样性,且少数植株表现显著特殊,因此退化种子途径可作为一个新思路进行枇杷新品种新品系选育,为小种子途径开拓种质资源提供了重要的形态学依据。
枇杷; 退化种子植株; 性状; 叶形态; 多样性
枇杷(EriobotryajaponicaLindl.)原产我国,是南方名贵特产果品之一[1]。由于果实成熟于水果淡季,加以果肉柔软多汁,甜酸适度,风味优美,又具有很丰富的营养价值[2]和药用价值[3],深受人们喜爱。因此,枇杷优良品种的选育和推广具有很大的发展空间。
丰富的种质资源是培育出优良品种的前提和基础[4],寻找新途径拓宽植物遗传资源范围,创新和丰富种质资源越来越受到育种工作者的重视[5]。近几年小种子在果树育种中的价值成为研究热点[6-8],研究表明小种子植株在形态学,细胞学,分子生物学水平上均表现出丰富的遗传多样性[9]。因此小种子途径可能成为一种拓宽和创新种质资源的新途径。
小种子即大小为正常种子的1/3~1/6或更小,饱满,种胚部分败育。枇杷果实有5个心室,每心室各有2粒种子,在果实发育过程中,由于各种原因多数种子不同程度退化,每个果实仅有 3~4 粒种子发育成熟,约有 0.6 粒小种子产生[10]。自20世纪90年代以来,四川省农科院园艺所的研究人员经过多年潜心研究,利用大五星枇杷自然授粉所得小种子,成功培育了一批小种子植株。本文从叶形态标记入手对枇杷小种子植株进行分析,旨在检测小种子植株遗传多样性状况,为通过小种子途径进行枇杷育种提供依据,同时为其它果树和园艺植物种质资源开拓提供思路和借鉴。
1 材料与方法
1.1 材料
供试材料为四川农业大学生物技术研究中心种质资源圃内79份大五星枇杷后代10年生小种子植株。
1.2 方法
试验于2012-2014年在四川农业大学生物技术研究中心种质资源圃内进行, 连续3年在枇杷夏梢停止生长期调查记录了79株小种子植株叶的13个形态学性状,评价标准及对质量性状的赋值参照《中国果树志——龙眼枇杷卷》[1]和《枇杷种质资源描述和数据标准》[11]。
1.3 分析统计方法
用Excel 2003统计各性状平均数、标准差、最大值、最小值、极差、变异系数和多样性指数。多样性指数采用辛普森指数[12],DPS v3.01软件对数据进行标准化转换,样本间的距离采用欧氏距离,应用可变类平均法(UPGMA)进行系统聚类分析。
2 结果与分析
2.1 遗传多样性评价
枇杷小种子植株叶形态多样性分析结果见表2。各性状多样性指数变化范围在0.514~0.995,平均为0.785,显示出丰富的遗传多样性,其中叶长(D=0.991),叶宽(D=0.994),叶柄长(D=0.982),叶柄宽(D=0.995),叶片厚度(D=0.987)等多样性指数居于前列,表现出最高的遗传多样性水平,各个特征变异幅度很大,变异系数在9.84 %~40.09 %.说明大五星小种子再生植株叶形态表型丰富,选择潜力较高。
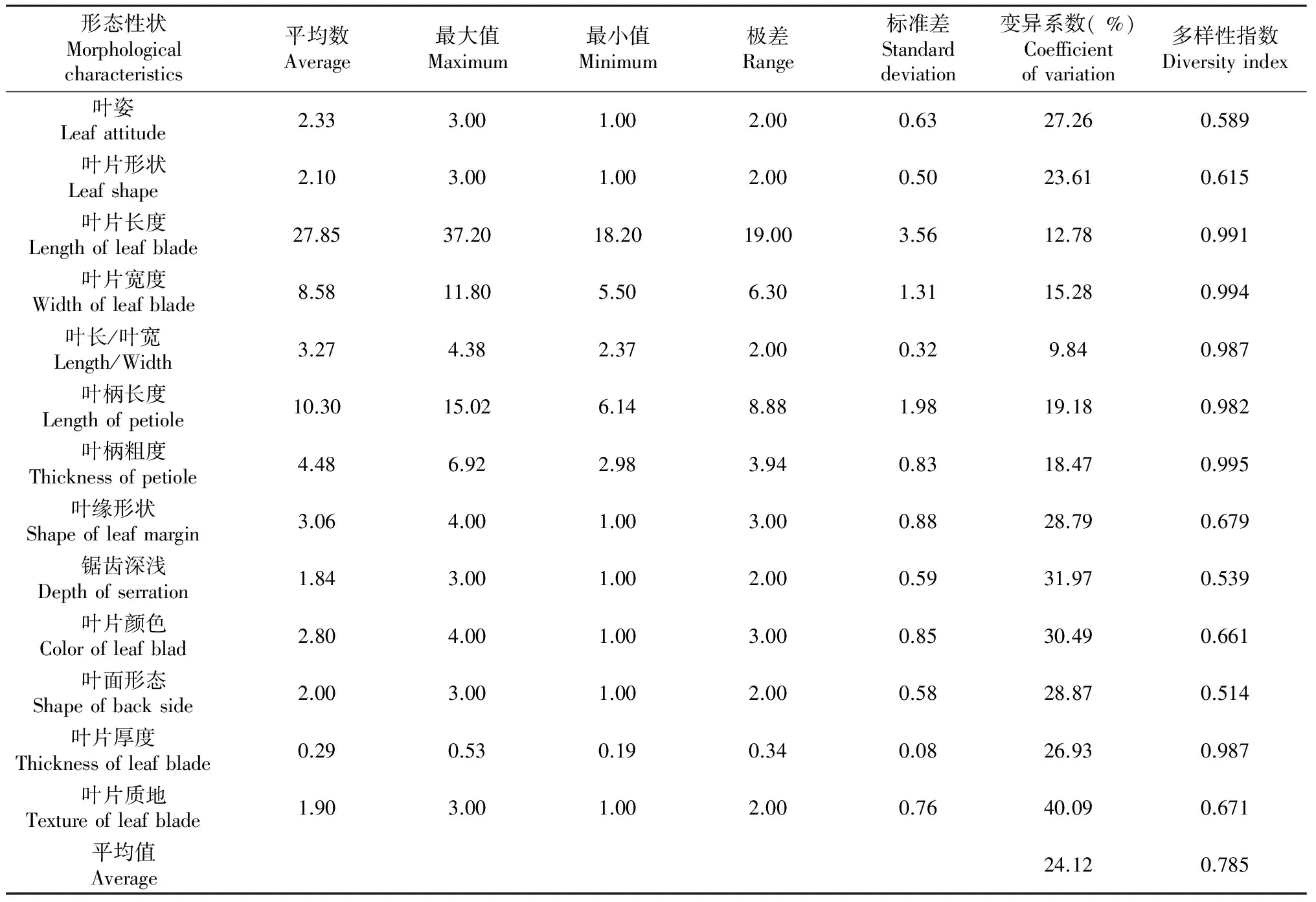
表1 枇杷小种子植株叶形态多样性的基本统计数据
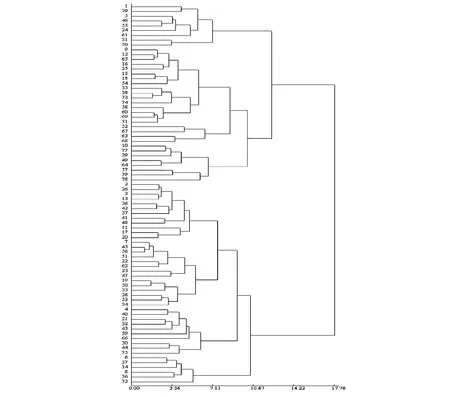
图1 79份退化种子植株叶形态聚类图(欧氏距离)Fig.1 Dendrogram of 79 degenerated seed derived plants based on Euclidean distances of the morphological traits
2.2 聚类分析
利用DPS3.01软件将79份枇杷退化种子植株的13个叶形态特征值进行聚类。聚类分析(图1)显示,以8.89的遗传距离为阈值,所有小种子植株供试材料被分为6类。
类群Ⅰ包括植株1、5、24、29、31、46、55、61、70号。此类材料表现为叶片巨型、椭圆形、平伸、叶柄粗长、叶色浓绿、质地厚实、坚硬(表1~2)。
类群Ⅱ包括植株9、12、15、16、18、25、35、38、52、54、58、60、63、65、67、68、69、71、73、74号。此类材料表现为叶片大型,椭圆形、斜向下生长,叶柄粗长、叶缘外卷、绿色、质地稍厚,稍硬。
类群Ⅲ包括植株10、39、49、57、64、77、78、79号。此类材料表现为叶片较大、椭圆形、平伸、叶缘波浪形,绿色、叶面稍皱、叶片质地厚实、坚硬。
类群Ⅳ包括植株2、3、7、11、13、17、19、20、22、23、26、28、33、34、36、37、41、42、45、47、48、50、51、53、56、62号。材料表现为叶片中等大小、椭圆形、平伸、叶缘外卷、绿色、叶面稍皱、叶片中等厚度、质地稍硬厚。
类群Ⅴ包括植株4、21、30、32、40、43、44、59、66、75号。此类材料表现为叶片较小、椭圆形、平伸、叶柄较长、中等粗度、叶缘内卷、绿色、叶面稍皱、质地稍薄软。
类群Ⅵ包括植株6、8、14、27、72、76号。材料表现为叶片细小、倒卵形、斜向下生长、叶柄细长、叶色黄绿、质地偏薄软。
从表2可知,各居群间叶片形态差异较大,叶姿、叶形、叶片大小、叶片质地等叶片特征具有多种类型,呈现出较高的多样性,第Ⅰ类和第Ⅵ类表现最为特殊,明显区别于母本大五星。其中Ⅰ类表现出叶片宽厚、叶色浓绿、质地坚硬等多倍体具有的特征(细胞学鉴定为多倍体,资料整理中待发表)。Ⅵ类表现为叶片细小、叶柄细长、叶色黄绿、质地偏薄软等单倍体特征(推测为单倍体自然加倍而来,待进一步研究),为枇杷优良种质选育和核心种质构建的重要类群。
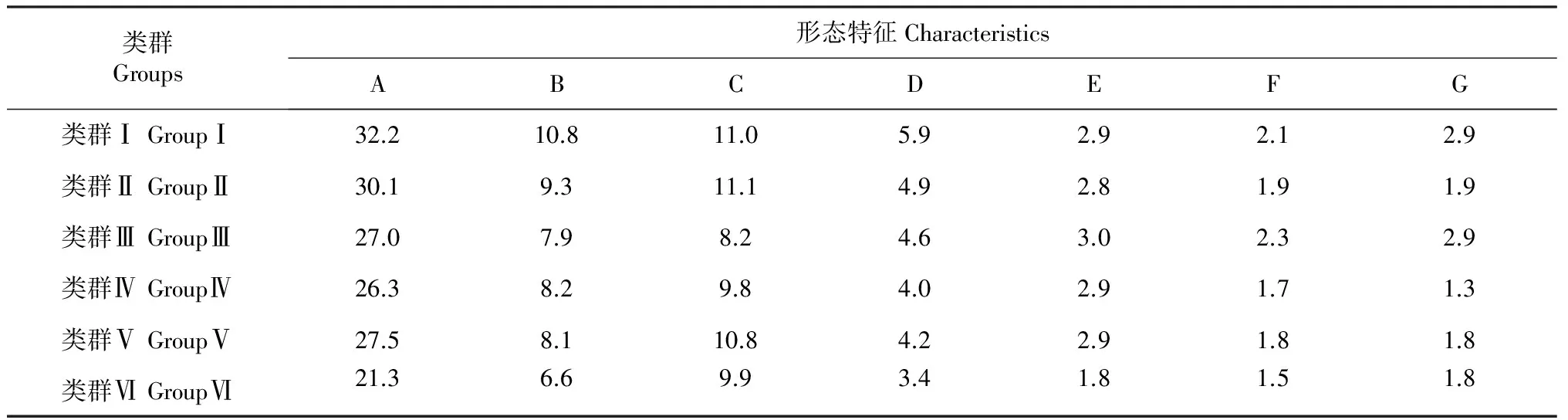
表2 不同组群叶形态比较
注:A:叶片长度;B:叶片宽度;C:叶柄长度;D:叶柄粗度;E:叶片颜色;F:锯齿深浅;G:叶片质地。 Notes: A: Length of leaf blade; B: Width of leaf blade; C: Length of petiole; D: Thickness of petiole ;E : Color of leaf blade; F : Depth of serration;G: Texture of leaf blade.
3 讨 论
我国作为枇杷起源地,栽培历史悠久,拥有极为丰富的种质资源[13]。研究发现枇杷种植资源的坐果性状[14]、果实性状[15]、花器性状[16]和种子性状[17]均存在丰富的遗传多样性,而这些性状的变异幅度是枇杷种植资源赖以生存和进化的基础,也是人类改造枇杷品种,使其适应人类需要的潜力所在。
遗传多样性、核心种质等不仅是近年来国内外研究的热点问题,同时也是保护生物学及遗传育种的重要基础[18]。丰富的遗传多样性向外表现在丰富的表型性状多样性上。叶片性状的多样性指数越高,说明该性状的遗传性越丰富,选择力越大,育成新品种、新类型的几率也就越高[19]。本研究的结果表明,供试的79份枇杷小种子株系叶片形态的13个性状均存在丰富的多样性,其中叶姿、叶片形状、叶缘形状、锯齿深浅、叶片颜色、叶面形态、叶片质地等性状多样性指数在0.514~0.679,性状表现相对稳定,而叶片长度、叶片宽度、叶长/叶宽、叶柄长度、叶柄粗度、叶片厚度等性状多样性指数居于0.982~0.995,多样性指数高,叶柄粗度的多样性指数甚至到达0.995,遗传多样性丰富,与其果实和种子等表型性状多样性丰富一致,说明79份枇杷小种子株系中优良种质的选择潜力很大。
本研究材料虽然均属于‘大五星’枇杷的后代,但是小种子株系在叶片形态上呈现出丰富的遗传多样性,且少数株系表现出显著特殊,因此,小种子途径可作为一个新思路进行枇杷新种质、新品种选育。当然要对其遗传变异特性及育种价值作更准确,深入的研究和分析,需要采用更多的形态学性状如花器、果实、种子等性状,同时结合细胞学,分子标记等多层手段来进行。
[1]邱武陵,章恢志.中国果树志﹙龙眼、枇杷卷﹚[M].北京:中国林业出版社,1996:92-237.
[2]Xu C M,Liu D,Zhang Z. et al.Genetic relationship of loquat analyzed by ISSR[J].Acta Horticulturae,2007(750):175-181.
[3] Deng Q X,Yang Q,Wang Y Q,et al.Style morphology in situ pollen germination and pollen tube growth of loquat[J].Acta Horticultruae,2011(887):275-279.
[4]王永清,付 燕,杨 芩,等. 枇杷属植物遗传多样性的 ISSR分析[J].林业科学,2009,46(4):49-57.
[5]吕柳新.亚热带果树及若干园艺植物遗传背景研究[M].北京:中国农业出版社,2007:3-35.
[6]邓群仙,董燕妮,王永清,等. 枇杷种子的退化及胚败育研究[J].中国南方果树,2007,36(6):46-48.
[7]祝 进. 尤力克柠檬[Citruslimon(L.)Burm.F.]小种子植株遗传多样性研究[D].四川农业大学,2007:1-58.
[8]Wang Y Q,Fu Y,Yang Q,et al. Analysis of a germplasm collection of loquat using ISSR markers[J].Journal of Horticultural Science & Biotechnology,2010,85 (2):113-118.
[9]严 娟. 枇杷小种子植株多样性分析和优异种质筛选及种子退化机理研究[D].四川农业大学,2013:1-110.
[10]Yan J,Wang Y Q, Tao L, et al.The pistil structure in loquat [Eriobotryajaponica(Thumb.)Lindl.][J]. Pakistan Journal of Botany, 2012, 44(4):1215-1218.
[11]郑少泉,陈秀萍,许秀淡,等.枇杷种质资源描述规范和数据标准[M].北京:中国农业出版社,2006:63-67.
[12]李景文.森林生态学[M]. 北京:中国林业出版社, 2003:203-204.
[13]林顺权,杨向晖,刘成明,等.中国枇杷属植物的自然地理分布[J].园艺学报,2004,31(5):569-573.
[14]林其华,许奇志.枇杷种质资源坐果的遗传多样性及相关性研究[J].福建果树, 2009(1):4-10.
[15]章希娟,郑 姗,张小艳,等.枇杷种质资源果穗与果实外观性状研究[J].福建果树,2009(2): 63-67.
[16]陈秀萍,黄爱萍,蒋际谋,等. 枇杷属植物4个种的花序性状多样性研究[J].植物遗传资源学报,2010, 11(6):709-714.
[17]姜 帆,黄爱萍,陈志峰,等.枇杷种质资源种子性状研究[J].福建果树,2009(4):19-24.
[18]马玉敏,陈学森,何天明,等.中国板栗3个野生居群部分表型性状的遗传多样性[J].园艺学报,2008,35(12):1717-1726.
[19]卢华琼,苏智先. 部分柚类品种主要果实性状变异及相关性研究[J].中国农学通报, 2006, 22(12):220-222.
(责任编辑 李 洁)
Study on Diversity of Leaf Morphological Traits of Plants Regenerated from‘Miniature Seeds’in Loquat
TAO Lian1, XIE Hong-jiang1, YANG Wen-yuan1, WANG Yong-qing2,PAN Cui-ping2,TU Mei-yan1,LI Jing1, ZHANG Yao-xun3
(1.Horticulture Institute, Sichuan Academy of Agricultural Sciences, Sichuan Chengdu 610066, China;2.College of Horticulture, Sichuan Agricultural University, Sichuan Ya’an 625014, China; 3.People’s Government of Maoxian, Sichuan Aba 623200, China)
The genetic diversity of 79 accessions regenerated from ‘miniature seeds’ of loquat (EriobotryajaponicaLindl. cv. ‘Dawuxing’) was analyzed based on 13 morphological characteristics of leaves in this study, in order to provide important morphological basis for breeding new varieties and materials through ‘miniature seed’ breeding method in loquat. The results showed that there was abundant genetic diversity in leaf morphological characteristics of regenerated plants (D=0.785), especially indicated by diversity indexes of leaf length (D=0.991), leaf width (D=0.994), petiole length (D=0.982), petiole thickness (D=0.995) and leaf thickness(D=0.987). And all the characteristic values varied broadly with coefficients of variation ranging from 9.84 % to 40.09 %; 79 accessions were divided into 6 groups by UPGMA method, there were significant differences in leaf morphological traits among the 6 groups; GroupⅠand group Ⅵ were quite different from other groups and parent plants (cv. ‘Dawuxing’). The leaves ofgroupⅠwere darkgreen, large, hard and thick with long and thick petioles; while those of group Ⅵ were yellowgreen, small, thin and soft with slender petioles. These two groups were important excellent germplasm. Based on the abundant genetic diversity in leaf morphological characteristics, the breeding via ‘miniature seeds’ was considered as an efficient method for broadening the germplasm resources and breeding new varieties of loquat.
EriobotryajaponicaLindl.;Genetic diversity;Leaf morphology;Miniature seed
1001-4829(2016)08-1958-04
10.16213/j.cnki.scjas.2016.08.037
2015-10-12
四川省财政基因工程专项资金项目“果树生物技术研究与创新”(2011JYGC05-018);国家公益性行业(农业)科研专项经费项目“枇杷产业技术研究与试验示范(201003073)
陶 炼(1985-),男,博士,研究方向为果树生物技术育种,E-mail: tao_lian@163.com。
S667.3
A
