伴有t(8;21)急性髓系白血病的特征及预后因素分析*
2016-12-19宋立孝陶善东张丽娟丁邦和何正梅王春玲
宋立孝,陶善东,张丽娟,丁邦和,何正梅,王春玲,于 亮
(南京医科大学附属淮安第一医院血液科 223300)
·经验交流·
伴有t(8;21)急性髓系白血病的特征及预后因素分析*
宋立孝,陶善东,张丽娟,丁邦和,何正梅,王春玲△,于 亮
(南京医科大学附属淮安第一医院血液科 223300)
目的 探讨伴有t(8;21)染色体异常的急性髓系白血病(AML)临床及实验室特征,并对预后因素进行分析。方法 分析28例t(8;21)AML患者,主要包括:临床特征、外周血象、AML1/ETO融合基因、免疫分型、细胞遗传学、治疗经过,并根据染色体核型特征,分为单纯t(8;21)组及附加染色体核型异常组进行比较。结果 28例t(8;21)AML患者,M2 25例,M4 1例,M5 2例;单纯组15例,伴附加染色体异常组13例(其中伴性染色体缺失9例,9q- 3例,11q- 1例);两组在年龄、性别、免疫表型、完全缓解率未见明显异常,初诊时白细胞计数、是否伴附加染色体核型异常、缓解后是否选择大剂量阿糖胞苷巩固对预后有影响。结论 t(8;21)多见于M2患者,伴附加染色体异常者生存期短,缓解后使用大剂量阿糖胞苷的方案化疗对总体生存有益。
t(8;21);核型分析;预后;白血病;急性
急性髓系白血病(AML)是成人急性白血病中最常见的类型,伴t(8;21)的AML是最常见的AML,约占成人原发AML的6%[1],主要出现在M2型AML,亦可见于M4、M5等其他AML,被WHO分类归为预后良好的一类白血病,化疗完全缓解率(CR)可达80%[2],较正常核型和其他异常染色体核型可获得更长的生存期[3],文献报道采用含大剂量阿糖胞苷治疗患者5年总生存率可达50%~60%[4],但近年来越来越多的研究发现,t(8;21)AML存在一定的异质性,部分患者化疗效果差,病情易复发,预后不佳[5],且多数t(8;21)AML常伴有附加染色体异常,其对患者预后的影响尚无定论,本文通过对28例AML伴t(8;21)患者的临床特征、外周血象、AML1/ETO融合基因、免疫分型、细胞遗传学、治疗经过等进行回顾性分析,以了解影响患者生存率的主要因素。
1 资料与方法
1.1 一般资料 28例患者为本院2010年6月至2014年7月收治的住院病例,所有患者均进行了形态学、细胞化学、免疫分型、细胞遗传学和(或)AML1/ETO融合基因的分子生物学检查,符合WHO分类的AML伴t(8;21)。随访截止至2015年6月30日,中位随访时间14(1~57)个月。28例t(8;21)AML患者中,男22例,占78.6%,女6例,占21.4%,年龄13~75岁,中位年龄40岁,发病时中位白细胞计数17.34×109/L[(1.06~172.92)×109/L],中位血红蛋白水平67 g/L[(27~155)g/L],中位血小板计数25×109/L[(4~110)×109/L]。
1.2 方法
1.2.1 骨髓细胞学 28例患者按照FAB或WHO诊断标准进行诊断和分型。
1.2.2 AML1/ETO融合基因检测 采用RT-PCR方法,PCR产物在20 g/L琼脂糖凝胶上进行电泳,扫描并分析结果。
1.2.3 免疫分型分析 EDTA抗凝管收集新鲜骨髓液,采用流式细胞仪和单克隆抗体检测白血病细胞膜表面抗原,以抗原阳性率大于20%为阳性标准。
1.2.4 染色体核型分析 标本取自患者初诊时骨髓,按照常规染色体制备,G显带技术处理分析,依据《人类细胞遗传学国际命名体制(IScN)》(2005)进行染色体核型描述,每例分析20个中期细胞。
1.2.5 治疗方法 28例患者采用含标准剂量Ara-C的化疗方案进行诱导治疗,方案包括DA、MA、HA、IA [D为柔红霉素(45 mg·m-2·d-1×3 d),M为米托蒽醌(8 mg·m-2·d-1×3 d),H为高三尖杉酯碱(2.5 mg·m-2·d-1×7 d),I为去甲氧柔红霉素(8 mg·m-2·d-1×3 d),A为Ara-C(100 mg·m-2·d-1×7 d)]。缓解后采用含标准剂量Ara-C(100 mg·m-2·d-1×7 d)或大剂量Ara-C的方案(3 g·m-2·d-1,每12小时1次×3 d)巩固治疗。

2 结 果
2.1 实验室检测结果
2.1.1 28例患者分型 按照FAB或WHO诊断标准进行诊断和分型,其中M2 25例(占79%),M4 1例,M5 2例。
2.1.2AML1/ETO融合基因检测 结果提示:均为阳性。
2.1.3 20例免疫分型分析示 13例表达CD13+(65%),CD34+18例(90%),CD33+12例(60%),HLA-DR+18例(90%),CD117+7例(35%)。
2.1.4 染色体核型分析 28例患者中,15例(53.6%)为单纯t(8;21),13例(46.4%)为附加染色体异常,其中9例(32.1%)为伴Y染色体丢失,3例(10.9%)伴9q-,1例为11q-,见表1。
2.2 疗效分析 28例患者中,5例确诊后放弃治疗,23例进行诱导缓解治疗,1疗程完全缓解(CR)率为52.1%(12/23),化疗过程中因感染及出血死亡3例,20例进行第2疗程化疗,2疗程CR率为90%(18/20),CR后有2例选择自体造血干细胞移植,其中1例因复发死亡。18例CR后巩固化疗的患者分为标准化疗组(8例)和大剂量阿糖胞苷(HDAC)化疗组(10例),其中HDAC3年总生存率(OS)为(45.3±3.8)%,高于标准化疗组(21.9±5.4)%,差异有统计学意义(P<0.05)。
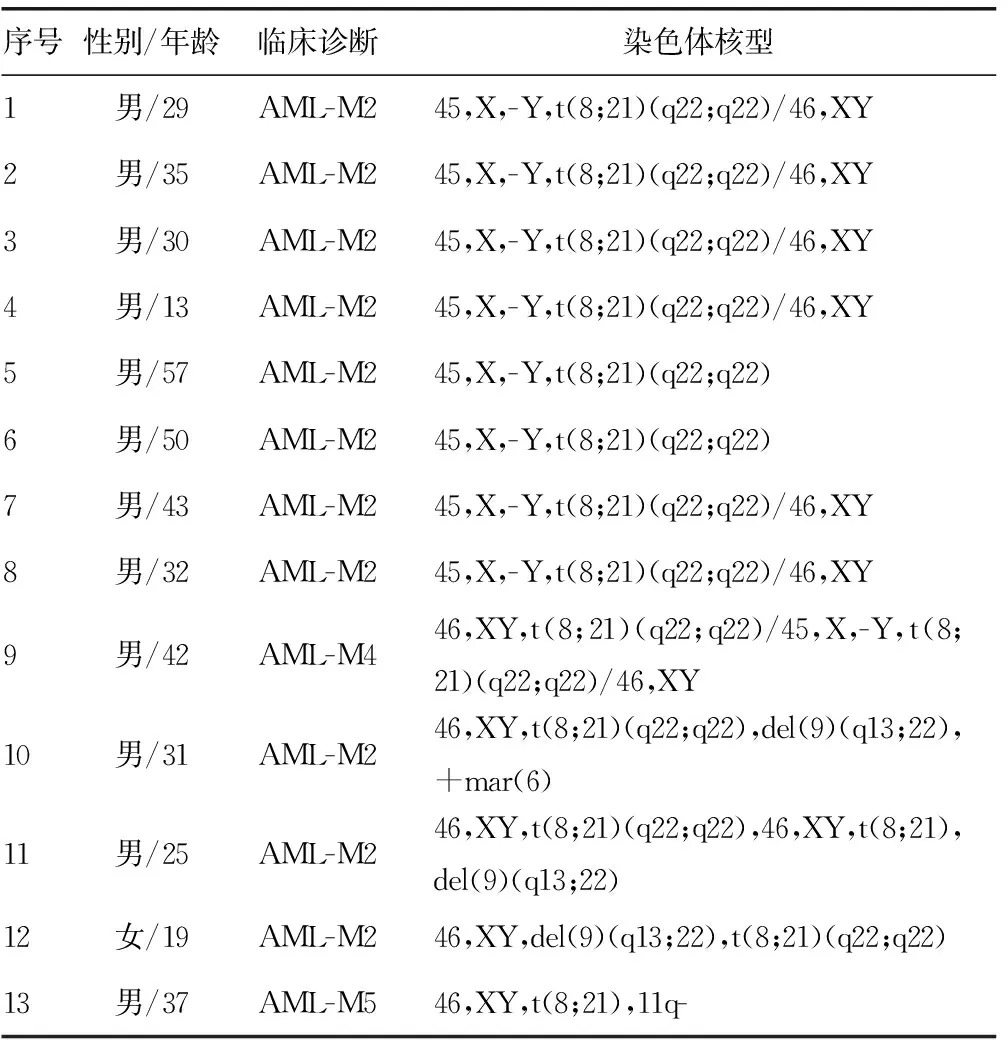
表1 13例伴附加染色体异常t(8;21)AML患者临床 特征及细胞遗传学特点

表2 28例t(8;21)AML患者单因素生存分析结果
2.3 影响生存因素分析 单因素生存分析:性别、起病时的血红蛋白水平、血小板计数等因素与预后无相关性,实验室检查:免疫分型示:CD13、CD33、CD117、HLA-DR、CD34与预后无相关性,而发病时的白细胞计数大于20×109/L,伴附加染色体异常是影响患者OS的不良预后因素,见表2。多因素生存分析:将发病时的白细胞数、染色体核型、巩固方案等3项指标进行多因素分析,结果发现起病时白细胞数、染色体核型、巩固时含HDAC的方案均对OS有影响(P=0.005、0.010、0.002)。
3 讨 论
t(8;21)AML是一种特殊的白血病亚型,具有独特的生物遗传学特征,累及8号染色体的ETO基因和21号染色体上的AML1基因发生重排,形成AML1-ETO融合基因,主要出现在M2型AML,本组患者M2型AML占79%,与文献报道相符[6]。t(8;21)AML多伴有附加染色体异常,如-X/-Y,9q-,+8,+7或-7及复杂核型,较常见的是伴性染色体丢失;9q-,+8,+7或-7及复杂核型等染色体变异相对少见,Gmidene等[7]报道:57.2%的t(8;21)AML患者伴有附加染色体异常,最常见的为性染色体丢失(35%)、9q-、+8,国内多家单位也有类似的报道[8-9],本组中46.4%患者为t(8;21)易位伴附加染色体异常,与研究结果[10]较一致。在伴附加染色体异常患者中,最常见的染色体异常为伴Y染色体丢失(32.1%),其次是9q-(10.9%),该结果与刘旭平等[11]报道接近,在其报道中,还检测出+4,+8等少见重现性异常,而本研究可能因为病例数少,未检测到。随着年龄增长,健康老年男性可以出现随机性的Y染色体丢失,有研究发现,t(8;21)AML患者性染色体丢失非常常见,约56%的男性患者丢失一条Y染色体[12],本组病例中伴有Y染色体丢失的男性患者有9例(40.9%),中位年龄36岁(13-57岁),患者年龄偏小,Y染色体丢失原因可能为附加于t(8;21)的克隆性异常而非Y染色体的随机丢失。
在AML的危险度分层中,t(8;21)被认为是预后较好的类型,对于t(8;21)AML的预后影响因素,尤其是附加染色体对预后的影响,目前仍存在争议,Nguyen等[13]认为t(8;21)AML预后与核型是否伴有复杂异常无关,Lin等[14]报道56例t(8;21)AML患者,单纯t(8;21)组与附加染色体异常组5年总体生存率无明显差异。而Schlenk等[15]提到伴有性染色体丢失是预后不良的因素,对患者总体生存不利,赖悦云等[8]对72例患者的研究发现伴附加染色体异常提示患者预后不良。本研究发现,染色体核型与t(8;21)AML患者预后有关,伴附加染色体异常患者预后差。另外本研究还发现患者初发时的白细胞计数与预后有关,白细胞计数大于20×109/L患者生存期短,原因可能与大量白血病细胞积聚于外周血,易导致血管栓塞、出血,化疗后白细胞溶解破坏,释放多种促凝物质,黏附分子等,易引起DIC、ARDS、高尿酸血症等急性肿瘤溶解综合征有关[16]。
作为细胞周期特异性抗肿瘤药物,阿糖胞苷(Ara-C)适合于治疗细胞增殖活跃,增殖周期较短的恶性血液肿瘤,主要作用细胞周期S期,Ara-C用于治疗急性白血病已有40余年的历史,尤其在20世纪90年代提出的以中、大剂量Ara-C为主治疗急性髓系白血病的化疗方案,明显缩短了维持化疗时间,提高了患者的缓解率,延长了无病生存时间。一般认为t(8;21)AML患者化疗缓解率高,化疗缓解后HDAC巩固可使患者获得较高的5年生存率,为一组预后较好的类型。Tomizawa等[17]研究发现,HDAC缓解后巩固治疗可延长生存期。本研究比较了HDAC组和标准化疗组,结果显示HDAC的3年OS明显高于标准化疗组,故缓解后多疗程的HDAC方案巩固,能明显改善患者的预后,但本研究病例数偏少,仍需扩大样本进一步研究。
综上所述,本研究结果提示,t(8;21)AML多伴有附加染色体异常,附加染色体异常患者生存期短,且合并高白细胞计数提示预后不良,采用HDAC的方案巩固治疗能提高远期疗效。
[1]ByrdJC,MrozekK,DodgeRK,etal.Pretreatmentcytogeneticabnormalitiesarepredictiveofinductionsuccess,cumulativeincidenceofrelapse,andoverallsurvivalinadultpatientswithdenovoacutemyeloidleukemia:resultsfromCancerandLeukemiaGroupB(CALGB8461)[J].Blood,2002,100(13):4325-4336.
[2]SlovakML,KopeckyKJ,CassilethPA,etal.Karyotypicanalysispredictsoutcomeofpreremissionandpostremissiontherapyinadultacutemyeloidleukemia:aSouthwestOncologyGroup/EasternCooperativeOncologyGroupStudy[J].Blood,2000,96(13):4075-4083.
[3]MrozekK,HeinonenK,BloomfieldCD.Prognosticvalueofcytogeneticfindingsinadultswithacutemyeloidleukemia[J].IntJHematol,2000,72(3):261-271.
[4]AppelbaumFR,KopeckyKJ,TallmanMS,etal.Theclinicalspectrumofadultacutemyeloidleukaemiaassociatedwithcorebindingfactortranslocations[J].BrJHaematol,2006,135(2):165-173.
[5]NumataA,FujimakiK,AoshimaT,etal.Retrospectiveanalysisoftreatmentoutcomesin70patientswitht(8;21)acutemyeloidleukemia[J].RinshoKetsueki,2012,53(7):698-704.
[6]VardimanJW,HarrisNL,BrunningRD.TheWorldHealthOrganization(WHO)classificationofthemyeloidneoplasms[J].Blood,2002,100(7):2292-2302.
[7]GmidèneA,SennanaH,WahchiI,etal.CytogeneticprofileofalargecohortofTunisiandenovoacutemyeloidleukemia[J].Hematology,2012,17(1):9-14.
[8]赖悦云,邱镜滢,江滨,等.t(8;21)急性髓性白血病特征和预后分析(英文)[J].中国实验血液学杂志,2005,13(5):733-740.
[9]牧启田,陈志妹,楼基余,等.154例t(8;21)急性髓系白血病遗传学分析[J].浙江大学学报(医学版),2010,39(3):236-240.
[10]沈军,马亮,钟明华,等.伴t(8;21)易位急性髓细胞白血病实验室及临床特点分析[J].现代检验医学杂志,2014,29(2):130-133.
[11]刘旭平,薛艳萍,刘世和,等.成人急性髓系白血病189例伴有t(8;21)的遗传学特点及预后分析[J].中华内科杂志,2006,45(11):918-921.
[12]PetersonLF,BoyapatiA,AhnEY,etal.Acutemyeloidleukemiawiththe8q22;21q22translocation:secondarymutationaleventsandalternativet(8;21)transcripts[J].Blood,2007,110(3):799-805.
[13]NguyenS,LeblancT,FenauxP,etal.Awhitebloodcellindexasthemainprognosticfactorint(8;21)acutemyeloidleukemia(AML):asurveyof161casesfromtheFrenchAMLIntergroup[J].Blood,2002,99(10):3517-3523.
[14]LinP,ChenL,LuthraR,etal.Acutemyeloidleukemiaharboringt(8;21)(q22;q22):aheterogeneousdiseasewithpooroutcomeinasubsetofpatientsunrelatedtosecondarycytogeneticaberrations[J].ModPathol,2008,21(8):1029-1036.
[15]SchlenkRF,BennerA,KrauterJ,etal.Individualpatientdata-basedmeta-analysisofpatientsaged16to60yearswithcorebindingfactoracutemyeloidleukemia:asurveyoftheGermanAcuteMyeloidLeukemiaIntergroup[J].JClinOncol,2004,22(18):3741-3750.
[16]方艳红,刘红星,童春容.89例成人融合基因AML1/ETO阳性急性髓系白血病长期生存分析[J].中国实验血液学杂志,2009,17(3):750-755.
[17]TomizawaD,TabuchiK,KinoshitaA,etal.Repetitivecyclesofhigh-dosecytarabineareeffectiveforchildhoodacutemyeloidleukemia:long-termoutcomeofthechildrenwithAMLtreatedontwoconsecutivetrialsofTokyoChildren′sCancerStudyGroup[J].PediatrBloodCancer,2007,49(2):127-132.
10.3969/j.issn.1671-8348.2016.32.028
江苏省自然科学基金项目(BK20141254);江苏省“六大人才高峰”人才培养资助项目(WSN-099);江苏省“333工程”培养资金资助项目(BRA2015152);淮安市血液病重点实验室(HAP201423)。 作者简介:宋立孝(1983-),主治医师,在读博士,主要从事恶性血液病的基础与临床研究。△
R557.3
B
1671-8348(2016)32-4551-04
2016-04-14
2016-05-27)
