AIF对人宫颈癌Hela细胞体外生物学活性的影响及机制研究*
2016-12-19郭连峰张宪军张丽娟
徐 敏,邱 雷,郭连峰,赵 宁,张宪军△,张丽娟
(1.哈励逊国际和平医院医保科,河北衡水 053000;2.哈励逊国际和平医院病理科,河北衡水 053000;3.哈励逊国际和平医院检验科,河北衡水 053000;4.哈励逊国际和平医院妇科,河北衡水 053000;5.河北医科大学第二医院妇产科,河北石家庄 050000)
论著·基础研究
AIF对人宫颈癌Hela细胞体外生物学活性的影响及机制研究*
徐 敏1,邱 雷2,郭连峰3,赵 宁4,张宪军4△,张丽娟5
(1.哈励逊国际和平医院医保科,河北衡水 053000;2.哈励逊国际和平医院病理科,河北衡水 053000;3.哈励逊国际和平医院检验科,河北衡水 053000;4.哈励逊国际和平医院妇科,河北衡水 053000;5.河北医科大学第二医院妇产科,河北石家庄 050000)
目的 探讨凋亡诱导因子(AIF)对人宫颈癌Hela细胞体外生物学活性的影响及其作用机制。方法 通过脂质体转染pcDNA3空载体质粒及pcDNA3-AIF质粒于人宫颈癌Hela细胞,采用免疫荧光反应,RealtimePCR及Westernblot法检测细胞中AIF的表达。四甲基偶氮唑蓝(MTT)法检测细胞活力,AnnexinV-PI流式双染及Hoechst染色检测细胞凋亡情况,RealtimePCR及Westernblot法检测细胞中腺苷二磷酸核糖聚合酶-1(PARP-1)及核酸内切酶G(EndoG)蛋白及mRNA的表达。结果 与pcDNA3组比较,pcDNA3-AIF组细胞中AIF主要定位于细胞核中,且细胞核中AIF蛋白及mRNA表达量皆显著提高(P<0.01),同时细胞活力下降,细胞凋亡率提高(P<0.01),细胞中PARP-1、EndoG蛋白及mRNA表达量显著提高(P<0.01)。结论AIF具有促进宫颈癌Hela细胞凋亡的作用,可能与PARP-1/AIF/EndoG信号通路有关。
凋亡诱导因子;宫颈肿瘤;Hela细胞;凋亡;腺苷二磷酸核糖聚合酶-1;核酸内切酶G
宫颈癌是常见的妇科恶性肿瘤,在女性恶性肿瘤中发病率居第2位[1-2]。宫颈癌的发病机制多样,受多种因素影响,其中细胞凋亡与细胞增殖的失衡在肿瘤的发生、发展中起着重要作用。细胞凋亡主要有依赖性含半胱氨酸的天冬氨酸水解酶3(Caspase 3)及非依赖性Caspase 3水解酶两种途径,其中凋亡诱导因子(AIF)通路是属于后一种,是由线粒体途径直接诱导细胞凋亡却又独立于Caspase 3途径的一条信号通路[3-4]。已有报道AIF在包括宫颈癌、胃癌、肝癌等多种恶性肿瘤中高表达,并与肿瘤的发生、发展密切相关[5-7],但AIF在宫颈癌中的作用机制尚未见报道,因此本研究拟阐述AIF对宫颈癌Hela细胞凋亡的影响及相关机制。
1 材料与方法
1.1 材料 宫颈癌细胞Hela购于中国科学院细胞库,目录号:TCHu187。主要试剂和仪器:兔抗AIF,PARP-1,EndoG多克隆抗体购于美国Abcam公司;兔抗β-actin单克隆抗体购于美国Cell Signaling Technology公司;Annexin V-PI流式双染检测试剂盒,Hoechst 33258染色试剂盒购于碧云天生物技术有限公司;pcDNA3空载体质粒及pcDNA3-AIF质粒购于广州锐博生物技术有限公司;四甲基偶氮唑蓝(MTT)购于Gibco公司;胎牛血清,DMEM养基购于Hyclone公司。迷你双垂直电泳仪,迷你转印电泳仪购于北京六一仪器厂公司;ChemiDocTM XRS凝胶成像系统购于美国Bio-Rad公司,AF6000荧光显微镜(德国Leica公司)。
1.2 方法
1.2.1 质粒的转染 将宫颈癌细胞Hela接种于96、24或6孔板,当细胞汇合度达到50%时,用LipofectamineTM2000分别转染pcDNA3空载体质粒(pcDNA3)及pcDNA3-AIF,转染6 h后,弃去转染液,并通过Realtime PCR,Western blot及免疫荧光检测转染效果。
1.2.2 Real time PCR检测AIF、PARP-1及Endo mRNA表达 采用Trizol法抽提细胞总RNA。通过一步法将RNA逆转录为cDNA,并定量PCR检测。引物由上海生工生物工程有限公司合成。引物如表1所示。反转录体系为:总RNA模板2 μL(1 μg)、dNTP混合物2 μL、MgCl22 μL、加EDPC补充蒸馏水至25 μL。反应参数为:95 ℃预变性 5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,循环次数为40。以-△△CT值法计算靶基因的相对表达水平:3次平行重复实验的平均值作为每个样本的CT值,△CT=CT(目的基因)-CT(内参基因),△△CT=△CT(样本平均)-△CT(对照组),因此目的基因相对表达水平=2-△△CT,对照组的相对表达量为20=1。

表1 PCR引物序列
1.2.3 免疫荧光检测 将Hela细胞加到24孔板的玻片上,24 h后,进行转染,48 h后取出细胞爬片,磷酸盐缓冲液(PBS)洗涤,4%多聚甲醛固定20 min,再加入1% Triton X-100进行细胞穿膜处理30 min,PBS洗涤,加入1%牛血清室温封闭1 h,接着加入兔抗人AIF多克隆抗体,4 ℃过夜,二抗(FITC标记)室温孵育1 h。细胞核在室温进行PI染色15 min,后于荧光显微镜下进行检测。细胞核染为红色,细胞膜染为绿色。
1.2.4 MTT法检测Hela细胞活力 按“1.2.1”进行操作后,分别于24、48、72、96 h后,加入MTT,继续培养4 h后吸弃培养液,每孔加入DMSO,震荡使结晶物充分溶解,于酶标仪490 nm处测光密度(OD)值,以OD值表示细胞相对活力。
1.2.5 Annexin V-PI流式双染检测Hela细胞凋亡 按“1.2.1”进行操作后,48 h后消化收集细胞,避光染色30 min上机检测。按照Annexin V-FITC/ PI细胞凋亡检测试剂盒说明书的方法,在1 h内进行流式细胞仪检测。
1.2.6 Hoechst染色检测Hela细胞凋亡 按“1.2.1”进行操作后,48 h后消化收集细胞,后按照Hoechst 33258染色试剂盒说明书进行操作,在荧光显微镜下观察并拍照。
1.2.7 Western blot检测 按“1.2.1”进行操作后,48 h后消化收集细胞,加入RIPA裂解液,裂解细胞,吸取上清液即可获得总蛋白。采用BCA试剂盒测定蛋白浓度。蛋白变性并上样,进行十二烷基硫酸钠(SDS)凝胶电泳1~2 h,后湿法转膜30~50 min。一抗孵育,4 ℃过夜;二抗室温孵育1~2 h。在凝胶成像系统中曝光。

2 结 果
2.1 AIF转染的鉴定 pcDNA3组中AIF在细胞中呈点状,主要位于细胞质中,在转染pcDNA3-AIF组中AIF蛋白已有大部分位于细胞核内,见图1。pcDNA3组及pcDNA3-AIF组细胞核中AIF蛋白及mRNA表达水平分别为[(0.19±0.02)vs. (0.95±0.09),P=0.004]及[(0.27±0.03)vs. (0.88±0.09),P=0.005],差异有统计学意义(P<0.01),见图2。
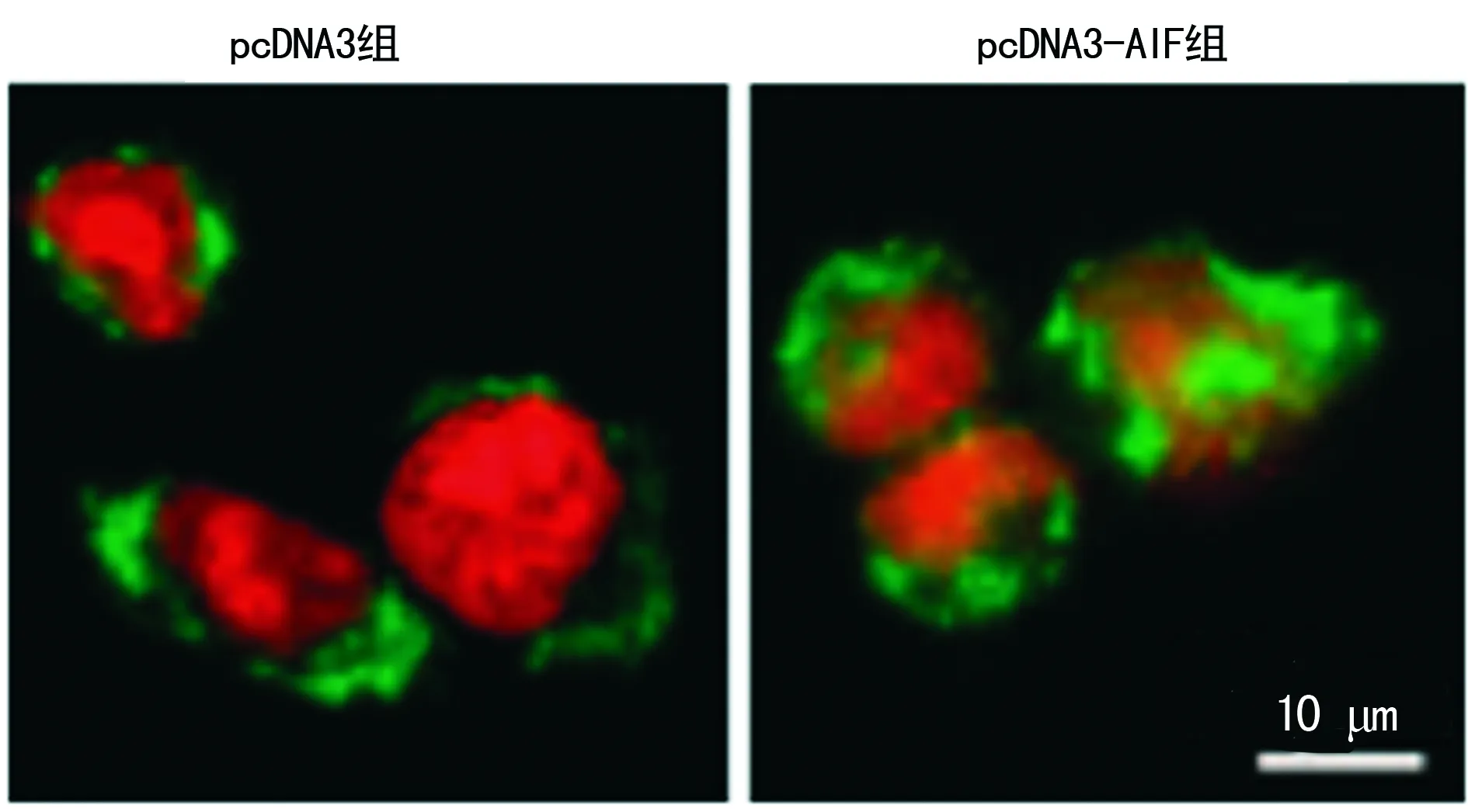
图1 AIF蛋白在Hela细胞中的表达及定位
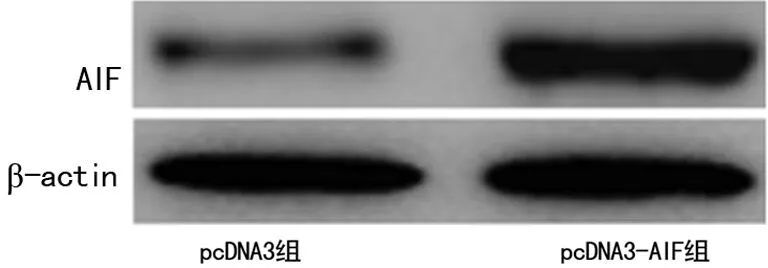
图2 AIF蛋白在Hela细胞中的表达
2.2 pcDNA3-AIF对Hela细胞活力的影响 在作用24、48、72、96 h时,与pcDNA3组比较,pcDNA3-AIF组细胞活力显著降低,差异有统计学意义(P=0.009,P=0.004,P=0.005,P=0.006),见图3。且在48、72、96 h时作用强度一致。
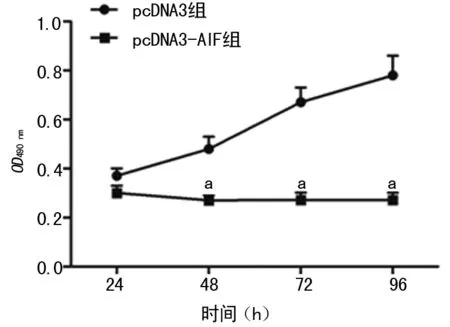
a:P<0.01,与pcDNA3组比较。
图3 pcDNA3-AIF对Hela细胞活力的影响
2.3 pcDNA3-AIF对Hela细胞凋亡情况的影响 表2所示,经流式双染及Hoecsht染色发现,与pcDNA3组比较,pcDNA3-AIF组细胞凋亡率显著提高,差异均有统计学意义(P=0.003,P=0.005),见图4。
2.4 pcDNA3-AIF对Hela细胞核中PARP-1及EndoG表达的影响 与pcDNA3组比较,pcDNA-3-AIF组细胞核中PARP-1、EndoG蛋白(P=0.006,P=0.005)及mRNA表达均显著升高,差异均有统计学意义(P=0.008,P=0.004),见图5、6。
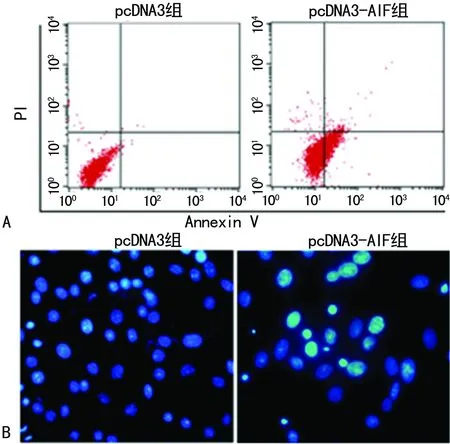
A:流式细胞术检测;B:Hoecsht染色检测(×200)。
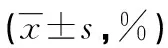
图4 pcDNA3-AIF对Hela细胞凋亡情况的影响表2 pcDNA3-AIF对Hela细胞凋亡情况的影响
a:P<0.01,与pcDNA3组比较。
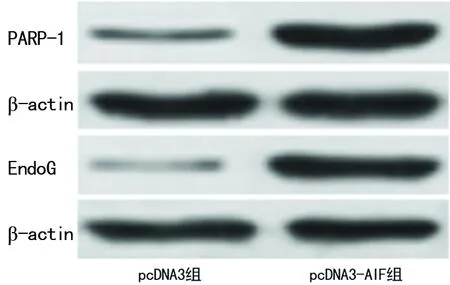
图5 pcDNA3-AIF对Hela细胞核中PARP-1及EndoG蛋白表达的影响
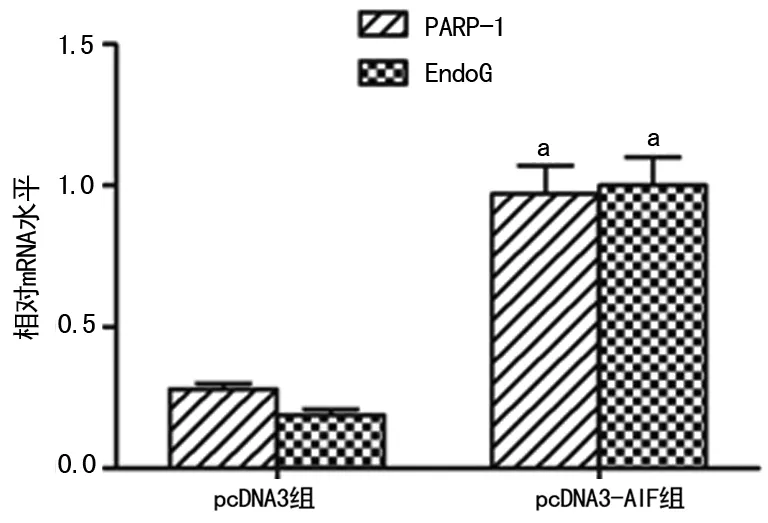
a:P<0.01,与pcDNA3组比较。
图6 pcDNA3-AIF对Hela细胞核中PARP-1及EndoG mRNA表达的影响
3 讨 论
AIF是1996年由Susin等在采用Caspase光谱抑制剂z-VAD.fmk处理鼠肝细胞线粒体膜中发现的一种活动蛋白。AIF是一种黄素蛋白,人源AIF位于X染色体q25-26区。在正常生理状态下,AIF定位于细胞线粒体膜间隙中,在外界凋亡信号刺激下,AIF将由线粒体膜进入细胞质,继而通过核定位信号进入细胞核,进而直接引起染色体聚集及DNA等大分子断裂,导致细胞凋亡。说明说AIF对于细胞凋亡的影响不仅与其表达量有关,更主要的是看其所定位的亚细胞位置[8]。因此本研究首先转染pcDNA3-AIF质粒及空载体质粒,结果发现pcDNA3-AIF组细胞中AIF主要定位于细胞核中,且蛋白及mRNA表达量显著提高。同时代安亚等[8]研究结果表明,腺病毒载体转染AIF到白血病K562能直接显著的诱导细胞凋亡。赵悦等[9]的研究也表明真核表达载体pcDNA3-AIF能显著的降低乳腺癌MCF细胞线粒体膜电位,提高细胞凋亡率。此现象说明过表达AIF可能诱导Hela细胞凋亡。所以本研究进一步通过MTT,流式双染及Hoechst染色检测转染后两组细胞凋亡率,结果表明pcDNA3-AIF组比pcDNA3组细胞活力显著降低,细胞凋亡率上升,与代安亚等[8]、赵悦等[9]的研究结果一致,说明过表达AIF对Hela细胞凋亡起着促进作用。
已报道AIF不依赖于Caspase途径,不受Bcl-2家族蛋白的影响,能够由上游刺激信号腺苷二磷酸核糖聚合酶-1(PARP-1)诱导,进而进行细胞凋亡的调控[11]。PARP-1是一种核蛋白酶,能参与细胞DNA损伤修复,基因调控转录,蛋白降解等多种生理过程。PARP-1在正常生理条件下,与核纤层蛋白(laminB)共定位,在氧化应激,机械力,化学诱导剂等刺激下,与laminB脱离并积聚于核仁,进而在DNA损伤修复中发挥作用,但是过度的DNA损伤及PARP-1表达,造成细胞内NAD和ATP耗竭,能量的耗竭使得线粒体膜通透性增加,膜电位降低,并使线粒体肿胀破裂,使得AIF及EndoG从线粒体中释放出来,进入细胞核,诱发非Caspase3途径,最终导致细胞凋亡的产生[12]。Gerace等[12]将DNA烷化剂MNNG处理海马神经元,发现PARP-1被持续激活,AIF核转位并积聚,细胞凋亡率显著提高,而当转染AIF抗体后,能显著的抑制此变化。给予PARP-1抑制剂PJ34能显著的抑制外伤性脑损伤引起的神经细胞凋亡,并降低PARP-1表达,同时抑制AIF的核转位[13]。说明通过上调细胞核中PARP-1表达,进而促进AIF的核转位及在细胞核中的聚集,能显著的诱导肿瘤细胞凋亡。因此,本研究采用Western blot检测pcDNA3-AIF及pcDNA3转染后,细胞核中PARP-1及AIF的表达,结果表明过表达pcDNA3-AIF组细胞核中PARP-1表达量及AIF显著上调,提示过表达AIF亦能通过激活PARP-1/AIF途径,从而诱导Hela细胞凋亡。此外在凋亡信号刺激下,线粒体特异性核酸酶EndoG能够与AIF蛋白一起从线粒体释放出来,引起细胞凋亡。谢丹等[14]研究表明通过使AIF定位于肿瘤细胞核中并在细胞核集聚,从而使AIF及EndoG表达上调,能显著的遏制肝癌肿瘤的生长。所以本研究进一步通过Western blot检测细胞核中EndoG的表达,结果表明pcDNA3-AIF组较pcDNA3组细胞核中EndoG1表达量显著上调,从而说明通过提高AIF表达,能通过激活PARP-1/AIF/EndoG信号通路从而诱导Hela细胞凋亡。
综上所述,通过促进宫颈癌Hela细胞中AIF的表达,能显著的提高其上游蛋白PARP-1表达,并上调其下游蛋白EndoG表达,从而诱导细胞凋亡。可以进一步采用Caspase抑制剂及PARP-1抑制剂处理细胞来进一步说明AIF对Hela细胞的凋亡诱导作用是独立于此通路的,是通过PARP-1/AIF/EndoG信号通路实现的[14-16]。
[1]王妍,何慧仪.宫颈癌相关基因的研究进展[J].中华肿瘤防治杂志,2011,18(16):1316-1320.
[2]Larmour LI,Jobling TW,Gargett CE.A review of current animal models for the study of cervical dysplasia and cervical carcinoma[J].Int J Gynecol Cancer,2015,25(8):1345-1352.
[3]Zhao YY,Yan DJ,Chen ZW.Role of AIF-1 in the regulation of inflammatory activation and diverse disease processes[J].Cell Immunol,2013,284(1/2):75-83.
[4]Delavallée L,Cabon L,Galán-Malo P,et al.AIF-mediated caspase-independent necroptosis:a new chance for targeted therapeutics[J].IUBMB Life,2011,63(4):221-232.
[5]李海霞,鲁艳明,温冬雪,等.凋亡诱导因子在宫颈癌组织中的表达及意义[J].中国医科大学学报,2009,38(4):268-269,273.
[6]Da Silva LC,Forones NM,Ribeiro DA,et al.Immunoexpression of DIABLO,AIF and cytochrome C in gastric adenocarcinoma assessed by tissue Microarray[J].Anticancer Res,2013,33(2):647-653.
[7]郭晓东,杨永平,楼敏,等.凋亡诱导因子AIF在肝癌组织中的表达及临床意义[J].现代生物医学进展,2011,11(3):502-504.
[8]代安亚,王方,冯文莉.腺病毒介导的AIF及其突变体对K562细胞凋亡的影响[J].基础医学与临床,2015,35(11):1453-1459.
[9]赵悦,肖华卫,王乐,等.真核表达载体PcDNA3.0-AIF△1-480构建及其促凋亡活性的研究[J].中华肿瘤防治杂志,2013,20(11):806-810.
[10]Turner RL,Wilkinson JC,Ornelles DA.E1B and E4 oncoproteins of adenovirus antagonize the effect of apoptosis inducing factor[J].Virology,2014,456(1):205-219.
[11]Fujikawa DG.The role of excitotoxic programmed necrosis in acute brain injury[J].Comput Struct Biotechnol J,2015(30):212-221.
[12]Gerace E,Masi A,Resta F,et al.PARP-1 activation causes neuronal death in the hippocampal CA1 region by increasing the expression of Ca2+-permeable AMPA receptors[J].Neurobiol Dis,2014,70(5):43-52.
[13]Stoica BA,Loane DJ,Zhao Z,et al.PARP-1 inhibition attenuates neuronal loss,microglia activation and neurological deficits after traumatic brain injury[J].J Neurotrauma,2014,31(8):758-772.
[14]谢丹,林源,杨阿莉.大黄素抑制人肝癌裸鼠移植瘤生长机制探讨[J].中华肿瘤防治杂志,2015,22(1):28-33.
[15]赵伟,张连双,李红星,等.联合应用PARP-1与Caspase-3抑制剂对脊髓损伤大鼠神经细胞凋亡的影响[J].中国脊柱脊髓杂志,2015,25(10):926-934.
[16]Han B,Wang TD,Shen SM,et al.Annonaceous acetogenin mimic AA005 induces cancer cell death via apoptosis inducing factor through a caspase-3-independent mechanism[J].BMC Cancer,2015,15(1):139.
Study on effect and mechanism of AIF on in vitro biological activity of human cervical cancer Hela cells*
XuMin1,QiuLei2,GuoLianfeng3,ZhaoNing4,ZhangXianjun4△,ZhangLijuan5
(1.DepartmentofMedicalInsurance;2.DepartmentofPathology;3.DepartmentofClinicalLaboratory;4.DepartmentofGynecology,HarrisonInternationalPeaceHospital,Hengshui,Hebei053000,China;5.DepartmentofObstetricsandGynecology,SecondHospitalofHebeiMedicalUniversity,Shijiazhuang,Hebei050000,China)
Objective To explore effect of apoptosis inducing factor(AIF)on the in vitro biological activity of human cervical cancer Hela cells and its mechanism.Methods Hela cells were transferred with pcDNA3 plasmid and pcDNA3-AIF plasmid.The location and expression of AIF in Hela cell was determined by immunofluorescent,realtime PCR and Western blot.The cell viability was detected by MTT.The cell apoptosis was examined by Annexin V-PI flow cytometry and Hoechst staining.The expression of poly(ADP-ribose)polymerases-1(PARP-1)and endonuclease G(EndoG)was detected by Western blot.Results Compared with the pcDNA3 group,AIF in the pcDNA3-AIF group was mainly localized in the nucleus,moreover the expression of AIF protein and mRNA in nucleus was significantly increased(P<0.01),meanwhile the cell viability was decreased,cell apoptotic rate was increased(P<0.01),the expressions of PARP-1 and EndoG protein and mRNA were significantly increased(P<0.01).Conclusion AIF has the effect for promoting Hela cell apoptosis,which might be related to PARP-1/AIF/EndoG signal pathway.
apoptosis inducing factor;uterine cervical neoplasms;Hela cells;apoptosis;poly(ADP-ribose)polymerases-1;endonuclease G
10.3969/j.issn.1671-8348.2016.32.003
国家自然科学基金资助项目(81100394)。 作者简介:徐敏(1981-),中级医师,本科,主要从事妇产科疾病的研究。△
E-mail:xmlm520@163.com。
R
A
1671-8348(2016)32-4471-04
2016-04-05
2016-05-18)
