天女木兰不同组织总RNA提取方法的筛选与优化
2016-12-19陆秀君张晓林
侯 哲,陆秀君,张晓林,梅 梅,魏 俊,李 昂
(沈阳农业大学 林学院,辽宁 沈阳 110866)
天女木兰不同组织总RNA提取方法的筛选与优化
侯 哲,陆秀君,张晓林,梅 梅,魏 俊,李 昂
(沈阳农业大学 林学院,辽宁 沈阳 110866)
试验以天女木兰叶芽、幼叶、成熟叶、花芽、花瓣、种子为材料,分别采用Trizol法、改良Trizol法、CTAB-异丙醇法、CTAB-NaAc和无水乙醇法、CTAB-LiCl法、天根试剂盒法对其各器官进行总RNA的提取。总RNA的完整性、纯度和浓度等提取效果分别通过琼脂糖凝胶电泳和酶标仪进行检测。结果表明:叶芽的总RNA最适合用改良Trizol法进行提取,花瓣和花芽的总RNA最适合用改良的CTAB法提取,幼叶的总RNA可选择试剂盒法,Trizol可用于成龄叶片的提取,而天根试剂盒最适合天女木兰种子总RNA的提取。通过不同提取方法获得的高质量总RNA经RT-PCR检测表明:可以直接用于后续分子克隆和基因表达分析等分子生物学实验。
天女木兰;总RNA;提取方法;RT-PCR
天女木兰Magnolia sieboldiiK.Koch 是中国唯一的一种野生木兰属Magnolia植物,别称天女花,在历史上有稀世奇花的美称。叶互生、大而肥厚,可制芳香油;花色洁白素雅,花大清香,被称之为“木本西施”,花可制香浸膏,也是重要的香精植物资源;种子含油量很高,油是重要的日用化工原料,精油经分析有19种成分,可药用;同时天女木兰具有很多木本植物的原始特征,是一种具有广阔开发前景的珍稀野生木本植物,在中国植物红皮书中被列为国家重点保护的珍稀濒危植物[1]。
目前针对天女木兰的研究主要集中在苗木的生长与繁育、林木的保育开发及种子的休眠与萌发方面,例如:陆秀君等[2]研究了天女木兰种子后熟期间的生理生化变化;杜凤国等[3]研究了天女木兰种子形态及生物学特性;杨铁囡等[4]研究了天女木兰在不同生境下的叶片解剖结构;李澎等探究天女木兰种子深休眠的特性,从生理生化的水平上解释了其难以萌发的原因。有关天女木兰(乃至木兰科)分子生物学研究报道极少。
植物相关基因的差异表达、Northern杂交分析、基因克隆、cDNA文库的构建、RT-PCR半定量分析等分子生物学的研究均需要以量足质佳的RNA为基础。但是,植物组织RNA的提取受到众多内源因素的影响,包括自身富含的大量脂肪、多糖、贮藏蛋白、酚等次生代谢物;以及外源RNase的干扰。这使得从植物器官中抽提高纯度RNA变得十分困难[5-6]。
目前,植物组织总RNA提取的常用方法有CTAB法、改良的CTAB法、Trizol法、改良Trizol法、SDS法、试剂盒等。Trizol是天根生产的一种总RNA抽提试剂,其优点是需要的时间较短、容易上手操作,最近几年广泛用于植物RNA的提取。CTAB法、改良的CTAB法、改良的SDS法也是提取核桃[7]、杏[8]、桃[9]、白桦[10]、山核桃[11]、侧柏[12]等RNA常用的方法。天女木兰各器官富含多糖、多酚、脂肪、贮藏蛋白等次生代谢物质,都是干扰RNA提取的成分,使得天女木兰总RNA的提取变得十分困难。到目前为止,关于天女木兰总RNA提取的方法并不明确,而且同种植物的不同器官与部位、甚至同种植物的相同组织在不同的发育时期,其RNA提取的方法也不一定相同,为获得高质量的天女木兰总RNA,需要针对不同的组织部位,摸索与筛选出最佳的提取方法。本研究以天女木兰叶芽、幼叶、成熟叶、花芽、成熟花瓣、种子为试验材料,对比Trizol法、改良Trizol法、CTAB-异丙醇法、CTAB-NaAc和无水乙醇法、CTAB-LiCl法、天根试剂盒等六种方法的提取效果,从而有针对性的摸索出一套适宜天女木兰各组织总RNA的提取方法,以期为今后天女木兰后续的分子生物学研究提供科学基础。
1 材料与方法
1.1 试验材料与试剂
试验用到的天女木兰各器官材料采于沈阳农业大学植物园内8年生的健康植株,分别于4月上旬采集天女木兰叶芽、5月初采集幼叶、花芽采于5月中旬、成熟叶与成熟花瓣采集于6月中旬、9月末采集种子等材料并迅速冷冻于液氮中,或者冷藏于-80℃的超低温冰箱中,直到RNA提取。
试验所用试剂CTAB(十六烷基三甲基溴化铵)为Sanland-chem产品,EDTA购自上海生工,Trizol与试剂盒均为天根公司产品,PVP为上海生工产品,PVPP为Salarbio产品,β-巯基乙醇购自Amresco,反转录First stand cDNA synthesis kit试剂盒从TOYOBO购买,引物由上海生工合成。其余试剂均为国产分析纯。
1.2 天女木兰各器官总RNA的提取
RNA提取过程中所用的离心管、枪头盒、枪头等塑料器皿必须经0.1%的DEPC水37 ℃浸泡过夜后于121℃高温高压灭菌40 min后使用,研钵、量筒等玻璃器皿、药匙等应用铝锡纸包好后于烘箱中180 ℃烘6~8 h灭菌,其他试剂配置参考《分子克隆实验指南》[12]。
1.2.1 Trizol法
按照Invitrogen公司Trizol试剂说明书进行提取。
1.2.2 改良 Trizol法
称取0.01 gPVPP与0.1 g的天女木兰组织置于研钵中,液氮冷却种子后用研杵碾碎种子后,边加液氮边研磨至种子成为细粉末状,用液氮预冷过的药匙迅速将粉末转移到1.5 mL预冷的离心管中,加入10 µLβ-巯基乙醇和1mLTrizol,剧烈震荡混匀后室温静置10 min;
①4℃,12 000 r/min离心5min,将上清小心转入另一个预冷的离心管中,加入5 mol/L的NaCl溶液 200 µL,混匀后加入 200 µL 氯仿,混匀后室温静置15 min;
②4℃,12 000 r/min离心15 min,仅转移最上层水相于另一个的预冷的离心管中,加200 µL氯仿抽提;
③4℃,12 000 r/min离心15 min,仅转移最上层水相于另一个的预冷的离心管中,加入等体积的水饱和酚∶氯仿∶异戊醇(25∶24∶1),充分混匀后室温静置5 min;
④4℃,12 000 r/min离心10 min,抽出上清后转入0.5 mL异丙醇,静置5 min沉淀RNA;
⑤4℃,12 000 r/min离心10 min,小心倒掉上清,转入75%乙醇1 mL悬浮清洗沉淀;
⑥4℃,8 000 r/min离心5 min,倒掉上清液,放置在干净的实验台上彻底晾干沉淀5 min;
⑦取50 µLRNase-free dd H2O溶解沉淀得RNA溶液,-80 ℃保存备用。
1.2.3 改良CTAB法
①称取样品0.1g至于研钵中,加液氮研磨成细粉末状,转入1.5 mL的离心管中,并加入1 mL65 ℃预热30 min的CTAB提取缓冲液,涡旋振荡充分混匀;
②放置在65 ℃水浴锅中水浴20 min,4 ℃,12 000 r/min离心10 min;
③取上清溶液于新的预冷的离心管中,加入1 mL酚/氯仿/异戊醇(25∶24∶1),混匀后冰浴10 min,4 ℃,12 000 r/min离心10 min;
④取上清溶液转入新的离心管中,加入pH值5.5,4 mol/L,1/20体积的KAc和1/10体积的无水乙醇,充分混匀后加入等体积的氯仿/异戊醇(24∶1)混匀后冰浴10 min;
⑤4℃,12 000 r/min离心10 min,取上清于新的离心管中,用不同方法进行RNA的沉淀。
1.2.4 异丙醇沉淀法
将上清液中加入等体积的异丙醇,置于-20℃冰浴1 h,4 ℃,12 000 r/min离心10 min,倒掉上清液,加入75%乙醇,清洗并悬浮沉淀,放置于超净工作台晾干数分钟,加入50 µLRNase-free dd-H2O溶解沉淀得RNA溶液;
1.2.5 LiCl沉淀法
于上清液中加入8 mol/L,1/3体积的LiCl溶液,-20℃贮藏过夜,离心等工作同上;
NaAc及无水乙醇沉淀法,于上清液中加入pH5.2,1/10体积3 mol/L的NaAc和2.5倍体积的无水乙醇,充分混匀后-20℃冰浴2 h,离心等操作同上。
1.2.6 试剂盒法
按照Invitrogen公司的植物RNA快速提取试剂盒说明书进行。
1.3 RNA检测
1.3.1 凝胶电泳检测 RNA完整性
分别取各器官的总RNA2 µL在1%的琼脂糖凝胶、0.5×TBE、150 V电压下电泳15 min,总RNA的完整性通过BioRad凝胶成像系统拍照检测。
1.3.2 RNA样品含量与纯度检测
通 过 NanoDrop ND-1000(Thermo Scienti fi c,USA)酶标仪测定RNA在260 nm和280 nm处的吸光值(以实验中溶解RNA的ddH2O为空白进行调零),通过得到的RNA质量浓度可得RNA产率:RNA质量浓度(µg/mL)×体积(mL)/样品质量(g)。
1.3.3 RT-PCR分析检测cDNA
采用cDNA第一链反转录试剂盒进行RNA的 反 转 录,20 µL体 系: 总 RNA 模 板 2 µL,Oligo(dT)2 µL,ddH2O 8 µL, 离心 混匀后,70 ℃10 min后迅速冰浴2 min以上,然后开始反转录:上述液 12 µL,5×M-MLV Buffer 4 µL,dNTPMixture 1 µL, RNase Inhibitor 0.5 µL RTaseMMLV(RNaseH-)1 µL,ddH2O 1.5 µL,反应程序为:42 ℃1 h,70 ℃15 min,冰上冷却。
每个样品取5 µL进行1.0%的琼脂糖凝胶、1%的琼脂糖凝胶、0.5×TBE、150V电压下电泳15 min,cDNA通过BioRad凝胶成像系统拍照检测。
1.3.4 半定量RT-PCR分析
反转录合成第一条cDNA链后,根据NCBI上其他已知的Actin基因设计同源序列,正向引物 5′-CACAGGTGGACCATCCCATC-3′; 反 向引 物:5′-TGCTAGCCATGTGATGTGGG-3′, 进行半定量RT-PCR分析。20 µL的反应体系:10 mmol/L dNTPs,0.5 µL;10×Buffer,2 µL;Taq DNA Polymerase,0.5 µL;10 µmol/L 的上下游引物,0.5 µL;ddH2O,15.5 µL;cDNA,0.5 µL。
各试剂加入PCR管后离心混匀。按照如下反应程序进行PCR:94 ℃预变性,5 min;94 ℃变性,30 s;55 ℃退火,30 s;74 ℃延伸,1 min; 循环27次;72 ℃延伸,10 min。
PCR反应产物由1%的琼脂糖凝胶电泳检测。
2 结果与分析
2.1 天女木兰各组织总RNA完整性的检测
以天女木兰幼芽、幼嫩叶片、成龄叶片、花芽、成熟花瓣及种子为试材,用Trizol法、改良Trizol法、天根试剂盒法、CTAB-异丙醇法、CTAB-醋酸钠及无水乙醇法、CTAB-氯化锂法分别提取总RNA,取2 µL样品电泳检测,凝胶由1%的琼脂糖制成,图1为BioRad凝胶成像系统检测结果,就天女木兰叶芽来看,只有Trizol和改良Trizol法获得了不同品质的RNA,其余方法均未提出叶芽总RNA,但Trizol法得到的RNA两条带比较模糊,且5S处拖尾严重,说明RNA存在严重降解;经改良后,条带清晰、完整、无拖尾,因此,最适合叶芽的提取方法为改良Trizol法。从幼嫩叶片的电泳图可知,Trizol、改良Trizol、CTAB-异丙醇、试剂盒均得到了不同品质的RNA,但是Trizol法提取的RNA纯度较低,有明显的多糖污染,这点可以从点样孔明显的亮带看出; CTAB-异丙醇法得到的RNA条带亮度很弱,说明RNA有少量的降解;改良Trizol法条带清晰、完整,适合幼嫩叶片RNA的提取,天根试剂盒法同样适用。除了CTAB-异丙醇法外,其余几种方法均得到了不同品质的成龄叶片RNA,然而改良Trizol法18S处弥散严重,说明大部分RNA发生降解;CTAB-醋酸钠及无水乙醇法得到的条带18S亮度是28S的两倍,不符合完整RNA的要求;CTAB-氯化锂法条带呈团簇状,表明RNA降解;相比来说,Trizol与试剂盒得到的条带清晰、完整,可用于提取天女木兰成熟叶片的RNA。除试剂盒外,其余五种方法均得到了不同品质的花芽RNA,但只有改良Trizol法和CTAB-氯化锂法得到的RNA条带清晰、亮度适宜,适合花芽总RNA的提取。从成熟花瓣的电泳图得知,除了Trizol法和天根试剂盒法外,其余四种方法均得到了两条清晰完整、亮度适宜的条带,且每条带之间没有出现拖尾、弥散,表明提取的RNA结构完整,得率较高,均可以用于成熟花瓣总RNA的提取。从种子的提取效果来看,只有天根试剂盒得到的总RNA点样孔处无亮斑,无DNA、多糖、蛋白等的污染,条带的亮度与清晰度达到要求,两条带之间干净无弥散,最适合天女木兰种子RNA的提取。
2.2 天女木兰各组织总RNA的纯度和产率的检测
用不同提取方法获得的天女木兰各组织总RNA产率及质量浓度见表1。从表1可得到,Trizol法提取成龄叶RNA,OD260/OD280为1.96,质量浓度与产率分别达到353.04 µg/mL、176.52µg/g,说明RNA纯度较高,多糖、蛋白等杂质去除的较彻底,适用于成龄叶片RNA提取,其他组织的OD260/OD280相对较低,产率不高,不适宜RNA的提取。在Trizol的基础上进行改良后,除了成龄叶与种子外,其他各组织的OD260/OD280值与产率均得到了大幅度的提高,表明改良Trizol法相比与Trizol法,得到的叶芽、幼叶、花芽、花瓣总RNA纯度高,污染少,可用于RNA的提取。CTAB-异丙醇法只适用于成熟花瓣总RNA的提取,OD260/OD280为 2.03,产率达 118.68 µg/g,与电泳结果相一致。花芽与成熟花瓣用CTAB-醋酸钠及无水乙醇沉淀法提出总RNA 的OD260/OD280分别为2.06与2.03,说明杂质去除的教彻底,RNA纯度相对较高,完整性也好,产率分别为108.80 µg/g与 108.34 µg/g。从表1得知,通过改良CTAB法中的LiCl沉淀RNA,抽提的总RNA OD260/OD280值均在2.0左右,花芽与花瓣的RNA产率也显著高于其他方法,表明LiCl可以高效的沉淀RNA。通过纯度与产率的分析,进一步确定了来源于相同植物的不同种器官,各部位获取高质量RNA的方法也不同的观点,不同组织的总RNA需要采取不同的方法来进行提取。
2.3 天女木兰各组织总RNA反转录合成cDNA的检测
为了进一步检测天女木兰各组织通过适宜的提取方法得到的总RNA质量,本试验对提取得到的RNA反转录后电泳检测,通过BioRad凝胶成像系统拍照检测。由图2我们可以看出,每个点样孔的cDNA跑胶得到的是一条明亮清晰呈弥散状的条带,长度大约在150~2 000 bp之间,带型完整,由此表明,反转录得到的cDNA比较完整,可以充分满足后续的分子试验要求。
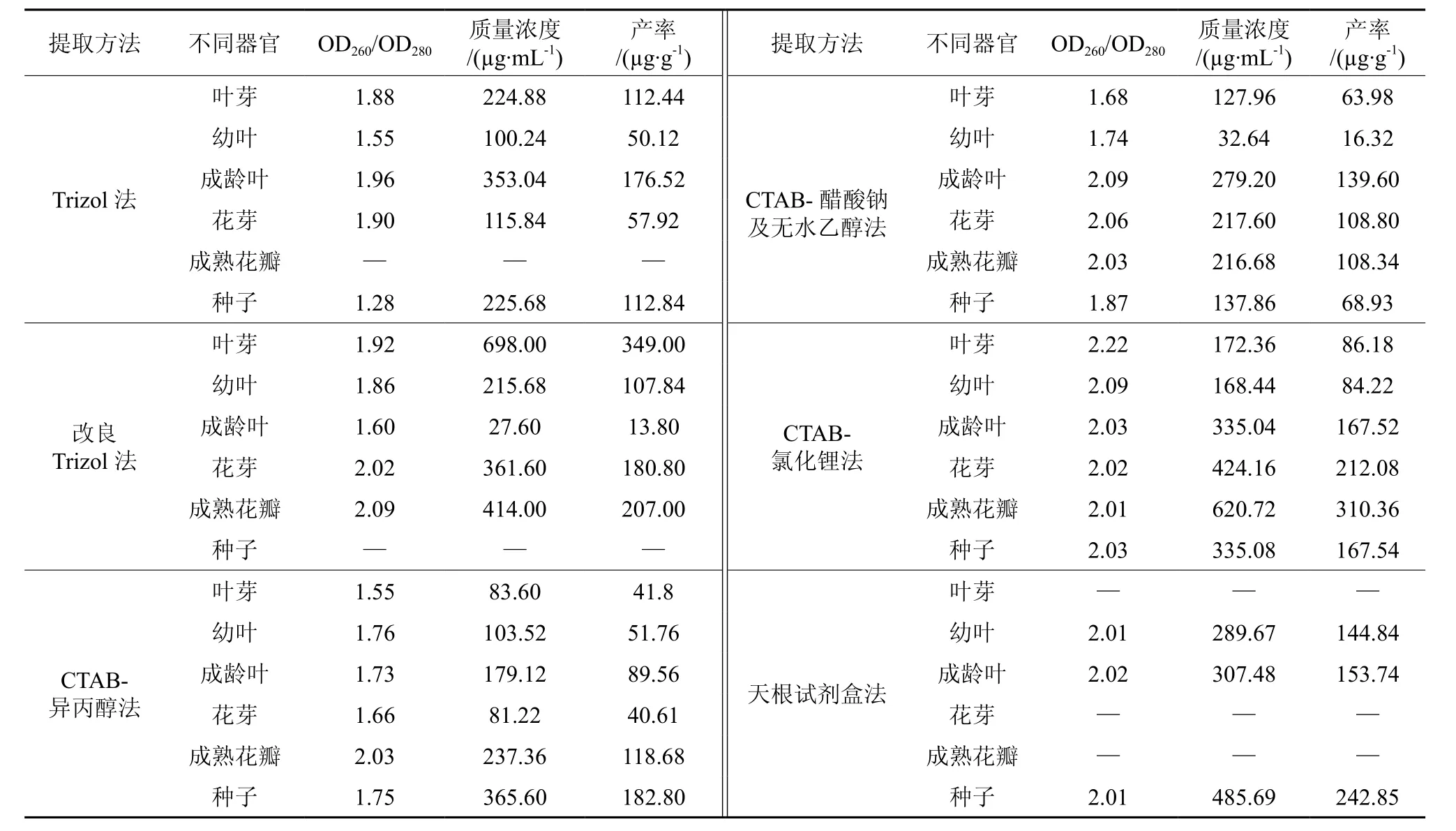
表1 不同方法对提取的天女木兰总RNA质量浓度和产率的影响†Table 1 Mass concentrations and productivities of Magnolia sieboldii total RNA with different extraction methods
2.4 天女木兰各组织总RNA的RT-PCR扩增检测
天女木兰不同组织通过不同方法提取的高质量RNA经反转录后,利用NCBI设计天女木兰β-Actin内参基因的引物,以期验证所得的cDNA是否能够完成特异性扩增,这可以深度反应出前期提取得到的RNA质量,以及是否满足后续分子试验。经PCR扩增后,取2 µL样品进行电泳检测,拍照后得图3,分析所得的电泳图后发现,以高质量的RNA反转录后的cDNA为模板扩增所得的条带完整清晰,与预计目的片段的大小相一致,可以满足天女木兰后续分子试验要求。
3 结论与讨论

图2 天女木兰各组织质量优良RNA的反转录电泳检测Fig.2 Electrophoresis of good quality Magnolia sieboldii total RNA reverse transcription

图3 抽提高质量天女木兰总RNA的RT-PCR检测Fig.3 RT-PCR of high quality total Magnolia sieboldii RNA extracted with different methods
时至今日,众多学者对于如何获取高质量植物总RNA的方法进行了大量的探索与研究[14-19],不同植物及同一植物不同的部位都具有各自的特点,因此,不同物种或同种植物不同组织或器官RNA的提取存在差异。为确保获得高质量的RNA以应用于后续分子试验,有必要针对天女木兰不同器官或组织筛选出最佳RNA提取方法。
天女木兰各组织富含多酚、多糖、蛋白质等次生代谢产物,随着各器官的不断成熟,会积累大量的水解酶,多糖和多酚的含量也随之增加,而RNA的很多理化性质与多糖相似,很难将它们分开;多酚容易被氧化,被氧化的褐色醌类物质[20]会与RNA不可逆的结合,使RNA发生降解[21];多酚水解酶与RNA酶都属于蛋白质,要获得高品质、完整的总RNA,在抑制RNase的前提下,最重要的是将RNA的干扰蛋白完全排除;RNA很容易与次生代谢产物结合,从而阻碍RNA的提取[22]。因此,要在天女木兰的各器官中获取高质量的RNA,重中之重就是将多糖、多酚、蛋白等干扰物质完全去除。而天女木兰各组织或器官中多糖、多酚、蛋白质均不完全相同,需根据不同组织材料的特点,进行具体的摸索和完善。
本研究采用六种方法提取天女木兰叶芽、幼叶、成龄叶、花芽、成熟花瓣、种子各组织总RNA,结果表明:
Trizol法抽提RNA需要的时间短,且容易上手操作,其在甜瓜、芒果、茶树等许多植物RNA提取过程中都取得了很好的效果[23-24]。但在本研究中发现,仅在天女木兰成龄叶片提取到的RNA质量相对较好,而在其他组织中提到的RNA质量较差,甚至不能抽提出RNA,分析可能是由于该方法步骤简单,不能有效去除多糖、蛋白等杂质的污染,从而无法从其他组织中提取出完整的RNA。
通过对以往的Trizol法进行改良,在研磨前将PVPP与天女木兰样品混合,添加液氮快速磨碎样品,并将β-巯基乙醇混匀入裂解液中,从而彻底排除酚类物质,杂质和色素等对RNA的干扰,NaCl高盐溶液沉淀RNA的基础上加氯仿抽提,可以较彻底排除多糖和蛋白质等干扰物质的影响,可以看出,要获取天女木兰叶芽、花芽、成熟花瓣的高质量总RNA,可以将Trizol改良后抽提,且整个提取过程耗时较短,操作简便,提取的RNA产量大,纯度好,对具有天女木兰类似成分的其他作物的RNA提取具有一定的借鉴意义。
CTAB一方面可以很好的打破植物细胞,释放核酸,另一方面可以将核酸上的其他附属物脱离核酸,并在裂解液中加入β-巯基乙醇,从而抑制RNA酶活性。沉淀RNA的方式有很多,如异丙醇法、NaAc和无水乙醇法、LiCl法,本研究对不同的方法进行了比较研究,结果表明,CTAB-异丙醇法仅可以在天女木兰的成熟花瓣中提取到高质量的RNA;CTAB-NaAc和无水乙醇法可以在花芽与成熟花瓣中提取得到高质量的RNA;CTABLiCl法可以在花芽、成熟花瓣、种子中提取得到RNA,但在种子中从电泳结果可以看出,质量并不理想;由此可以看出,本研究采用的3种改良CTAB法只能在天女木兰的花芽和成熟花瓣中提取得到质量良好的总RNA,在其他组织中提取的RNA质量不佳,甚至不能提到RNA,这可能是由于CTAB只可以很好的针对天女木兰花瓣一类的植物材料,有效提取得到总RNA,而在天女木兰其他器官中,CTAB不能很好的发挥其药效。进一步通过表1分析RNA的质量浓度与产率我们可以看出,通过CTAB-LiCl法得到的总RNA OD260/OD280值均在2.0左右,花芽与花瓣的RNA产率也显著高于其他方法,这可能是由于,LiCl本身具有沉淀大片段RNA的特点,得到的RNA纯度好、质量佳。进一步证明了了同一种植物的不同组织,获取高质量RNA的方法也不一定相同的观点,需要在了解植物特性的基础上,通过不断的探索与研究,筛选与优化最佳方案。
天根试剂盒能够很好的从天女木兰种子中提到完整性好,纯度高,质量佳的总RNA,从幼叶与成龄叶提到的RNA质量相对较低,不能从叶芽、花芽、成熟花瓣中提到总RNA,这可能与植物材料本身有关,林木种子相对于根、茎、叶来说稳定性较高[25],因此获取RNA也不尽相同。而天女木兰种子不易萌发,种子需特殊处理约4~5个月才可萌发,关于天女木兰(乃至木兰科)种子萌发调控分子机制的相关研究尚属空白,因此,欲从长远和根本上解决种质资源危机,有必要开展种子萌发分子调控机制研究。采用天根试剂盒可以提取得到高质量的天女木兰种子总RNA,为后续的相关分子试验奠定基础。
将各个器官的总RNA通过最适宜的方法提取出来后,尽快将高质量的RNA反转录,因为cDNA相对于RNA稳定的多,可贮存于-20℃的冰箱内保存[26]。电泳后通过BioRad凝胶成像系统拍照检测,每个点样孔的cDNA跑胶得到的是一条明亮清晰呈弥散状的条带,长度大约在150~2 000 bp之间,带型完整,证明RNA质量较高。
综合以上研究可知,天女木兰叶芽与幼叶的总RNA的最佳提取方法为改良Trizol法,Trizol法可以从成龄叶中提到质量相对较好的总RNA,3种改良的CTAB法最适宜也只能从天女木兰的花芽与成熟花瓣中提取到高质量的总RNA,而要从天女木兰种子种获得品质优良的总RNA,可以选择天根试剂盒法。
本研究结果还进一步说明了同一种植物的不同器官和组织都具有各自的特点,其RNA提取的最适宜方法也存在着差异,应在熟练掌握基本操作原理的基础上,根据材料自身的特点,并在试验过程中对所有的仪器设备经过严格处理,防止RNA 被降解,从而选择适宜的方法提取 RNA,才能更好地进行转录组测序和 cDNA 文库建立等后续分子研究工作[27]。
[1]宋朝枢,徐荣章,张清华,等.中国珍稀濒危保护植物[M].北京:中国林业出版社, 1989.
[2]李 澎,陆秀君,姚 飞,等.天女木兰种子休眠原因的初步探讨[J].种子, 2006, 25(2): 36-39.
[3]杜凤国,王 欢,杨德冒,等.天女木兰种子形态及生物学特性[J].北华大学学报:自然科学版, 2006, (3) : 269-272.
[4]杨轶囡.不同生境天女木兰叶片解剖结构比较[J].吉林农业大学学报, 2006, 12(3) : 269-272.
[5]李 宏,王新力.植物组织RNA提取的难点及对策[J].生物技术通报, 1999, 1(1): 1-6.
[6]胡群文,陈晓玲,张志娥,等.干种子高质量总RNA的快速提取方法[J].植物遗传资源学报, 2010, 11(3): 360-363.
[7]刘晓菊,洪海波,李 敏,等.改良CTAB法提取核桃总RNA试验[J].山东农业科学, 2008(1): 97-99.
[8]李晓颖,曹 雪,房经贵,等.杏叶片与果实总RNA提取方法研究[J].中国农学通报, 2010, 26(2): 152-156.
[9]王 宇,李 玲,王 慧,等.两种桃芽总RNA提取方法的比较研究[J].山东农业大学学报:自然科学版, 2011, 42(3):388-391.
[10]杨传平,姜 静,那冬辰,等.白桦花芽RNA的快速提取[J].东北林业大学学报, 2002, 30(3): 2-4.
[11]沈 乾,夏国华,张秋月,等.山核桃花芽总RNA提取方法研究[J].浙江林业科技, 2009, 29(3): 57-60.
[12]王暑辉,徐 倩,徐 筱,等.富含多糖多酚的侧柏叶片总RNA提取方法[J].吉林农业大学学报, 2012, 34(1): 76-80.
[13]J萨姆布鲁克,DW拉塞尔.分子克隆实验指南[M].黄培堂等译.第3版.北京:科学出版社, 2003: 582-584.
[14]Teixeira J, Fidalgo F.Salt stress affects glutamine synthetetase activity and mRNA accumulation on potato plants in an organdependent manner[J].Plant Physiology and Biochemistry, 2009,47(9): 807-813.
[15]Niu Y Y, Luo H M, Sun C,et al.Expression profiling of the triterpene saponin biosynthesis genes FPS, SS, SE, and DS in the medicinal plant Panax notoginseng[J].Gene, 2014, 533(1): 295-303.
[16]Yamaguchi H, Hasegawa K, Esumi M.Protein from the fraction remaining after RNA extraction is useful for proteomics but care must be exercised in its application[J].Experimental and Molecular Pathology, 2013, 95(1): 46-50.
[17]Djami-Tchatchou A T, Straker C J.The isolation of high quality RNA from the fruit of avocado[J].South Afican Journal of Botany, 2012, 79: 44-46.
[18]陈宏伟,万里红,杨进军,等.盐肤木叶片总RNA提取方法的比较研究[J].江苏农业科学, 2012, 40(5): 27-30.
[19]王 伟,李立芹,邹 雪,等.马铃薯块茎总RNA提取方法的比较研究[J].江苏农业科学, 2013, 41(1): 38-40.
[20]Su X, Gibor A.A method for RNA isolation from marine macroalgae[J].Anal.Biochem., 1991, 197: 91-95.
[21]Schneiderbauer A, Sandermann H, Ernst D.Isolation of functional RNA from plant tissues rich in phenolic compounds[J].Anal.Biochem., 1991, 197: 91-95.
[22]裴 东,谷瑞升.几种提取木本植物中RNA方法的比较和改进[J].植物生理学通讯, 2002, 38(4): 362-365.
[23]林金科,开国银.茶树RNA的提纯与鉴定[J].福建农业大学学报, 2003, 32(1): 70-73.
[24]赵继荣,毕 阳,刘红霞,等.Trizol法提取厚皮甜瓜果实RNA条件的筛选[J].甘肃农业大学学报, 2009, 44(2): 56-59.
[25]王旭军,张日清,许忠坤,等.红榉不同种源种子形态性状变异[J].中南林业科技大学学报,2015,35(1):1-7.
[26]刘美兰,谭晓风,龙洪旭,等.油桐丙二酰单酰CoA:ACP转酰基酶的克隆与序列分析[J].经济林研究, 2014, 32(4): 1-7.
[27]魏琦琦,冯延芝,林青,等.适于转录组测序的枣不同器官总RNA提取方法筛选[J].经济林研究, 2015, 33(2): 63-67.
Selection and optimization of total RNA extraction methods fromMagnolia sieboldiidifferent tissues
HOU Zhe, LU Xiu-jun, ZHANG Xiao-lin, MEI Mei, WEI Jun, LI Ang
(College of Forestry, Shenyang Agricultural University, Shenyang 110866, Liaoning, China)
Six extraction methods, including modi fi ed CTAB, Trizol, modi fi ed Trizol, TIANGEN extraction kit, were studied in the RNA extraction fromMagnolia sieboldiibuds, leaves, mature leaves, flower buds, petals and seeds.Integrity, purity and concentration of total RNA were examined by agarose gel electrophoresis and nucleic acid analyzer.Of these six methods, the method of modi fi ed Trizol was better for buds isolation, the method of modi fi ed CTAB was better for fl ower buds and petals isolation, Trizol method can be used to extract mature leaves, while the RNA extracted by TIANGEN kit is effective to the leaves and seeds.High quality total RNA obtained by different extraction methods through RT-PCR analysis indicated that the RNA satis fi ed the standard for gene cloning and other molecular biological experiments,
Magnolia sieboldii; total RNA; extraction methods; RT-PCR
10.14067/j.cnki.1673-923x.2016.07.019
http: //qks.csuft.edu.cn
S722.1
A
1673-923X(2016)07-0109-07
2015-09-14
国家自然科学基金项目(31070561;31570621)
侯 哲,硕士研究生
陆秀君,教授;E-mail:353020376@qq.com
侯 哲,陆秀君,张晓林,等.天女木兰不同组织总RNA提取方法的筛选与优化[J].中南林业科技大学学报,2016, 36(7):109-115.
[本文编校:吴 毅]
