欧美杨108高效组培再生系统
2016-12-19李永丽安世恒胡建军
周 洲,李永丽,安世恒,胡建军
(1.河南科技大学 林学院,河南 洛阳 471003;2.河南农业大学 植保学院,河南 郑州 450002;3.中国林业科学研究院 林业研究所,北京 100091)
欧美杨108高效组培再生系统
周 洲1,李永丽1,安世恒2,胡建军3
(1.河南科技大学 林学院,河南 洛阳 471003;2.河南农业大学 植保学院,河南 郑州 450002;3.中国林业科学研究院 林业研究所,北京 100091)
欧美杨108生产性状优良,是基因工程转化的理想受体,高效的组培再生系统是转化工作的基础。以欧美杨108茎段、叶柄、叶片3种外植体为起始材料,确定了植株再生过程中诱导丛生芽、芽的茎伸长和生根培养的最优培养条件,建立了稳定高效的再生培养系统。结果表明:基本培养基MS优于WPM;最适从生芽诱导培养基为MS + TDZ 0.05 mg/L + 6-BA 0.05 mg/L + NAA 0.05 mg/L+蔗糖30 g/L,茎段、叶柄、叶片3种外植体丛生芽诱导率分别达 100%、100%和86%。丛生芽需要进行茎伸长诱导的环节,茎伸长诱导效率最高是MS +KT 0.5 mg/L+ GA32 mg/L +果糖30 g/L 培养基,茎段和叶柄丛生芽茎伸长诱导最好,诱导培养20 d,得到平均芽长3 cm的有效芽,增殖系数大于4。抽茎芽转入生根培养前,须经MS基本培养基壮化培养。在1/2 MS + IAA 0.02 mg/L+ IBA 0.02 mg/L + AC3 g/L+蔗糖30 g/L培养基上,试管苗生根率可达100%,苗体健壮。欧美杨108高效组培再生系统为其遗传转化奠定了基础。
欧美杨108;离体培养;芽伸长诱导;芽壮化培养
欧美杨108P.euramericana‘Guariento’具有优良的速生性、抗病虫害能力及材性,可营造工业和造纸商品林,也适于营造生态林改善生态环境[1,2]。组培再生系统是其种质资源保存利用和基因转化研究的基础[3]。杨树不同品种再生研究表明[4-14],杨树品种间组培再生条件区别明显。欧美杨108高效组培再生系统具有应用价值高,笔者选择叶片、叶柄和茎段3种外植体,反复试验启动培养和循环继代培养条件,建立其稳定高效的组培再生系统。
1 材料与方法
1.1 材料与培养条件
欧美杨108P.euramericana‘Guariento’由中国林业科学研究院提供。培养温度 (26 ±1) ℃,光周期16L:8D,光照度 2 000 lx。
1.2 启动培养
1.2.1 外植体处理
欧美杨108一年生枝条扦插苗,5~7月剪取新生嫩枝,自来水下流动冲洗2 h。超净工作台中,用75%乙醇浸泡30 s,无菌水洗涤1次;再用1 g/L 的HgCl2溶液浸泡4 min,最后用无菌水洗涤5次,获得除菌外植体。茎段、叶柄剪成1.5 cm左右长度,幼嫩叶片剪3道切口横向深达主脉,接种于丛生芽诱导培养基上,叶背面向上;每种外植体接种60个。
1.2.2 丛生芽的诱导与分化
基本培养基MS和wpm,添加不同质量浓度的噻苯隆(TDZ)、6-苄氨基嘌呤(6-BA)、萘乙酸(NAA),最后添加琼脂5 g/L,蔗糖30 g/L,灭菌前pH值调整至6.0。15d在原接种培养基上继代1次,30 d 后统计愈伤和丛生芽诱导状况,统计各处理丛生芽诱导率。

1.2.3 丛生芽抽茎生长及壮化
基本培养基MS,分别添加TDZ、激动素(KT)、6 -BA、吲哚丁酸(IBA)、NAA、谷氨酰胺(Gln)、赤霉素(GA3)等植物生长调节物质,部分组合见表2,另附加葡萄糖、果糖或蔗糖30 g/L,琼脂5 g/L,灭菌前pH值调整至6.0。20 d 后观察丛生芽伸长状况,统计各处理的丛生芽伸长率,对比不同生长调节物质对试管苗茎伸长的影响。

1.2.4 试管苗的生根
基本培养基MS、1/2 MS或1/4 MS,添加吲哚乙酸(IAA)、IBA、NAA,或附加活性炭(AC),另附加蔗糖30 g/L,琼脂 5 g/L,灭菌前pH值调整至6.0。每处理接种40个4 cm长的芽,20 d 后统计各处理的生根率、每苗平均生根数、平均根长。

1.3 循环继代培养
1.3.1 外植体处理
欧美杨108高度10 cm的生根组培苗,茎段、叶柄分别剪成1 cm的短段;完全展开的叶片剪3道切口横向深达主脉,叶背面向上,每处理40个外植体接种在丛生芽诱导培养基上。
1.3.2 丛生芽的诱导
基本培养基MS,附加不同含量TDZ、6-BA、NAA组合见表4,另附加琼脂5 g/L,蔗糖30 g/L,灭菌前pH值调整至6.0。15 d在原接种培养基上继代1次,培养 30 d 后并观察愈伤和丛生芽生长状况,统计各处理丛生芽诱导率(同1.2.2)。
1.3.3 丛生芽抽茎生长及壮化
基本培养基MS,添加KT、GA3、果糖组合见表5,另附加琼脂5 g/L,蔗糖30 g/L,灭菌前pH值调整至6.0。培养20 d后,统计各处理的丛生芽伸长率和平均芽长(同1.2.3)。
2 结果与分析
2.1 启动培养
2.1.1 田间来源外植体丛生芽的诱导
当6-BA、TDZ和 NAA 同时存在时,茎段、叶柄和叶片3种外植体均可诱导出丛生芽,而其中任意2种调节物质的组合,未能诱导产生丛生芽(见表1)。相同植物生长调节物质组合,MS比WPM上的外植体丛生芽诱导率高;经过30 d培养,外植体更绿。在MS + TDZ 0.05 mg/L+6-BA 0.05 mg/L+ NAA 0.05 mg/L的培养基上,接种7 d后,茎段、叶柄外植体切口发红膨大,切面中部向外凸起,形成绿色愈伤组织;接种15 d后,愈伤组织开始出现密集的丛生芽,芽诱导率分别达95%和90%。每隔15 d在原培养基上继代一次,30 d后,丛生芽叶片长度1 cm左右,但没有茎(见图 1a、b)。叶片外植体接种10 d后,主叶脉切口处形成的白色愈伤,20 d后出现丛生芽(见图1c),丛生芽较茎段、叶柄外植体上密度小,丛生芽诱导率10%。
2.1.2 丛生芽诱导茎伸长及壮化培养
丛生芽需诱导茎伸长诱导的环节,才能形成有效的再生芽,此过程需更换与丛生芽诱导组分不同的培养基。外植体初始诱导出的丛生芽,在原丛生芽诱导培养基上继代培养;或在丛生芽诱导培养基中再添加GA3;或用IBA代替NAA;或降低细胞分裂素6-BA、TDZ或生长素NAA的含量;或仅有生长素IBA存在,丛生芽的茎均不能伸长生长;随着培养时间的延长,丛生芽逐渐黄化,甚至褐化死亡。MS培养基附加KT和GA3,能够较好地诱导丛生芽茎伸长生长。培养基为MS+ KT 0.5 mg/L + GA32 mg/L +果糖 30 g/L时,茎伸长诱导最好,茎段外植体来源的丛生芽伸长率达100 %,第14天芽高度平均3 cm,每外植体平均有4个抽茎芽(见表2)。在茎伸长诱导培养基MS + KT 0.25 mg/L+ GA31 mg/L +果糖30 g/L中,培养14 d后,茎伸长的有效芽平均高2 cm,每外植体平均有3个芽,芽长度稍短;培养基为MS + KT 1 mg/L + GA34 mg/L + 果糖 30 g/L时,培养14 d后,每个外植体平均有3个芽,有效的再生芽平均高3 cm,抽茎芽数量稍少。茎伸长诱导后得到的芽的茎、叶细弱(见图 2a、b);将原外植体携带此细弱的芽转移到MS基本培养基上,可使茎、叶器官逐渐增粗增大,使有效芽木质化程度加深(见图 2c)。
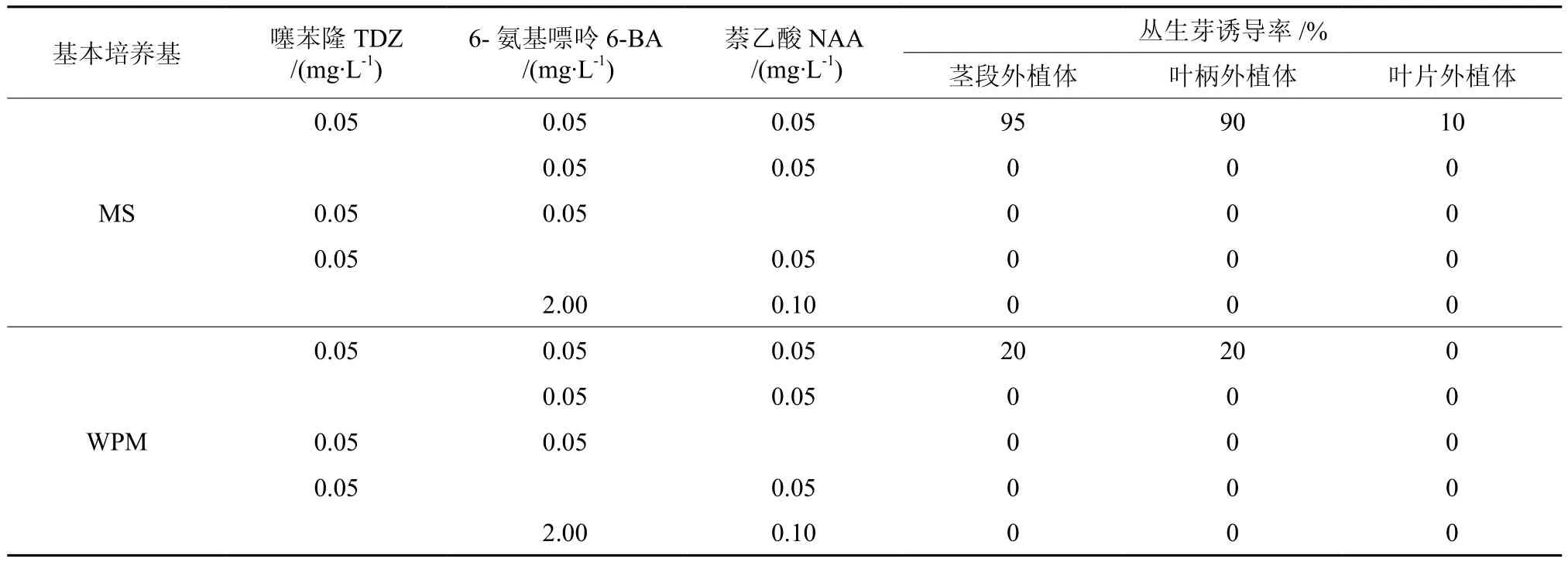
表1 不同质量浓度的植物生长调节剂组合对欧美杨108丛生芽诱导的影响Table 1 Effect of different hormone concentration on bud induction of P.euramericana ‘Guariento’

图1 欧美杨108田间外植体的丛生芽的诱导Fig.1 Shoots induction on different explants from fi eld cultures of P.euramericana ‘Guariento’

表2 不同质量浓度的植物生长调节剂组合对欧美杨108茎段丛生芽伸长的影响Table 2 Effect of different hormone concentration on enlongation of adventitious shoots from stem xplants of P.euramericana ‘Guariento’
2.1.3 试管苗的生根

图2 欧美杨108丛生芽的伸长及壮化培养Fig.2 Adventitious shoots enlongation and shoot strengthening of P.euramericana ‘Guariento’
选择高4~5 cm、茎健壮的无根苗用以生根。植物生长调节物质不同,试管苗生根差别较大(见表3),在培养基中添加IAA和IBA,生根率高。其中在1/2MS + IAA 0.02 g/L +IBA 0.02 g/L+ AC 3 g/L培养基中生根最好,生根率100%;生根培养7 d后,茎基部长出红色凸起根点;20 d后生根4条以上,根长度4 cm左右;主根粗壮,侧根丰富(见图 3)。

表3 不同培养基中欧美杨108芽生根Table 3 Shoots rooting of P.euramericana ‘Guariento’ in different culture mediums

图3 欧美杨108试管苗生根Fig.3 Shoot rooting of P.euramericana ‘Guariento’
2.2 循环继代培养
2.2.1 无菌苗外植体诱导丛生芽
TDZ、6-BA和NAA共同存在,且质量浓度在0.025~0.10 mg/L范围内,全部茎段和叶柄外植体可诱导出丛生芽,叶片外植体丛生芽诱导率较低,诱导率可达86%(见表4)。在MS+TDZ 0.05 mg/L+ 6-BA 0.05 mg/L + NAA 0.05 mg/L的培养基上,接种5 d后,茎段、叶柄和叶片切口就观察到绿色愈伤组织形成,15 d左右开始出现大量丛生芽,丛生芽无茎(见图 4),30 d后丛生芽叶片长为1 cm。TDZ、6-BA和NAA质量浓度在0.025 mg/L或0.10 mg/L时,外植体形成的愈伤体积稍小,丛生芽密度也低。
2.2.2 不同外植体来源的丛生芽伸长差异
在MS + KT 0.25 mg/L + GA31 mg/L+果糖 30 g/L培养基上,丛生芽诱导茎伸长效果最好,可形成数量较多的有效芽(见图 5);但不同外植体来源的丛生芽茎,伸长诱导效率差异明显(见表5)。茎段和叶柄外植体上的丛生芽茎伸长诱导率100%,叶片外植体上的丛生芽茎伸长诱导率为80%。茎段外植体来源的丛生芽,茎伸长诱导20 d后,每个外植体形成有效芽平均6.3个,芽平均长度4.5 cm,茎伸长诱导效率显著高于叶柄和叶片外植体。

表4 不同质量浓度的植物生长调节剂组合对欧美杨108组培苗外植体丛生芽诱导的影响Table 4 Effect of different hormone concentration on shoot induction from tissue-culture plantlet explants of P.euramericana ‘Guariento’

图4 欧美杨108无菌苗外植体丛生芽的诱导Fig.4 Shoots induction from different explants from tissue culture plantlets of P.euramericana ‘Guariento’

表5 欧美杨108不同外植体丛生芽伸长†Table 5 Difference on adventitious shoots enlongation for explants of P.euramericana ‘Guariento’

图5 欧美杨108不同外植体的丛生芽茎伸长诱导Fig.5 Adventitious shoots enlongation form different explants of tissue cultured plantlets of P.euramericana ‘Guariento’
3 结论与讨论
3.1 TDZ、6-BA和NAA配合诱导丛生芽
在培养条件相同的情况下,TDZ 0.05 mg/L、6-BA 0.05 mg/L 和 NAA 0.05 mg/L 共同配合,欧美杨108丛生芽诱导率最高;但是相同质量浓度的TDZ、6-BA 和 NAA,任何2种配合均不能诱导成芽。在河北杨和新疆杨[8],以及在‘2001’杨[11]及银中杨[15]再生过程中,均发现TDZ对丛生芽分化有重要影响,较低质量浓度的TDZ有利于分化。在欧美杨108丛生芽诱导过程中,6-BA和NAA的配合也非常关键,同时也要求存在低质量浓度的TDZ。
3.2 丛生芽需茎伸长诱导环节
欧美杨108丛生芽形成后,必须更换培养基,才能促使芽进一步生长,诱导丛生芽和诱导茎伸长所用培养基不同。在KT 0.5 mg/L和GA32 mg/L条件下,辅以30 g/L的果糖碳源培养基上,欧美杨108丛生芽茎伸长诱导效率最高,3种外植体来源的丛生芽均可得到很好伸长。在杨树许多品种的组织培养中,丛生芽形成后,并非必须诱导茎伸长培养环节。白杨派来源的杨树,往往不用更换培养基,丛生芽的茎叶便继续生长[5];而黑杨派来源的杨树,往往需更换培养基,减少原茎伸长培养基中细胞分裂素含量,丛生芽方可进一步生长[6]。
本试验中,丛生芽接种在茎伸长诱导培养基上,GA3含量在2~4 g/L范围内,均能够诱导茎伸长。一般认为,GA3对试管苗的增殖和伸长有显著效果,但是GA3会抑制根原基和芽原基分化,必须在愈伤组织分化后,才能加入GA3[9]。碳源是果糖时,欧美杨108丛生芽茎伸长效率最高,张小苹[16]也发现果糖对桑树丛生芽茎伸长效率更好,不同器官对于不同碳源利用能力差异是原因之所在。
3.3 Ac和壮化培养对生根的重要性
一般认为Ac的作用是通过吸附而发挥,有效吸附有害物质。在培养基中加入Ac,对许多植物的组培生长均表现出促进作用[17],并提供了黑暗的生长环境有助根的形成[18-19];但也有研究发现,Ac对杨树的组培生根有害[10]。在欧美杨108试验中,设置了Ac梯度,比较其对欧美杨108生根的作用。结果表明,适量的Ac能对其生根起到促进作用,在3 g/L时最有利,不但有助于欧美杨108根系的增粗和伸长,而且防止褐化产生。
对欧美杨108来说,芽的壮化对生根非常重要。经诱导茎伸长形成的欧美杨108有效芽,经MS壮化培养后,木质化程度加深,茎增粗,叶片增大,诱导生根很容易;如果不经壮化培养,则生根困难,苗成活率低。一般从愈伤组织上诱导出的丛生芽较小,长势不良,如果直接让其生根,生根率也低,则不易成活,故及时进行壮化培养是有效提高生根率的措施。有研究发现,部分杨树品种形成的芽可直接生根,无需壮化。如中黑防杨丛生芽长至0.5 cm左右时,切下转入茎伸长培养基中,21 d后丛生芽长成无根苗;将苗进行生根培养,基部14 d左右长出白色小根,95%的苗20 d后可长出l~2 cm粗壮的根[7]。欧美杨108同属于黑杨派,品种间组培生根差别是明显的,这种差异的原因有待进一步研究。
[1]王维正,刘 红.林木良种指南[M].北京:中国林业出版社,2003: 88-96.
[2]牛正田.黑杨派无性系苗期产量相关性状的遗传变异[D].北京:中国林业科学研究院,2007.
[3]卢孟柱,胡建军.我国转基因杨树的研究及应用现状[J].林业科技开发, 2006(6): 1-4.
[4]卢善发,赵华燕,魏建华,等.三倍体毛白杨组织培养再生系统的建立[J].植物学报, 2001, 43(4): 435-437.
[5]樊军锋,李 玲,韩一凡.84K 杨叶片外植体再生系统的建立[J].西北林学院学报, 2002, 17(2): 33-36.
[6]金顺玉,刘桂丰,杨传平.黑林1号杨的组织培养与植株再生[J].植物生理学通讯, 2003, 39(6): 639.
[7]程贵兰,姜 静,蔡智军.中黑防杨(美洲黑杨×青杨)的组织培养与植株再生[J].植物生理学通讯, 2004, 40(5): 585.
[8]贾小明,樊军锋,王娟娟.河北杨和新疆杨离体叶片诱导丛生芽研究[J].西北农林科技大学学报, 2006, 34(12): 109-115.
[9]李 昆.I-63 杨和 I-69 杨组织培养研究[D].武汉:华中农业大学, 2007.
[10]张 蕾,苏晓华,张冰玉,等.京 2 杨组培条件的优化及再生体系建立[J].林业科学研究, 2007, 20(6): 787-793.
[11]李永丽,周 洲,范晶超,等.2001杨组培再生体系建立[J].西北林学院学报, 2012, 27(6): 45-50.
[12]Ferreira S, Batista D, Serrazina S,et al.Morphogenesis induction and organogenic nodule differentiation inPopulus euphraticaleaf explants[J].Plant Cell Tissue and Organ Culture, 2009,96(1): 35-43.
[13]Kang BG, Osburn L, Kopsell D,et al.Micropropagation ofPopulus trichocarpa‘Nisqually-1’: the genotype deriving thePopulus referencegenome[J].Plant Cell Tissue and Organ Culture, 2009, 99(3): 251-257.
[14]Zhou Z, Wang M J, Hu J J,et al.Improve freezing tolerance in transgenic poplar by overexpressing a ω-3 fatty acid desaturase gene[J].Molecular Breeding, 2010, 25(4): 571-579.
[15]王慧梅,刘红梅,王文杰.TDZ, 基本培养基和光质对银中杨无菌苗茎段离体再生的影响[J].林业研究, 2008, 19(3): 257-259.
[16]张小苹.桑树茎尖培养中碳源,激素,水解乳蛋白的应用[J].河北农业科学, 2000(1): 20-23.
[17]胡蕙露,杨景华,杨荻荣,等.银杏茎段试管培养条件筛选研究[J].林业科学, 2002, 38(3): 52-56.
[18]许秀玉,施季森,席梦利,等.墨西哥落羽杉离体培养及再生体系的建立[J].林业科学, 2007, 43(10): 40-44.
[19]董玉峰,姜岳忠,张明哲,等.不同杨树品种的分枝及与生长和干形的关联[J].中南林业科技大学学报, 2014, 34(2): 34-38.
Effective tissue culture system forPopulus euramericana‘Guariento’
ZHOU Zhou1, LI Yong-li1, AN Shi-heng2, HU Jian-jun3
(1.College of Forestry, Henan University of Science and Technology, Luoyang 471003, Henan, China;2.College of Plant Protection, Henan Agricultural University, Zhengzhou 450002, Henan, China;3.Research Institute of Forestry, Chinese Academe of Forestry, Beijing 100091, China)
Production behaviors ofP.euramericana‘Guariento’ show that it is a superior variety, so it is a good recipient material for gene transformation.Stem, petiole and leaf were cultured as the initiation explants developing from tender branches outdoor to investigate the micropropagation.The key factors affecting the growth ofP.euramericana‘Guariento’in vitroand the optimal tissue culture conditions for it were ascertained.The optimum basic culture medium was MS.Cultured explants on MS + TDZ 0.05 mg/L +6-BA 0.05 mg/L+ NAA 0.05 mg/L+ Sucrose 30 g/L was the best way of inducement and differentiation, with inducement rate 100%,100% and 86% for stem, petiole and leaf from tissue culture plantlets.For elongation of the induced buds, the suitable culture medium was MS + KT 0.5 mg/L+ GA32 mg/L+ Fructose 30 g/L.More than 4 shoots about 3 cm high were elongated from the induced buds after 20 days.The optimal subculture medium and root inducement culture medium for shoot were 1/2 MS + IAA 0.02 mg/L + IBA 0.02 mg/L +AC3 g/L+ Sucrose 30 g/L, and the rooting rate was 100%.The high frequency regeneration system forP.euramericana‘Guariento’in vitroprovides a basis for gene modi fi cation in this study.
Populus euramericana‘Guariento’;in vitroculture; shoot elongation induction; shoots strengthen culture
10.14067/j.cnki.1673-923x.2016.07.001
http: //qks.csuft.edu.cn
A
1673-923X(2016)07-0001-06
2015-03-10
国家自然科学基金项目(U1204324);河南省科技攻关重点项目(132102110037)
周 洲,副教授,博士;E-mail:zhouzhouhaust@163.com
周 洲,李永丽,安世恒,等.欧美杨108高效组培再生系统[J].中南林业科技大学学报,2016, 36(7): 1-6.
[本文编校:吴 毅]
