蝴蝶兰组培苗瓶外生根的研究
2016-12-17闫海霞何荆洲黄昌艳邓杰玲王晓国卜朝阳
闫海霞,何荆洲,黄昌艳,邓杰玲,王晓国,卜朝阳
(广西农业科学院花卉研究所,广西 南宁 530007)
蝴蝶兰组培苗瓶外生根的研究
闫海霞,何荆洲,黄昌艳,邓杰玲,王晓国,卜朝阳*
(广西农业科学院花卉研究所,广西 南宁 530007)
为降低蝴蝶兰组培苗生产成本、缩短种苗繁育周期,利用瓶外生根技术,研究不同蝴蝶兰品种、组培苗的不同培养阶段、不同激素种类和浓度对组培苗瓶外生根的影响。结果表明,不同蝴蝶兰品种的组培苗瓶外生根有所差异,3个蝴蝶兰品种瓶外生根效果由好到次的排序是:“柳林黑玫瑰”>“文景天使”>“大辣椒”;经过壮苗培养的组培苗适宜进行瓶外生根;用100 mg/L的IBA溶液处理,瓶外生根效果最好,生根率为94.80 %,平均根数为3.72条,平均叶数4.24片,生根时间为38.00 d;用100 mg/L的NAA溶液处理,瓶外生根效果较好,生根率为86.80 %,平均根数为3.84条,平均叶数3.30片,生根时间为36.40 d。
蝴蝶兰;组培苗;瓶外生根;激素
蝴蝶兰(Phalaenopsisspp.)属兰科 (Orchidaceae)蝴蝶兰属 (Phalaenopsis) 植物。原产于菲律宾、印度尼西亚、泰国、马来西亚及我国台湾等地,其花型奇特,色彩艳丽,花色繁多,花期持久,有“洋兰皇后”之美誉,具有极高的欣赏价值与经济价值。蝴蝶兰为典型的单茎性热带附生兰,很少发生侧枝,难以通过分蘖繁殖植株,通常采用组织培养进行快速繁殖,此法具有繁殖系数大、繁育周期短,并能保持优良性状的优点。目前组织培养技术在蝴蝶兰的种苗繁育上应用广泛,相关研究逐年增多[1-5]。沈周高等研究表明,蝴蝶兰“V31”最佳腋芽诱导培养基是MS+6-BA 8.0 mg/L+NAA 2.0 mg/L+椰子粉15 g/L,最佳增殖培养基是MS+KT 10 mg/L+NAA 0.6 mg/L+2,4-D 0.2 mg/L,最佳生根壮苗培养基是1/2MS+NAA 0.1 mg/L+6-BA 1.0 mg/L+蔗糖20 g/L+香蕉粉10 g/L[6]。王玲等通过对比不同种类细胞分裂素及浓度对蝴蝶兰花梗芽增殖生长的影响发现,6-BA、Ad配合使用时增殖倍数均比各自单独使用时高,比例以1∶2为最好[7]。组培苗的生根有瓶内生根以及瓶外2种方式,瓶内生根生产成本高、育苗周期长、占用室内空间大;而采用试管外生根,直接将生根过程与移栽过程相结合,缩短了育苗周期,节约成本、节约室内培养空间。后一种方法的可行性在很多植物上得到了验证,比如蓝莓[8]、甘蔗[9]、栀子[10]。在现有的蝴蝶兰组培研究中,组培苗的生根以瓶内生根为主,尚未有将瓶外生根技术应用于蝴蝶兰组培育苗上,本实验通过对蝴蝶兰组培苗进行瓶外生根的研究,探讨蝴蝶兰瓶外生根的主要影响因子,以期建立蝴蝶兰瓶外生根技术,丰富蝴蝶兰繁殖理论,对推动蝴蝶兰的商业化生产、栽培具有较大的应用价值和重要意义。
1 材料与方法
1.1 材料
本实验于2013年开始研究,蝴蝶兰组培苗由广西农科院花卉所提供。
1.2 方法
1.2.1 移栽前处理 将水苔用0.1 %~1.0 %高锰酸钾浸泡3~6 h后,用洗衣机脱水5~8 min,以备用。将未生根的组培苗置于室温下1 d,然后除去瓶盖再炼苗1 d,洗净基部培养基,并将组培苗用50 %多菌灵可湿性粉剂800~1000倍液浸泡10 min,备用。
1.2.2 移栽方法 用湿润的水苔将蝴蝶兰组培苗下部(约长1.5~2.0 cm)包裹,包裹后放入直径1.5寸育苗杯中,压实水苔,保持水苔距离育苗杯高度0.4~0.7 cm。包裹组培苗时不能损伤茎段及叶片。移栽后置于育苗摇床上,并浇透定根水。
1.2.3 移栽后管理 温度控制在18~30 ℃。夏天注意通风并遮阴降温,冬季温度过低时要及时加温。移栽10 d后,每隔7 d喷施1次花多多水溶性速效肥15号(9-45-15)1000~2000倍液,连续喷2次。1个月后改喷施花多多水溶性速效肥1号(20-20-20)1000~2000倍液,每月喷施1次。要保持水苔的湿润,防止干燥。
1.3 实验设计
1.3.1 不同品种组培苗间的瓶外生根差异 将蝴蝶兰品种“大辣椒”、“文景天使”和“柳林黑玫瑰”进行壮苗培养10~15 d后(组培苗未生根),选取生长相对一致的组培苗,具有真叶3~4片,高度为2~3 cm,按照1.2的方法进行移栽,每个品种的处理数为45,重复3次。观察生长情况,连续观察60 d后,并统计生根数,计算生根率,生根率( %)=生根数/接种数×100。
1.3.2 不同培养阶段组培苗对瓶外生根的影响 以蝴蝶兰“柳林黑玫瑰”为材料,将经过增殖培养45 d的组培苗以及经过壮苗培养45 d的组培苗(组培苗未生根),具有真叶3~4片,高度为2~3 cm,按照1.2的方法进行移栽,每个培养阶段的处理数为45,重复3次。观察生长情况,连续观察60 d,并统计生根数计算生根率。
1.3.3 不同激素处理对蝴蝶兰组培苗瓶外生根的影响 以蝴蝶兰品种“柳林黑玫瑰”为材料,在壮苗培养基上培养后,选取未生根的组培苗,具有真叶3~4片,高度为2~3 cm,按照1.2.1方法处理后,将基部在不同浓度的激素中(表1)快速蘸2~3 s后,再按照1.2的方法进行移栽,每个激素浓度处理数为50,重复3次。观察生长情况, 60 d后,并统计生根数计算生根率。
1.4 统计分析
试验数据采用SPSS 19.0 统计软件进行差异显著性分析(Duncan′s 多重比较)。
2 结果与分析
2.1 品种间瓶外生根的差异
由表2 可以看出,“柳林黑玫瑰”、“文景天使”的生根率显著高于“大辣椒”的生根率。“柳林黑玫瑰”的平均根数最多,显著高于其他2个品种,“大辣椒”的平均根数最少。3个品种的平均新叶、生根时间的差异不显著,其中“柳林黑玫瑰”的平均新叶最多,生根时间最短。由此表明,蝴蝶兰组培苗瓶外生根效果受品种的影响较大,即不同品种的瓶外生根效果不同。生根率从高至低依次为:“柳林黑玫瑰”>“文景天使”>“大辣椒”;生根时间从短到长的顺序为:“柳林玫瑰”<“大辣椒”<“文景天使”。
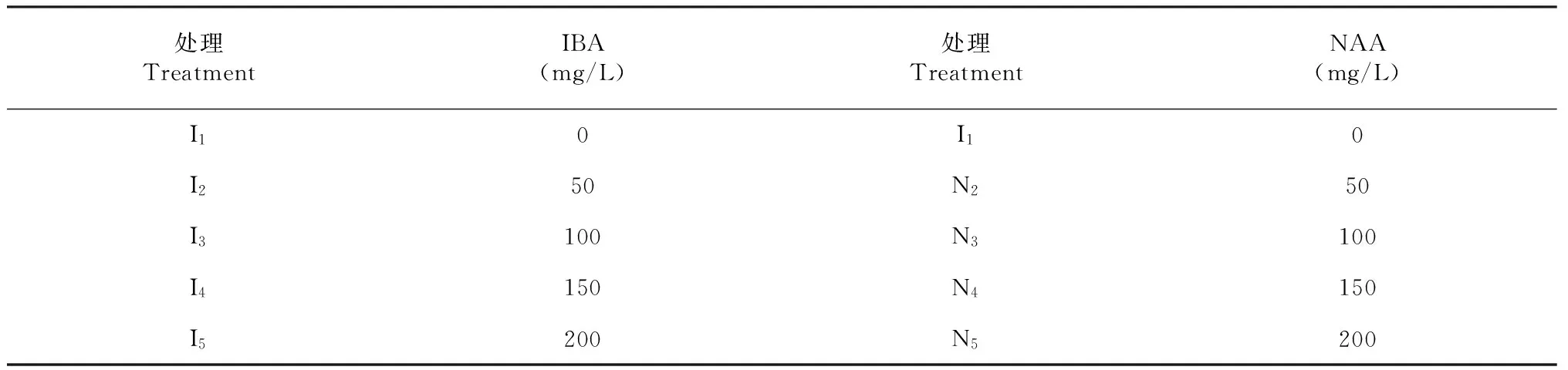
表1 激素的种类和浓度
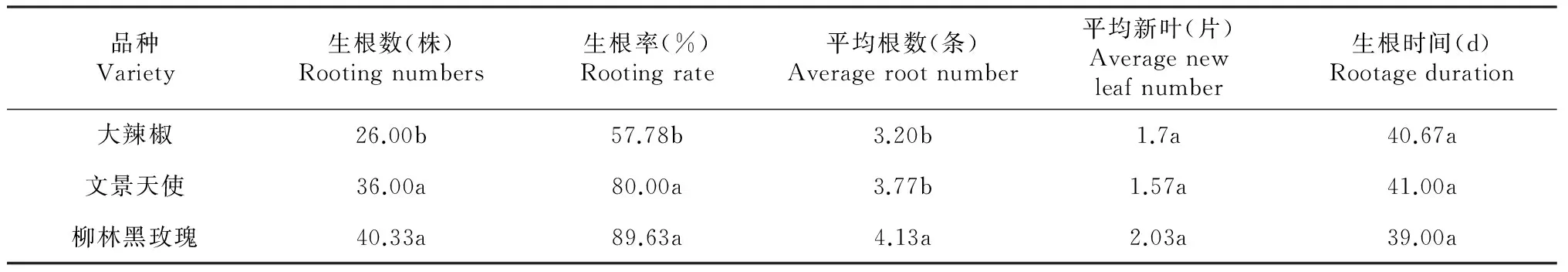
表2 不同品种间瓶外生根的差异
注:同列数据后不同小写字母表示差异达显著水平(P<0.05),下同。
Note:Different lowercase and capital letters in the same column indicated significant difference at the 0.05 level.The same as below.
2.2 不同培养阶段组培苗对瓶外生根的影响
从表3可以看出,P1和P2的生根率存在显著差异,P2的生根率显著高于P1的生根率。P1和P2的平均根数、平均新叶均存在显著差异,且P2的平均根数、平均新叶均显著高于P1的平均根数、平均新叶。P1和P2的生根时间无显著差异,但P2的生根时间较P1的生根时间短。由此表明,不同培养阶段的组培苗对瓶外生根的影响存在显著差异。其中,经过增殖培养的组培苗生根率较低,为40.74 %,平均根数为2.17条,平均新叶为1.33片,生根时间较长,为50.33 d;经过壮苗培养的组培苗生根率较高,为85.18 %,生长表现也较好,平均根数为4.13条,平均新叶为3.93片,生根时间较短,为47.00 d。由上可得,组培苗经过壮苗培养后的瓶外生根效果比经过增殖培养后的瓶外生根效果好,因此,进行瓶外生根时,组培苗应先经过壮苗培养。
2.3 不同激素对瓶外生根的影响
从表4分析可得,I1处理的生根率与I2、I3、I4、I5处理的生根率存在显著差异,并且I1处理的生根率显著低于其他4种处理的生根率,为40.40 %,I3处理的生根率最高,为94.80 %。从生根时间来看,I1处理的生根时间显著长于其余4种处理,为42.80 d;I2、I5处理的生根时间无显著差异,I2处理的生根时间最短,为33.00 d,I3、I4处理的生根时间无显著差异,I4、I5处理的生根时间无显著差异。平均根数显示,I1处理的平均根数显著低于其余4种处理,I2、I3、I4、I5处理的平均根数无显著差异。平均新叶显示。I1和I3处理的平均新叶存在显著差异,I3的平均新叶最多,为4.24。由此可知,I1处理较其余4种处理的瓶外生根效果差,即组培苗不经过IBA溶液处理的瓶外生根效果差,组培苗经过IBA溶液处理后,生根率有所提高,所需生根时间较短,平均根数和平均新叶都有所增加。其中,以100 mg/L的IBA溶液处理(I3)的瓶外生根效果最好,生根率为94.80 %,平均根数为3.72条,平均新叶4.24片,生根时间为38 d。
从表5可以看出,I1处理的生根率显著低于N3处理的生根率,N3处理和N2、N4处理的生根率无显著性差异,N3处理的生根率最高,为86.00 %。生根时间显示,I1、N2、N5处理的生根时间无显著差异,N3、N4处理的生根时间无显著差异,N3、N4处理和I1、N2、N5处理的生根时间存在显著差异,N2处

表3 不同培养阶段对瓶外生根的影响
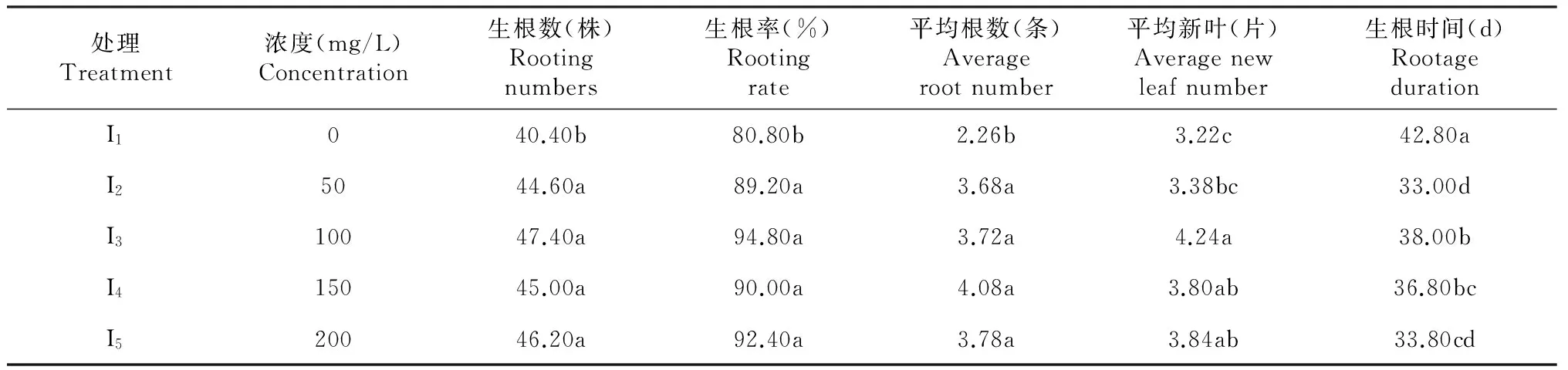
表4 不同浓度的IBA对瓶外生根的影响
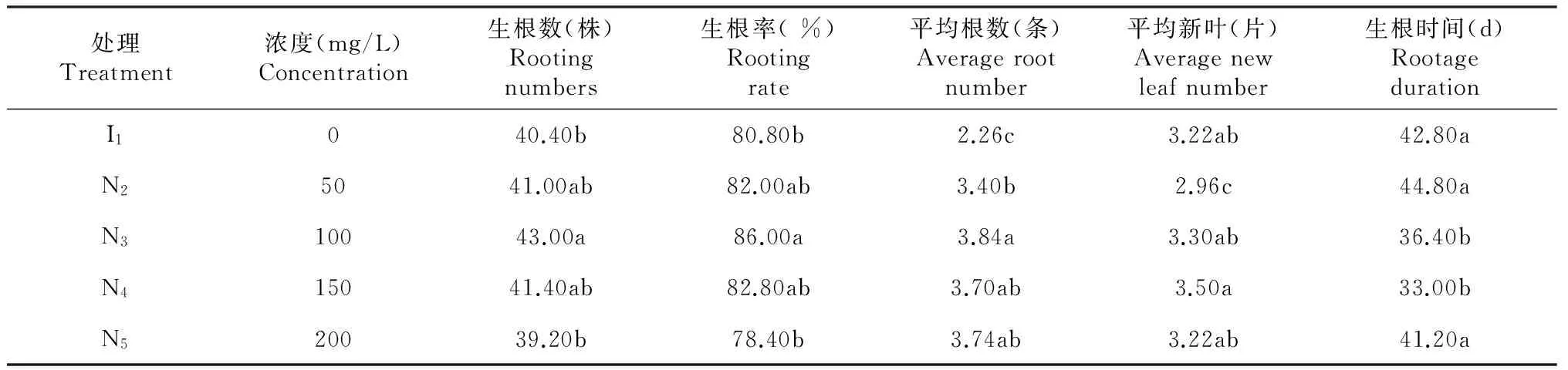
表5 不同浓度的NAA对瓶外生根的影响
理的生根时间最长,为44.80 d,N4处理的生根时间最短,为33.00 d。平均根数显示I1处理的平均根数显著低于其他4种处理,N3处理的平均根数最多,为3.84条。平均新叶片数显示I1、N3、N4、N5处理的平均新叶无显著差异。由此表明,组培苗经过不同浓度的NAA处理后,生根效果有所差异,适宜浓度可提高生根效果,反之则降低生根效果。综上分析可知,当组培苗用100 mg/L 的NAA溶液处理后,瓶外生根效果比不使用NAA溶液处理的效果好,生根率为86.00 %,平均根数为3.84条,平均新叶3.30片,生根时间为36.40 d。
3 讨 论
3.1 品种间的差异对瓶外生根的影响
不同蝴蝶兰品种的瓶外生根效果存在一定的差异。本试验采用的3个品种中,瓶外生根效果由好到次的顺序是:“柳林黑玫瑰”>“文景天使”>“大辣椒”。产生这种差异的主要原因是品种自身的基因型决定的。例如陈瑶瑶等[11]以3个不同花色蝴蝶兰V31、夕阳红和大红花品种为试材研究不同品种间的生根差异,结果表明,不同品种之间存在一定程度的差异性,品种“V31”在1/2 MS+NAA 0.5 mg/L培养70 d生根效果最佳,生根数最多,达4.47条,根的平均长度为3.76 cm,叶片数为3.00;品种“夕阳红”在1/2 MS+NAA 0.5 mg/L培养70 d后,生根数达5.27条,根的平均长度为2.73 cm,叶片数为2.32;大红花品种在1/2 MS+NAA 0.5 mg/L培养70 d后,生根数为2.52条,根的平均长度为2.78 cm,叶片数为2.97。此外,虽然多数研究是基于瓶内生根,但这种来自基因型的差异同样存在于瓶外生根中[12-15]。因此,在蝴蝶兰的组培快繁中,是否适宜采用瓶外生根的方法,品种(或品系)间的差异应该是考虑因素之一。
3.2 不同培养阶段组培苗对瓶外生根的影响
蝴蝶兰组培快繁技术的完整周期包括:初代诱导、增殖培养、壮苗培养、生根培养、炼苗移栽。而采用组培苗瓶外生根技术,则省去了瓶内生根的环节,大大缩短了育苗时间。本试验研究不同培养阶段组培苗对瓶外生根的影响,主要是指经过增殖培养或经过壮苗培养(含增殖培养阶段)的组培苗不经过瓶内生根,直接在炼苗移栽后进行生根。结果表明:不同培养阶段的组培苗对瓶外生根的影响不同,组培苗经过壮苗培养后的瓶外生根效果比经过增殖培养后的瓶外生根效果好,适宜进行瓶外生根的组培苗是经过壮苗培养的组培苗。出现这种差异的原因可能是一方面组培苗在经过壮苗培养后,植株有所生长,并趋向于成熟,而成熟植株的移栽更易于生根成活;另一方面壮苗培养后的植株吸收的外源激素得到一定的积累和增加,并转化为自身养分,为植株的移栽生根提供了充足的养分,而增殖培养的植株直接进行瓶外生根,缺少足够的成熟度以及外源激素,生根率会比较低,需要的生根时间较长。
3.3 不同生根剂对瓶外生根的影响
在蝴蝶兰的生根培养中,生根需选择合适的激素种类和浓度。常用的激素为NAA、IBA。李丽等研究发现培养基中添加NAA 0.2 mg/L和IBA 0.1 mg/L有利于蝴蝶兰无根苗生根[16],卜朝阳等研究认为蝴蝶兰生根培养时添加IBA 的效果比NAA好[17]。而陈瑶瑶等发现一定浓度的NAA更有利于促进根的生成[11],这与李金雨[4]等的研究结果相同。在蝴蝶兰的瓶外生根中,不同激素种类和浓度对瓶外生根的影响不同,适宜的浓度对蝴蝶兰瓶外生根起促进作用。本研究结果,用100 mg/L的IBA溶液处理时,生根率为94.80 %,平均根数为3.72条,平均新叶4.24片,生根时间为38 d;用100 mg/L的NAA溶液处理时,生根率为86.80 %,平均根数为3.84条,平均叶数3.30片,生根时间为36.40 d。但若仅从从生根率的角度考虑,100 mg/L的IBA较100 mg/L NAA好,这与陈维认为在相同浓度、相同处理条件下IBA的效果均优于2,4-D和NAA[18]的结论是一致的。原因是:IBA移动速度慢,大多保留在施用部位,是长效化合物。研究还发现,当NAA浓度为200 mg/L时,生根率有所降低,为78.40 %,可能是NAA具有一定的毒性,用量过多会对组培苗产生损伤从而导致生根率下降[19]。
4 结 论
不同蝴蝶兰品种的组培苗瓶外生根有所差异,3个蝴蝶兰品种瓶外生根效果由好到次的顺序是:“柳林黑玫瑰”>“文景天使”>“大辣椒”;经过壮苗培养的组培苗适宜进行瓶外生根;用100 mg/L 的IBA溶液处理,瓶外生根效果最好,生根率为94.80 %,平均根数为3.72条,平均叶数4.24片,生根时间为38 d;用100 mg/L的NAA溶液处理,瓶外生根效果较好,生根率为86.00 %,平均根数为3.84条,平均叶数3.30片,生根时间为36.40 d。
[1]王常芸,李晓亮,张京伟,等.蝴蝶兰组培快繁技术体系研究[J].北方园艺,2013(15):122-124.
[2]彭 娇,崔金腾,王爱香,等.基于再生不定芽的蝴蝶兰继代扩繁体系建立[J].中国农学通报2015,31(4):162-166.
[3]张 伟,乔保建,李冰冰,等.蝴蝶兰高效组培快繁及温室移栽技术[J].江苏农业科学,2015,43(9):83-86.
[4]李金雨,洪丽萍.蝴蝶兰丛生芽途径的组织培养技术[J].热带作物学报,2010,31(4):610-613.
[5]杨少辉,季 静,王 罡,等.蝴蝶兰组织培养及水培移栽技术[J].天津大学学报,2008,41(6):709-713.
[6]沈周高,任 洁,项 艳.蝴蝶兰“V31”品种花梗腋芽快繁体系的建立[J].安徽农业大学学报,2014, 41(3):435-439.
[7]王 玲,陈发棣,陈 凤,等.不同细胞分裂素及使用浓度对蝴蝶兰花梗芽增殖生长的影响[J].江苏农业科学,2013,41(2):49-51.
[8]黄国辉,姚 平.蓝莓组培苗瓶外生根的研究[J].江苏农业科学, 2011, 39(4):227-228.
[9]何为中,刘红坚,李 松,等.甘蔗试管苗瓶外生根技术的研究[J].安徽农业科学,2012,40(29):14191-14194.
[10]潘虹虹,廉美兰,朴炫春,等.栀子组培苗的瓶外生根[J].东北林业大学学报,2009,37(1):30-31,41.
[11]陈瑶瑶,庄卫东,马晓娟,等.植物生长调节剂对不同蝴蝶兰品种丛生芽增殖与生根的影响[J].福建农业学报, 2011,26(5):762-765.
[12]王冬云,汪建亚,蔡 桁,等.蝴蝶兰组培不定芽增殖条件的优化[J].华中农业大学学报,2007,26(6):856-858.
[13]刘奕清,熊运海,王大平.蝴蝶兰离体快繁优化体系研究[J].西南农业大学学报,2005,27(3):410-412.
[14]刘 亮,易自力,蒋建雄,等.蝴蝶兰丛生芽、原球茎途径的组织培养研究[J].亚热带植物科学,2008,37(3):43-45.
[15]王玉英,李枝林,余朝秀,等.蝴蝶兰离体快繁技术研究[J].西部林业科学,2006(2):99-101.
[16]李 丽,罗君琴,王海琴.蝴蝶兰离体培养条件的筛选[J].西南园艺,2005,33(3):7-8.
[17]卜朝阳,董伟清,闭志强,等.蝴蝶兰克隆苗根系生长影响因素研究[J].西南农业学报,2009,22(6):1737-1740.
[18]陈 维.3种生长素类似物对月季和蔷薇扦插生根影响[J].生物学通报,2004,39(11):49-50.
[19]闫海霞,武 鹏,万正林,等.月季扦插繁殖的影响因子及育苗技术[J].广东农业科学,2013(7):54-56.
(责任编辑 王冠玉)
Study on Plantlet Rooting out of Test-tube inPhalaenopsisspp.
YAN Hai-xia, HE Jing-zhou, HUANG Chang-yan, DENG Jie-ling, WANG Xiao-guo,BU Zhao-yang*
(1.Flower Research Institute, Guangxi Academy of Agricultural Sciences, Guangxi Nanning 530007,China)
In order to reduce the production cost and short the period ofPhalaenopsisspp. seedlings, using technology of rooting out of test-tube, the effect of different varieties, different culture stage, different kind and concentration of hormones were studied on rooting out of test-tube. The results showed that different varieties of rooting out of test-tube was different.The effects of 3 varieties ofPhalaenopsisspp. which rooted out of test-tube were ranked:‘Liulin black rose ’>’Wenjing Angel’> ‘pepper ’; tissue cultured seedlings which after strong seedling culture was suitable for rooting out of test-tube .With 100 mg/L IBA solution treatment, outside the bottle rooting effect was the best, the rooting rate was 94.80 %. The average root number was 3.72 and the average number of leaves was 4.24, the rooting time was 38.00days. With 100 mg/L NAA solution treatment, bottle rooting had better effect, the rooting rate was 86.80 %, average root number was 3.84, average leaf number was 3.30, rooting time was 36.40 days.
Phalaenopsisspp.; Tissue culture seedling; Rooting out of test-tube; Hormone
1001-4829(2016)11-2709-05
10.16213/j.cnki.scjas.2016.11.036
2016-06-16
广西农业科学院科技发展基金(2015JM30);广西农业科学院稳定资助团队项目(2015YT89);广西科学研究与技术开发项目(桂科能14123006-41)
闫海霞(1981-),女,广西贵港人,助理研究员,从事花卉新品种选育与示范推广工作,*为通讯作者,E-mail:yangnv@126.com。
S682.31
A
