油葵转化体系建立和重组人胰岛素的初步表达
2016-12-17安胜军邵铁梅高维娟柴锡庆
焦 展,安胜军*,邵铁梅,仵 陶,李 雪,刘 培,高维娟,柴锡庆
(1.河北化工医药职业技术学院,河北省高校生物反应器与蛋白类药物开发应用技术研发中心,河北 石家庄 050026;2.河北中医学院,河北 石家庄 050200)
油葵转化体系建立和重组人胰岛素的初步表达
焦 展1,安胜军1*,邵铁梅1,仵 陶1,李 雪1,刘 培1,高维娟2,柴锡庆1
(1.河北化工医药职业技术学院,河北省高校生物反应器与蛋白类药物开发应用技术研发中心,河北 石家庄 050026;2.河北中医学院,河北 石家庄 050200)
为建立并研究利用油葵油体表达系统表达重组人胰岛素蛋白的方法,采用PCR技术构建植物种子特异性表达载体,经花粉管通道用重组人胰岛素基因转化油葵。利用PCR法检测目的基因的转化情况,用SDS-PAGE和Western blot对胰岛素蛋白的表达进行鉴定。结果表明,合成了重组人胰岛素与花生油体蛋白融合基因,并获得植物种子特异性表达载体pBINOI。花粉管通道转化油葵的适宜条件为,花柱剪切1/2,质粒浓度为50~100 ng/μl转化效率最高。PCR结果显示,油葵花粉管通道法转胰岛素基因总转化率为3.2 %,温室转化率(5.20 %)高于大田转化率(1.12 %)。获得T1~T5代转基因种子,播种为T1~T5代植株。获得的1号转基因株系T5代植株阳性/阴性植株为11∶1。经SDS-PAGE电泳分析和Western blot检测结果显示,融合蛋白约为23 kDa,重组人胰岛素基因在油葵种子中得到了表达。本实验建立了转基因油葵油体表达系统,且该系统能够成功表达重组人胰岛素。
转基因油葵;花粉管通道;重组人胰岛素;融合表达
胰岛素(Insulin)是治疗糖尿病的主要药物。为开发更安全高效的胰岛素蛋白生产方式,利用植物生物反应器替代微生物发酵方法已被研究者广泛重视[1],而植物油体表达系统具有蛋白高表达且易分离的特点,可降低产物下游分离纯化的生产成本[1-3]。
油葵,即油用向日葵(HelianthusannuusL.),是我国主要油料作物之一。目前,向日葵基因转化已有一些报道[4-7],研究中大部分依赖农杆菌介导的组织培养方法[8-12]。少数研究利用直接导入法进行转化,但由于原生质体再生困难或稳定整合率低,未能达到理想效果[13-14]。利用向日葵表达重组蛋白的研究虽有涉及[15-17],但利用油用向日葵成功完整表达重组药用蛋白的研究,还未见报道。其主要原因之一在于,油葵是通过再生手段获得转基因植株较难的作物之一,再生和转化效率很大程度受到基因型限制,且组织培养过程中常伴有“早花”现象。为避免这些不利因素,本研究将人胰岛素基因与花生油体蛋白基因构建为融合基因,并获得植物表达载体pBINOI,通过非组培再生的花粉管通道法对油葵进行转化,利用油葵油体表达系统,实现重组人胰岛素蛋白的表达,以期为利用基因工程技术依靠植物生物反应器生产重组蛋白开拓新的途径,并为其它植物基因工程育种研究提供参考。

表1 引物序列
1 材料与方法
1.1 供试材料
本试验采用油葵罗马尼亚“精选”恢复系为材料,由河北省半干旱研究中心提供。根 癌 农 杆 菌 (Agrobacteriumtumefaciens) 菌株LBA4404由本实验室保存,植物表达载体pBINOI由本实验室构建。
1.2 试验方法
1.2.1 质粒提取方法 质粒的提取方法参照文献[18]。将质粒溶于纯水中,导入液终浓度约为10~300 ng/μl。
1.2.2 花粉管通道转化法 采用柱头滴加法进行转化。在人工授粉后3~6 h,管状花的羽状柱头萎蔫,表示授粉已经完成。用剪刀减去已萎蔫的柱头,用25 μl微量进样器在花柱上滴质粒DNA溶液3~5 μl。为了防止质粒DNA液蒸发,可以重复滴加1次。操作时将质粒DNA溶液置于冰浴中保存,以免被DNA酶降解。
柱头剪切程度试验中,授粉后6 h,分别设不剪切花柱(0)、剪掉萎蔫柱头(约剪掉1/4花柱)、剪掉1/2花柱(1/2)和剪掉全部花柱(1)4个处理。质粒浓度试验中,取浓度为10~300 ng/μl质粒分别注射油葵管状花。每处理5个花盘,重复3次。收获后统计结实率(结实率=结籽小花数/注射小花数×100 %)。将结实种子全部播种,长出植株取叶片提取基因组,经PCR检测,统计T1代植株阳性率(T1代植株PCR阳性率=T1代PCR阳性植株数/T1代植株总数×100 %)。
1.2.3 DNA提取和PCR检测 DNA的提取采用SDS法 (参照赖相红的方法[19])。根据目的基因胰岛素序列,设计特异性引物(引物序列见表1),扩增产物在1.5 %琼脂糖凝胶电泳检测。
1.2.4 油葵种子油体蛋白的提取 参照文献[20]的方法,取转化油葵种子,液氮研磨,加入提取液,4 ℃,10 000 g离心,取上层油层,得到沉淀加入20 mmol Tris-HCl(pH 8.0)和2 %SDS的混合提取液溶解,备用。
1.2.5 油葵种子油体蛋白SDS电泳检测和Western blot 检测 将提取的油体蛋白,进行15 %的SDS-PAGE电泳分析和Western blot分析。采用PVDF膜进行电泳转膜,转膜完毕后用TBST漂洗,10 min×5次,后用5 %的脱脂奶粉封闭1 h,再次漂洗3次,加入1∶1000比例稀释的鼠抗人胰岛素单克隆一抗,4 ℃过夜,次日室温孵育1 h后,用TBST漂洗,10 min×5次,再加入1∶2000比例的羊抗鼠二抗室温孵育1 h,再用TBST漂洗10 min×5次。最后加入ECL发光液,在暗室中曝光,显影5 min,定影5 min。观察分析。
1.2.6 数据处理 数据用Excel和DPS7.05软件处理,显著水平P=5 %。
2 结果与分析
2.1 载体的构建
采用PCR方法扩增了油菜油体蛋白基因启动子(NOP),将该启动子插入pUC19的HindIII和BamH I酶切位点之间得到pUCN。同时依据人胰岛素基因序列和油葵偏爱的密码子设计并人工合成了人胰岛素基因,并将该合成的基因插入花生油体蛋白基因(Ole)的3’末端,获得花生油体蛋白和人胰岛素融合基因,同时在花生油体蛋白基因和人胰岛素基因之间添加了胰蛋白酶识别序列Klip27。进而将该融合基因插入pUCN的BamH I和SacI酶切位点之间得到pUCNOI,HindIII和SacI双酶切pUCNOI,琼脂糖凝胶回收1779 bp的外源片段,并将该外源片段插入植物双元表达载体pBI121的HindIII和SacI酶切位点之间,获得植物表达载体pBINOI[21]。pBINOI的表达盒为以油菜油体蛋白基因启动子(NOP)驱动的Ole-Klip27-insulin融合基因,pBINOI结构如图1所示。

1:油菜油体蛋白基因启动子; 2:花生油体蛋白基因; 3:KLIP-27; 4:人胰岛素基因图1 pBINOI结构Fig.1 Structure of pBINOI
2.2 花粉管通道法转化油葵的条件优化
花粉管通道法转化油葵过程中,质粒浓度和管状花花柱剪切程度对果实结实率和转化效率有不同程度的影响。如图2所示,当质粒浓度逐渐升高,在10 和50 g/μl时结实率较高,为50 % 以上;而100和200 ng/μl时,结实率有所降低;至300 ng/μl时,结实率最低,仅为33.64 %。而质粒浓度在50 和100 ng/μl时,转化率较高,且与10和300 ng/μl的转化率差异显著。综合考虑结实率和转化率,并从经济的角度考虑,50~100 ng/μl是花粉管通道法转化油葵的适宜质粒浓度。
柱头剪掉的程度会影响转化效率,但剪掉过多会严重影响结实率。因此,比较了不剪柱头、剪掉1/4、剪掉1/2和全部剪掉仅留子房对转化和结实的影响(图3)。结果表明,柱头剪掉1/2对转化最为有利,结实率较高,且转化率最高,可达12. 89 %。
2.3 花粉管通道法转胰岛素基因油葵的获得及其遗传特性

同一指标不同字母表示差异显著(P<5 %)图2 质粒浓度对花粉管通道法转化油葵的影响Fig.2 Effect of plasmid concentration on gene transformation via pollen-tube pathway in Oil Sunflower

同一指标不同字母表示差异显著(P<5 %)图3 花柱剪切程度对花粉管通道法转化油葵的影响Fig.3 Effect of shearing degree of the style on gene transformation via pollen-tube pathway in Oil Sunflower
携带胰岛素基因的质粒进行花粉管通道转化。大田操作共转化油葵30个花盘,每个花盘大约转化小管状花200朵,共得到T1代种子约2500粒。温室操作共转化油葵100个花盘,每个花盘大约转化小管状花20~30朵,共得到T1代种子1000粒。将这些种子播种,取T1代幼苗的幼嫩叶片提取基因组,经PCR检测共获得80株PCR阳性植株,总转化率为3.2 %。其中大田获得28株,温室获得52株。转化率分别为1.12 % 和5.2 %。单株收获T1代植株结实的种子(T2种子),从中选择9个株系,每株系随机选择48粒进行播种。取T2植株幼嫩叶片进行基因组提取和PCR检测,结果均检测到阳性植株。但是这些株系T2代植株阳性与阴性的比例不尽相同(表2)。经卡方适合性检验,除1号近似分比例分别为10∶1、1∶1、1∶2和1∶2。类似,随机播种阳性株系后代,T4~T5代PCR数据显示,各株系阳性植株与阴性植株的比例明显不同,后代遗传分离现象很明显(表3)。有些T5代植株阳性/阴性高的可达11∶1,最低仅为1∶11。仅有少数株系能比例较大的遗传胰岛素基因。研究中还没能确定转胰岛素基因纯和株系,PCR检测结果如图4所示。

1,2 转胰岛素基因T1代阳性植株;3,4 转胰岛素基因T2代阳性植株;5,6 转胰岛素基因T3代阳性植株;7,8 转胰岛素基因T4代阳性植株;9,10转胰岛素基因T5代阳性植株;11,12 非转基因植株;13阳性对照;14阴性对照离比例为3∶1外,其它编号转基因后代的遗传分离比例都不符合孟德尔遗传规律,而且有的阳性比例很低,仅为1∶4。1-1号、2-1号、3-1号、9-1号为相应的1号,2号,3号和9号的阳性子代,其阳性/阴性图4 花粉管通道转化法转胰岛素基因油葵植株PCR检测电泳图Fig.4 Electrophoretogram of insulin gene transgenic plants by PCR via pollen-tube pathway in Oil Sunflower
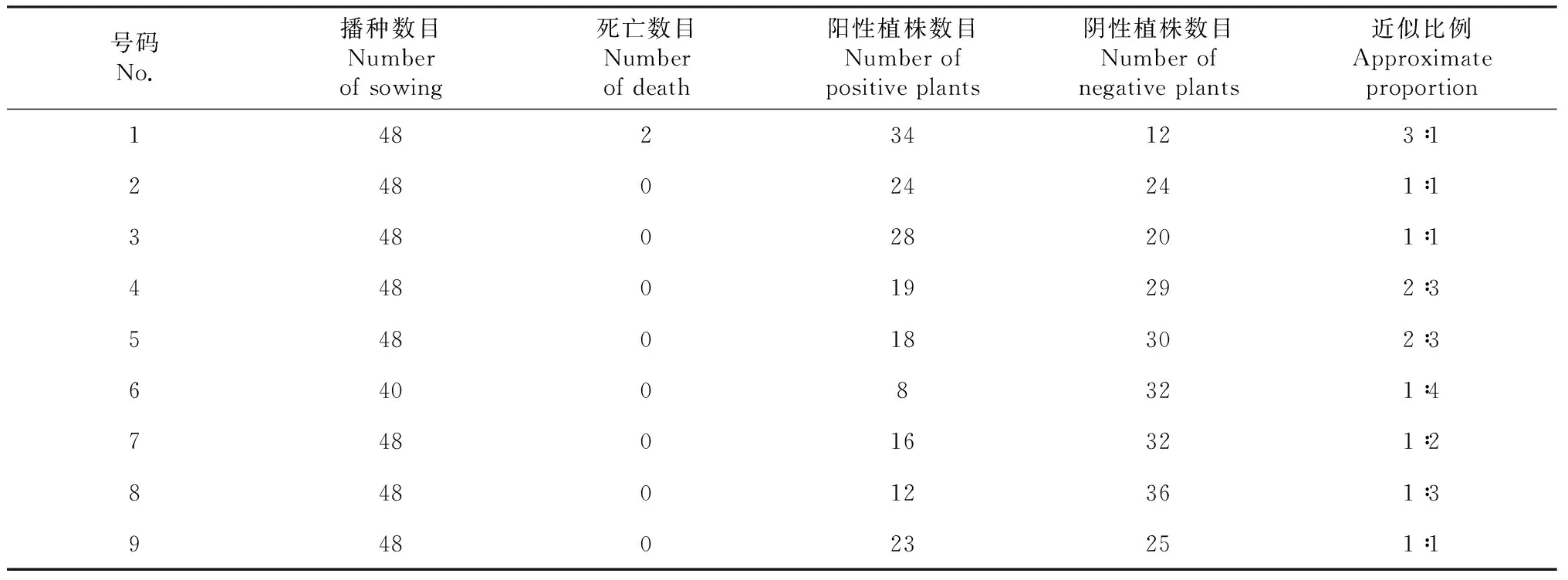
号码No.播种数目Numberofsowing死亡数目Numberofdeath阳性植株数目Numberofpositiveplants阴性植株数目Numberofnegativeplants近似比例Approximateproportion148234123∶1248024241∶1348028201∶1448019292∶3548018302∶364008321∶4748016321∶2848012361∶3948023251∶1

表3 花粉管通道法转化油葵后代植株PCR阳性/阴性分析
2.4 油葵转化植株种子的SDS-PAGE和Western blot检测
以植株后代PCR检测阳性率较高的1号株系T5代种子提取油体蛋白,进行15 %的SDS-PAGE电泳检测分析,可见23 kDa处有一明显条带,而非转基因种子此处无条带。该条带大小与油体和胰岛素形成的融合蛋白大小相一致。另外,转化油葵的油体蛋白泳道在5 kDa左右有明显条带,该条带与胰岛素标准品位置近似,而非转基因种子无此条带(图5)。经用胰岛素单克隆抗体对其免疫原性进行Western blot分析,结果显示,泳道1的非转基因油葵种子没有看到杂交条带,而泳道2、3的转基因种子中表达的融合蛋白(23 kDa)具有胰岛素的免疫原性,其大小与油体和胰岛素形成的融合蛋白大小相一致,泳道4、5为胰岛素蛋白标准品。证明重组胰岛素基因融合蛋白在油葵转基因种子中得到了表达(图6)。
3 讨论与结论
油葵是通过组织培养再生途径较难实现转化的植物。本研究利用油葵油体系统表达胰岛素蛋白基因,通过花粉管通道转化方法已得到PCR阳性植株,免除了组织培养过程中受到的低再生率和低转化率的限制。
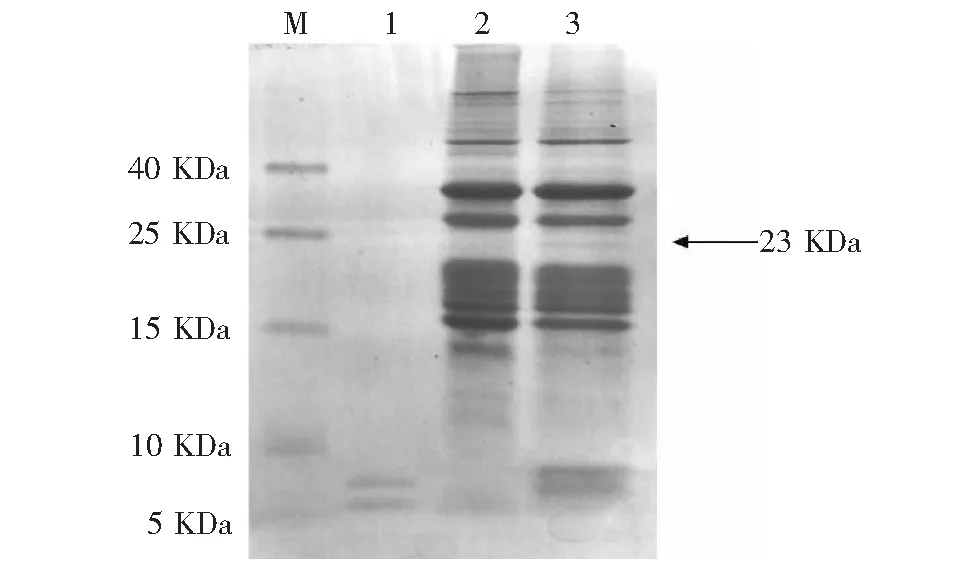
M:蛋白质分子marker;1:胰岛素蛋白标准品2:非转化油葵种子油体蛋白;3:转化油葵种子油体蛋白图5 SDS-PAGE分析油葵种子油体蛋白的表达Fig.5 Expression of oil body protein in Oil Sunflower seeds by SDS-PAGE
花粉管通道转化法导入外源DNA的关键因素在于精确掌握受体植物的受精过程及时间规律。研究发现,与大田操作相比,温室操作更容易获得阳性植株。原因可能是温室条件容易控制,而油葵开花季节大田温度较高,质粒容易降解从而影响转基因效率。此外,如果试验中加大转基因样本,则推测筛选出纯系的可能性会增大。外源基因的导入具有很大的随机性,和染色体配对完全不同。花粉管通道法转化应采取导入植株的单株记录,单株扩种检验,获得含目的基因的后代[18]。笔者也遵循这一原则进行试验和后代的统计分析。然而,花粉管通道转化法得到的结果证明,只有1号株系T2代阳性/阴性符合3∶1,该株系T3代阳性比例很大(11∶1)但也依然没有筛选到全阳株系。而其他编号的T2至T5代植株均不符合孟德尔遗传规律,仅少数株系能比例较大的遗传胰岛素基因。原因可能是,花粉管通道法属于种质系统介导的转化方法,其中有表现3∶1的分离方式,但是占总数中的比例较少。这可能由于外源DNA结构变异较大,整合位点相对较多,因此在有性繁殖过程传递的遗传规律比较复杂,稳定性也相对较差[18]。但是,研究中发现,有的株系上代阳性比例较高,后代阳性比例也相对较高。因而,转基因纯系的获得还需要对T2代1号株系的其他后代播种进行跟踪研究,分析遗传组成;并播种新的转基因后代种子,筛选其他T2代符合3∶1分离比例的株系,以期获得阳性纯合株系。另外,还可对转基因植株进行基因整合,蛋白表达等相关研究,从而为后期胰岛素蛋白的表达以及蛋白的提取纯化的研究奠定基础。
下游的提取和纯化成本高是植物转化系统生产药用蛋白最主要的限制因素。利用油体系统表达重组蛋白,由于油体蛋白镶嵌在油体上,利用油体亲脂疏水的特性,将转基因植物种子经粉碎→液体抽提→离心处理,回收上层油相即可将融合蛋白与细胞内其它组分分开,可去除90 %以上的种子蛋白。获得油体后,利用内切蛋白酶将目的蛋白与油体蛋白分开,通过再纯化,分离获得目的蛋白,从而显著降低目的蛋白的分离纯化成本。这是利用植物系统生产重组外源蛋白的有效途径[2]。目前,国内外研究中已有利用油体表达系统成功获得重组蛋白的先例[1, 22-24]。本研究利用油葵油体系统表达重组人胰岛素,实验证明,胰岛素基因导入油葵后,融合基因能够在油葵中得到表达。但是胰岛素蛋白的表达量,不同世代间蛋白表达的差异和稳定性,以及重组胰岛素蛋白的功能活性有待进一步研究。

1.非转化油葵种子油体蛋白;2,3.转化油葵种子油体蛋白(融合蛋白);4,5.胰岛素蛋白标准品图6 Western blot 分析油葵种子中的胰岛素融合蛋白的表达Fig.6 Expression of insulin fusion protein in Oil Sunflower seeds by Western blot
本试验成功构建植物种子特异性胰岛素融合蛋白表达载体pBINOI。花粉管通道转化油葵的适宜条件为,花柱剪切1/2,质粒浓度为50~100 ng/μl转化效率最高。PCR结果显示,油葵花粉管通道法转胰岛素基因总转化率为3.2 %,温室转化率(5.20 %)高于大田转化率(1.12 %)。获得T1~T5代转基因种子,播种为T1~T5代植株。获得的1号转基因株系T5代植株阳性/阴性植株为11∶1。经SDS-PAGE电泳分析和Western blot检测结果显示,融合蛋白约为23kDa,重组人胰岛素基因在油葵种子中得到了表达。
[1]Maite S, Paul C, Teresa C. Recombinant plant-derived pharmaceutical proteins:current technical and economic bottlenecks[J]. Biotechnology Letters,2014,36(12):2367-2379.
[2]Ling Hua. Oleosin fusion expression systems for the production of recombinant proteins[J]. Biologia, 2007, 62(2):119-123.
[3]曲 勍, 李校堃,于雅琴. 利用油体表达系统生产外源重组蛋白[J]. 中国生物工程杂志, 2007, 27(8):111-115.
[4]司立平, 李联社, 吴燕民. 向日葵基因工程研究进展[J]. 中国农业科技导报, 2012, 14(6):62-69.
[5]Cantamutto M, Poverene M. Transgenic sunflower[A]. In:Hu J, Seiler G, Kole C (eds) Genetics, genomics and breeding of sunflower[C]. Boca Raton, F L:CRC, 2010:279-309.
[6]Radonic L M, Lewi D M, López N E, et al. Sunflower (HelianthusannuusL.)[J]. Methods Mol Biol, 2015, 1224:47-55.
[7]郝彦玲, 罗云波. 向日葵遗传转化研究进展[J]. 中国生物工程杂志, 2005, 25(1):25-28.
[8]Tishchenko E N, Komisarenko A G, Mikhal'skaia S I, et al. Agrobacterium-mediated sunflower transformation (HelianthusannuusL.) in vitro and in Planta using strain of LBA4404 harboring binary vector pBi2E with dsRNA-suppressor proline dehydrogenase gene[J]. Tsitol Genet, 2014, 48(4):19-30.
[9]Kyle A B, Kim R F, Dee M M, et al. Isolation and characterization of novel Agrobacterium strains for soybean and sunflower transformation[J]. Plant Cell Tissue Organ Cult, 2015, 121(1):71-81.
[10]Sujatha M, Vijay S, Vasavi S, et al. Agrobacterium-mediated transformation of cotyledons of mature seeds of multiple genotypes of sunflower (HelianthusannuusL.)[J]. Plant Cell Tissue Organ Cult, 2012, 110(2):275-287.
[11]Lucas O, Kallerhoff J, Alibert G. Production of stable transgenic sunflowers (HelianthusannuusL.) from wounded immature embryos by particle bombardment and co-cultivation with Agrobacterium tumefaciens[J]. Molecular Breeding, 2000, 6(5):479-487.
[12]Müller A, Iser M, Hess D. Stable transformation of sunflower (HelianthusannuusL.) using a non-meristematic regeneration protocol and green fluorescent protein as a vital marker[J]. Transgenic Research, 2001, 10(5):435-444.
[13]Taski-Ajdukovic K, Nagl N, Miladinovic D, et al. Shoot development from hypocotyl protoplasts of sunflower (HelianthusannuusL.)[J]. Acta Biol Hung, 2009, 60(2):233-239.
[14]Moyne A L, Tagu D, Thor V, et al. Transformed calli obtained by direct gene transfer into sunflower protoplasts[J]. Plant Cell Reports, 1989, 8(2):97-100.
[15]Sawahel W, Hagran A. Generation of white mold disease-resistant sunflower plants expressing human lysozyme gene[J]. Biologia Plantarum, 2006, 50(4):683-687.
[16]Murai N, Kemp J D, Sutton D W, et al. Phaseolin gene from bean is expressed after transfer to sunflower via tumor-inducing plasmid vectors[J]. Science, 1983, 222(4623):476-482.
[17]杜希龙. 生物融合蛋白CTB-LK在向日葵中的表达研究[D]. 天津:天津大学, 2010.
[18]王关林, 方宏筠. 植物基因工程[M]. 北京:科学出版社, 2002:428-430.
[19]赖相红, 王沛政, 朱文彬, 等. 向日葵总DNA不同提取方法比较及在RAPD中的应用研究[J]. 新疆农业大学学报, 2003, 26(1):24-27.
[20]Katavic V, Agrawal G K, Hajduch M, et al. Protein and lipid composition analysis of oil bodies from twoBrassicanapuscultivars[J]. Proteomics, 2006, 6(16):4586-4598.
[21]安胜军, 柴锡庆, 王崑声. 一种含有人胰岛素基因的表达载体及其构建方法与应用[P]. 中国, ZL201110142310.3, 2014-03-12.
[22]Abiri R, Valdiani A, Maziah M, et al. A Critical Review of the Concept of Transgenic Plants:Insights into Pharmaceutical Biotechnology and Molecular Farming[J]. Curr Issues Mol Biol, 2015, 18:21-42.
[23]蒋 滢. 基于大豆种子油体系统表达重组白介素IL-21的研究[D]. 沈阳:沈阳师范大学, 2014.
[24]刘 宇. 利用拟南芥油体系统表达重组人胰岛素的研究[D]. 上海:上海交通大学, 2008.
(责任编辑 陈 虹)
Establishment of Genetic Transformation System and Primary Expression of Recombinant Human Insulin in Oil Sunflower
JIAO Zhan1,AN Sheng-jun1*, SHAO Tie-mei1, WU Tao1, LI Xue1, LIU Pei1, GAO Wei-juan2, CHAI Xi-qing1
(1.Center of Bioreactor and Protein Drug Research and Development of Hebei Universities, Hebei Chemical &Pharmaceutical College, Hebei Shijiazhuang 050026,China; 2.Hebei University of Chinese Medicine, Hebei Shijiazhuang 050200, China)
In order to establish and study the expression of recombinant human insulin in Oil Sunflower oil body expression system, plant seed-specific expression vector was constructed by PCR technique, and recombinant human insulin gene was introduced into Oil Sunflower via pollen tube pathway. Insulin gene was detected by PCR, and the expression of insulin in Oil Sunflower was detected by SDS-PAGE and Western blot. The result showed that recombinant human insulin fusion gene was synthesized, and seed-specific expressed vector pBINOI was obtained. 1/2 shearing of the style and 50-100 ng/μl of plasmid concentration were the suitable conditions of genetic transformation via pollen tube pathway. The result of PCR indicated that the total transgene rate of the insulin genetic transformation in Oil Sunflower via pollen tube pathway was 3.2 % and the transgene rate in glassroom (5.20 %) was higher than that in field(1.12 %). The transgenic seeds of T1-T5generation were obtained, which grew into plants of T1-T5generations. The approximate proportion of positive plants/negative plants of T5generation of No.1 plant line was 11∶1. The results of SDS-PAGE and Western blot showed that fusion protein was estimated to be 23kDa, and recombinant human insulin gene was successfully expressed in Oil Sunflower seeds. It was concluded that the transgenic Oil Sunflower oil body system was established in this experiment. It could be used effectively for expressing recombinant human insulin.
Transgenic Oil Sunflower; Pollen tube pathway; Recombinant human insulin; Fusion expression
1001-4829(2016)11-2682-06
10.16213/j.cnki.scjas.2016.11.031
2015-11-11
河北省高等学校科学技术研究重点项目“利用转基因亚麻悬浮细胞表达阿朴脂蛋白米兰突变体”(ZD2014087);河北省高等学校科学技术研究重点项目“植物生物反应器的方法生产Reteplase的研究与开发”(ZD2010216)
焦 展(1982-),女,河北赵县人,硕士,讲师,研究方向:植物组织培养和转基因研究,E-mail:jiaozhan959@126.com, *为通讯作者:安胜军,教授,从事植物生物反应器与蛋白类药物生产相关研究,E-mail:anshjun@yahoo.com。
565.5
A
