PEG-6000模拟干旱胁迫对甘薯近缘野生种Ipomoeatrifida (Kunth) G. Don幼苗生理生化指标的影响
2016-12-17曹清河李雪华戴习彬周志林赵冬兰
曹清河, 李雪华, 戴习彬, 唐 君, 周志林, 赵冬兰, 张 安
(江苏徐州甘薯研究中心/中国农业科学院甘薯研究所/农业部甘薯生物学与遗传育种重点实验室, 江苏 徐州 221131)
PEG-6000模拟干旱胁迫对甘薯近缘野生种Ipomoeatrifida(Kunth) G. Don幼苗生理生化指标的影响
曹清河, 李雪华, 戴习彬, 唐 君, 周志林, 赵冬兰, 张 安
(江苏徐州甘薯研究中心/中国农业科学院甘薯研究所/农业部甘薯生物学与遗传育种重点实验室, 江苏 徐州 221131)
Ipomoeatrifida(Kunth) G. Don(2n=2x=30)是甘薯祖先种之一,具有较强的抗旱性,其抗旱生理机制尚无报道。本文采用营养液水培法,以30 %浓度的PEG6000模拟干旱,研究干旱胁迫对甘薯近缘野生种幼苗叶片生理生化指标的影响。结果表明:随着PEG6000干旱胁迫时间的延长,叶片中丙二醛(MDA)、游离脯氨酸(Pro)含量逐渐增加。过氧化物酶(POD)和过氧化氢酶(CAT)及谷胱甘肽还原酶(GR)活性在PEG处理后活性均增强,揭示了甘薯近缘野生种MDA和Pro含量和氧化酶类的活性在短时间急性胁迫情况下的不同变化规律,可为抗旱品种的筛选和下一步抗旱相关基因的挖掘提供一定的参考。
甘薯近缘野生种;聚乙二醇(PEG-6000);模拟干旱;脯氨酸;抗氧化系统
Effects of Drought Simulated by PEG-6000 on Seedling Physiological and Biochemical Indexes of Wild
随着全球气候变暖,干旱已成为作物生长发育的重要影响因素[1]。据统计,我国干旱半干旱地区面积约542万公里,约占国土面积的56 %[2]。因此,植物对干旱胁迫的适应性及其机制一直是植物逆境适应策略研究的热点。探讨干旱胁迫下作物生理指标的变化对于作物抗旱品种选育及栽培技术研究具有重要意义。多年来人们对作物耐旱性进行了大量研究,其中以人工模拟干旱处理最多。聚乙二醇(Polyethyleneglycol,PEG)是一种惰性的、非离子型的较为理想的渗透调节剂,通过PEG诱导探究干旱胁迫植物抗旱机制的报道很多[3-7]。Gergeley等[7]认为用PEG诱导水分胁迫与对土壤控水的效果相仿,利用PEG-6000模拟植物干旱逆境是研究作物耐旱性的有效方法。甘薯[Ipomoeabatatas(L.) Lam]是旋花科(Convolvulaceae)甘薯属(Ipomoea)植物,在亚、非、拉美等热带及亚热带地区广为栽培,是一种重要的粮食、蔬菜、工业原料作物及新型能源作物。目前我国各地均有栽培,尤以华北平原、长江流域及东南沿海各省区栽种较多。甘薯属包含了600~700个甘薯近缘种,甘薯近缘野生种Ipomoeatrifida(Kunth) G. Don是栽培甘薯的祖先种之一,具有抗旱、抗病、高干率等优良基因[8]。已经利用这个种为亲本培育出了很多甘薯优良品种。然而,关于这个野生种的抗旱生理机制尚未见报道。本实验通过PEG-6000处理模拟干旱胁迫,研究甘薯近缘野生种幼苗植株内渗透调节物质含量以及抗氧化特性等生理指标的变化,为探讨作物耐旱机制与甘薯抗旱性品种的筛选奠定理论依据。同时,为课题组利用转录组技术挖掘甘薯近缘野生种I.trifida抗旱等优异抗旱基因提供最佳取样时间和生理生化指标参考。
1 材料与方法
1.1 材料的培养和处理
供试材料为甘薯近缘野生种Ipomoeatrifida(Kunth) G. Don (2n=2x=30),由国际马铃薯中心(CIP)提供(材料编号:DLP4597)。此材料由江苏徐州甘薯研究中心国家种质徐州试管苗库以组培苗形式保存。幼苗开口炼苗7 d 后,在植物培养箱中用Hoagland溶液培养:昼夜温度 29/22 ℃;昼夜光照 15/9 h;光强6000 lx,待幼苗长至5叶1心期时,选长势一致的幼苗分组对其根部进行以下处理。T0:Hoagland营养液作为对照;Tl:Hoagland营养液+30 %PEG作为处理组。每组重复3次,每3 d 换1次营养液。在处理后的0、1、3、6、9 h,取顶部叶片的混合样品用于各项生化测定,每项指标测定重复3次,实验数据用平均值表示。
1.2 测定方法
1.2.1 超氧化歧化酶(SOD)活性的测定 采用氮蓝四唑法[9]测定。取甘薯幼苗叶片0.5 g,加入1 mL预冷的磷酸缓冲液在冰浴上研磨成匀浆,加入缓冲液使终体积为4 mL。在8000 r/min 离心20 min,即为粗酶液。取酶液0.05 mL,依次加入反应液(1.5 mL 0.05 mol/L磷酸缓冲液,0.3 mL 130 mmol/L甲硫氨酸溶液,750 μmol/L NBT,100 μmol/L EDTA-Na2溶液,20 μmol/L核黄素)总体积为3 mL。在25 ℃ 4000 lx下照光20 min后,在黑暗条件下终止反应,在波长560 nm下测定吸光值,以缓冲液代替酶液作为空白。酶活性单位以抑制NBT光化还原的50 %为一个酶活性单位表示,酶活性以U/mg FW表示。
1.2.2 丙二醛(MDA)含量的测定 MDA的提取采用张承烈方法测定[10],取0.5 g甘薯叶片(去脉),用2.5 mL 50 mM的PBS(pH 7.8)冰浴研磨匀浆,四层纱布过滤后,12 000 r/min离心30 min,记录上清体积,取1.5 mL上清加入2.5 mL硫代巴比妥酸(0.6 %TBA)的三氯乙酸(10 %TCA)溶液,沸水浴20 min,速冷,1800 r/min离心10 min,记录上清体积.,取上清测定A532、A450和A600,根据公式计算MDA在提取液中的浓度c(mol/L)=6.45(A532-A600)-0.56×A450,然后进一步计算其在植物组织中的含量。
1.2.3 过氧化物酶(POD)活性的测定 (1)粗酶液的提取:称取甘薯幼苗叶片0.25 g,加20 mmol/L KH2PO42.5 mL,于研钵中研成匀浆,以4000 r/min离心10 min,收集上清液保存在冷处,所得残渣再用20 mmol/L KH2PO42.5 mL提取1次,全并2次上清液,所得的即为粗酶提取液(酶活性过高,稀释10倍)。
(2)酶活性的测定:按愈创木酚法测定[11],取试管3只,于1只中加入反应混合液3 mL,KH2PO41 mL,作为校零对照,另外3只中加入反应混合液3 mL,稀释后的酶液1 mL,立即开启秒表,于分光光度计470 nm波长下测量OD值,每隔1 min读数1次(4 min)。以每分钟表示酶活性大小,将每分钟OD值增加0.01定义为1个活力单位。
1.2.4 脯氨酸(Pro)含量的测定 (1)Pro的提取:准确称取不同处理的待测植物叶片各0.5 g,分别置大管中,然后向各管中分别加入5 mL 13 %的磺基水杨酸溶液,在沸水浴中提取10 min(提取过程中要经常摇动),冷却后过滤于干净的试管中,滤液即为脯氨酸的提取液。吸取2 mL提取液于另一干净的带玻塞试管中,加入2 mL冰醋酸及2 mL酸性茚三酮试剂,在沸水浴中加热30 min,溶液即呈红色。冷却后加入4 mL甲苯,摇荡30 s,静置片刻,取上层液至10 mL离心管中,在3000 r/min下离心5 min。用吸管轻轻吸取上层脯氨酸红色甲苯溶液于比色杯中,以甲苯为空白对照,在分光光度计上520 nm波长处比色,求得吸光度值。
(2)根据回归方程计算出2 mL测定液中脯氨酸的含量(X μg /2mL),然后计算样品中脯氨酸含量的百分数。
1.2.5 过氧化氢酶(CAT)活性的测定 按李合生[12]的方法测定。
(1)酶液提取:称取新鲜甘薯叶片0.5 g置研钵中,加入2 mL 4 ℃下预冷的pH 7.8磷酸缓冲液和少量石英砂研磨成匀浆后,再用缓冲液冲洗研钵数次定容25 mL,合并冲洗液,混合均匀后置于5 ℃冰箱中静置10 min,取上清液在4000 r/min下离心15 min,上清液即为过氧化氢酶粗提液,5 ℃下保存备用。

表1 紫外吸收法测定过氧化氢样品液配置
(2)测定:取10 mL试管3支,其中2支为样品测定管,1支为空白管,按表1顺序加入试剂。煮死酶在沸水浴中煮沸5 min。30 ℃预热后,逐管加入0.3 mL 0.1 mol/L的H2O2,每加完1管立即记时,并迅速倒入石英比色杯中,240 nm下测定吸光度,每隔1 min读数1次,共测4 min,待3支管全部测定完后,按下式计算酶活性。以1 min内A240减少0.1的酶量为1个酶活单位(U)。
1.2.6 谷胱甘肽还原酶活性(GR)的测定 按照Halliwell和Foyer[13]的方法,并作如下修改:反应混合液为50 mmol/ L Tris-HCl缓冲液pH 7.5,内含0. 1 mmol/ L EDTA,5 mmol/L MgCl2。测定时,反应混合液、10 mmol/ L NADPH2和10 mmol/L GSSG 预先于25 ℃水浴中预热。取反应混合液780 μl,加入酶液150 μl、10 mmol/ L NADPH220 μl (终浓度为0. 2 mmol/L) 及10 mmol/ L GSSG 50 μl (终浓度为0. 5 mmol/ L) 以启动反应,终体积为1 mL,每隔30 s读出A340的减少值。取0~9 h时间段,即9 h反应时间来计算酶活性。
2 结果与分析
2.1 PEG-6000模拟干旱胁迫对甘薯近缘种I.trifida 叶片SOD活性的影响
SOD是一种能消除植物体内有强烈毒性的超氧阴离子自由基的酶,使植物免受活性氧的伤害,且酶活性与植物的抗性密切相关。由图1可知,不同程度的干旱胁迫时间,0~6 h之内,SOD活性随着胁迫程度的增大而升高,这表明了在短时间内,随着干旱胁迫程度的加强,SOD被诱导出现。不同胁迫时间下,甘薯野生种幼苗叶片SOD活性存在一定的差异,与胁迫前的0 h(CK)相比较,6 h>3 h>1 h>9 h,在整个胁迫时间内,SOD活性变化呈逐渐上升后下降的趋势。在PEG胁迫处理9 h时,SOD活性趋于减少。
2.2 PEG-6000模拟干旱胁迫对甘薯近缘种I.trifida幼苗叶片MDA含量的影响
甘薯野生种这种植物的器官在衰老或逆境条件下遭受干旱胁迫伤害时往往发生膜脂过氧化作用,MDA是膜脂过氧化的最终产物,其MDA含量的高低反映了甘薯野生种膜脂受伤害的程度。由图2所示,PEG不同胁迫时间下甘薯野生种叶片的MDA含量变化呈上升趋势,在胁迫3 h后剧增,不同干旱胁迫时间下甘薯野生种叶片MDA含量存在一定的差异,与CK(0 h)对照相比,9 h>6 h>3 h>1 h,随着胁迫时间的延长,MDA含量呈上升趋势。方差分析表明,甘薯野生种的MDA含量存在显著的差异:6 h>0 h>1 h>3 h>9 h,表明胁迫6 h叶片膜脂过氧化程度低,细胞膜系统结构和功能受伤害程度轻,此时的甘薯野生种植株生理代谢旺盛。
2.3 PEG-6000模拟干旱胁迫对甘薯近缘种I.trifida幼苗叶片POD活性的影响
POD是植物脂膜过氧化过程中重要的保护酶之一,是植物体内消除过氧化物、降低活性氧伤害的一种关键酶,对保护膜结构的稳定性起到了不可或缺的作用。如图3所示,PEG胁迫初期POD活性开始上升,干旱胁迫9 h达到最大值,PEG胁迫下的不同时间段内甘薯野生种叶片POD活性存在一定的差异。与CK(0 h)相比较,9 h>6 h>3 h>1 h,在处理6 h时PEG胁迫下的酶活性开始迅速上升,在9 h的时候,POD活性达到了最大值。方差分析表明,甘薯野生种POD活性存在显著的差异:6 h>9 h>3 h>1 h>0 h,表明了甘薯野生种在PEG胁迫6 h下,POD能有效清除过氧化氢的过度积累,增强了植株的抗旱能力。POD也是植物体内的一种重要抗氧化酶,可有效清除植物体内产生的H2O2。
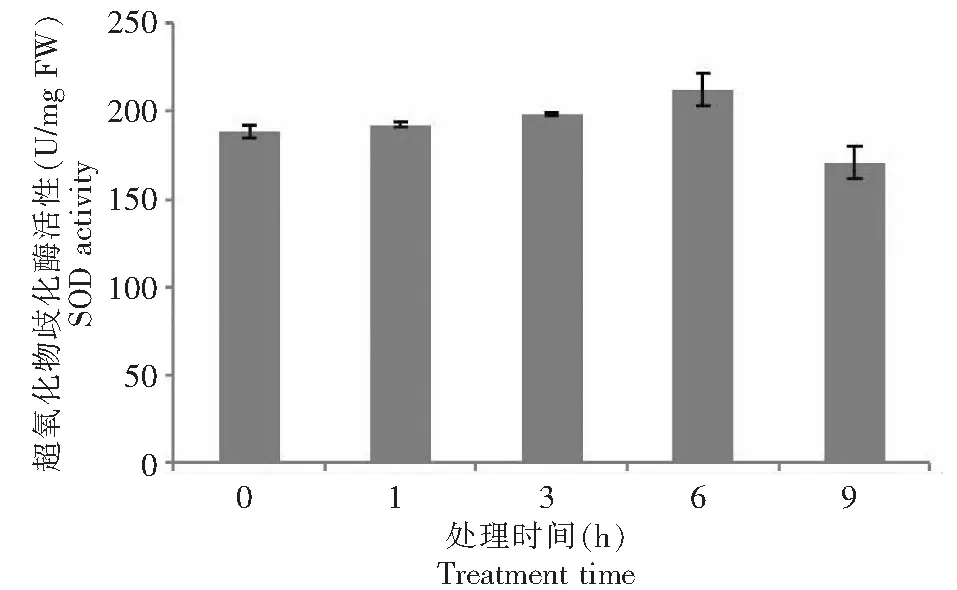
图1 PEG-6000模拟干旱胁迫对甘薯近缘种I.trifida幼苗叶片超氧化物歧化酶活性的影响Fig.1 Effect of drought stress simulated with PEG-6000 on activity of SOD in leaves of I.trifida seedling
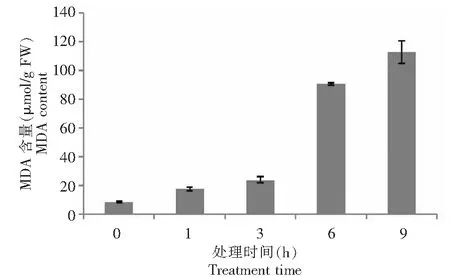
图2 PEG-6000模拟干旱胁迫对甘薯近缘种I.trifida幼苗叶片丙二醛含量的影响Fig.2 Effect of drought stress simulated with PEG-6000 on MDA content in leaves of I.trifida seedling
2.4 PEG-6000模拟干旱胁迫对甘薯近缘种I.trifida幼苗叶片Pro含量的影响
Pro是植物体内一种重要的渗透调节物质和抗氧化物质,测定植物体内游离Pro的含量,可以判断干旱等逆境对植物的危害程度和植物对干旱的抵抗力。如图4所示,在30 % PEG-6000胁迫下,甘薯幼苗叶片的Pro含量与对照相比也有比较明显的增加,并随PEG-6000胁迫时间的延长而显著增加。这表明甘薯幼苗体内游离Pro的含量与干旱程度呈正相关性,这是植物对干旱胁迫的适应性反应之一。正常条件下,甘薯幼苗叶片中Pro含量不明显,处理显著促进甘薯幼苗叶片中Pro的含量上升。随着干旱胁迫时间的延长,Pro含量呈递增趋势。
2.5 PEG-6000模拟干旱胁迫对甘薯近缘种I.trifida幼苗叶片CAT活性的影响
由图5可知,在30 %PEG6000模拟干旱胁迫下,0~3 h的CAT活性缓慢递增趋势,3~6 h的CAT活性差异较大;6~9 h CAT活性呈递增趋势。
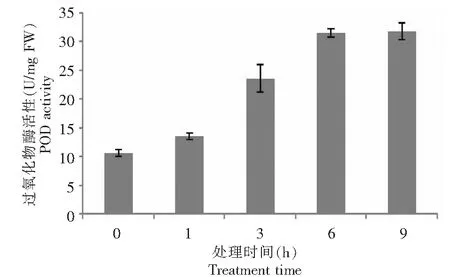
图3 PEG-6000模拟干旱胁迫对甘薯近缘种I.trifida幼苗叶片过氧化物酶活性的影响Fig.3 Effect of drought stress simulated with PEG-6000 on activity of POD in leaves of I.trifida seedling
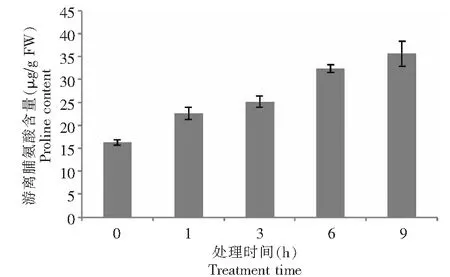
图4 PEG-6000模拟干旱胁迫对甘薯近缘种I.trifida幼苗叶片脯氨酸含量的影响Fig.4 Effect of drought stress simulated with PEG-6000 on Pro in leaves of I.trifida seedling
说明了CAT活性在水分渗透胁迫下的加强,这也说明了CAT活性的专一性保护功能是最基本和最有效的,在植物的过氧化物体(或乙醛酸循环体)中,CAT作为主要的存在形式,对光呼吸或者脂肪酸在β-氧化过程中产生的过氧化氢,可以起到有效的清除作用,CAT活性的升高有助于清除细胞代谢所产生的H2O2。
2.6 PEG-6000模拟干旱胁迫对甘薯近缘种幼苗叶片GR活性的影响
GR以GSSG为底物,以NADPH2为氢供体,把GSSG还原为GSH。由于NADPH2的最大光吸收为340 nm,故可用NADPH2被氧化过程中的OD340的减少来表示GR活性的大小。共测定0~9 h 内时间段GR活性,得到了GR动力学曲线。从图6可以看出,在0~9 h 内,GR酶促反应呈较好的线性关系。与干旱胁迫前比较,干旱胁迫使GR活性有升有降,在6 h 的时候,GR活性达到了最大值,由此说明了,当植物在遭受干旱胁迫时,植物体内的内源抗氧化剂的含量也在发生着变化。因此进一步说明了GR活性的提高和谷胱甘肽含量的增加,使得GR对干旱胁迫有较大的稳定性,从而使得GR对基质有较高的亲和性。
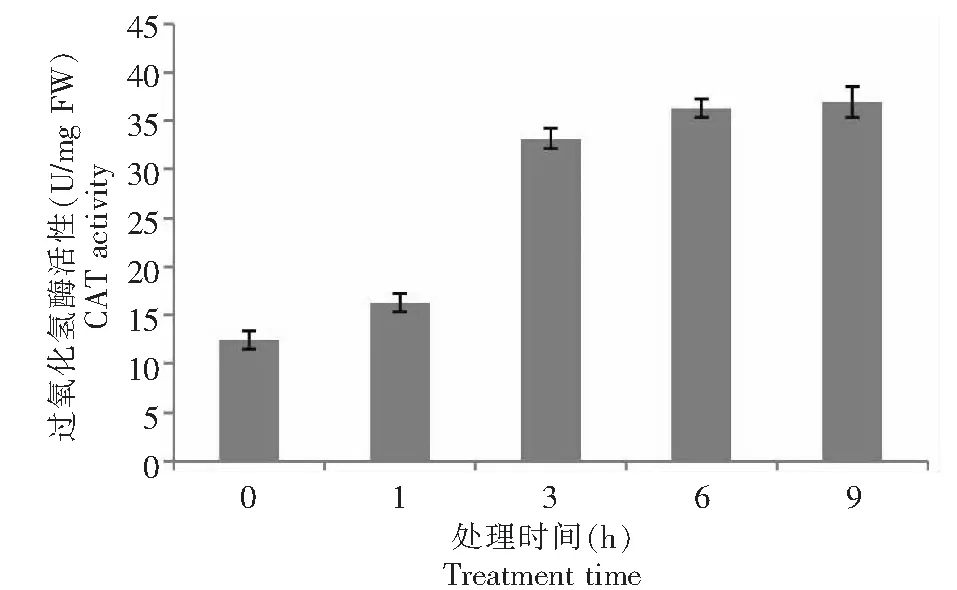
图5 PEG-6000模拟干旱胁迫对甘薯近缘种I.trifida幼苗叶片过氧化氢酶活性的影响Fig.5 Effect of drought stress simulated with PEG-6000 on activity of the CAT in leaves of I.trifida seedling
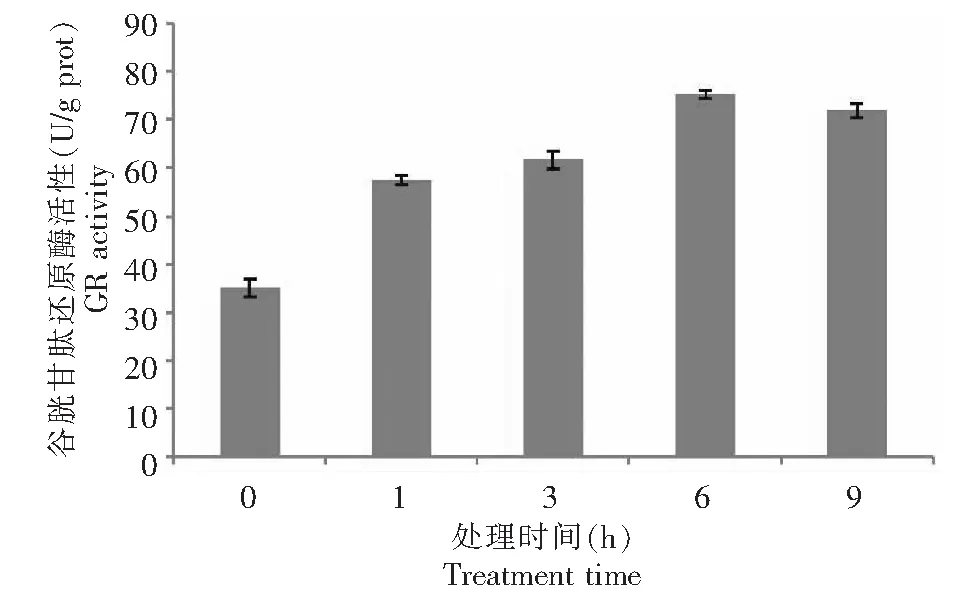
图6 PEG-6000模拟干旱胁迫对甘薯近缘种I.trifida幼苗叶片GR的影响Fig.6 Effect of drought stress simulated with PEG-6000 on activity of GR in leaves of I.trifida seedling
3 讨论与结论
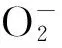
研究表明,渗透调节作用的增强是植物对干旱逆境响应的重要生理机制[16],在细胞内Pro可以作为与酶和其它细胞大分子的相容性较高的渗压剂,因此保护细胞免受干旱胁迫诱导的损伤,Pro可以降低植物组织中的渗透势[17]。Pro对植物渗透胁迫的作用中一个非常重要的部分包括细胞壁蛋白(如伸展素)的生物合成的,具有在渗透胁迫下稳定细胞形态的细胞的机械支持的重要作用。在本研究中,甘薯近缘野生种品种的幼苗在PEG胁迫处理3h下,游离Pro含量增加,表明Pro积累可能与甘薯干旱胁迫相关,并且可以用作介导的干旱耐受性的适应响应。这一结果也与其它植物中同类研究结果类似,进而也表明植物体内游离Pro含量的变化可以作为植物抗旱性的重要检测指标之一。脂质过氧化反应已被定义为包含两个以上的碳-碳双键的共价键[18]的多不饱和脂质的氧化降解。MDA,多不饱和脂肪酸的氢过氧化物的分解产物,已经经常作为合适的生物标志物的脂质过氧化,这是氧化损伤[ 19]的效果。脂质过氧化的橄榄树增加干旱胁迫下观察为干旱胁迫的时间进展。这也是明显的是,过氧化过程由水分胁迫的调控力度,作为MDA形成率随水分亏缺的强度。Sofo等[ 20]还发现了一个增加MDA含量在水中强调橄榄植物,它是伴随着脂氧合酶的活性相应增加。MDA含量也已报道对盐胁迫和日光辐射响应[21]。因此,MDA的积累经常被用来作为膜脂质过氧化反应的指标。在目前的研究中,甘薯近缘种I.trifida叶片MDA含量变随渗透胁迫持续的时间增加,表明了干旱导致了甘薯近缘种I.trifida叶细胞的膜脂质过氧化。
水分胁迫已被证明能增加在植物细胞中的活性氧(ROS)水平。植物也能产生抗氧化剂,其主要功能是清除ROS。以前的研究表明,酶抗氧化系统,其中包括CAT、POD和SOD在清除有害的氧自由基起到了重要作用[22],当植物受到胁迫的时候,这些抗氧化酶的活性会改变。最近的一项研究报告称,SOD和CAT活性在干旱胁迫下上调是耐旱作物适应机制之一[23]。耐旱作物如菜豆、向日葵及高粱在干旱胁迫条件下比敏感植物有更高POD活性[24]。研究结果显示,随PEG渗透胁迫下时间持续甘薯近缘种I.trifida叶的SOD、POD和CAT的活性增加,表明甘薯近缘种I.trifida干旱诱导的氧化胁迫可由SOD,POD和CAT活性上调而减轻。
综上所述,本研究表明,遭受干旱胁迫的甘薯近缘种I.trifida可改变抗氧化酶活性和增加渗透调节物质。SOD、CAT、POD活性的动态增加与游离Pro增加是平行的。这些结果表明,甘薯近缘种I.trifida植株可以利用抗氧化酶和渗透活性溶质来适应渗透胁迫。因此,提高植物的干旱胁迫时,这些酶的活性和渗透调节物质含量快速上调可作为生物技术方法提高甘薯耐旱胁迫候选途径之一。
[1]汤章城. 植物的抗逆性和节水栽培[J]. 植物生理学通讯, 1997, 33(6):473-474.
[2]罗志成. 北方旱地农业研究的进展与思考[J]. 干旱地区农业研究, 1994, 12(1):4-13.
[3]张明生, 张丽霞, 戚金亮, 等. 甘薯品种抗旱适应性的主成分分析[J]. 贵州农业科学, 2006, 34(1):11-14.
[4]毕会涛, 黄付强, 邱 林, 等. 干旱胁迫对灰枣保护性酶活性及膜脂过氧化的影响[J]. 中国农学通报, 2007, 23(2):151-155.
[5]侯嫦英, 方升佐, 薛建辉, 等. 干旱胁迫对青檀等树种苗木生长及生理特性的影响[J]. 南京林业大学学报:自然科学版, 2003, 27(6):103-106.
[6]李广敏, 唐连顺, 商振清, 等. 渗透胁迫对玉米幼苗保护酶系统的影响[J]. 河北农业大学学报, 1994, 17(2):1-5.
[7]Gergely I. polyethylene glycol induced water stress effects on apple seedings[J]. Am SOC Hortis Sci., 1980, 105:854-857.
[8]安婷婷, 汤佳立, 孙健英, 等. 甘薯栽培种及其近缘野生种的DAPI核型及rDNA-FiSH分析[J]. 西北植物学报, 2012, 32(4):682-687.
[9]王建华, 刘鸿先, 徐 同. 超氧化物歧化酶(SOD)在植物逆境和衰老生理中的作用[J]. 植物生理学通讯, 1989(1):1-7.
[10]周瑞莲, 张承烈, 金巨和. 水分胁迫下紫花苜蓿叶片含水量、质膜透性、SOD、CAT活性变化与抗旱性关系的研究[J]. 中国草地, 1991(2):20-24.
[11]高俊风. 植物生理学实验指导[M]. 北京:高等教育出版社,2006:217-218.
[12]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[13]Halliwell B, Foyer CH.Properties and physiological function of a glutathione reductase purified from spinach leaves by affinity chromatography[J]. Planta,1978,139:9-17.
[14]Bowler C, Montagu V M, Inze D. Superoxide dismutase and stress tolerance[J]. Ann Rev Plant Physiol Plant Mol Biol,1992,43:83-116.
[15]Baily C, Benamar A, Corbineau F, et al. Changes in malondialdehyde content and in superoxide dismutase, catalase and glutathione reductase activities in sunflower seed as related to deterioration during accelerated aging[J]. Physiol Plant, 1996, 97:104-110.
[16]黎 裕. 植物的渗透调节与其它生理过程的关系及其在作物改良中的作用[J]. 植物生理学通讯, 1994,30(5):377-385.
[17]Maggio A, Miyazaki S,Veronese P, et al. Does proline accumulation play an active role in stress induced growth reduction?[J]. Plant Journal, 2002, 31(6):699-712.
[18]Mishra R K, Singhal G S. Function of photosynthetic apparatus of intact wheat leaves under high light and heat stress and its relationship with peroxidation of thylakoid lipids[J]. Plant Physiol,1992,98:1-6.
[19]Petridis A,Therios I,Samouris G, et al. Effect of water deficit on leaf phenolic composition, gas exchange, oxidative damage and antioxidant activity of four Greek olive (OleaeuropaeaL.) cultivars[J]. Plant Physiology and Biochemistry, 2012, 60:1-11.
[20]Sofo A, Dichio B, Xiloyannis C, et al. Effects of different irradiance levels on some antioxidant enzymes and on malondialdehyde content during rewatering in olive tree[J].Plant Sci., 2004,166:293-302.
[21]Remorini D, Melgar J C, Guidi L, et al. Interaction effects of root-zone salinity and solar irradiance on the physiology and biochemistry of Oleaeuropaea[J]. Environ. Exp. Bot., 2009, 65:210-219.
[22]Alia, Prasad K V, Saradhi P P. Effect of zine on free radical and proline in Brassica and cajanus[J]. Phytochem, 1995, 39:45-47.
[23]Devi R N, Kaur, Gupta AK. Potential of antioxidant enzymes in depicting drought tolerance of wheat (TriticumaestivumL.).Indian[J]. Biochem. Bio., 2012, 49:257-265.
[24]Pourtaghi A, Darvish F, Habibi D, et al. Effect of irrigation water deficit on antioxidant activity and yield of some sunflower hybrids[J]. Aust J Crop Sci., 2011, 5(2):197-204.
(责任编辑 陈 虹)
Sweetpotato RelativeIpomoeatrifida(Kunth) G. Don
CAO Qing-he, LI Xue-hua, DAI Xi-bin, TANG Jun, ZHOU Zhi-lin, ZHAO Dong-lan, ZHANG An
(Jiangsu Xuzhou Sweetpotato Research Center/Sweetpotato Research Institute, CAAS/ Key Laboratory for Biology and Genetic Breeding of Sweetpotato, Ministry of Agriculture, Jiangsu Xuzhou 221131,China)
Ipomoeatrifida(Kunth) G. Don (2n=2x=30) was one of the ancestors of a sweetpotato and had high-drought resistance, however, its drought-resistant physiological mechanism was still not reported. In this study, using the method of the simulated-drought water culture with 30 % concentrations of PEG-6000, the effects of drought stress on the physiological and biochemical indexes of sweetpotato seedling leaf of wild relatives were studied. The results showed that the malonaldehyde (MDA) and free proline (Pro) content increased with the prolongation of PEG-6000 treatment time. Peroxidase (POD), catalase (CAT) and glutathione reductase (GR) activity were enhanced after PEG treatment, which revealed different changing law of the MDA and Pro content of sweetpotato wild relatives and their enzyme activity in a short period of acute stress, which could provide some references for screening drought resistant varieties and tapping drought-resistant related genes.
Ipomoeatrifida; PEG-6000; Simulated drought stress; Proline; Anti-oxidant system
1001-4829(2016)11-2536-06
10.16213/j.cnki.scjas.2016.11.005
2015-11-11
国家自然科学基金(31461143017);江苏省自然科学基金(BK20141144);江苏省科技支撑计划(BE2014311);“863”计划(2012AA101204-1-8);“948”项目(2011-G1-20);徐州市国际合作项目(XM13B022)
曹清河(1975-),男,江苏徐州人,博士,主要从事甘薯种质创新及遗传改良研究,E-mail: cqhe75@yahoo.com,Tel:13775983327。
S531
A
